麥冬中萜類成分龍腦次苷的合成研究
程冬萍,周俠毅,宋立芳
(浙江工業大學 藥學院,浙江 杭州 310014)
?
麥冬中萜類成分龍腦次苷的合成研究
程冬萍,周俠毅,宋立芳
(浙江工業大學 藥學院,浙江 杭州 310014)
摘要:采用2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖與三氯乙腈親核加成得到2,3,4,6-四-O-乙酰基-α-D-吡喃葡萄糖三氯乙酰亞胺酯,亞胺酯與l-龍腦進行糖苷化,再用甲醇鈉脫保護得到龍腦次苷。并著重對糖苷化一步的反應條件進行探索優化,得到了較優的反應條件:當投料比為n(亞胺酯)∶n(l-龍腦)=1.3,催化劑三氟化硼·乙醚用量為10%,二氯甲烷中-15 ℃反應5 h,收率65.0%.
關鍵詞:龍腦次苷;三氯乙酰亞胺酯;糖苷化;脫保護
龍腦次苷是自然界中稀有的雙環單萜葡萄糖苷,是中藥麥冬的特征性成分之一[1].由于龍腦次苷在麥冬中的含量低微,如果采用傳統的提取分離方法從中藥麥冬來獲得龍腦次苷,則生產成本高昂.文獻[2]報道龍腦次苷的合成方法是以四乙酰基溴代葡萄糖作為糖基供體,在碳酸銀的催化下,和苷元l-龍腦進行糖苷化反應,再經過脫保護得到龍腦次苷,報道收率為35%.但是此方法不僅使用了價格昂貴的重金屬鹽催化劑,而且底物溴代葡萄糖不穩定,反應總收率低下.因此,改用三氯乙酰亞胺酯作為糖元供體,與傳統的溴代法相比,收率高,操作簡便.其中重點研究了葡萄糖三氯乙酰亞胺酯與l-龍腦的糖苷化條件.
1合成工藝探索及優化
2,3,4,6-四-O-乙酰基-α-D-吡喃葡萄糖三氯乙酰亞胺酯Ⅳ的合成路線為
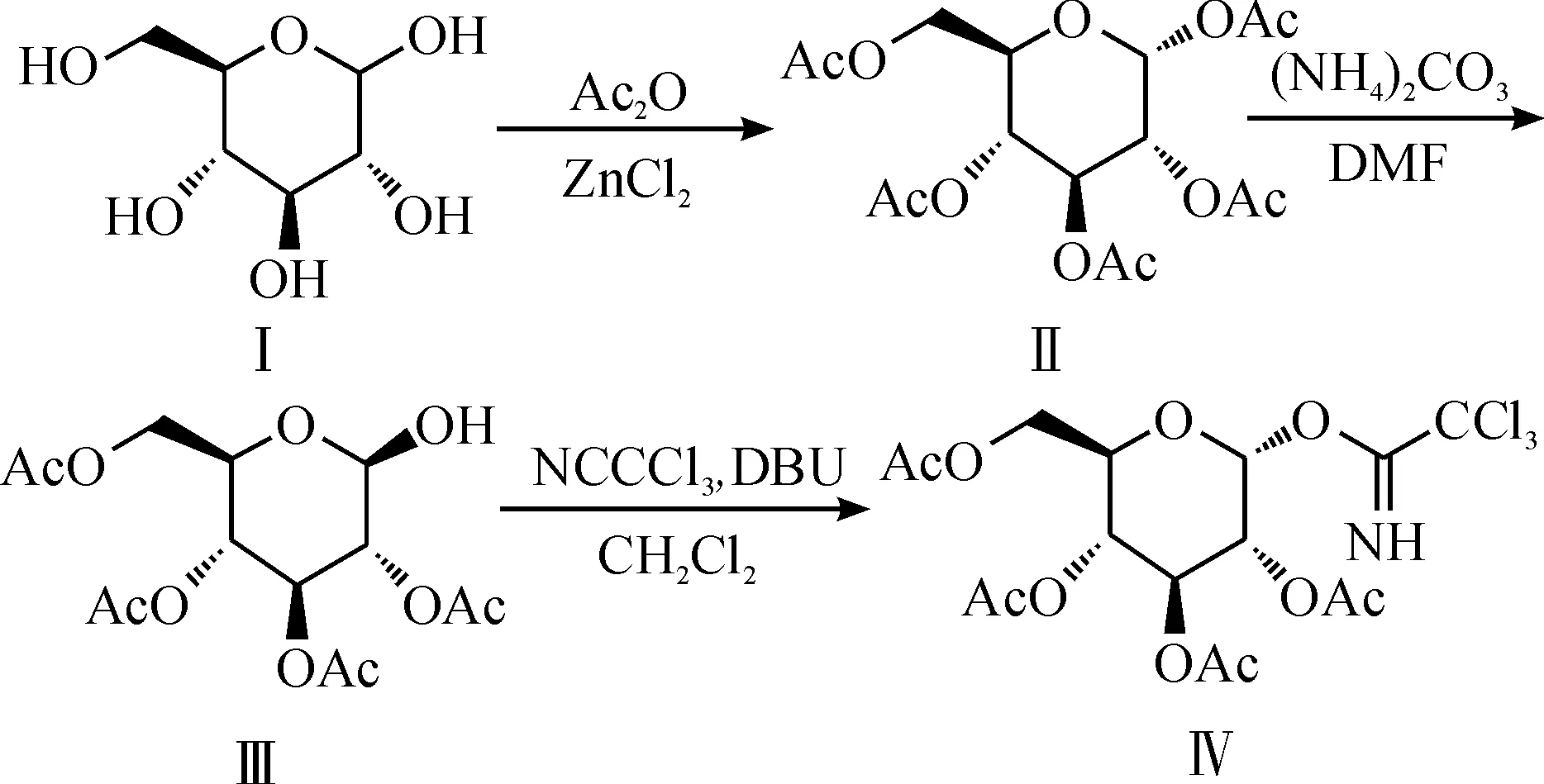
其中第一步乙酰化據文獻報道有醋酸酐-醋酸鈉法[3]、硫酸-醋酸酐法[4]、氯化鋅-醋酐法[5]和三氯化鐵-醋酐法[6]等,這幾種方法收率都在70%~80%之間.醋酸酐-醋酸鈉法和三氯化鐵-醋酸酐法都要消耗大量的醋酐,成本高,后處理難度大;硫酸-醋酐法以濃硫酸做催化劑,濃硫酸酸性強,反應劇烈,有一定危險性;氯化鋅-醋酐法以氯化鋅為催化劑,作用較溫和.該反應D-葡萄糖Ⅰ與溶劑醋酐的投料比為1∶6 g/mL,氯化鋅與Ⅰ用量的摩爾比為40%,收率可達85%.
第二步脫1位乙酰基應有兩種方法,一是與溴化氫、碳酸銀反應[7],二是與碳酸銨反應[8].前者操作較繁瑣,總收率較低,還使用了毒性大的溴化氫氣體和高成本的銀鹽.相比之下,碳酸銨法應用更廣泛.其中底物五乙酰基葡萄糖Ⅱ與溶劑DMF的投料比為1∶2 g/mL,碳酸銨與Ⅱ用量的摩爾比為2,收率可達90%.
第三步亞胺化多采用1, 8-二氮雜雙環[5.4.0]十一碳-7-烯(DBU)[9]催化,反應條件溫和,收率高,后處理簡單.催化劑DBU的量一般在10%以內即可,實驗中投量為7%,三氯乙腈與底物用量的摩爾比為2,收率可達65%.
故最終選用以上合成路線制備化合物Ⅳ.
l-龍腦2-O-2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖苷Ⅴ的合成路線為

該反應一般要路易斯酸作催化劑,如三氟甲磺酸三甲基硅酯[10]、三氟化硼·乙醚[11]和對甲苯磺酸[12]等.
1.1催化劑選擇
本研究考察了四種催化劑,三氟化硼·乙醚、三氟甲磺酸酐、苯磺酸以及三氟甲磺酸三甲基硅酯.將1 mmoll-龍腦和1.3 mmol三氯乙酰亞胺酯溶于5 mL二氯甲烷,氮氣保護,于5 ℃下加入1.0 mmol催化劑,攪拌過夜,反應結果如表1所示.

表1 催化劑篩選
由實驗結果看出:以三氟甲磺酸酐催化無目標產物生成,以苯磺酸催化有極少量產物,以三氟甲磺酸三甲基硅酯催化生成的是α構型的產物,只有以三氟化硼·乙醚催化時可得到約40%的目標產物.初步確定三氟化硼·乙醚作為糖苷化反應的催化劑.
1.2單因素試驗
根據上述結果,投入1 mmoll-龍腦,1.3 mmol三氯乙酰亞胺酯,5 mL二氯甲烷和三氟化硼·乙醚,5 ℃反應過夜.結果見表2.
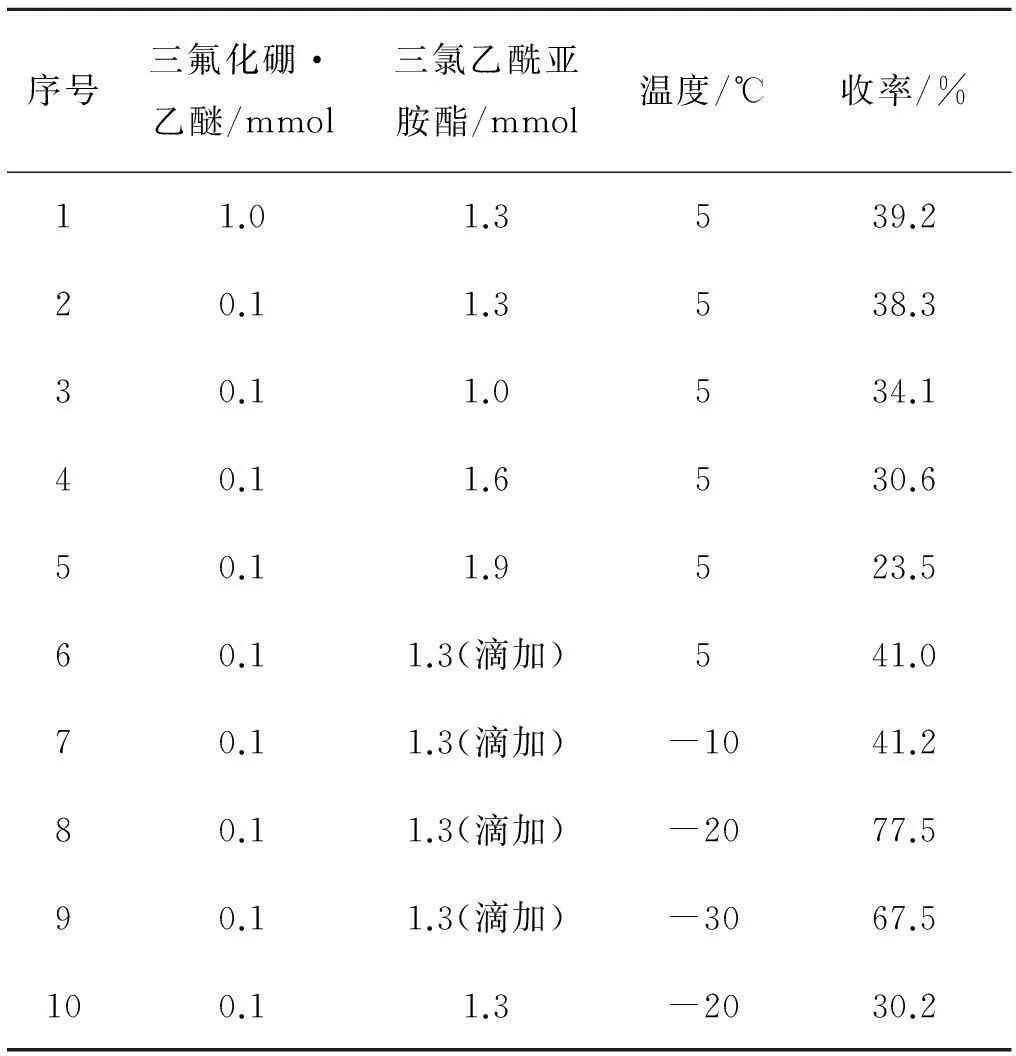
表2 單因素試驗表1)
注:1) 表中底物l-龍腦用量均為1 mmol,所有反應均在氮氣保護下進行.
由表2中可以得出:當三氟化硼·乙醚降至0.1 mmol,收率仍能達到38%,與1.0 mmol的收率相比無明顯變化,因此三氟化硼·乙醚用量為0.1 mmol即可.
根據三氟化硼·乙醚的考察結果,投入1 mmoll-龍腦,0.1 mmol三氟化硼·乙醚,5 mL二氯甲烷,5 ℃反應,考察三氯乙酰亞胺酯的用量對反應的影響(表2中第二至五組).可以得出三氯乙酰亞胺酯的量由1.0 mmol增至1.3 mmol,收率有所提高,但繼續增加三氯乙酰亞胺酯,收率開始降低.選取其中收率最好的1.3 mmol,滴加三氯乙酰亞胺酯(二氯甲烷溶解),收率略有提高(表2中第二組與第六組).故三氯乙酰亞胺酯暫且選擇滴加,用量為1.3 mmol.
確定投料比、催化劑用量以及加料方式后,投入1 mmol的l-龍腦,5 mL的二氯甲烷,1.3 mmol的三氯乙酰亞胺酯,0.1 mmol的三氟化硼·乙醚,其中4 mL二氯甲烷用于溶解龍腦,剩余1 mL二氯甲烷用于溶解三氯乙酰亞胺酯且滴加,考察了溫度對反應的影響.
總體來看,-20 ℃左右是較適宜的反應溫度.為驗證三氯乙酰亞胺酯的加入方式對收率的影響,特地補做一組-20 ℃的實驗,直接加入三氯乙酰亞胺酯而非滴加,收率僅為30.2%(該條件下反應收率較5 ℃低,其可能原因為在低溫下體系中水分含量較高,三氯乙酰亞胺酯水解更嚴重),故必須滴加.
確定最佳反應條件后,考察了反應時間的影響,通過TLC檢測反應進度后發現,反應5 h后原料l-龍腦以完全消失,故選擇反應時間為5 h.
1.3正交試驗分析及穩定性考察
根據以上的單因素試驗確定了三氟化硼·乙醚、三氯乙酰亞胺酯和溫度三個因素,每個因素設三個水平,如表3所示.L9(33)正交實驗結果見表4.
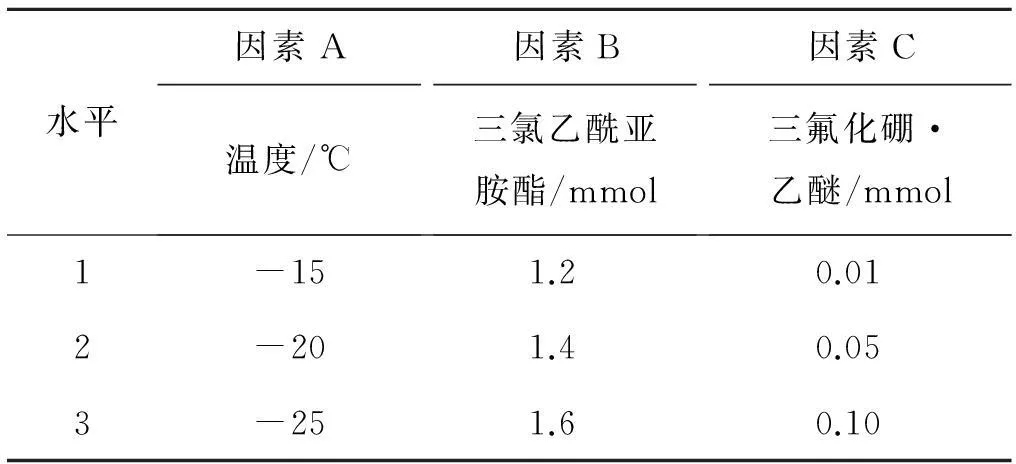
表3 正交試驗的因素和水平1)
注:1) 表中底物l-龍腦用量均為1 mmol,所有反應均在氮氣保護下進行,反應時間為5 h.
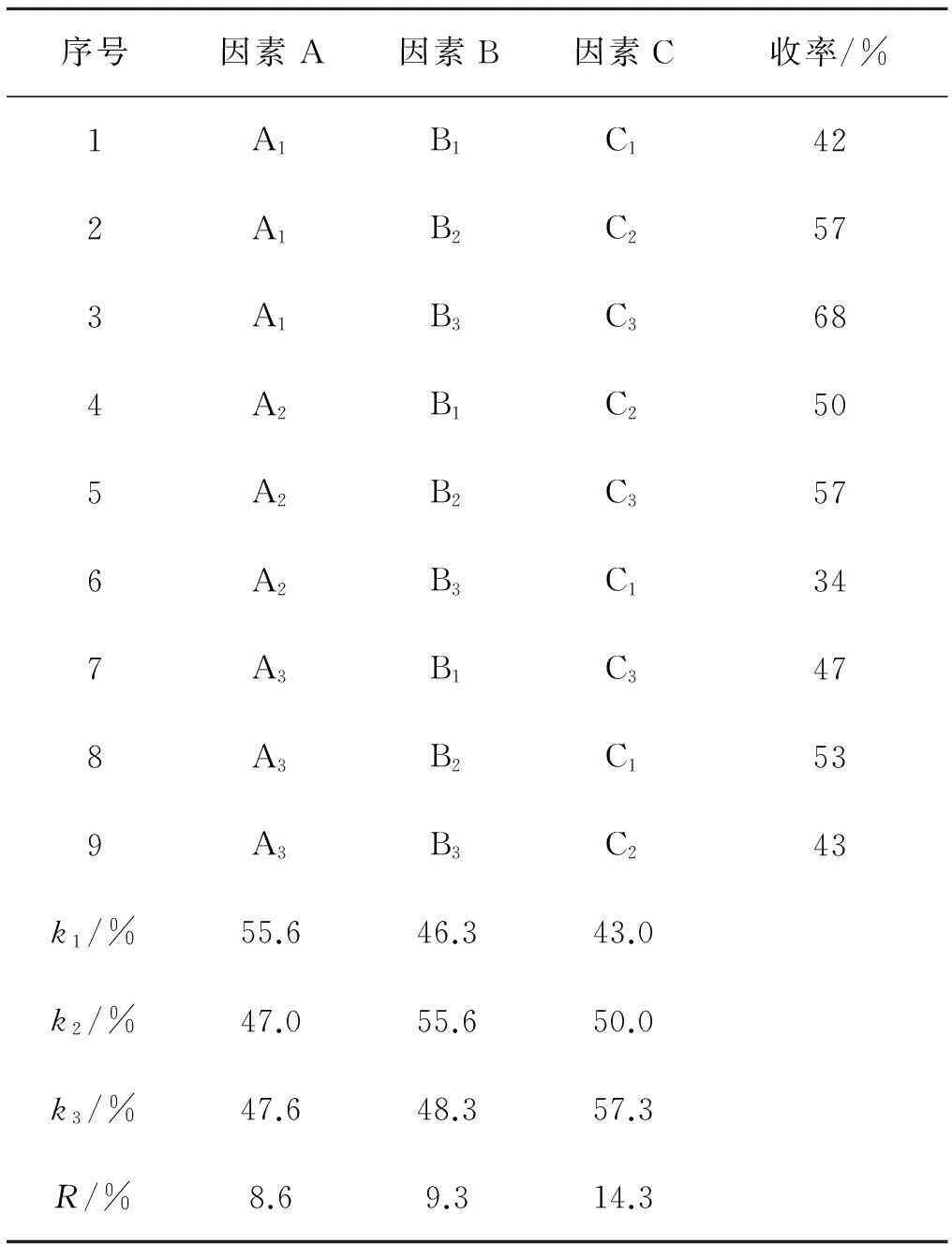
表4 L9(33)糖苷化反應正交設計實驗結果
觀察表4的極差分析,影響反應收率的最大因素是三氟化硼·乙醚的量,其次是三氯乙酰亞胺酯,溫度對收率影響較小.溫度的k1最大,亞胺酯k2最大,三氟化硼·乙醚k3最大,因此正交實驗所得的最佳反應條件組合為A1B2C3,即溫度為-15 ℃,三氯乙酰亞胺酯是1.4 mmol,三氟化硼·乙醚的量是0.1 mmol.
觀察表4中各因素在不同水平下的收率變化,反應溫度從-15 ℃降至-20 ℃,收率明顯下降,由-20 ℃降至-25 ℃,收率基本平穩.因此在考查范圍內,-15 ℃反應效果較好.溫度-15 ℃繼續升高,反應收率仍有提高的可能,故補做一組實驗,三氯乙酰亞胺酯的用量為1.4 mmol,催化劑為0.1 mmol,-10 ℃反應,收率為66.0%,因此以-15 ℃為最佳溫度.
三氯乙酰亞胺酯為1.4 mmol時收率有最大值,故以1.4 mmol為最佳投量.
三氟化硼·乙醚從0.01 mmol增加至0.05 mmol,再增加至0.1 mmol,收率幾乎呈直線式增長.雖然前述單因素實驗中0.1 mmol與1.0 mmol的收率無明顯差異,但不能確定繼續增加三氟化硼·乙醚是否會使收率提高.因此補做一組實驗,1.4 mmol三氯乙酰亞胺酯,三氟化硼·乙醚增至0.2 mmol,-15 ℃反應,收率79.1%,與0.1 mmol時無明顯變化,故選0.1 mmol為最佳投量.
綜上所述,最佳組合為A1B2C3,即-15 ℃,三氯乙酰亞胺酯為1.4 mmol,催化劑為0.1 mmol.對該組條件做穩定性實驗,收率與前述實驗結果基本吻合,如表5所示.

表5 穩定性實驗1)
注:1) 表中底物l-龍腦用量均為1 mmol,所有反應均在氮氣保護下進行,反應時間為5 h.
2實驗部分
2.1主要儀器與試劑
主要儀器:X-4 型數字顯示顯微熔點測定儀(溫度未校正);Bruker Avance III(500M)核磁共振儀.
主要試劑:D-葡萄糖(CP,國藥集團化學試劑有限公司) ;醋酐(AR,杭州雙林化工試劑廠) ;三氯乙腈(AR,無錫海碩生物有限公司) ;DBU (AR,杭州雙林化工試劑廠) ;三氟化硼·乙醚(AR,阿拉丁試劑公司) ;l-龍腦(AR,阿拉丁試劑公司).
2.2實驗過程與方法
龍腦次苷的總合成路線為
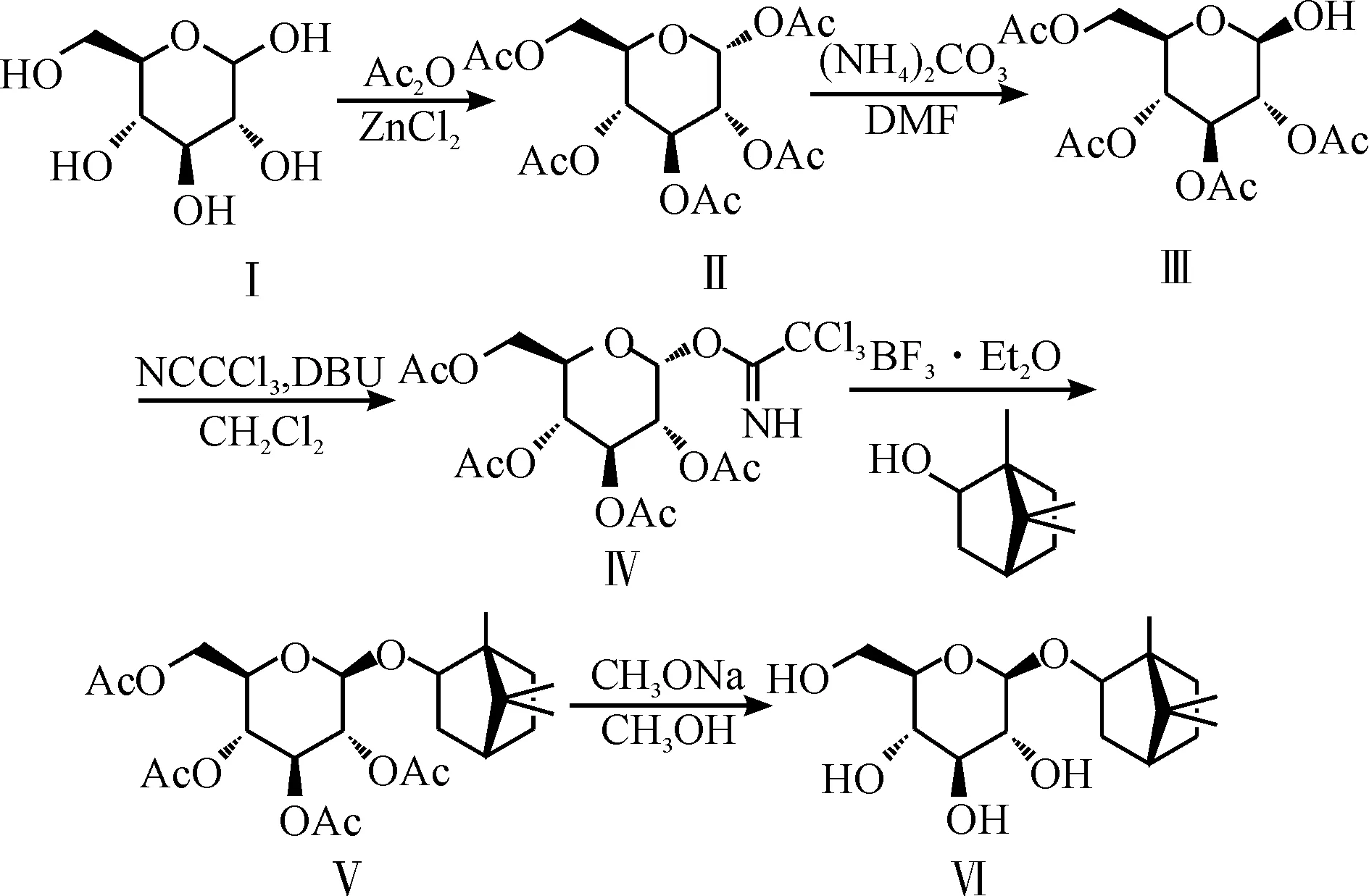
1,2,3,4,6-五-O-乙酰基-α-D-吡喃葡萄糖Ⅱ:在1 000 mL圓底燒瓶中加入600 mL醋酸酐和30.2 g(0.222 mol)氯化鋅[5],加熱至60 ℃使氯化鋅溶解.停止加熱,在60 ℃以下分批加入100 g D-葡萄糖Ⅰ,約45 min加完.然后100 ℃回流4 h,降至室溫,減壓蒸餾除去未反應的醋酸酐,將剩余溶液倒入3 000 mL冰水中,攪拌約2 h待晶體充分析出后,過濾,洗滌,用50%乙醇水溶液重結晶,60 ℃減壓干燥得白色粉末162.10 g,收率82.4%,m.p.110~111 ℃.
2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖Ⅲ:稱取97.6 g (0.25 mol)Ⅱ,2.48 g (0.5 mol)碳酸銨,加入到195 mL DMF中,40 ℃反應6 h[8],用乙酸乙酯萃取,有機相用飽和食鹽水洗滌,無水硫酸鈉干燥,減壓除去溶劑得80.4 g淡黃色糖漿,收率92.4%.
2,3,4,6-四-O-乙酰基-α-D-吡喃葡萄糖三氯乙酰亞胺酯Ⅳ:將174.2 g (0.5 mol) Ⅲ和144.4 g(1.0 mol)三氯乙腈加入到350 mL干燥的二氯甲烷中溶解,降至0 ℃,滴加入5.2 mL (0.035 mmol) DBU,室溫反應過夜[9].次日旋干溶劑,柱層析分離得160.1 g淡黃色糖漿,收率65.0%.1H-NMR (500 MHz, CDCl3): δ 1.97(s, 3H), 1.98(s, 3H), 2.00(s, 3H), 2.02(s, 3H), 4.07(dd,J=12.4 Hz, 1.7Hz, 1H), 4.17(m, 1H), 4.23(dd,J=12.4, 4.13 Hz, 1H), 5.09(dd,J=10.1, 3.61 Hz, 1H), 5.13(t,J=9.8 Hz, 1H), 5.51(t,J=9.8 Hz, 1H), 6.51(d,J=3.7 Hz, 1H), 9.69(s, 1H).
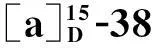
3結論
以廉價易得的D-葡萄糖為原料經過全乙酰化、脫1位乙酰基、與三氯乙腈親核加成后,再與l-龍腦進行糖苷化,最后通過甲醇鈉脫保護即為龍腦次苷,共5步反應,總收率35.4%.每步反應均具有良好的收率,且反應過程及后處理均較為簡便.其中糖苷化是比較困難的一步.對于該步反應我們擯棄了傳統的溴代糖法,用三氯乙酰亞胺酯法借助鄰基參與效應高選擇性地合成了龍腦次苷.并對其進行單因素考察和正交試驗優化,最后將該步反應收率提升至79%.三氯乙酰亞胺酯法成功用于合成龍腦次苷,為其它單萜葡萄糖苷尤其是大位阻的雙環單萜葡萄糖苷的合成提供了思路.
參考文獻:
[1]程志紅,李林洲,劉楠等.中藥麥冬脂溶性化學成分的研究[J].中國藥學雜志,2005,40(5):337-341.
[2]PATOV S A, PUNEGOV V V. Synthesis of certain monoterpenoid glucosides[J]. Chemistry of natural compounds,2006,42(4):431-433.
[3]DEREDAS D, FRANKOWSKI A. Synthesis of d-erythrofuranosyl C-nucleosides of imidazole from 4(5)-(D-arabino- tetritol-1-yl) imidazole[J]. Carbohydrate research,1994,252:275-281.
[4]LICHTENTHALER F W, KOEHLER B. An expedient route to acylated glucosyl halides with a free 2-OH group[J]. Carbohydrate research,1994,258(1/2):77-85.
[5]俞繼華,肖紅新.α-五酰葡萄糖的合成[J].化學推進劑與高分子材料,2000(3):28-28.
[6]劉媛媛,劉伯成.五乙酰葡萄糖的合成工藝研究[J].科技視界,2013(29):422-423.
[7]于小鳳,孫玉.2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖的合成工藝改進[J].化工進展,2010,29(2):334-337.
[8]DORST J A, HEUSDEN ] C J, TIKKANEN J M. Synthesis of Hexp-(1→4)-β-D-GlcpNAc-(1→2)-α-D-Manp-(1→O)(CH2)7CH3probes for exploration of the substrate specificity of glycosyltransferases: part II Hex=3-O-methyl-β-D-Gal, 3-deoxy-β-D-Gal, 3-deoxy-3- fluoro-β-D-Gal, 3-amino-3-deoxy-β-D-Gal,β-D-Gul,α-L-Alt, orβ-L-Gal[J]. Carbohydrate research,1997,297(3):209-227.
[9]傅大雙,張首國,彭濤,等.合成2,3,4,6-O-四芐基-α-D-葡萄糖三氯乙酰亞胺酯的工藝改進[J].合成化學,2013,21(3):333-335.
[10]周峰巖.苯丙素苷類化合物的合成[D].杭州:浙江大學,2005.
[11]LI W, WU X F, TONG Y F,; et al. Total synthesis of adicardin[J]. Journal of Asian natural products research,2009,11(8):720-727.
[12]HANAURA M, AGOCS A. New methods for the synthesis of carotenoid glycosides[J]. Tetrahedron letters,2014,55(26):3625-3627.
(責任編輯:陳石平)
A study on the synthesis ofl-borneol 2-O-β-D-glucopyranoside in radix ophiopogonis
CHENG Dongping, ZHOU Xiayi, SONG Lifang
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:2,3,4,6-tetra-O-acetyl-α-D-glucopyranosyl trichloroacetimidate was obtained by 2,3,4,6-tetra-O-acetyl-β-D-glucose reacting with trichloroacetonitrile, and then reacted with l-borneol to give l-borneol -2-O-2,3,4,6-tetra-O-acetyl-β-D-glucopyranoside through glycosidation. The target product l-borneol 2-O-β-D-glucopyranoside was formed through the deprotection of l-borneol -2-O-2,3,4,6-tetra-O-acetyl-β-D-glucopyranoside in methanol with sodium methoxide as base. The reaction conditions were optimized and the optimal process conditions were obtained. l-borneol reacted with trichloroacetimidate (1.3 equiv.) in dichloromethane at -15 ℃ for 5 h in the presence of 0.1 equivalents of boron fluoride ethyl ether to give an optimum yield of 65.0%.
Keywords:l-borneol-2-O-β-D-glucopyranoside; trichloroacetic imine esters; glycosylation; deprotection
收稿日期:2015-09-30
作者簡介:程冬萍(1976—),女,浙江溫州人,副教授,博士,研究方向藥物和藥物中間體的合成研究,E-mail:chengdp@zjut.edu.cn.
中圖分類號:O629.13
文獻標志碼:A
文章編號:1006-4303(2016)02-0169-05

