大黃素抑制結腸癌轉移的研究*
王旻晉,王元元,范繼斌
1.四川大學華西醫院 實驗醫學科 (成都 610041); 2.成都醫學院 生物醫學系(成都 610083);3.綿陽市梓潼縣工人醫院(梓潼 622150)
大黃素抑制結腸癌轉移的研究*
王旻晉1,王元元2△,范繼斌3
1.四川大學華西醫院 實驗醫學科 (成都610041); 2.成都醫學院 生物醫學系(成都610083);3.綿陽市梓潼縣工人醫院(梓潼622150)
【摘要】目的研究大黃素對結腸癌細胞轉移的抑制作用及其作用分子機制。方法通過MTT法確定大黃素有效作用濃度,采用細胞劃痕實驗、Transwell和基質膠實驗檢測大黃素對結腸癌細胞遷移、侵襲能力的影響。通過免疫印跡試驗(Western blot)檢測EMT事件標志性蛋白的變化及上游信號通路的標志性蛋白。結果MTT表明,大黃素對結腸癌細胞SW480有明顯的抑制作用;細胞劃痕、Transwell和基質膠實驗表明,大黃素具有抑制結腸癌遷移和侵襲的能力;Western blot 結果表明,大黃素激活N-cadherin,抑制E-cadherin、Vimmentin、β-catenin的表達,同時抑制惡性基因VEGF、MMP-2、MMP-9的表達,抑制Akt/mTOR、STAT3 的磷酸化。結論大黃素通過抑制STAT3、PI3K-AKT信號通路進而抑制結腸癌轉移,為其在臨床上作為治療結腸癌的輔助藥物或直接作用藥物提供理論依據。
【關鍵詞】結腸癌;大黃素;轉移;信號通路
結腸癌(colon cancer)是全球最常見的惡性腫瘤之一,位居惡性腫瘤死因的第2位,是我國高發癌癥之一[1],其發生和發展與日常飲食習慣密切相關。結腸癌的發生與轉移是一個十分復雜的生物學過程,很多分子參與其中。目前,結腸癌的治療手段主要為放、化療和手術,但放、化療有很多的缺陷[2]。近年來日常飲食中的植物化學在腫瘤預防和治療中得到廣泛的認可,其化學成分單獨或與其他藥物共同起著對腫瘤的治療作用[3]。大黃素作為從大黃根部提取的一種蒽醌類物質,在不同腫瘤細胞及動物模型中表現出抗炎、抗增殖、抗轉移等作用[4-6]。研究[7]報道,大黃素能夠抑制結腸癌、乳腺癌的遷移與浸潤,但其作用分子機制不明確。本研究以結腸癌細胞SW480為研究對象,研究大黃素抑制結腸癌細胞轉移的分子機制,以探討大黃素的抗腫瘤藥用價值。
1材料與方法
1.1材料
人結腸癌細胞SW480購自上海中科院細胞庫,于-80 ℃凍存;DMEM培養基購自美國Gibco;胎牛血清購于杭州四季青生物公司;大黃素購自上海譜振生物科技有限公司;MTT、Transwell、基質膠購自美國Sigma 公司;蛋白質預染Marker購自立陶宛Fermentas公司;Tween-20購自北京中衫金橋生物技術有限公司;Vimentin、E-cadherin、N-cadherin、β-catenin、VEGF、STAT3、p-STAT3、AKT、p-AKT和β-Actin單克隆抗體均購自美國CST公司;PVDF 膜和 ECL 顯影液購于美國Millipore 公司;X 光膠片購于美國Kodak 公司;其余化學試劑均為分析純。
1.2方法
1.2.1細胞培養SW480在含有10% 胎牛血清的RPMI1640 培養基(含105U/L青霉素,100 mg/L鏈霉素)中于37 ℃,5% CO2培養箱中培養。
1.2.2MTT將100 μLSW480細胞懸液以50 000個/mL的密度接種于96孔板,在CO2孵箱中37 ℃培養孵育過夜。待細胞貼壁后,加入不同濃度(0、15、30、40、60、75和90 μM)的大黃素100 μL繼續培養24、48和36 h。每組設4個復孔,另設不含細胞僅有培養基的空白孔為空白對照孔。藥物處理結束后,加入MTT(5 mg/mL)試劑20 μL,37 ℃ 5% CO2孵育4 h,以空白孔調零,酶標儀檢測590 nm波長下的吸光值。
1.2.3細胞劃痕實驗將生長良好的SW480細胞以6×104個/孔接種于6孔板中,培養24 h后,待密度達到90%以上時,用200 μL的槍頭在6孔板中劃痕,PBS洗2次,加入含大黃素的雙無培養基,繼續培養48 h后,照相觀察劃痕愈合情況。
1.2.4Transwell、基質膠實驗參考文獻[8]方法,將經大黃素處理48 h 后的細胞,PBS洗2次,用無血清培養液重懸。將200 μL細胞懸液(3×105/mL、4×105/mL)加入上室或含基質膠的小室,將含20%胎牛血清DMEM培養基540 μL加入24孔板下室,每組設3個復孔,培養48 h,取出小室,經 4%多聚甲醛固定后,結晶紫染色,用濕棉簽擦去膜上面未穿過膜的細胞,自然風干后,在顯微鏡下照相,低倍鏡下隨機選取5個視野計數。最終以穿膜細胞的數目代表體外遷移能力、外侵襲能力。
1.2.5免疫印跡收集經藥物處理后的細胞, 按1×106細胞濃度加入100 μL細胞裂解液,渦旋震蕩,冰上放置1 h,將細胞裂解液 4 ℃ 13 000 rpm/min 離心15 min,取上清液加上樣緩沖液,85 ℃加熱變性10 min,樣品中蛋白經BCA試劑盒定量,以確保蛋白上樣量一致。將細胞總蛋白通過15% SDS-PAGE電泳分離后,轉膜至PVDF膜上。分別加入一抗(一抗稀釋比例均為1∶1 000),4 ℃孵育過夜。用TBST 洗膜后,辣根過氧化物酶標記二抗(1∶5 000)37 ℃ 孵育1 h,TBST 洗滌PVDF膜5次, 每次10 min,加入ECL顯影劑后,通過X光膠片曝光。
1.3統計學方法
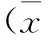
2結果
2.1大黃素抑制結腸癌細胞SW480的增殖
使用不同濃度(0、15、 30、 40、60、75和90 μM)的大黃素處理結腸癌細胞SW480 24、48和72 h 后,通過 MTT 實驗檢測細胞活力(圖1)。結果表明,大黃素能促進細胞內毒性,顯著抑制細胞增殖速率,并且抑制程度呈濃度依賴性。
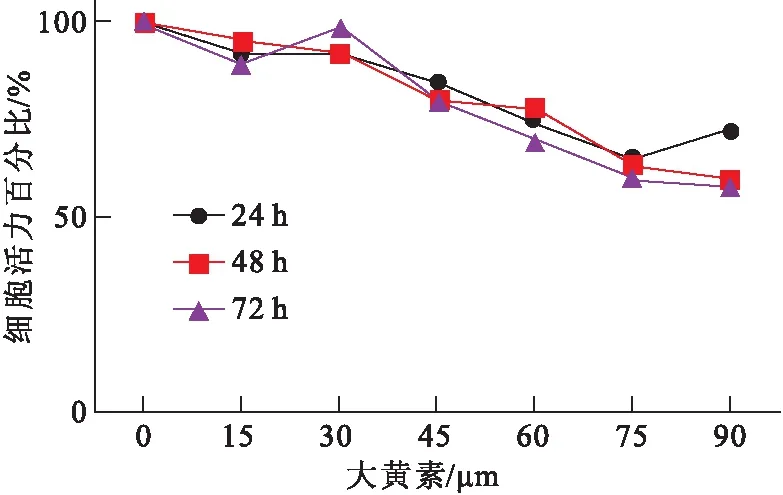
圖1不同濃度大黃素處理SW480細胞24、48和36 h的細胞活力
2.2大黃素抑制結腸癌細胞遷移和浸潤
采用45 μM大黃素處理結腸癌細胞SW480 48 h。通過劃痕實驗、Transwell和基質膠實驗檢測大黃素對結腸癌細胞遷移和浸潤能力的影響。劃痕實驗結果表明,經大黃素處理后的細胞劃痕處細胞愈合程度明顯比對照低(圖2)。Transwell 實驗結果顯示,經45 μM大黃素處理后的SW480穿過基底膜的細胞個數為(107.30±14.34),對照組穿過基底膜的細胞個數為(216.40±23.12),兩組比較,差異有統計學意義(t=7.357,P< 0.001),表明大黃素抑制了結腸癌細胞的遷移能力(圖3)。基質膠實驗結果表明,經大黃素處理后SW480的浸潤能力明顯降低,穿過基底膜的細胞數為(205.00±17.24),對照組穿過的細胞數為(342.00±24.63),兩組比較,差異有統計學意義(t=7.72,P<0.01) (圖4)。以上實驗結果說明,大黃素抑制了結腸癌細胞的遷移和浸潤能力。

圖2劃痕實驗檢測大黃素對SW480的遷移能力改變
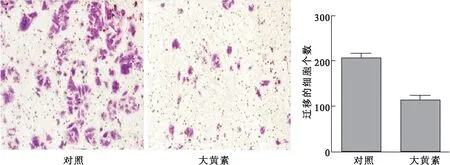
圖3Transwell 實驗檢測大黃素對SW480遷移能力的影響
圖4基質膠實驗檢測大黃素對SW480浸潤能力的影響
2.3大黃素抑制EMT信號通路
將經大黃素處理后的結腸癌細胞SW480細胞裂解液進行蛋白質免疫印跡檢測EMT相關基因的表達情況,western結果顯示:大黃素促進了SW480細胞胞內表皮標志性蛋白E-Cadherin的表達,抑制了間質化細胞標志性蛋白N-Cadherin、vimentin的表達,同時抑制了胞內信號傳導分子β-Cantein的表達(圖5)。以上結果表明大黃素通過負調控EMT事件進而抑制了結腸癌細胞的轉移。
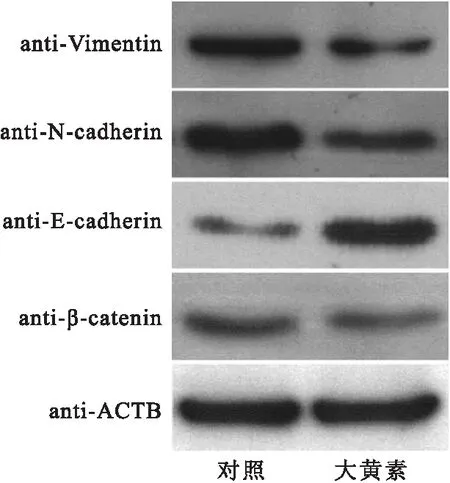
圖5免疫印跡檢測EMT相關標志性蛋白
2.4大黃素抑制惡性基因的表達
結腸癌細胞SW480經45 μM大黃素處理48 h后,Western結果顯示:SW480細胞胞內惡性基因MMP-9、MMP-2和VEGF的表達明顯降低進而抑制了結腸癌細胞的轉移。
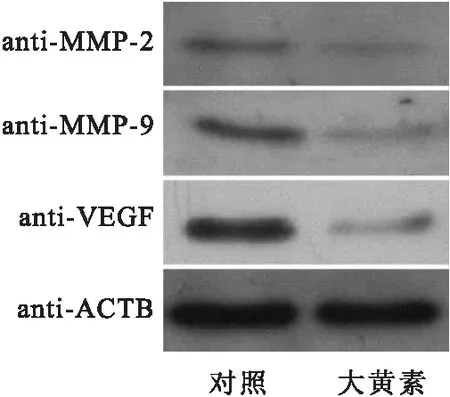
圖6免疫印跡檢測惡性基因的表達
2.5大黃素抑制Akt/mTOR和 STAT-3 信號通路
用大黃素處理結腸癌細胞SW480 48 h后,進行免疫印跡檢測。Western結果表明,大黃素抑制了AKT(S473)和mTOR(S2448)磷酸化水平,同時胞內STAT3(Tyr705)的磷酸化水平降低(圖7)。以上實驗結果表明,大黃素抑制了Akt/mTOR 和 STAT-3 信號通路。
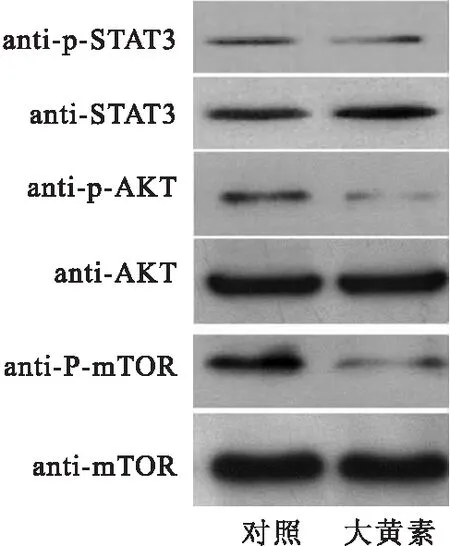
圖7免疫印跡分析AKT-mTOR和STAT3
3討論
大黃素是一種傳統中藥,作為具有抗腫瘤作用的蒽醌類藥品,主要用于抗菌、利尿、止咳等治療[9]。1976首次提出大黃素具有抗腫瘤的作用[10]。后續研究[11-13]表明大黃素對前列腺癌、肺癌、乳腺癌均具有抗增殖作用。在體內實驗中,大黃素對腫瘤細胞具有抑制作用,但對正常細胞或組織沒有明顯的毒性作用。癌癥轉移是癌癥治療過程中最為關鍵的因素[14]。大量文獻[15-16]報道,大黃素通過阻斷細胞周期和促凋亡進而抑制多種癌細胞。研究[17]表明,大黃素具有抗轉移和浸潤的作用。EMT是上皮細胞來源的惡性腫瘤細胞獲得遷移和侵襲能力的重要生物學過程,表現為上皮標志蛋白E-Cadherin表達降低,間質化標志蛋白N-Cadherin和Vimentin表達上調[18]。在本研究中,大黃素抑制了EMT過程的發生,表現為E-Cadherin高表達,而N-Cadherin和Vimentin低表達。
隨著研究的深入,EMT過程的發生受越來越多分子共同調控。文獻[19]報道,基質金屬蛋白酶(MMPS)在癌癥細胞中調控EMT時間的發生。本研究檢測了其中兩個基質金屬蛋白酶MMP-2、MMP-9。經大黃素處理后,MMP-2、MMP-9表達明顯被抑制。進而檢測調控該基質金屬蛋白酶的上游Akt/mTOR 和 STAT-3 信號通路,實驗結果表明,Akt/mTOR 和 STAT-3的磷酸化水平明顯降低。血管生成是腫瘤轉移過程中一個標志性事件,腫瘤細胞通過釋放VEGF調控胞外基質進而激活下游信號促進腫瘤的惡化和癌癥轉移[20],本實驗結果表明,大黃素能夠顯著抑制結腸癌細胞SW480胞內VEGF的表達。因此可推斷出大黃素通過抑制Akt/mTOR 和 STAT-3 信號通路、調控MMP-2、MMP-9 酶活性和抑制VEGF的表達進而抑制結腸癌細胞的轉移。
本研究結果解釋了大黃素抑制結腸癌轉移的作用機制,為其作為抗腫瘤藥物提供了理論基礎。研究表明,大黃素通過多個作用靶點影響多種癌細胞的生長、轉移和增殖,但其作用機制不同[21-23],說明藥物作用的直接靶點還不明確。筆者將在后續的研究中采用藥物蛋白組學的方法對其藥物直接作用靶點進一步驗證與研究,為其在臨床上更為廣泛地運用提供理論基礎。
參考文獻
[1]Rasool S,Kadla SA,Rasool V,etal.A comparative overview of general risk factors associated with the incidence of colorectal cancer[J].Tumour Biol,2013,34(5): 2469-2476.
[2]Ahnen DJ,Wade SW,Jones WF,etal.The increasing incidence of young-onset colorectal cancer: a call to action[J].Mayo Clin Proc,2014,89(2): 216-224.
[3]Priyadarsini RV,Nagini S.Cancer chemoprevention by dietary phytochemicals: promises and pitfalls[J].Curr Pharm Biotechnol,2012,13(1): 125-136.
[4]Srinivas G,Babykutty S,Sathiadevan PP,etal.Molecular mechanism of emodin action: transition from laxative ingredient to an antitumor agent[J].Med Res Rev,2007,27(5): 591-608.
[5]Wei WT,Lin SZ,Liu DL,etal.The distinct mechanisms of the antitumor activity of emodin in different types of cancer (Review)[J].Oncol Rep,2013,30(6): 2555-2562.
[6]Damodharan U,Ganesan R,Radhakrishnan UC.Expression of MMP2 and MMP9 (gelatinases A and B) in human colon cancer cells[J].Appl Biochem Biotechnol,2011,165(5-6): 1245-1252.
[7]Lu Y,Zhang J,Qian J.The effect of emodin on VEGF receptors in human colon cancer cells[J].Cancer Biother Radiopharm,2008,23(2): 222-228.
[8]Yang J,Li TZ,Xu GH,etal.Low-concentration capsaicin promotes colorectal cancer metastasis by triggering ROS production and modulating Akt/mTOR and STAT-3 pathways[J].Neoplasma,2013,60(4): 364-372.
[9]Kupchan SM,Karim A.Tumor inhibitors.114.Aloe emodin: antileukemic principle isolated from Rhamnus frangula L[J].Lloydia,1976,39(4): 223-224.
[10] Acevedo-Duncan M,Russell C,Patel S,etal.Aloe-emodin modulates PKC isozymes,inhibits proliferation,and induces apoptosis in U-373MG glioma cells[J].Int Immunopharmacol,2004,4(14): 1775-1784.
[11] Guo J,Xiao B,Liu Q,etal.Suppression of C-myc expression associates with anti-proliferation of aloe-emodin on gastric cancer cells[J].Cancer Invest,2008,26(4): 369-374.
[12] Guo JM,Xiao BX,Liu Q,etal.Anticancer effect of aloe-emodin on cervical cancer cells involves G2/M arrest and induction of differentiation[J].Acta Pharmacol Sin,2007,28(12): 1991-1995.
[13] Yilmaz M,Christofori G.EMT,the cytoskeleton,and cancer cell invasion[J].Cancer Metastasis Rev,2009,28(1-2): 15-33.
[14] He TP,Yan WH,Mo LE,etal.Inhibitory effect of aloe-emodin on metastasis potential in HO-8910PM cell line[J].J Asian Nat Prod Res,2008,10(5-6): 383-390.
[15] Kuo PL,Lin TC,Lin CC.The antiproliferative activity of aloe-emodin is through p53-dependent and p21-dependent apoptotic pathway in human hepatoma cell lines[J].Life Sci,2002,71(16): 1879-1892.
[16] Lin ML,Lu YC,Chung JG,etal.Down-regulation of MMP-2 through the p38 MAPK-NF-kappaB-dependent pathway by aloe-emodin leads to inhibition of nasopharyngeal carcinoma cell invasion[J].Mol Carcinog,2010,49(9): 783-797.
[17] Spaderna S,Schmalhofer O,Hlubek F,etal.Epithelial-mesenchymal and mesenchymal-epithelial transitions during cancer progression[J].Verh Dtsch Ges Pathol,2007,91: 21-28.
[18] Kessenbrock K,Plaks V,Werb Z.Matrix metalloproteinases: regulators of the tumor microenvironment[J].Cell,2010,141(1): 52-67.
[19] Zhang L,Kim S,Ding W,etal.Arsenic sulfide inhibits cell migration and invasion of gastric cancer in vitro and in vivo[J].Drug Des Devel Ther,2015,9: 5579-5590.
[20] Buchanan FG,DuBois RN.Connecting COX-2 and Wnt in cancer[J].Cancer Cell,2006,9(1): 6-8.
[21] Huang D,Du X.Crosstalk between tumor cells and microenvironment via Wnt pathway in colorectal cancer dissemination[J].World J Gastroenterol,2008,14(12): 1823-1827.
[22] Rao C,Lin SL,Wen H,etal.Crosstalk between canonical TGF-β/Smad and Wnt/β-catenin signaling pathway[J].Journal of Zhejiang University Medical Sciences,2013,42(5): 591-596.
[23] Su YT,Chang HL,Shyue SK,etal.Emodin induces apoptosis in human lung adenocarcinoma cells through a reactive oxygen species-dependent mitochondrial signaling pathway[J].Biochem Pharmacol,2005,70(2): 229-241.
Emodin′s Suppression on Metastasis of Colorectal Cancer
WangMinjin1,WangYuanyuan2△,FanJibin3.
1.DepartmentofLaboratoryMedicine,WestChinaHospital,SichuanUniversity,Chengdu610041,China; 2.SchoolofBiomedicalSciences,ChengduMedicalCollege,Chengdu610083,China; 3.ZitongWorkers′HospitalinMianyang,Zitong622150,China
【Abstract】ObjectiveTo study the suppression and its underlying molecular mechanism of emodin on the. MethodsMTT method was used to identify the effective working concentration of emodin. Scarification, Transwell and Matrigel assays were used to measure the influence of emodin on the metastasis of colorectal cancer cells. Western blot was used to detect the expression of proteins involved in EMT and marker proteins in upstream signaling pathway. Results MTT assay demonstrated that emodin significantly inhibited the proliferation of SW480. Scarification, Transwell and Matrigel assays showed that emodin suppressed the metastasis and invasion of colorectal cancer. Western blot showed that emodin promoted the expression of N-cadherin while inhibited the expression of E-cadherin, Vimmentin and β-catenin. Meanwhile, emodin decreased the expression levels of VEGF, MMP-2, MMP-9 and the phosphorylation of Akt/mTOR and STAT3. ConclusionEmodin suppressed STAT3 and Akt/mTOR signaling pathway, which further inhibited the metastasis of colorectal cancer. This study provides theoretical evidence that emodin functions as adjunct or direct drugs that targeting at colorectal cancer cells.
【Key words】Colorectal cancer; Emodin; Metastasis; Signal pathway
doi:10.3969/j.issn.1674-2257.2016.01.004
*基金項目:四川省教育廳基金項目(No:13ZB0225);四川省衛生廳基金項目(No:130303)
通信作者:△王元元, E-mail:vicky6936vicky@126.com
【中圖分類號】R735.35
【文獻標志碼】A
網絡出版地址:http://www.cnki.net/kcms/detail/51.1705.R.20160301.0944.006.html
·論著·

