三氯生毒性效應及水質基準研究進展
鄭欣,劉婷婷,王一喆,王曉南,劉征濤,張亞輝,楊霓云,閆振廣
中國環境科學研究院,環境基準與風險評估國家重點實驗室,國家環境保護化學品生態效應與風險評估重點實驗室,北京 100012
?
三氯生毒性效應及水質基準研究進展
鄭欣,劉婷婷,王一喆,王曉南,劉征濤,張亞輝,楊霓云,閆振廣*
中國環境科學研究院,環境基準與風險評估國家重點實驗室,國家環境保護化學品生態效應與風險評估重點實驗室,北京 100012
摘要:三氯生(TCS)是一種高效的廣譜抗菌劑,廣泛用于個人護理品和工業產品中,在水體和陸生環境及生物體內均被檢測到,具有較高的潛在生態風險。文章綜述了近年來國內外有關三氯生的生物毒性效應,分別對其在生物分子水平、細胞水平、組織器官水平及個體水平的毒性效應進行了分析總結。此外,對三氯生的水質基準研究現狀進行了分析,并對其可能的研究方向進行了探討。相關研究發現,三氯生可對水生生物特別是藻類產生較高的急性毒性。三氯生可在生物分子水平上產生毒性效應,影響酶和基因的正常表達及生理功能;還可產生細胞毒性,導致生物體組織器官產生畸變、癌變。三氯生對生物體具有顯著的內分泌干擾效應,可擾亂生物體的生殖系統、甲狀腺系統和神經系統的正常生理功能。但目前還沒有充分的證據表明,通過日常使用個人護理品攝入的三氯生會對人體產生毒性效應。此外,雖然三氯生在水體中具有較高的暴露風險,但其水質標準基準研究并不完善,相關研究還較少。鑒于三氯生對水生生物具有較高的毒性效應,今后應加強三氯生水質基準方面的研究,不斷豐富三氯生的水生生物毒性數據庫,并進一步探索其在生物分子水平上的水質基準研究,以建立更科學有效的水質基準和標準。
關鍵詞:三氯生;急性毒性;分子細胞毒性;致畸致癌性;內分泌干擾性;水質基準
引用格式:鄭欣, 劉婷婷, 王一喆, 王曉南, 劉征濤, 張亞輝, 楊霓云, 閆振廣. 三氯生毒性效應及水質基準研究進展[J]. 生態環境學報, 2016, 25(3): 539-546.
ZHENG Xin, LIU Tingting, WANG Yizhe, WANG Xiaonan, LIU Zhengtao, ZHANG Yahui, YANG Niyun, YAN Zhenguang. Research Progress on the Toxic Effects and Water Quality Criteria of Triclosan [J]. Ecology and Environmental Sciences, 2016, 25(3): 539-546.
三氯生(Triclosan,TCS)作為一種廣譜抗菌劑,被廣泛應用于個人護理產品(如牙膏、化妝品)、日用消費類產品(如纖維織品)、醫療用品(如牙科類耗材、醫用殺菌劑等)以及家居清潔用品(Daughton et al.,1999)。TCS的大量應用使其在各種環境介質中廣泛存在,其主要通過污水廠出水排放進入水體,最終進入到地表水、土壤和地下水,現已在污水處理廠進出水、污泥、河流、河口及沉積物中都有檢測到TCS(Chu et al.,2007;Chalew et al.,2009)。據調查,美國表層水體中TCS的質量濃度為250~850 ng·L-1(Capdevielle et al.,2007),中國河流(遼河、海河、黃河、珠江和東江)表層水體中TCS質量濃度高達478 ng·L-1,在沉積物中的質量濃度高達2723 ng·L-1(Zhao et al.,2013)。TCS為疏水性物質,其辛醇水分配比(Kow)為4.8,具有在生物體內富集的趨勢。研究調查顯示,TCS在水生植物(如剛毛藻Cladophora、寬葉香蒲Typha latifolia L.等)、水生動物(如海豚),甚至人類血漿和母乳中均有較高的檢出率(高海萍等,2012)。
隨著TCS在環境介質和生物體內檢出率的逐年升高,其對生態環境和人類健康的潛在威脅越來越受到關注。研究發現,TCS可使污水處理系統產生大量抗性細菌,這些抗性細菌隨出水排放到環境中,可能對生態環境造成較大的危害(Pruden,2014)。此外,TCS由于具有親脂性,可長期在生物體內累積,對生物具有潛在的威脅(周世兵等,2008)。目前,已有大量研究探索了TCS對生物可能產生的毒性效應,本文對這些研究成果進行了系統性描述,發現TCS對生物體在個體水平乃至分子水平均可產生毒性效應。
鑒于TCS對生物的急慢性毒性效應和生理生態毒性,許多國家對食品和個人護理品中TCS的添加量進行了限制(Dayan et al.,2007),但是卻很少有國家對TCS在水體中的濃度設定安全閾值。近些年TCS在我國水體中的暴露潛勢逐漸上升,顯示出較高的生態風險(Chen et al.,2014)。然而相關的基準標準研究并不完善,對水質管理造成了一定的困難。本文對TCS的水質基準研究現狀進了分析,并探討了可能的研究方向,以期建立更加完善合理的水質基準,為TCS的標準制定和生態風險預防管理提供參考。
1 水生生物急性毒性效應
TCS在水體中廣泛存在,其對水生生物的毒性效應是殺菌效果的100~1000倍(Chalew et al.,2009)。本文從相關文獻及數據庫中搜集整理了TCS對水生生物的急性毒性數據(表1),毒性數據涉及到的生物包括水生植物、魚類、兩棲類、甲殼類、軟體動物、昆蟲等。其中,對TCS最敏感的前5種生物均為藻類,與之前的研究結論一致(高海萍等,2012;Dann et al.,2011)。除藻類外,魚類也表現出很高的敏感性,如泥鰍Misgurnus anguillicaudatus和麥穗魚Pseudorasbora parva的敏感性僅次于藻類。
2 酶和基因毒性
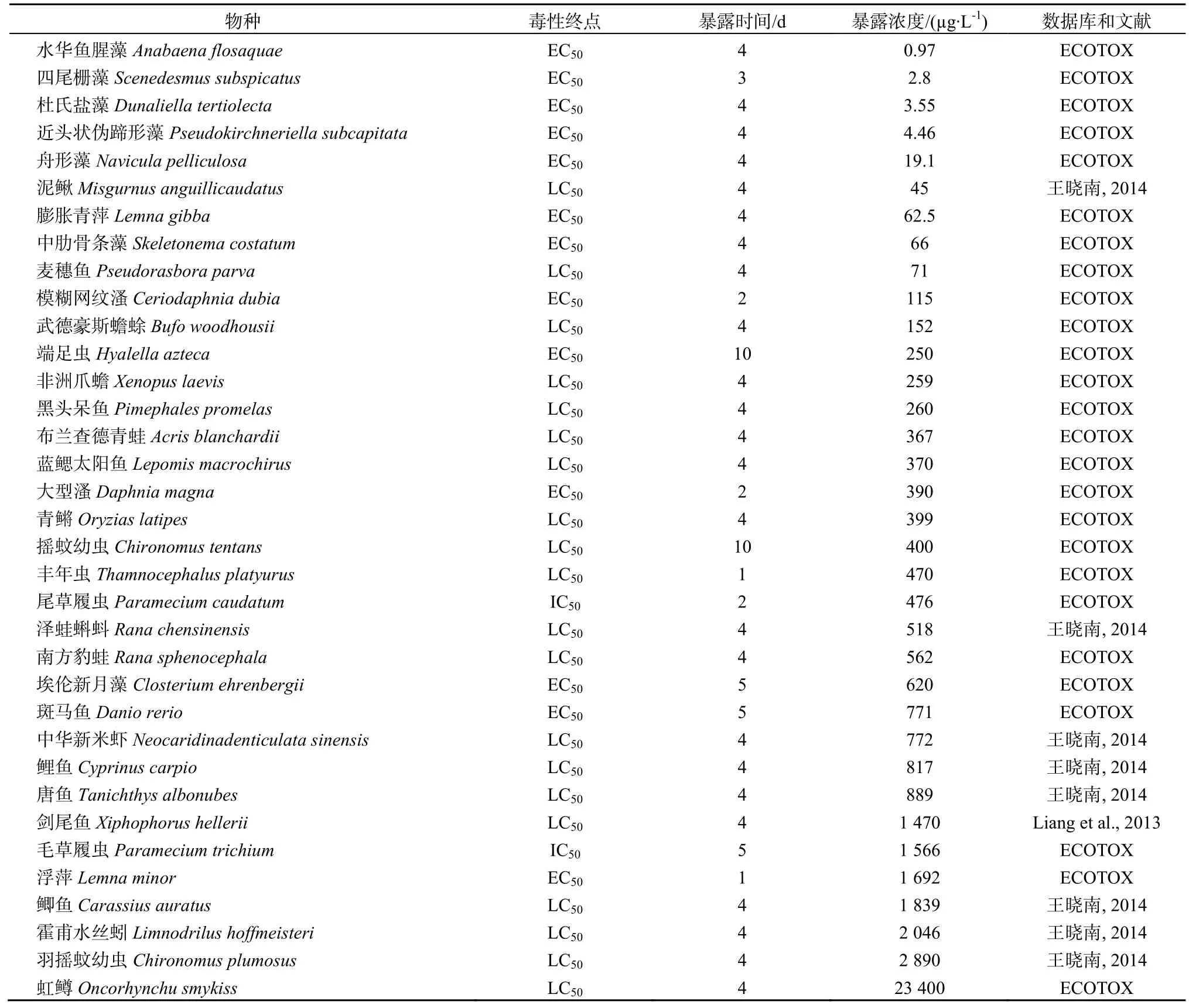
表1 三氯生的水生生物急性毒性Table 1 Acute toxicity of triclosan on aquatic organisms
表2顯示,TCS可對生物體產生分子水平的毒性效應。TCS在酶和蛋白水平上的毒性效應表現為,TCS可通過誘導氧化壓力對生物體內的抗氧化酶系統產生抑制作用,如氧化物歧化酶(SOD)、丙二醛(MDA)、氨基比林N-脫甲基酶(APND)、過氧化氫酶(CAT)和谷胱甘肽-S-轉移酶(GST);并對生物體的細胞色素氧化酶系統產生影響,如P450、CYP1A等;此外,還有研究顯示TCS可影響熱休克蛋白Hsp70的表達(Liang et al.,2013;Peng et al.,2013;Binelli et al.,2009;Pedriali,2012;武小燕,2013;Lin et al.,2010;Lin et al.,2014)。基因水平的影響表現為,TCS可直接導致DNA的損傷,也可能作為加合物對DNA的合成產生影響,干擾DNA的正常生理遺傳功能(Binelli et al.,2009;Pedriali,2012;Lin et al.,2014)。此外,TCS可通過干擾細胞內分子信號的傳導對機體產生毒性效應。利用熒光探針的流式細胞儀測定TCS對小鼠胸腺細胞中Zn2+濃度的影響,發現亞致死濃度的TCS可誘導細胞內的氧化應激反應,導致與硫醇蛋白結合的Zn2+釋放,促使細胞內Zn2+濃度升高,導致機體免疫力下降(Tamura et al.,2012)。此外,還有研究顯示TCS可限制L型Ca2+在心肌細胞和骨骼肌細胞相關信號通路中的轉導,導致心肌和骨骼肌收縮力的減弱,相關證據包括:暴露在TCS中不到20 min,麻醉小鼠的心臟功能減弱了25%;向小鼠施以單劑量的TCS,60 min后小鼠的握力減弱了18%;黑頭鰷魚Fathead minnow在TCS中暴露7 d后,游泳速度比正常魚類顯著降低(Ahn et al.,2008;Cherednichenkoa et al.,2012)。
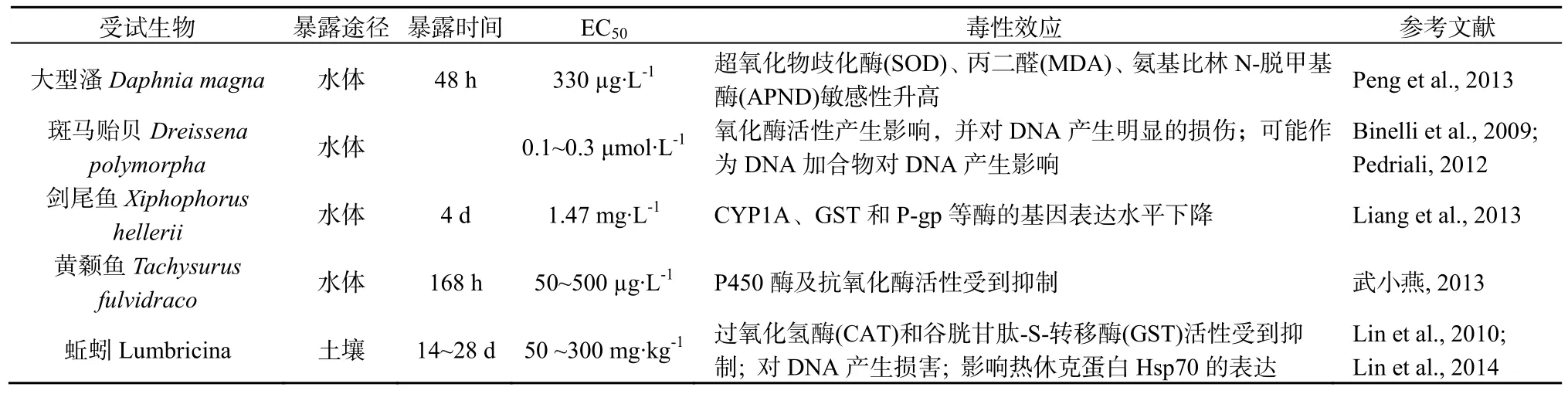
表2 TCS對生物體的酶和基因毒性Table 2 Toxic effects of TCS on enzyme and gene
3 細胞毒性效應
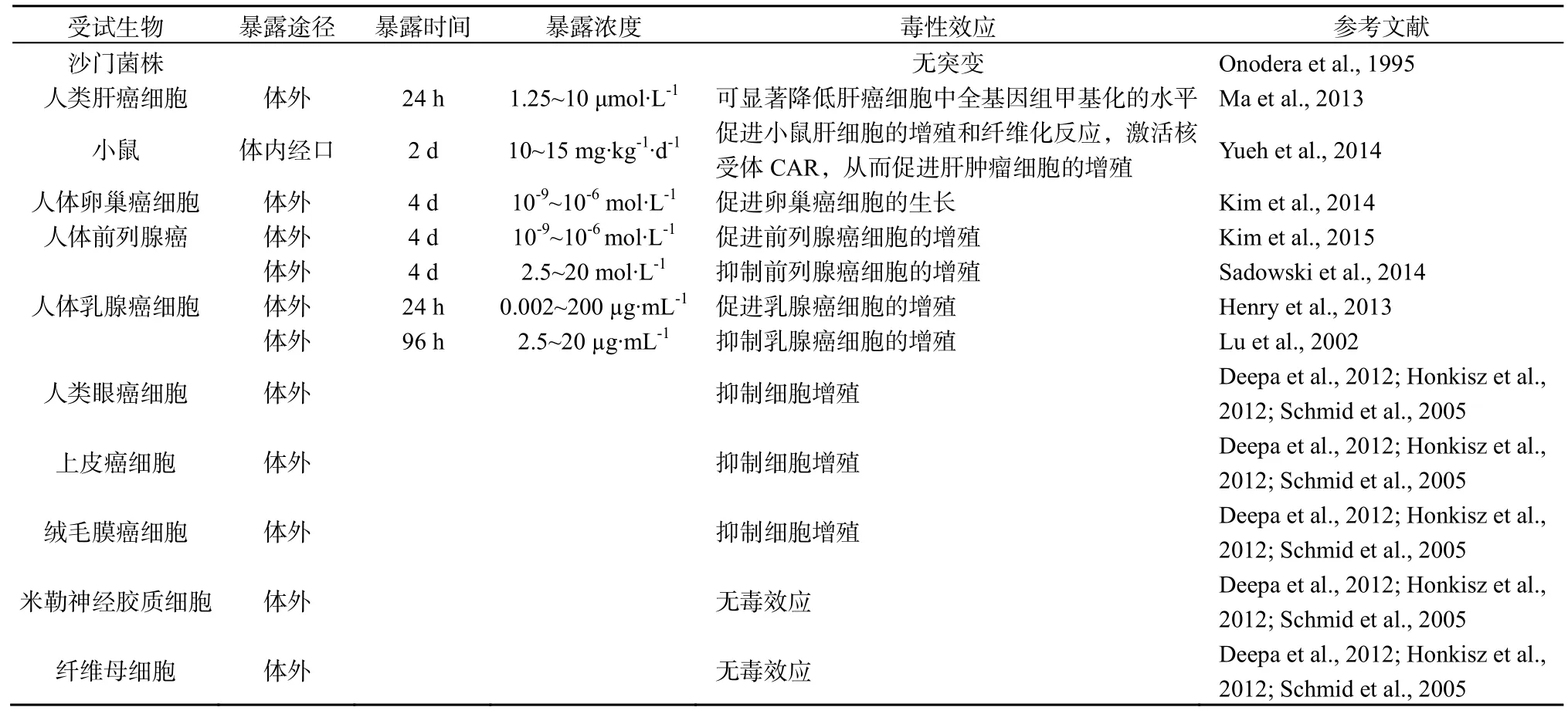
表3 TCS的細胞毒性效應Table 3 Mutagenic and carcinogenic effects of TCS
TCS是否具有致突變和致癌效應一直存有爭議(表3)。有研究者以沙門菌株為對象進行致突變試驗,結果并未發現突變效應(Onodera et al., 1995)。但由于TCS對于細菌本身就是高毒性物質,其致突變效應難于檢測,因此以細菌類生物作為致突變效應的試驗對象并不合理,其研究結果還有待進一步確認(Rodricks et al.,2010)。而其后的研究中,部分研究顯示TCS可促進癌細胞的增殖,如人類肝癌細胞、卵巢癌細胞、前列腺癌細胞和乳腺癌細胞(Ma et al.,2013;Yueh et al.,2014;Kim et al.,2014;Kim et al.,2015;Henry et al.,2013)。還有一部分研究卻顯示TCS對癌細胞有抑制作用,如前列腺癌細胞、乳腺癌細胞、人類眼癌細胞、上皮癌細胞和絨毛膜癌細胞(Sadowski et al.,2014;Liu et al.,2002;Deepa et al.,2012;Honkisz et al.,2012;Schmid et al.,2005)。值得注意的是,以前列腺癌細胞和乳腺癌細胞為試驗對象的研究均出現了相反的作用效果,差異的原因還有待于進一步研究。機理研究顯示,TCS對癌細胞增殖的效應可能是通過雌/雄激素介導的信號通路調控與細胞周期和凋亡有關的周期蛋白D1、P21和Bax的表達,從而促進癌細胞的生長(Yueh et al.,2014;Kim et al.,2014);而抑制作用則是通過對FAS表達的限制引起的,TCS對癌細胞產生促進效應還是抑制效應可能與某些條件有關,但仍需進一步探索(Henry et al.,2013)。此外,上述研究均是以癌細胞為試驗對象,并不能證明TCS會誘導正常細胞的畸變或癌化。研究顯示,TCS在相似范圍內對良性細胞并未顯示出細胞毒性,如米勒神經膠質細胞和纖維母細胞(Honkisz et al.,2012;Schmid et al.,2005)。推測其原因為,FAS在癌細胞中有較高的含量,在正常細胞中則含量較少(Brusselmans et al.,2009),由于TCS可通過抑制FAS對細胞產生毒性作用,因此TCS對癌細胞的影響要大于正常細胞,但該推測有待研究進行驗證。
4 內分泌干擾性
4.1 生殖系統毒性
TCS與雌激素在結構上相似,可通過與內源性雌激素競爭結合雌激素受體(ER),從而直接影響ER的促轉錄活性,引起雌激素效應(或抗雄激素效應)。如表4顯示,TCS可加快雌鼠的性成熟,增加其子宮重量;并可使孕鼠產道開口提前;對于雄鼠,TCS可降低其睪丸、前列腺等性腺器官的重量,顯著減少雄激素相關蛋白及固醇生成酶的基因表達,并降低血清中雄性相關激素的水平,TCS可在雄鼠副睪中累積,引起其組織形態發生改變,并對精子的形態和數量產生影響。表4還顯示,TCS可提高雄性水生動物體卵黃原蛋白的含量,并對其精子的形態和數量產生影響。體外細胞試驗也顯示,TCS可限制睪丸間質細胞中黃體生成素和絨膜促性腺激素誘導的睪酮的生成,其可能的機制是:環腺苷酸(cAMP)具有調節神經遞質合成,促進激素分泌的作用,而TCS可降低腺苷酸環化酶的活性,減少cAMP的產量并抑制固醇生成酶基因的轉錄和表達,導致固醇系統的紊亂,從而抑制睪丸素的合成。雖然TCS在結構上與雌激素相似,但卻可以顯示出一定的雄激素效應(或抗雌激素效應)。如表4所示,TCS可抑制羊胎盤中雌激素硫酸轉移酶的活性,影響胎盤對胎兒的雌激素供給;可改變雄性青鳉魚的鰭長并可能對其性別比例產生影響,還可降低非洲爪蟾血清中卵黃原蛋白和睪酮的水平;體外乳腺癌細胞試驗也顯示,TCS可增強二氫睪酮調節的雄激素受體應答基因的轉錄激活,其增強作用可達到180%。
機理研究顯示,TCS可分別與細胞中的雌激素受體和雄激素受體結合,既顯示出雌激素效應又顯示出雄激素效應;同時,在與雌激素或雄激素共存時,卻可分別限制雌激素誘導的ERE-CAT受體的表達和雄激素誘導的LTR-CAT受體的表達,顯示出抗雌激素活性或抗雄激素活性(Henry et al.,2013)。TCS顯示出抗雌激素活性的性質與其他外源性雌激素(如對羥苯甲酸酯、多氯聯苯、己烯雌酚等)相比比較特別,因為后者只顯示出雌激素活性而未顯示抗雌激素活性,這種差異可能是由于它們在分子結構上存在差異以及它們與受體結合模式上存在差異,其機理需要更深入的研究(Byford et al.,2002;Darbre et al.,2002)。
4.2 甲狀腺系統毒性
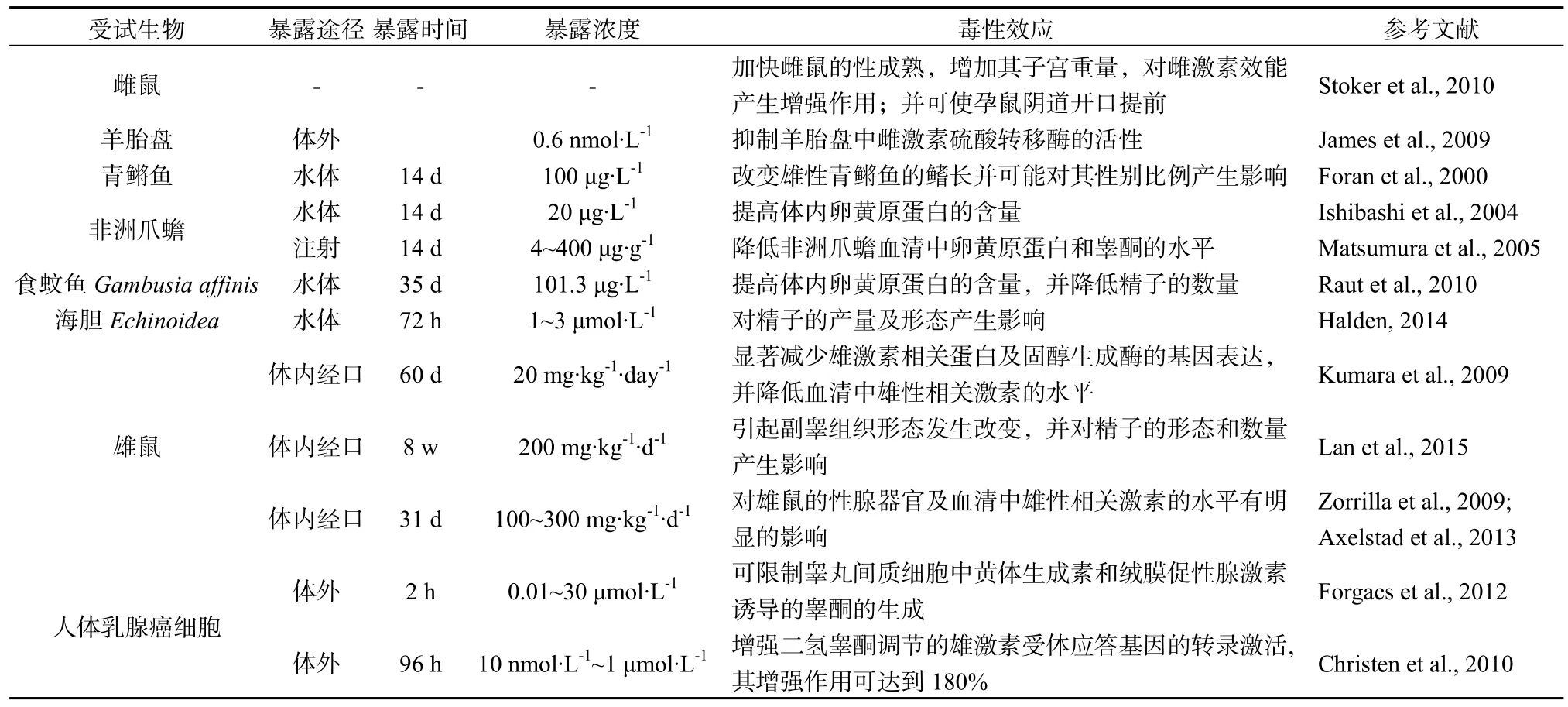
表4 TCS對生殖系統的毒性效應Table 4 Toxic effects of TCS on reproductive system
TCS的內分泌干擾性還表現為對生物體甲狀腺系統的影響(表5)(Schuur et al.,1998;Veldhoen et al.,2006;Crofton et al.,2007;Paul et al.,2010;Paul et al.,2012;Paul et al.,2013;Pinto et al.,2013)。TCS可通過間接的方式對甲狀腺系統代謝產生影響,如TCS可降低生物體內甲狀腺激素受體α的轉錄水平,或抑制T2磺基轉移酶的活性,對甲狀腺激素介導的生長發育過程產生影響。此外,還有學者推測TCS可通過PXR和CAR信號通路上調肝酶代謝相關基因的表達,增強對甲狀腺素T4的代謝,從而導致生物體內甲狀腺素水平的降低,引起低甲狀腺素血癥。然而,其后的一些研究并未能提供有力支持,該假設有待于進一步驗證(Zorrilla et al.,2009;Paul et al.,2012;Paul et al.,2013)。除了通過間接方式對甲狀腺系統代謝產生影響,TCS也可能直接對甲狀腺組織及其激素產生影響。研究顯示,TCS可引起斑馬魚體內促甲狀腺激素(TSH)和碘化鈉載體(NIS)相關基因的上調表達,并可引起甲狀腺組織形態學上的畸變,但其機制還有待于進一步研究(Pinto et al.,2013)。
5 神經系統毒性
TCS作為內分泌干擾物質,相關研究多集中于其對生殖系統和甲狀腺系統影響,關于其對神經系統影響的研究則比較少。Szychowski et al.(2015)首次對TCS的神經毒性機制進行了研究,發現TCS可通過誘導FasR和caspase-8的表達來激活外部細胞凋亡信號通路,從而引起腦內神經元細胞的凋亡。但TCS是否還可以通過其他途徑對神經系統產生影響還需要更多的探索。研究顯示,與TCS在結構上非常相似的三氯卡班(TCC)能夠通過增強外源性雌激素誘導的芳香化酶AroB的過度表達,對腦組織的發育產生影響(Chung,2011),因此是否可以推測TCS也能通過與TCC相似的機制對腦組織產生影響還需要研究進行驗證。此外,由于甲狀腺對腦組織的發育有重要作用,而TCS可對生物體的甲狀腺系統產生影響(Pinto et al.,2013),因此推測TCS也可能通過影響甲狀腺系統從而對腦神經系統的發育產生危害,但此機制還需要進一步驗證。
6 人體健康毒性效應
關于TCS對人體的毒性作用,大多進行的是體外細胞試驗研究。如利用人體乳腺癌細胞進行的TCS毒性檢測,顯示TCS可以促進人體乳腺癌細胞的增殖;以及利用人體間充質干細胞進行的體外細胞試驗,顯示TCS在低濃度(0.156~2.5 μmol·L-1下會抑制人體hMSCs脂肪細胞的分化(Guo et al.,2012)。盡管TCS在人體外細胞試驗中顯示出一定的毒性效應,但還沒有證據表明TCS可對人體產生毒性。Allmyr et al.(2009)研究了TCS對人體甲狀腺系統的影響,通過14 d的暴露檢測,人體血液中TCS的含量顯著提高,但并未對甲狀腺激素及相關酶的活性產生影響,表明正常使用含TCS的個人護理品不會對人體的甲狀腺內穩態產生影響。Ros-Llor et al.(2014)研究認為,即使頻繁使用含有TCS的口腔清洗劑也不會對人體產生基因毒性。Witorsch(2014)通過對現有的關于TCS對哺乳動物和人類影響的相關文獻的整理,認為現有研究雖然證明TCS可對動物產生毒性,但其作用機制在人體內是不存在的,因此通過日常使用個人護理品而攝入的TCS,不具有對人體產生內分泌干擾的風險。TCS對人體不產生毒性效應的原因可能是,TCS在人體內并不持久,會在24 h內被快速排出體外,因此在人體內的積累較少(Sandborgh-Englund et al.,2006)。即使有報道顯示,人體乳液中的TCS含量可高達2.1 mg·kg-1,但仍會通過人體可能的解毒機制逐漸消除,但這種解毒機制還有待于進一步研究(Dayan,2007)。
7 水質基準研究

表5 TCS對甲狀腺系統的毒性效應Table 5 Toxic effects of TCS on thyroid system
雖然研究顯示TCS具有潛在的生態風險,但由于TCS屬于一種新型污染物,關于其標準的制定還比較欠缺,如我國地表水水質標準還未有關于其標準閾值的規定。此外,TCS的水質基準的研究也比較少,美國等發達國家還沒有關于其水質基準的研究。最近,我國學者利用10種中國本土水生生物進行了TCS的急慢性試驗,并推導出TCS的急性基準值(Criteria Maximum Concentration,CMC)和慢性基準值(Criteria Continuous Concentration,CCC)分別為0.009和0.002 mg·L-1(Wang et al.,2013),該結果對于我國制定TCS的水質標準制訂具有一定的指導意義。
通常水質基準是建立在個體水平毒性數據的基礎上,如急性水質基準的建立是以LC50或EC50為毒性終點,慢性水質基準的建立是以最低有影響濃度LOEC或最大無影響濃度NOEC等為毒性終點。然而,當生物體暴露于污染物時,基因表達的改變通常要先于細胞、組織、個體和群體的改變,相比于個體水平的生存指標或生殖指標,基因表達水平上的響應更具有早期預警的作用,因此基因毒性數據可能比急慢性毒性數據更為敏感(Menzel et al.,2009)。但其后的研究并不能為該假設提供有力證明,部分重金屬(Cd、Zn)的研究顯示出相反的趨勢,即其基因毒性數據敏感性遠低于其慢性毒性數據(Fedorenkova et al.,2010;Yan et al.,2012)。這可能是由多方面的原因造成的,如相關的毒性數據較少,使研究結果的可靠性降低;此外,試驗數據的目標基因可能并不是對污染物最敏感的響應基因,造成了基因毒性數據的敏感性低于個體水平的慢性數據。因此,基因毒性數據是否能應用于水質基準的研究仍需要進一步的驗證,而TCS由于基因毒性數據較少,還未有相關方面的研究。
此外,污染物質對生物的毒性作用常常存在著Hormesis效應(即低劑量促進,高劑量抑制效應),且Hormesis的效應濃度通常比NOEC低10倍左右(Stebbing et al.,1998)。也就是說,Hormesis效應濃度可能是更嚴格意義上的無作用濃度,這有助于更準確地劃定安全濃度,對生態風險評估有著重要意義(Chapman,2002)。在水質基準研究方面,將Hormesis效應濃度作為毒性作用終點,同時結合分子水平的毒性效應來進行水質基準的研究,可能會得出比現有的慢性基準更為嚴格的水質基準值,但還未有相關方面的研究,其科學性和有效性有待于驗證。
8 總結與展望
綜上,TCS可在分子和細胞水平上對生物造成影響,產生酶和基因毒性,導致生物體組織器官的突變和癌變。此外,TCS對生物體具有顯著的內分泌干擾性,可通過對生殖發育系統、甲狀腺系統和神經系統產生影響,造成生物內穩態的破壞,但相關的分子機制還需要加強研究。雖然TCS可對哺乳動物產生毒性效應,但現有研究還不能證明TCS可對人體產生類似的毒性效應,日常攝入的TCS不會對人體產生內分泌干擾,但其清除機理有待于進一步研究。此外,鑒于我國水體中TCS的暴露風險不斷上升,應盡快擴充TCS的本土毒性數據,為進一步完善其水質基準提供數據支持。另外,開展以TCS為目標污染物的基因組學研究,利用高通量技術篩選對TCS最敏感的響應基因,有利于進一步探索基因毒性數據應用于水質基準研究的可能性。同時,開展TCS在基因水平的Hormesis效應研究,以期從不同的視角探索水質基準研究的可能性,有利于更科學合理地制定水質基準標準。
參考文獻:
AHN K C, ZHAO B, CHEN J G, et al. 2008. In vitro biologic activities of the antimicrobials triclocarban, ttsanalogs, and triclosan in bioassay screens: receptor-based bioassay screens [J]. Environmental Health Perspectives, 116(9): 1203-1210.
ALLMYR M, PANAGIOTIDIS G, SPARVE E, et al. 2009. Human exposure to triclosan via toothpaste does not change CYP3A4 activity or plasma concentrations of thyroid hormones [J]. Basic & Clinical Pharmacology & Toxicology, 105(5): 339-344.
AXELSTAD M, BOBERG J, VINGGAARD A M, et al. 2013. Triclosan exposure reduces thyroxine levels in pregnant and lactating rat dams and in directly exposed off spring [J]. Food and Chemical Toxicology,59: 534-540.
BINELLIA, COGNI D, PAROLINIM, et al. 2009. Cytotoxic and genotoxic effects of in vitro exposure to triclosan and trimethoprim on zebra mussel (Dreissena polymorpha) hemocytes [J]. Comparative Biochemistry and Physiology C: Pharmacology Toxicology and Endocrinology, 150(1): 50-56.
BRUSSELMANS K, SWINNEN J. 2009. The Lipogenic Switch in Cancer [M]. Mitochondria and Cancer: Springer New York): 39-59.
BYFORD J R, SHAW L E, DREW M G B, et al. 2002. Oestrogenic activity of parabens in MCF7 human breast cancer cells [J]. Journal of Steroid Biochemistry, 80(1): 49-60.
CAPDEVIELLE M, EGMOND R V, WHELAN M, et al. 2007. Consideration of exposure and species sensitivity of triclosan in the freshwater environment [J]. Integrated Environmental Assessment and Management, 4(1): 15-23.
CHALEW T E A, HALDEN R U. 2009. Environmental exposure of aquatic and terrestrial biota to triclosan and triclocarban [J]. Journal of the American Water Resources Association, 45(1): 4-13.
CHAPMAN P M. 2002. Ecological risk assessmen (ERA) and hormesis [J]. The Science of the Total Environment, 288(1-2): 131-140.
CHEN Z F, YING G G, LIU Y S, et al. 2014. Triclosan as a surrogate for household biocides: An investigation into biocides in aquatic environments of a highly urbanized region [J]. Water Research, 58: 269-279.
CHEREDNICHENKOA G, ZHANGA R, BANNISTERB R A, et al. 2012. Triclosan impairs excitation-contraction coupling and Ca2+ dynamics in striated muscle[J]. PNAS, 109(40): 1-6.
CHRISTEN V, CRETTAZ P, OBERLI-SCHRAMMLI O, et al. 2010. Some flame retardants and the antimicrobials triclosan and triclocarban enhance the androgenic activity in vitro [J]. Chemosphere, 81(10): 1245-1252.
CHU S, METCALFE C D. 2007. Simultaneous determination of triclocarbon and triclosan in municipal biosolids by liquid chromatography tandem mass spectrometry [J]. Journal of Chromatography A, 1164(1-2): 211-218.
CHUNG E, GENCO M C, MEGRELIS L, et al. 2011. Effects of bisphenol A and triclocarban on brain-specific expression of aromatase inearly zebrafish embryos [J]. PNAS, 108(43): 17732-17737.
CROFTON K, PAUL K B, DE VITO M J, et al. 2007. Short-term in vivo exposure to the water contaminant triclosan: evidence for disruption of thyroxine [J]. Environmental Toxicology and Pharmacology, 24(2): 194-197.
DANN A B, HONTELA A. 2011. Triclosan: environmental exposure,toxicity and mechanisms of action [J]. Journal of Applied Toxicology,31(4): 285-311.
DARBRE P D, BYFORDJ R, SHAW L E, et al. 2002. Oestrogenic activity of isobutylparaben in vitro and in vivo [J]. Journal of Applied Toxicology, 22(4): 219-226.
DAUGHTON C G, TEMES T A. 1999. Pharmaceuticals and personal care products in the environment: agent s of subtle change [J]. Environmental Health Perspectives, 107(6): 907-938.
DAYAN A D. 2007. Risk assessment of triclosan [Irgasan (R)] in human breast milk [J]. Food and Chemical Toxicology, 45(1): 125-129.
DAYAN J, YOSHIDA K. 2007. Psychological and pharmacological treatments of mood and anxiety disorders during pregnancy and postpartum. Review and synthesis [J]. Uropean journal of obstetrics,gynecology, and reproductive biology (Paris), 36(6): 530-548.
DEEPA P R, VANDHANA S, JAYANTHI U, et al. 2012. Therapeutic and toxicologic evaluation of anti-lipogenic agents in cancer cells compared with non-neoplastic cells [J]. Basic & Clinical Pharmacology & Toxicology, 110(6): 494-503.
USEPA. ECOTOX Database [EB/OL]. [2015-07-10]. http://cfpub.epa.gov/ecotox/.
FEDORENKOVA A, VONK J A, LENDERS H J R, et al. 2010. Ecotoxicogenomics: Bridging the gap between genes and populations [J]. Environmental Science & Technology, 44(11): 4328-4333.
FORAN C M, BENNETT E R, BENSON W H. 2000. Developmental evaluation of a potential non-steroidal estrogen: triclosan [J]. Marine Environmental Research, 50(1-5): 153-156.
FORGACS A L, DING Q, JAREMBA R G, et al. 2012. BLTK1 murine Leydig cells: a novel steroidogenic model for evaluating the effects of reproductive and developmental toxicants [J]. Toxicological Sciences,127(2): 391-402.
GUO L W, WU Q G, GREEN B, et al. 2012. Cytotoxicity and inhibitory effects of low-concentration triclosan on adipogenic differentiation of human mesenchymal stem cells [J]. Toxicology and Applied Pharmacology, 262(2): 117-123.
HALDEN R U. 2014. On the need and speed of regulating triclosan and triclocarban in the United States [J]. Environmental Science & Technology, 48: 3603-3611.
HENRY N D, FAIR P A. 2013. Comparison of in vitro cytotoxicity,estrogenicity andanti-estrogenicity of triclosan, perfluorooctane sulfonate and perfluorooctanoic acid [J]. Journal of Applied Toxicology,33(4): 265-272.
HONKISZ E, ZIEBA-PRZYBYLSKA D, WOJTOWICZ A K. 2012. The effect of triclosan on hormone secretion and viability of human choriocarcinoma JEG-3 cells [J]. Reproductive Toxicology, 34(3): 385-392.
ISHIBASHIH, MATSUMURA N, HIRANO M, et al. 2004. Effects of triclosan on the early life stages and reproduction of medaka Oryzias latipes and induction of hepatic vitellogenin [J]. Aquatic Toxicology,67(2): 167-179.
JAMES M O, LI W, SUMMERLOT D P, et al. 2009. Triclosanis a potent inhibitor of estradiol and estrone sulfonation in sheep placenta [J]. Environment International, 36(8): 942-949.
KIM J Y, YI B R, GO R E, et al. 2014. Methoxychlor and triclosan stimulates ovarian cancer growth by regulating cell cycle-andapoptosis-related genes via an estrogen receptor-dependent pathway [J]. Environmental Toxicology and Pharmacology, 37(3): 1264-1274.
KIM S H, HWANG K A, SHIM S M, et al. 2015. Growth and migration of LNCaP prostate cancer cells are promoted by triclosan and benzophenone-1 via an androgen receptor signaling pathway [J]. Environmental Toxicology and Pharmacology, http://dx.doi.org/ 10.1016/ j.etap.2015.01.003
KUMARA V, CHAKRABORTY A, KURAL M R, et al. 2009. Alteration of testicular steroidogenesis and histopathology of reproductive system in male rats treated with triclosan [J]. Reproductive Toxicology, 27(2): 177-185.
LAN Z, KIM T K, BI K S, et al. 2015. Triclosan exhibits a tendency to accumulate in the epididymis and shows sperm toxicity in male sprague-dawley rats [J]. Environmental Toxicology, 30(1): 83-91.
LIANG X M, NIE X P, YING G G, et al. 2013. Assessment of toxic effects of triclosan on the swordtail fish (Xiphophoru shelleri) by a multi-biomarker approach [J]. Chemosphere, 90(3): 1281-1288.
LIN D S, LI Y, ZHOU Q X, et al. 2014. Effect of triclosan on reproduction,DNA damage and heat shock protein gene expression of the earthworm Eisenia fetida [J]. Ecotoxicology, 23(10): 1826-1832.
LIN D, ZHOU Q, XIE X, et al. 2010. Potential biochemical and genetic toxicity of triclosan as an emerging pollutant on earthworms (Eisenia fetida) [J]. Chemosphere, 81(10): 1328-1333.
LIU B, WANG Y, FILLGROVE K L, et al. 2002. Triclosan inhibits enoyl-reductase of type I fatty acid synthase in vitro and is cytotoxic to mcf-7 and skbr-3 breast cancer cells [J]. Cancer Chemotherapy and Pharmacology, 49(3): 187-193.
MA H M, ZHENG L J, LI Y H, et al. 2013. Triclosan reduces the levels of global DNA methylation in HepG2 cells [J]. Chemosphere, 90(3): 1023-1029.
MATSUMURA N, ISHIBASHI H, HIRANO M, et al. 2005. Effects of nonylphenol and triclosan on production of plasma vitellogenin and testosterone in male South African clawed frogs (Xenopus laevis) [J]. Biological & Pharmaceutical Bulletin, 28(9): 1748-1751.
MENZEL R, SWAINS C, HOESS S, et al. 2009. Gene expression profiling to characterize sediment toxicity--A pilot study using Caenorhabditis elegans whole genome microarrays [J]. BMC Genomics, 10: 160-174.
ONODERA S, TAKAHASHI M, OGAWA M, et al. 1995. Mutagenicity of polychlorophenoxyphenols (predioxins) and their photodegradation products in aqueous solution [J]. Japanese Journal of Pharmacology,41(3): 212-219.
PAUL K B, HEDGE J M, BANSAL R R, et al. 2012. Developmental triclosan exposure decreases maternal, fetal, and early neonatal thyroxine: a dynamic and kinetic valuation of a putative mode-of-action [J]. Toxicology, 300(1-2): 31-45.
PAUL K B, HEDGE J, DEVITO M, et al. 2010. Short-term exposure to triclosan decreases thyroxine in vivo via upregulation of hepatic catabolism in young Long-Evans rats [J]. Toxicological Sciences,113(2): 367-379.
PAUL K B, THOMPSON J T, SIMMONS S O, et al. 2013. Evidence for triclosan-induced activation of human and rodent xenobiotic nuclear receptors [J]. Toxicology in Vitro, 27(7): 2049-2060.
PEDRIALI A. 2012. Cyto-genotoxic effects and protein alterations induced by some pharmaceutical compounds and illicit drugs on non-target organisms [D]. Milan: University of Milan: 1-166.
PENG Y, LUO Y, NIE X P, et al. 2013. Toxic effects of Triclosan on the detoxification system and breeding of Daphnia magna [J]. Ecotoxicology, 22(9): 1384-1394.
PINTO P I S, GUERREIRO E M, POWER D M. 2013. Triclosan interferes with the thyroid axis in the zebra fish (Danio rerio) [J]. Toxicology Research, 2(1): 60-69.
PRUDEN A. 2014. Balancing water sustainability adn public health goals in the face of growing concerns about antibiotic resistance [J]. Environmental Science & Technology, 48(1): 5-14.
RAUT S A, ANGUS R A. 2010. Triclosan has endocrine-disrupting effects inmale Western mosquitofish, Gambusia affinis [J]. Environmental Toxicology and Chemistry, 29(6): 1287-1291.
RODRICKS J V, SWENBERG J A, BOZELLECA J F, et al. 2010. Triclosan: a critical review of the experimental data and development of margins of safety for consumer products [J]. Critical Reviews in Toxicology,40(5): 422-484.
ROS-LLOR I, LOPEZ-JORNET P. 2014. Cytogenetic analysis of oral mucosa cells, induced by chlorhexidine, essential oils in ethanolic solution and triclosan mouthwashes [J]. Environmental Research, 132: 140-145.
SADOWSKI M C, POUWER R H, GUNTER J H, et al. 2014. The fattyacid synthase inhibitor triclosan: repurposing an anti-microbial agent for targeting prostate cancer [J]. Oncotarget, 5(19): 9362-9381.
SANDBORGH-ENGLUND G, ADOLFSSON-ERICI M, ODHAM G, et al. 2006. Pharmacokinetics of triclosan following oral ingestion in humans [J]. Journal of Toxicology and Environmental Health, Part A: Current Issues, 69(20): 1861-1873.
SCHMID B, RIPPMANN J F, TADAYYONM, et al. 2005. Inhibition of fatty acid synthase prevents preadipocyte differentiation [J]. Biochemical and Biophysical Research Community, 328(4): 1073-1082.
SCHUUR A G, LEGGER F F, VAN MEETEREN M E, et al. 1998. In Vitro inhibition of thyroid hormone sulfation by hydroxylated metabolites of halogenated aromatic hydrocarbons [J]. Chemical Research in Toxicology, 11(9): 1075-1081.
STEBBING A R D. 1998. A theory for growth hormesis [J]. Mutation Research, 403(1-2): 249-258.
STOKER T E, GIBSON E K, ZORRILLA L M. 2010. Triclosan exposure modulates estrogen-dependent responses in the female wistar rat [J]. Toxicological Sciences, 117(1): 45-53.
SZYCHOWSKI K A, SITARZA M, WOJTOWICA A K. 2015. Triclosan induces fas receptor-dependent apoptosis in mouse neocortical neurons in vitro [J]. Neuroscience, 284: 192-201.
TAMURA I, KANBARA Y, SAITO M, et al. 2012. Triclosan, an antibacterial agent, increases intracellular Zn [J]. Chemosphere, 86(1): 70-75.
VELDHOEN N, SKIRROW R C, OSACHOFF H, et al. 2006. The bactericidal agent triclosan modulates thyroid hormone-associated gene expression and disrupts postembryonic anuran development [J]. Aquatic Toxicology, 80(3): 217-227.
WANG X N, LIU Z T, YAN Z G, et al. 2013. Development of aquatic life criteria for triclosan and comparison of the sensitivity between native and non-native species [J]. Journal of Hazardous Materials, 260: 1017-1022.
WITORSCH R J. 2014. Critical analysis of endocrine disruptive activity of triclosan and its relevance to human exposure through the use of personal care products [J]. Critical Reviews in Toxicology, 44(6): 535-555.
YAN Z G, YANG N Y, WANG X N, et al. 2012. Preliminary analysis of species sensitivity distribution based on gene expression effect [J]. Science China Earth Sciences, 55(6): 907-913.
YUEH M F, TANIGUCHI K, CHEN S J, et al. 2014. The commonly used antimicrobial additive triclosan is a liver tumor promoter [J]. PNAS,111(48): 17200-17205.
ZHAO J L, ZHANG Q Q, CHEN F, et al. 2013. Evaluation of triclosan and triclocarban at river basin scale using monitoring and modeling tools: Implications for controlling of urban domestic sewage discharge [J]. Water Research, 47(1): 395-405.
ZORRILLA L M, GIBSON E K, JEFFAY S C, et al. 2009. The effects of triclosan on puberty and thyroid hormones in male wistar rats [J]. Toxicological Sciences, 107(1): 56-64.
高海萍, 周雪飛, 張亞雷, 等. 2012. 三氯生對水生生物的毒性效應研究進展[J]. 環境化學, 31(8): 1145-1149.
王曉南. 2014. 典型污染物水生生物基準關鍵技術研究[D]. 北京: 北京師范大學: 1-157.
武小燕. 2013. 布洛芬、三氯生對黃顙魚P450酶及抗氧化酶系的毒性效應[D]. 廣州: 暨南大學: 1-102.
周世兵, 周雪飛, 張亞雷, 等. 2008. 二氯生在水環境中的存在行為及遷移轉化規律研究進展[J]. 環境污染與防治, 30(10): 71-74, 101.
Research Progress on the Toxic Effects and Water Quality Criteria of Triclosan
ZHENG Xin, LIU Tingting, WANG Yizhe, WANG Xiaonan, LIU Zhengtao, ZHANG Yahui,YANG Niyun, YAN Zhenguang*
State Key Laboratory for Environmental Criteria and Risk Assessment, State Environment Protection Key Laboratory of Ecological Effects and Risk Assessment of Chinese, Chinese Research Academy of Environmental Sciences, Beijing 100012, China
Abstract:Triclosan (TCS), an effective broad antibacterial agent, has long been used in personal care products and industrial products. With inceasing high detection rates in aquatic environment, terrestrial environment and organisms, TCS poses potential ecological risks. This paper summarizes recent advances about the toxic effect of TCS to organisms at levels of molecular, cell, tissue and organ, and indivdual, respectivelly. It aslo analyzes the reseach status of water quality criteria related to triclosan, and discusses some possible research directions on this field. Researches show that TCS is acutely toxic to aquatic organisms, especially algae. At microscopic level, TCS presents molecular and cellular toxicity, disrupting the expression and physiological function of enzyme and gene, leading to the mutation and canceration in tissues and organs of organisms. Additionally, TCS could cause adverse effects on the reproductive system, thyroid system and nervous system of organisms, showing evident endocrine disruption. However currently,there is no strong evidence that TCS intake through personal care products could pose a threat to human health. Given the high exposure risk in aquatic environment, researches on water quality standards and criteria are relatively less. Future research on this field should be strengthened. We should make more researches on the toxic effect of TCS on aquatic organisms to enrich the toxicity database and a further exploration on the water quality criteria at molecular level.
Key words:triclosan; acute toxicity; molecular and cellular toxicity; mutagenic and carcinogenic; endocrine disruption; water quality criteria
DOI:10.16258/j.cnki.1674-5906.2016.03.025
中圖分類號:X171.5; X824
文獻標志碼:A
文章編號:1674-5906(2016)03-0539-08
基金項目:國家水體污染控制與治理科技重大專項(2012ZX07501-003-06);科技部科技基礎性工作專項(2014FY120600)
作者簡介:鄭欣(1981年生),女,助理研究員,博士,從事水質基準研究。E-mail: Zhengxin@craes.org.cn
*通信作者
收稿日期:2015-08-18

