條葉百合的離體多倍體誘導
吳雪娟,楊利平,陳 敏
(長江師范學院生命科學與技術學院,重慶408100)
條葉百合的離體多倍體誘導
吳雪娟,楊利平*,陳 敏
(長江師范學院生命科學與技術學院,重慶408100)
為增強條葉百合的抗性,對其進行多倍體改良,利用不同濃度的秋水仙素附加2.00%二甲亞砜誘變離體培養條葉百合小鱗莖。結果表明:0.10%的秋水仙素溶液誘導效果好,直徑1.4cm鱗莖變異率達100%,直徑0.7cm鱗莖變異率達92%。經對4株疑似多倍體誘變株系的染色體檢測,僅有1個變異株系中含有48條染色體,4倍體細胞占63%,對其切割分離和純化培養,最終獲得1個四倍體株系(2n=4x=48)。除觀察到正常的染色體外,株系1、株系3和株系4約30%左右的細胞中含有數目不等的B染色體。
條葉百合;多倍體;秋水仙素;染色體;B染色體
條葉百合(Lilium callosum)為百合科多年生球根植物,其分布較廣,從我國的東北到臺灣都有標本采集記載,但因自然選擇、生態環境破壞及掠奪性采挖等因素,在其原產地已很難查詢[1]。至今,條葉百合在某些原產地仍處于天然野生狀態。條葉百合具有耐寒、耐旱、稍耐鹽堿、適應性強和病蟲害少等優點,可作為親本用于百合的抗性育種。此外,條葉百合花小,是理想的花境材料和“迷你型”花卉素材,主要可以應用于花境栽培或庭院栽培[2]。但條葉百合的莖稈纖細,易倒伏,故迫切需要對其進行育種改良。關于條葉百合的種子萌發,高效快速組織培養繁殖體系建立和以條葉百合為親本的雜交育種等已有研究報道[3-6],但未見條葉百合的多倍體誘變育種的研究報道。
通常認為,多倍體植株具有粗大性外,適應性增強,觀賞性提高,對新品種選育有重要意義。野生百合資源的化學誘變已有報道,其中多用秋水仙素為誘變劑并取得較好結果。如用秋水仙素采用浸泡法和混培法對我國特有的青島百合(L.tsingtauense)進行多倍體誘導,誘導頻率高達53.3%[7];用秋水仙素浸泡細葉百合(L.pumilum)種子,變異率達30%[8];用0.15%秋水仙素附加2.00%二甲亞砜誘變離體培養的卷丹(L.lancifolium)小鱗莖,變異率達54.29%[9]。筆者以條葉百合鱗莖為試驗材料,利用秋水仙素為誘變劑進行多倍體誘導,以獲得條葉百合多倍體的幼苗,為其開發利用提供新的種質材料。
1 材料與方法
1.1 材料
以條葉百合的鱗莖為試驗材料,采自黑龍江省齊齊哈爾市。
1.2 無菌苗的獲得
無菌苗參照文獻[9]方法獲得。
1.3 秋水仙素誘導
以2%的二甲基亞砜(DMSO)作溶劑配制成濃度為0.05%、0.08%和0.10%的秋水仙素溶液,24℃條件下,搖床轉速100r/min和室內避光分別處理無菌條葉百合鱗莖48h和72h。其中,濃度為0.05%和0.08%的秋水仙素處理直徑較小的鱗莖(平均值0.7cm),濃度為0.10%的秋水仙素分別處理直徑較小(平均值0.7cm)和直徑較大(平均值1.4cm)的2種鱗莖(表)。每隔3d觀察并記錄條葉百合的變異情況,并拍下具有變異特征的組織或幼苗的照片。
1.4 多倍體材料的穩定性與鑒定
參照文獻[9]等方法進行。將疑似變異器官從外植體上切割后接種到MS+6-BA 2.0mg/L+NAA 0.2mg/L培養基上,待疑似變異器官重新脫分化、再分化出芽,將其繼代增殖成1個株系,并標記該疑似變異株系。將正常對照植株和四倍體變異植株無菌苗接種到生根培養基(1/2MS+6-BA 0.5mg/L+NAA 0.2mg/L),25℃恒溫,培養4周。煉苗后移栽到草炭與蛭石混配(V草炭∶V蛭石=1∶1)的培養基質中培養,觀察兩者區別。
2 結果與分析
2.1 秋水仙素處理對條葉百合的誘導效果
由表中可見,0.05%秋水仙素有誘導效果,但誘導率較低;0.10%的秋水仙素溶液處理變異率最高。可見,在一定時間內,秋水仙素濃度越高,變異率越高,相同濃度下,不同處理時間誘導效果差異較小。0.10%的秋水仙素溶液處理大小鱗莖時,較大鱗莖的誘導效果稍好。

表 秋水仙素處理條葉百合的誘導情況Table Induction of L.callosumtreated by colchicine
2.2 多倍體的穩定性
將秋水仙素誘導處理的材料經過40d左右的培養,有些器官發生明顯的形態變異現象,如葉片變寬、變厚、變短,葉片肉質化,葉片表面粗糙;葉色加深;葉緣兩叉開裂等。這些表型變異,疑似多倍體變異株(圖1)。幼苗這些疑似變異株并不是每株具有所有的形態變異特征,可能具有其中的1個或幾個特征。
2.3 四倍體植株的鑒定及純化培養
經對4株疑似多倍體誘變株系的染色體檢測結果顯示(圖2),變異株系1、株系2、株系3中染色體24條的細胞占56%~63%,未見48條染色體,屬假誘變株系。變異株系4體細胞由31條到48條5個數目的染色體構成,其中48條染色體細胞占63%。從4個疑似多倍體誘變株系的染色體數目組成看,其體細胞均由不同比例染色體數目混合構成,但變異株系4已比較接近四倍體。將變異株系4切割分離和純化培養,最終得1個四倍體株系(2n=4x=48)。經細胞檢測誘變材料,除正常的染色體外,約30%細胞中能觀察到1至幾條的數目不定的B染色體。

圖1 條葉百合多倍體誘變過程的植株形態Fig.1 The morphology of L.callosumpolyploid during the induction
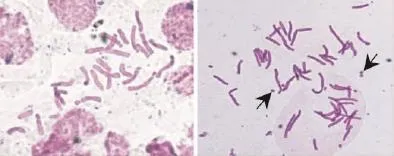
圖2 條葉百合根尖的染色體數目Fig.2 Chromosome quantity of root tip cells in L.callosum
2.4 四倍體植株的形態特征和移栽成活率
經培養,對照植株和四倍體變異植株生根率達100%。觀察誘變為四倍體植株的形態特征,剛純化出的四倍體植株生長相當緩慢,但葉色深綠,葉片變得粗大且表面不光滑,小鱗莖增大,根系變粗短。6周后,四倍體植株生長速度漸漸加快,植株整體表現粗大,顏色加深。其中,四倍體植株葉片寬度是二倍體植株的1.12倍,變異植株小鱗莖直徑是對照的1.41倍。出瓶煉苗后成活率達91%。
3 結論與討論
用0.10%濃度秋水仙素處理的試驗材料雖誘導效果顯著,誘變率超過90%,明顯高于前人在百合屬其他種類中的誘變效果[7-9],可能是種間對秋水仙素反應存在差異的表現。試驗中出現誘導的鱗莖中心部分腐爛甚至完全死亡等爛心現象,中心部位腐爛一般出現在秋水仙素處理的第3天,及時將其腐爛部位切割掉,其余未腐爛的部位幾乎不會受到影響,會繼續分化,部分植株的葉片顏色加深或高度肉質化。這是由于試驗中秋水仙素濃度較高,誘變劑毒性嚴重干擾了組織的代謝和分化[10]。由于百合小鱗莖內外層鱗片發育程度不同及小鱗莖個體間的不完全均一,導致誘變劑毒性使試驗材料部分受害現象發生。鱗莖的直徑大小與誘變劑的處理效果有密切關系,直徑1.4cm與直徑0.7cm的鱗莖相比,大鱗莖比小鱗莖鱗片多,不同發育階段的內外層鱗片對秋水仙素的反應敏感性多樣化。當秋水仙素處理時,大鱗莖更易發生一系列反應以適應環境,眾多鱗片中有發育后期對誘變劑反應遲鈍的,有發育中前期對誘變劑較為敏感的可達到預期誘變效果,或有剛剛發育的鱗片對誘變劑過于敏感嚴重受害而死亡。可見,在誘變劑處理較大鱗莖時,其中總有一些鱗片能夠達到育種期望的誘變程度。
B染色體是區別于正常染色體,隨機獨立存在于整倍體中的特殊染色體,不同物種B染色體數目不同,同一物種不同個體間B染色體數目不同,同一個體不同細胞B染色體數目不同,甚至不同分裂期細胞B染色體數目不同。此外,也存在同一物種,有的植株有B染色體,而有的植株不存在B染色體[11]。如李懋學[12]等對岷江百合的染色體進行觀察發現,岷江百合細胞中有B染色體,而劉華敏[13]等對岷江百合的研究過程中并未觀察到B染色體。有研究者在觀察產自我國黑龍江的條葉百合時,現頻率極低的1條B染色體[14]。本研究亦觀察到,部分條葉百合細胞中存在有B染色體。且不同株系B染色體出現的頻率不同,如株系4有33.33%,株系1有32%,株系3有26.67%,而株系2中并未觀察到B染色體。同一株系不同細胞含B染色體數目也不同,株系1的B染色體數目從1~5不等;株系4中B染色體數目有3條、4條、5條、6條、8條和9條共6種;株系3中B染色體數目多為2條或3條。
[1]汪發纘,唐 進.中國植物志:第14卷(百合科)[M].北京:科學出版社,1980:159-165.
[2]劉堂茂,吳年煒,孫曉玉,等.條葉百合的保護與利用[J].韶關學院學報,2005,26(6):86-89.
[3]孫曉玉,楊利平,姜浩野,等.條葉百合種子萌發的研究[J].植物研究,2003,23(1):61-65.
[4]顧地周,趙淑玲,郭 偉,等.條葉百合和垂花百合高效快繁體系的建立[J].福建農林大學學報:自然科學版,2009,38(3):244-247.
[5]趙 芳,向地英,孫曉玉,等.條葉百合的開花生物學特性研究[J].河北農業大學學報,2010,33(1):45-49.
[6]楊利平,李 蕊,程千釘.百合遠緣雜交育種及其真實性鑒定[J].植物遺傳資源學報,2011,12(6):896-903.
[7]張俊芳,劉慶華,王奎玲,等.秋水仙素誘導青島百合四倍體研究[J].核農學報,2009,23(3):454-457.
[8]楊英杰,葛蓓孛,魏 倩,等.秋水仙素誘導細葉百合多倍體研究[J].中國農業大學學報,2013,18(1):128-133.
[9]陳 艾,楊利平,譚 艷,等.秋水仙素誘變離體卷丹多倍體的研究[J].植物遺傳資源學報,2014,15(6):1385-1389.
[10]安學麗,蔡一林,王久光,等.化學誘變及其在農作物育種上應用[J].核農學報,2003,17(3):239-242.
[11]王玉元.染色體遺傳中的一個不解之謎——B染色體[J].武漢植物學研究,1997,15(1):73-79.
[12]李懋學,龍雅宜,龔維忠.岷江百合B染色體的初步觀察[J].植物學報,1984,26(2):151-155.
[13]劉華敏,智 麗,趙麗華,等.四種野生百合核型分析[J].植物遺傳資源學報,2010,11(4):469-473.
[14]楊利平,丁 冰,劉香環,等.東北百合屬植物的細胞遺傳多樣性[J].東北林業大學學報,1996,24(5):19-23.
(責任編輯:劉忠麗)
In vitro Polyploid Induction of Lilium callosum
WU Xuejuan,YANG Liping*,CHEN Min
(College of Life Science and Technology,Yangtze Noramal University,Chongqing408100,China)
L.callosummaterial used for experiment were polypoidized to improve the plant disease resistance of the species.Bulblets of L.callosumwere treated by colchicine of different concentration with 2.00%dimethyl sulfoxide for in vitro addition.The results indicated that 0.10%colchicine had the best induction,100%of the 1.4cm bulblets and 92%of the 0.7cm bulblets were inducted.By examining the chromosome for the four obtained mutative strains which were possibly the polyploids,only one strain showed 48chromosomes,and the proportion of tetraploid was 63%.After the separation and purification,finally one tetraploid strain(2n=4x=48)was obtained.Besides the normal chromosomes,B chromosomes with varying number were observed in some strains with the proportion of nearly 30%of the total cells.
Lilium callosum;polyploid;colchicine;chromosome;B chromosome
S682.2+9
A
1001-3601(2016)08-0346-0084-03
2016-01-12;2016-07-09修回
重慶市涪陵區科技計劃項目“西南地區特色百合資源收集與種質創新”(FLKJ,2012ABB1086)
吳雪娟(1994-),女,本科,研究方向:花卉育種。E-mail:1164418577@qq.com
*通訊作者:楊利平(1962-),男,教授,博士,從事花卉育種工作。E-mail:836711655@qq.com

