2型豬鏈球菌Rgg調控因子的序列結構分析及原核表達
鄭 峰,劉 鵬,蔡炳岡,朱 進,潘秀珍,王長軍
?
2型豬鏈球菌Rgg調控因子的序列結構分析及原核表達
鄭峰,劉鵬,蔡炳岡,朱進,潘秀珍,王長軍
南京軍區軍事醫學研究所,南京210002
摘要:目的克隆2 型豬鏈球菌Rgg轉錄調控因子編碼基因并進行原核表達和純化,并對其進行生物信息學分析和結構預測。方法PCR擴增2型豬鏈球菌中國強毒株05ZYH33基因組的rgg基因,構建重組表達質粒pQE30-rgg,轉化大腸桿菌M15,篩選陽性轉化子進行IPTG誘導表達,SDS-PAGE 鑒定表達產物;確定最佳誘導條件后,大量培養誘導重組表達菌,Ni2+親和層析柱純化重組蛋白,非變性PAGE電泳分析其體外聚合狀態。結果整個Rgg蛋白由15個α螺旋和2個β轉角組成;構建的重組質粒在宿主菌中可高效表達,15 ℃過夜誘導獲得可溶性重組蛋白的比例最高;獲得了較高純度的Rgg重組蛋白,并證實其在體外可形成同源二聚體。結論成功地原核表達并純化了Rgg重組蛋白,證明它存在二聚體結構,為進一步研究其調控機制奠定了基礎。
關鍵詞:豬鏈球菌;Rgg轉錄調控因子;原核表達
Supported by the National Natural Science Foundation of China (Nos. 31300119, 31170124, 81471920) and the Natural Science Foundation of Jiangsu Province (No. BK2012080)
2型豬鏈球菌(Streptococcussuisserotype 2,S.suis2)是豬鏈球菌35個血清型中分布最廣、致病能力最強的一種致病菌,可感染豬和人類引起腦膜炎、關節炎、敗血癥、肺炎乃至急性死亡,其疫源地主要分布在北歐、東南亞一些養殖和食用豬肉的國家和地區[1-3]。我國1998年和2005年分別在江蘇省和四川省暴發了S.suis2大規模感染人和豬的公共衛生事件,累計報告病例200余例,其中死亡42人[4],使得S.suis2致病性的研究受到國內外越來越多的關注。
Rgg家族的轉錄調節因子廣泛分布于各種革蘭氏陽性菌當中。該基因首先于1992年在格氏鏈球菌(S.gordonii)中發現[5],之后又在乳酸桿菌和多種鏈球菌中均發現了與其結構類似的調控蛋白。研究發現,Rgg家族的調控因子在不同的細菌中執行各種功能,包括控制糖代謝通路、胞外蛋白的分泌、細菌素的表達或者細菌密度感應等[6-8]。近年來,學者們也逐步聚焦于該蛋白的結構功能研究。例如,Loughman等以化膿鏈球菌(S.pyogenes)中的RopB蛋白為模型,證明了3個保守的氨基酸殘基對于Rgg 家族的轉錄調節功能是必需的[9];Parashar V等成功制備了停乳鏈球菌(S.dysgalactiae)中的Rgg2蛋白晶體,首次解析了Rgg家族蛋白成員的X射線三維晶體結構[10]。本實驗室前期在S.suis2中國強毒株05ZYH33中對該基因進行了敲除,發現Rgg的缺失改變了345個基因的轉錄水平,占總基因數的15.87%,并證明它與細菌的代謝、生長周期和毒力密切相關[11]。但是對于Rgg調節因子在S.suis2中的具體調控機制,及其特異性調控轉錄的下游基因,我們仍知之甚少。鑒于此,本研究通過結構域檢索和系統進化樹等方法,對S.suis2的Rgg轉錄調控因子進行生物信息學分析,并在大腸桿菌中對其進行體外表達和純化,為下一步深入研究Rgg 轉錄調控因子的結構和功能奠定基礎。
1 材料與方法
1.1實驗材料
1.1.1質粒和菌株菌株S.suis2 05ZYH33為本實驗室分離保存;表達質粒pQE30及其宿主菌E.coliDH5α和E.coliM15為本室保存;質粒pMD18-T購自TaKaRa公司。
1.1.2試劑PCR擴增試劑盒、T4連接酶為TaKaRa公司產品;DNA膠回收試劑盒為Promega公司產品;限制性內切酶BamHⅠ和Hind Ⅲ、DNA marker、蛋白marker均為Fermentas產品;超濾管為Millipore公司產品;抗His-Tag單克隆抗體、辣根過氧化物酶( HRP) 標記羊抗鼠IgG購自北京天根生物技術公司;DAB 顯色液購自武漢博士德生物工程有限公司。
1.2方法
1.2.1Rgg蛋白的生物信息學分析用Blastp和ClustalW等生物信息學工具對05ZYH33的Rgg氨基酸序列進行分析,并用ESPript 3.0[12]對Clustal W比對結果進行二級結構分析。再使用MEGA 3.1軟件中的Neighbor-Joining方法繪制Rgg蛋白的系統發生樹。
1.2.2目的基因的PCR 擴增及克隆根據rgg編碼基因序列設計合成引物,進行PCR擴增。上游引物為5′-ggatccatgagttgttttgggaaaac-3′,劃線部分為BamH I 酶切位點;下游引物為5′-aagcttctactcaataagtatcttttc-3′,劃線部分為Hind Ⅲ酶切位點。引物由南京金斯瑞生物技術公司合成。PCR體系:10×Taq buffer 4 μL,2.5 mmol/ L dNTP 3 μL,模板DNA 2 μL,10 pmol/μL上游,下游引物各0.5 μL,Ex Taq 酶0.5 μL,雙蒸水補至40 μL。PCR程序:94 ℃ 5 min,94 ℃ 30 s,52 ℃ 1 min,72 ℃ 1 min,30個循環,最后72 ℃延伸10 min。1%瓊脂糖凝膠電泳鑒定PCR產物,試劑盒回收目的片段。將回收產物與pMD18-T載體連接轉化至DH5α感受態細菌,經PCR檢測為陽性者送南京金斯瑞測序鑒定。
1.2.3重組表達載體的構建和鑒定質粒pMD18T-rgg和pQE30載體分別用BamH I /Hind Ⅲ雙酶切,并用膠回收試劑盒回收目的片段。4 ℃過夜連接后轉化DH5α感受態,經菌液PCR檢測為陽性的克隆提取質粒,進行PCR和雙酶切鑒定。
1.2.4重組蛋白的表達及其純化將重組表達載體pQE30-rgg轉化E.coliM15,菌液培養至OD600值約0.6 時加入IPTG至終濃度1 mmol/L,不同溫度下誘導表達4 h后收集菌體超聲破碎,離心取上清與沉淀進行SDS-PAG電泳,檢測目的蛋白的表達水平。將重組體擴大培養并經IPTG誘導表達,收集菌體,PBS重懸后冰浴超聲破碎,離心后上清用Ni2+親和層析柱純化重組蛋白,SDS-PAGE電泳鑒定目的蛋白純度。純化蛋白透析脫鹽除去咪唑,做非變性PAGE電泳分析,鑒定其是否存在聚合體結構。
1.2.5Western blot分析取純化蛋白進行PAGE電泳,采用電轉印法將蛋白轉移至硝酸纖維素膜,5%脫脂奶粉37 ℃封閉1 h后,加1∶1 000稀釋的His-Tag單克隆抗體,4 ℃孵育過夜,加1∶4 000稀釋的HRP標記山羊抗小鼠IgG,37 ℃孵育1 h,加底物DAB/ H2O2顯色。
2結果
2.1S.suis2編碼Rgg蛋白的序列結構分析將S.suis2中國強致病株05ZYH33的Rgg氨基酸序列在NCBI進行Blastp比對,結果發現該蛋白與S.dysgalactiae、無乳鏈球菌(S.agalactiae)、肺炎鏈球菌(S.pneumoniae)、S.pyogenes、變形鏈球菌(S.mutans)、口腔鏈球菌(S.oralis) 和馬鏈球菌獸疫亞種(S.equisubsp.zooepidemicus)中的Rgg家族蛋白的氨基酸序列分別具有26%、28%、26%、20%、40%、32%和42%的一致性。以停乳鏈球菌的Rgg2蛋白晶體結構(Protein data bank (PDB) ID: 4YV6 )為模型,使用ClustalW軟件和ESPript 3.0對其同源蛋白進行多重序列比對和二級結構分析,結果如圖1所示,它們都含有3個已證實的對于Rgg發揮轉錄調控功能所必需的恒定氨基酸殘基:甘氨酸(G5)、精氨酸 (R12)、和色氨酸 (W150),而且在二級結構上具有較高的相似性,整個蛋白僅由15個α螺旋和2個β轉角組成,無β折疊結構。
應用RPS-Blast工具對Rgg蛋白的保守功能結構域進行檢索分析,發現其N-端有數個特異的DNA結合位點,以及1個可結合DNA靶序列的螺旋-轉角-螺旋(helix-turn-helix, HTH)基序,而該部分序列在Rgg蛋白家族成員中非常保守(圖1),提示其調控特定DNA靶序列的功能可能非常相似。此外, 等報道S.dysgalactiae的Rgg2蛋白在第45位的半胱氨酸殘基可產生二硫鍵,使得Rgg2形成同源二聚體,但是序列比對顯示其它同源蛋白在該位點上并非半胱氨酸殘基(圖1)。

綠色三角:3個保守氨基酸殘基;紅色*:S.dysgalactiae編碼Rgg2蛋白的二硫鍵位置。
2.2Rgg蛋白的系統進化關系分析使用MEGA 4.1軟件中的Neighbor-Joining方法對上述不同來源的Rgg家族蛋白做進化樹分析,由結果(圖2)可知,S.suis2編碼的Rgg轉錄調控因子與變形鏈球菌中的同源蛋白在進化中親緣關系最近。
2.3目的基因擴增及重組表達載體的構建以05ZYH33基因組DNA為模板,對目的基因rgg進行PCR 擴增,產物分子量與預測基因分子量大小基本相符。測序結果顯示該片段全長864 bp,編碼287個氨基酸,與rgg基因序列完全相同。重組表
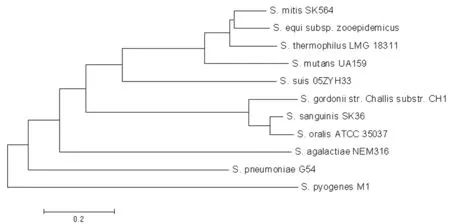
圖2 Rgg蛋白的系統發生樹
Fig.2Phylogenetic tree of Streptococcal isolates based on amino acid sequences of Rgg protein
達載體pQE30-rgg通過BamH I/Hind Ⅲ雙酶切后,1%瓊脂糖電泳顯示PCR鑒定產物和酶切片段的長度約900 bp(圖3)。

M:DNA marker;1:BamH I/Hind Ⅲ雙酶切鑒定;2. PCR鑒定
M: DNA marker; 1:BamH I/Hind Ⅲ double restriction enzymes; 2: Identification by PCR.
圖3pQE30-rgg重組質粒的鑒定
Fig.3Identification of the recombinant plasmid pQE30-rgg
2.4重組蛋白的表達及其條件優化轉化重組表達質粒pQE30-rgg的大腸桿菌M15,經1 mmol/L終濃度的IPTG于37 ℃誘導4 h后,SDS-PAGE分析表明在30 kD左右處有一明顯的新生條帶,分子量大小與預期一致。超聲裂解菌體后離心發現,目的蛋白在37 ℃下主要是以包涵體形式表達。通過降低誘導溫度至25 ℃、15 ℃,目的蛋白越來越多地以可溶性蛋白的形式表達(圖4)。

M:蛋白Marker;NC:未誘導的陰性對照;T:總蛋白;S:超聲破碎后上清;I:超聲破碎后沉淀;箭頭:目的蛋白的位置
M: Protein Marker; NC: pQE30-rgg/M15 uninduced with IPTG; T: Total protein; S: Soluble fraction; I: Insoluble fraction; arrow: Target protein.
圖4SDS-PAGE檢測目的蛋白在不同溫度下的表達形式
Fig.4Expression analysis of target protein at different induction temperatures by SDS-PAGE
2.5重組蛋白的純化與Western blot分析將重組表達菌轉接培養37 ℃至對數期后,加入IPTG至終濃度為1 mmol/L,15 ℃誘導24 h。離心收集菌體,超聲破碎,離心后收集上清,利用鎳離子親和層析純化重組蛋白,電泳可見純化產物只有一條特異的條帶(圖5A),表明得到了較高純度的Rgg重組蛋白。 Western blot 結果顯示, 重組Rgg蛋白可與抗His-Tag單抗發生特異性反應, 在約33 kD 處出現明顯的顯色條帶(圖5B), 表明該蛋白條帶的確是pQE30-rgg載體所表達的重組Rgg蛋白。

圖A:純化過程的SDS-PAGE分析。M:蛋白Marker;1-8:250 mM咪唑洗脫后的收集液;9:過柱前樣品。圖B:目的蛋白與His-tag單抗的western分析。M:蛋白Marker;1-2:純化蛋白。
A: SDS-PAGE analysis of the purification. M: Protein Marker; 1-8: Eluted fraction with 250 mM imidazole; 9: Lysate.B: Western blot with monoclonal antibody against His-tag. M: Protein Marker; 1-2: Purified protein.
圖5純化蛋白的SDS-PAGE和western分析
Fig.5Purified recombinant protein by SDS-PAGE and Western blot
2.6純化重組蛋白的非變性PAGE電泳分析由于文獻報道有HTH基序的DNA結合蛋白能夠在體外形成同質二聚體,因此我們將純化的重組蛋白脫鹽后進行了非變性PAGE電泳分析。結果如圖6所示,泳道內除了之前的30 kD條帶外,在約60 kD處明顯增加了一條新的蛋白條帶,提示Rgg重組蛋白經過純化和脫鹽后出現了二聚體結構。

M:蛋白Marker;1:純化脫鹽后的Rgg重組蛋白;箭頭:蛋白二聚體
M: Protein Marker; 1: Purified Rgg recombinant protein; arrow: Homodimeric protein.
圖6純化蛋白的非變性PAGE分析
Fig.6Native-PAGE analysis of purified recombinant protein
3討論
Rgg家族的調節因子是在革蘭氏陽性菌中負責轉錄調控的一種保守蛋白,在各種細菌中執行不同的調控功能,例如在格氏鏈球菌中調節葡萄糖糖基轉移酶表達的Rgg[5]、乳酸乳球菌中對酸性環境耐受所必需的GadR[13〗[14]、化膿鏈球菌中影響大量代謝與毒力基因表達的全局調控因子RopB[15]、無乳鏈球菌中調控毒力因子表達的RovS[16]。在一些細菌基因組中,如化膿鏈球菌[17]、肺炎鏈球菌[18]等,還存在多個該家族的調節因子。
我們對S.suis2中國強毒株05ZYH33基因組中05ssu1997基因編碼的蛋白進行了序列比對分析,發現它同無乳鏈球菌、肺炎鏈球菌等多種鏈球菌中的Rgg家族調控因子均為同源蛋白,而且通過結構域分析也發現它們的N端都具有DNA結合蛋白中常見的HTH基序和Rgg家族蛋白的3個保守氨基酸殘基。由序列分析結果中可見,不同細菌中的Rgg家族成員之間在氨基酸序列的一致性上并不是很高,基本不超過40%。但是其N端具有較強的保守性(圖1),而該部分正是Rgg蛋白能夠結合DNA序列從而調控靶基因的功能區域,提示它們作為同一個調控蛋白家族的成員,具有其共同的結構特征和類似的調控機制。
為了下一步能更好地對Rgg調控因子進行結構和DNA結合功能的研究,其重組表達蛋白需要盡可能保持天然構象。我們前期使用了PET32a表達載體對其進行表達,發現目的蛋白主要以包涵體形式表達,而且調整誘導條件后上清中的目的蛋白含量增加不多。因此本實驗更換了pQE30載體進行Rgg蛋白的原核表達,雖然37 ℃下誘導發現上清中目的蛋白量很少,但是將其置于15 ℃過夜誘導表達,目的蛋白的可溶性表達水平顯著增高,超聲破碎后上清中的目的蛋白量甚至多于沉淀。純化獲得最大產量的可溶性、有活性及正確折疊的Rgg重組表達蛋白,對于我們今后通過凝膠遷移阻滯等實驗鑒定其下游基因和特異性DNA結合序列非常重要。
此前,Loughman等已證明了化膿鏈球菌中的RopB蛋白和其它擁有HTH基序的DNA結合蛋白一樣能夠在體外形成同質二聚體[9],Parashar V等根據S.dysgalactiae編碼Rgg2蛋白的晶體結構,證明其通過半胱氨酸(C45)產生的二硫鍵形成同源二聚體[10]。雖然序列比對顯示S.suis2中的 Rgg蛋白在該位置上并非半胱氨酸,但本實驗將其原核表達后純化,通過非變性PAGE電泳證實其在體外也能形成二聚體結構,提示Rgg蛋白家族成員之間產生二硫鍵的位置或發生聚合的機制可能會有所不同。
本研究對S.suis2 中國強毒株中的Rgg調控因子進行了序列結構分析和原核表達,并獲得了較高純度的Rgg重組蛋白,該結果將有助于我們進一步研究其具體的調控功能,從而更加系統全面地認識S.suis2的致病機制。
參考文獻:
[1]Higgins R, Gottschalk M, Boudreau M, et al. Description of six new capsular types (29-34) ofStreptococcussuis[J]. J Vet Diagn Invest, 1995, 7(3): 405-406. DOI:10.1177/104063879500700322
[2]Staats JJ, Feder I, Okwumabua O, et al.Streptococcussuis: past and present[J]. Vet Res Commun, 1997, 21(6): 381-407.
[3]Silva LM, Baums CG, Rehm T, et al. Virulence-associated gene profiling ofStreptococcussuisisolates by PCR[J]. Vet Microbiol, 2006, 115(1-3): 117-127. DOI:10.1016/j.vetmic.2005.12.013
[4]Tang J, Wang C, Feng Y, et al. Streptococcal toxic shock syndrome caused byStreptococcussuisserotype 2[J]. PLoS Med, 2006, 3: e151. DOI:10.1371/journal.pmed.0030151
[5]Sulavik MC, Tardif G, Clewell DB. Identification of a gene, rgg, which regulates expression of glucosyltransferase and influences the Spp phenotype ofStreptococcusgordoniiChallis[J]. J Bacteriol, 1992, 174(11): 3577-3586.
[6]Vickerman MM, Sulavik MC, Clewell DB.Oralstreptococciwith genetic determinants similar to the glucosyltransferase regulatory gene,rgg[J]. Infect Immun, 1995, 63(11): 4524-4527.
[7]Rawlinson EL, Nes IF, Skaugen M. Identification of the DNA-binding site of the Rgg-like regulator LasX within the lactocin S promoter region[J]. Microbiology, 2005, 151(Pt 3): 813-823. DOI:10.1099/mic.0.27364-0
[8]Bortoni ME, Terra VS, Hinds J, et al. The pneumococcal response to oxidative stress includes a role for Rgg[J]. Microbiology, 2009, 155(Pt 12): 4123-4134. DOI: 10.1099/mic.0.028282-0
[9]Loughman JA, Caparon MG. Contribution of invariant residues to the function of Rgg family transcription regulators[J]. J Bacteriol, 2007, 189(2): 650-655. DOI:10.1128/JB.01437-06
[10]Parashar V, Aggarwal C, Federle MJ, et al. Rgg protein structure-function and inhibition by cyclic peptide compounds[J]. Proc Natl Acad Sci U S A,2015, 112(16): 5177-5182. DOI:10.1073/pnas.1500357112
[11]Zheng F, Ji H, Cao M, et al. Contribution of the Rgg transcription regulator to metabolism and virulence ofStreptococcussuisserotype 2[J]. Infect Immun, 2011, 79(3): 1319-1328. DOI:10.1128/IAI.00193-10
[12]Xavier R, Patrice G. Deciphering key features in protein structures with the new ENDscript server[J]. Nucl Acids Res, 2014, 42(W1): W320-W324.
[13]Sanders JW, Leenhouts K, Burghoorn J, et al. A chloride-inducible acid resistance mechanism inLactococcuslactisand its regulation[J]. Mol Microbiol, 1998, 27(2): 299-310. DOI:10.1046/j.1365-2958.1998.00676.x
[14]Qi F, Chen P, Caufield PW. Functional analyses of the promoters in the lantibiotic mutacin II biosynthetic locus inStreptococcusmutans[J]. Appl Environ Microbiol, 1999, 65(2): 652-658.
[15]Chaussee MS, Ajdic D, Ferretti JJ. The rgg gene ofStreptococcuspyogenesNZ131 positively influences extracellular SPE B production[J]. Infect Immun, 1999, 67(4): 1715-1722.
[16]Samen UM, Eikmanns BJ, Reinscheid DJ. The transcriptional regulator RovS controls the attachment ofStreptococcusagalactiaeto human epithelial cells and the expression of virulence genes[J]. Infect Immun, 2006, 74(10): 5625-5635. DOI:10.1128/IAI.00667-06
[17]Ferretti JJ, Mcshan WM, Ajdic D, et al. Complete genome sequence of an M1 strain ofStreptococcuspyogenes[J]. Proc Natl Acad Sci U S A, 2001, 98(8): 4658-4663. DOI:10.1073/pnas.071559398
[18]Tettelin H, Nelson KE, Paulsen IT, et al. Complete genome sequence of a virulent isolate ofStreptococcuspneumoniae[J]. Science, 2001, 293(5529): 498-506. DOI:10.1126/science.1061217
DOI:10.3969/j.issn.1002-2694.2016.03.004
通訊作者:鄭峰,Email:zhengf82@gmail.com
中圖分類號:R378.1
文獻標識碼:A
文章編號:1002-2694(2016)03-0229-05
Corresponding author:Zheng Feng, Email: zhengf82@gmail.com
收稿日期:2015-09-07;修回日期:2015-12-09
Sequence and structure analysis of Rgg transcription regulator in Streptococcus suis serotype 2 and prokaryotic expression
ZHENG Feng,LIU Peng,CAI Bing-gang,ZHU Jin,PAN Xiu-zhen,WANG Chang-jun
(HuadongMedicalInstituteofBiotechniques,Nanjing210002,China)
Abstract:To identify and demonstrated the properties of Rgg transcription regulator in highly virulent strains of Streptococcus suis serotype 2, the rgg gene from the genomic DNA in the virulent strain 05ZYH33 was amplified by PCR and subcloned into plasmid pMD18-T and pQE30 with double digestion of BamHⅠand Hind Ⅲ. Subsequently, the prokaryotic expression plasmid pQE30-rgg was transformed to E. coli M15 after identification by restriction endonuclease digestion and DNA sequencing. Upon induction with IPTG, E. coli M15 containing the recombinant plasmid could express a distinct band with a molecular weight of 30 kDa, which was similar to the predicted band of Rgg protein as demonstrated by SDS-PAGE and Western blot. It was demonstrated that the recombinant protein expression could be the highest soluble yield after induction for overnight at 15 ℃. The recombinant Rgg protein was purified by Ni2+NTA affinity chromatography. Native-PAGE results showed that the purified protein forms homodimers in vitro, consistent with data for other members of the Rgg family. Secondary structure analysis displayed Rgg protein contained 15 α-helices and 2 β-turn. These results would be useful in the further studies on the function of Rgg transcription regulator.
Keywords:Streptococcus suis; Rgg transcription regulator; prokaryotic expression
國家自然科學基金資助項目(No.31300119, 31170124, 81471920);江蘇省自然科學基金資助項目(No.BK2012080)

