弓形蟲ROP18重組腺病毒載體的構建及其對神經干細胞C17.2凋亡的影響
張 賢,甘小鳳,程正陽,都 建,羅慶禮,沈繼龍,余 莉
?
弓形蟲ROP18重組腺病毒載體的構建及其對神經干細胞C17.2凋亡的影響
張賢1,2,甘小鳳1,2,程正陽1,2,都建3,羅慶禮1,2,沈繼龍1,2,余莉1,2
1.安徽醫科大學病原生物學教研室,合肥230032;2.人獸共患病安徽省重點實驗室,合肥230032;3.安徽醫科大學生物化學教研室,合肥230032
摘要:目的構建弓形蟲棒狀體蛋白ROP18重組腺病毒載體,研究其對神經干細胞C17.2凋亡的影響。方法將弓形蟲ROP18從PEGFP-G2-ROP18重組質粒上亞克隆至腺病毒載體pHBAd-MCMV-GFP,重組腺病毒載體pHBAd-MCMV-GFP- ROP18經PCR、測序鑒定正確后,與骨架質粒pHBAd-BHG共轉染HEK293細胞進行包裝,收獲、擴增重組腺病毒并對其滴度進行測定。以MOI=70的重組腺病毒感染神經干細胞C17.2,轉染不同時間熒光顯微鏡觀察基因的表達情況。轉染48 h用CCK-8法檢測C17.2的增殖情況;轉染24 h采用Annexin V-APC/PI雙染流式細胞術檢測細胞凋亡情況;Western blot法檢測半胱天冬氨酸蛋白酶3(caspase-3)的蛋白水平。結果重組ROP18過表達腺病毒在C17.2神經干細胞內能有效表達。轉染48 h,與空載體對照組相比,C17.2細胞增殖活性明顯降低(P<0.05);轉染24 h,流式細胞術檢測結果顯示,ROP18基因轉染組C17.2細胞凋亡率明顯增加(P<0.001);Western blot檢測顯示caspase-3活性片段的表達明顯增加(P<0.05)。結論成功構建了弓形蟲ROP18重組腺病毒并在神經干細胞C17.2中表達,ROP18重組腺病毒能誘導C17.2神經干細胞凋亡。
關鍵詞:剛地弓形蟲;棒狀體蛋白18;神經干細胞C17.2;重組腺病毒;細胞凋亡
剛地弓形蟲(Toxoplasmagondii)簡稱弓形蟲,是頂復門的專性細胞內寄生原蟲,宿主范圍廣泛[1],嚴重危害人類健康及畜牧業的發展。弓形蟲是人類重要的生物致畸因子之一,先天性感染可侵犯腦、眼、心、肺和肌肉等器官組織,引起嬰兒小頭畸形、腦積水和脈絡膜視網膜炎等嚴重癥狀[2]。在上述器官中,中樞神經系統是最易受侵犯的部位,先天性弓形蟲病的神經病理主要表現為大腦皮質發育不全[3-4]。神經干細胞(neural stem cells,NSCs)經過增殖和分化后,形成具有各種功能的神經細胞,在大腦皮質形成的過程中發揮重要作用,任何干擾NSCs正常增殖的因素均可阻礙大腦皮質的正常發育[5]。因此,研究弓形蟲對NSCs的影響對于揭示弓形蟲腦病的發病機制及制定相應的防治策略,具有重要意義。
棒狀體是頂復合門原蟲一種重要的分泌器,在入侵宿主細胞過程中分泌的棒狀體蛋白(rhoptry proteins,ROPs)[6]對感染至關重要。弓形蟲棒狀體蛋白18(ROP18)為ROP2蛋白家族成員,具有絲氨酸-蘇氨酸蛋白激酶活性,是弓形蟲重要的毒力決定因子,定位于宿主納蟲泡膜(parasitophorous vacuole membrane,PVM)上[7],參與控制弓形蟲在細胞內的增殖。
我們在前期的研究中發現,弓形蟲與C17.2神經干細胞共培養或以弓形蟲排泄分泌抗原(excreted/secreted antigens,ESAs)[8-9]刺激C17.2神經干細胞,均能誘導C17.2細胞的凋亡。而弓形蟲ROP18作為蟲體的一個具有激酶活性的重要毒力分子,是否會對神經干細胞的增殖和凋亡產生影響尚不明確。鑒于此,我們構建了ROP18重組腺病毒,研究其對神經干細胞的影響。
1材料與方法
1.1實驗動物、蟲株、細胞株與質粒清潔級5周齡昆明小鼠,雌雄不限,由安徽醫科大學實驗動物中心提供;弓形蟲RH株速殖子由本室液氮保種,復蘇后腹腔接種昆明小鼠傳代;C17.2神經干細胞系由Dr. Evan Y. Snyder饋贈(The Burnham Institute for Medical Research; La Jolla, CA, USA);293A人胚腎細胞由本室保存;PEGFP-G2-ROP18質粒由安徽醫科大學都建教授饋贈。
1.2主要試劑和儀器載體pHBAd-MCMV-GFP(Hanbio公司);DMEM培養基(美國Hyclone公司);胎牛血清(杭州四季青生物工程有限公司);馬血清(美國Gibco 公司);轉染試劑Lipofiter2000(美國life公司);CCK-8細胞增殖及細胞毒性檢測試劑盒(上海貝博bestbio公司);Annexin V-APC/PI細胞凋亡檢測試劑盒(凱基KeyGEN BioTECH公司);兔抗人半胱天冬氨酸蛋白酶3(cysteine aspartate specific protease3,Caspase-3)抗體(美國Cell Signaling Technology公司);小鼠抗人β-actin 抗體(美國Cell Signaling Technology公司);BCA蛋白定量試劑盒、Western一抗稀釋液(江蘇碧云天公司);流式細胞儀(美國BD公司);化學發光成像系統(上海歐翔科學儀器有限公司)。
1.3ROP18重組腺病毒的構建
1.3.1ROP18基因擴增設計1對針對ROP18基因的特異性引物并加入酶切位點(pHBAd-MCMV-GFP載體用NotI和NsiI雙酶切),以PEGFP-G2-ROP18質粒作為擴增模板擴增ROP18全長。引物序列:上游引物:5′-ATTAGCGGCCGCATGTTTTCGGTACAGCGGCCA-3′,下游引物:5′-ACACATGCATTTATTCTGTGTGGAGATG-3′,反應參數為:94 ℃預變性5 min,94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸90 s,3步組成25個循環,最后72℃延伸10 min。PCR產物用1.5%瓊脂糖凝膠電泳鑒定,而后用Axygen公司回收試劑盒回收,紫外測定濃度。
1.3.2產物定向連接到pHBAd-MCMV-GFP載體的鑒定pHBAd-MCMV-GFP載體和ROP18-PCR產物分別用NotI和NsiI雙酶切,切膠回收后,以載體100-200 ng、目的片段20 μL的比例在16 ℃連接過夜,然后轉化DH5a感受態細胞,涂布于氨芐青霉素抗性的LB平板,挑可疑菌落先行PCR鑒定,再送上海桑尼生物技術有限公司測序。
1.3.3ROP18重組腺病毒的包裝、擴增和純化將293A細胞接種于60 mm培養皿,置37 ℃含5% CO2的培養箱中培養過夜。待細胞生長至底面積的70%~80%時,將pHBAd-MCMV-GFP-ROP18重組腺病毒載體質粒與骨架質粒pHBAd-BHG共轉染至293A細胞。轉染6 h,更換新鮮的細胞培養液,待細胞大部分病變后(約2~3 d)并從底部脫落進行收毒。將60 mm培養皿中所有細胞及培養液收于15 mL離心管中。打開恒溫水浴鍋至37 ℃,將15 mL離心管在液氮及37 ℃水浴反復凍融3次。于離心機離心3 000 r/min 5 min,收集含病毒的上清液,棄沉淀。該上清即為ROP18重組腺病毒,放于-80 ℃保存備用。
1.3.4ROP18重組腺病毒的滴度測定采用改良的TCID50進行測定:在96孔細胞培養板中以1×105/mL的濃度接種293A細胞,100 μL每孔,12孔為一組,共8組,重復一次。待24 h細胞貼壁以后,將病毒稀釋液從1×106加到1×1013,共8個稀釋度,每個稀釋度加10孔,其余2孔為陰性對照, 37 ℃ CO2培養箱中培養10 d,逐日觀察細胞狀況,并在第10 d用顯微鏡觀察每孔CPE情況,記錄每排樣品的陽性孔數。對于100 μL樣品,滴度T=101+d(s-0.5),其中d=log10稀釋度,s=陽性比率之和(即從第一個10倍稀釋度算起有CPE出現的陽性孔數)。再將TCID50/mL轉換成PFU/mL:TCID50/mL=0.7PFU/mL,兩次重復實驗得到的滴度值應相差≤100.7。
1.4C17.2神經干細胞的培養C17.2神經干細胞的培養參照Evan Y. Snyder教授實驗室所用標準操作流程[10]。用含10%胎牛血清,5%馬血清,100 U/mL青/鏈霉素的DMEM完全培養液(培養液使用一周后補加1%谷氨酰胺)培養,細胞融合至90%左右傳代。PBS洗兩遍后,胰酶細胞消化液消化2 min,含血清的完全培養液3 mL終止消化,吹打使分散均勻,最多1∶10傳代。
1.5ROP18重組腺病毒轉染C17.2神經干細胞將對數生長期的C17.2神經干細胞制成1×105/mL單細胞懸液接種于6孔板,每孔2 mL,培養24 h待細胞貼壁后,PBS洗兩遍。按照感染復數為1∶70轉染含有ROP18重組腺病毒、腺病毒空載體(對照)至C17.2中,培養24、48、72、96 h后觀察病毒的轉染效率。
1.6CCK-8法檢測細胞增殖將1×105/mL的C17.2神經干細胞加入96孔細胞培養板,每孔100 μL,分為4組,每組5個復孔,37 ℃、5%CO2培養箱中培養24 h,棄去培養液,PBS洗兩遍。前兩組分別加入ROP18重組腺病毒、腺病毒空載體對照(MOI為70),后兩組為細胞對照組和空白對照組。腺病毒轉染48 h,各孔棄一半液體,加CCK-8 溶液10 μL,在溫箱中孵育2 h至肉眼顏色改變后,用酶標儀測定每孔450 nm波長光密度(optical density, OD)值,各組重復實驗3次。
1.7Annexin V-APC/PI雙染檢測細胞凋亡將對數生長期的C17.2神經干細胞制成1×105/mL單細胞懸液接種于6孔板,每孔2 mL,培養24 h待細胞貼壁后,PBS洗兩遍,加入MOI為70的ROP18重組腺病毒及腺病毒空載體,培養液換成5%胎牛血清,2.5%馬血清的DMEM完全培養液。轉染24 h用細胞刮收集貼壁細胞至10 mL離心管。用冷PBS洗滌細胞2次,離心800 r/min,4 ℃,10 min,棄培養液,收集細胞,加入500 μL的Binding Buffer 懸浮細胞,再加入5 μL Annexin V-APC混勻后,4 ℃避光,反應15 min。用PBS洗滌細胞一次,離心2 000 r/min,5 min后,用PBS重懸細胞,上流式儀前5 min加入5 μL PI染液混勻后室溫避光孵育5 min。1 h內上流式細胞儀檢測,每組實驗重復3次。FCS express 4軟件分析細胞凋亡率。
1.8 Western blot法檢測蛋白表達收集重組腺病毒ROP18、腺病毒空載體及細胞對照組的貼壁細胞,用PBS洗2次,離心800 r/min,10 min,棄上清,每管加100 μL細胞總蛋白裂解液(99.5 μL強裂解液RIPA+0.5 μL蛋白酶抑制劑PMSF),冰上孵育20 min后離心12 000 r/min,4 ℃,10 min,取上清液,此即為細胞總蛋白。每次各組取30 μL蛋白上樣緩沖液在SDS-PAGE凝膠中電泳,200 mA恒流轉膜90 min,PVDF膜放入含5%脫脂奶粉的PBST封閉2 h,棄封閉液,PBST洗滌3次,加入按1∶1 000稀釋的caspase-3一抗,4℃孵育過夜,PBST洗3次后加HRP標記的山羊抗兔IgG二抗,室溫孵育2 h,PBST洗滌3次,ECL法顯色,照相并分析結果。每組實驗重復3次。
1.9統計學分析文中處理的數據結果均以均數±標準差形式表示。用t檢驗分析兩組數據間的統計學差異,用方差分析分析兩組以上數據間的統計學差異。t檢驗P<0.05表示差異具有統計學意義,方差分析P<0.05表示差異具有統計學意義。
2結果
2.1pHBAd-MCMV-GFP- ROP18重組腺病毒載體的鑒定重組子的鑒定結果見圖1。7個克隆經PCR鑒定均檢測到約1.6 kb的條帶,與目的DNA的長度符合。陽性克隆經上海桑尼生物技術有限公司測序與PEGFP-G2-ROP18載體序列100%吻合。

泳道1: DNA Marker;泳道2-8:不同重組子PCR鑒定結果
Lane 1: DNA Marker;Lane2-8: PCR products of different recombinants monoclonal identification.
圖1單克隆PCR鑒定結果
Fig.1Identification of recombinants using PCR
2.2ROP18重組腺病毒在293A細胞中的擴增及滴定將ROP18重組腺病毒轉染至293A細胞中,每天觀察細胞病變情況,約2~3 d,光鏡下可見細胞變圓、變大,呈葡萄狀,并在72 h左右漂起。改進的TCID50法測定重組腺病毒的滴度為1×106PFU/mL。ROP18重組腺病毒在293A細胞中的表達情況見圖2。

A:熒光顯微鏡照片;B:明場對照
A: fluorescence expression; B: field control
圖2ROP18重組腺病毒在293A細胞內的表達情況
Fig.2The 293A cell transfected by ROP18 recombinant adenovirus
2.3ROP18重組腺病毒在神經干細胞C17.2上的表達將ROP18重組腺病毒轉染至C17.2神經干細胞,用熒光顯微鏡觀察分別在轉染24、48、72、96 h檢測目的基因的表達情況。通過觀察可見C17.2細胞在轉染24、48 h時大約50%~70%表達綠色熒光蛋白,且細胞形態正常。
2.4ROP18重組腺病毒對C17.2細胞的增殖抑制作用CCK-8法檢測結果顯示(圖4):ROP18重組腺病毒組細胞增殖活力為(58.13±7.373)%,較腺病毒對照組(85.34±6.092)%及細胞對照組(81.51±3.415)%均有明顯的下降(P<0.05)。
2.5ROP18重組腺病毒誘導C17.2神經干細胞的凋亡流式細胞術檢測結果顯示:ROP18重組腺病毒組細胞凋亡率為(31.07±10.05)%,較腺病毒對照組(2.707±0.050 44)%及細胞對照組(0.777 5±0.052 50)%均有明顯的下降(P<0.000 1)。

A:轉染24 h、B:轉染48 h、C:轉染72 h、D:轉染96 h熒光表達與明場細胞的合圖情況
A: within 24 h; B: 48 h; C: 72 h; D: 96 h.
圖3ROP18重組腺病毒在C17.2神經干細胞內的表達情況
Fig.3C17.2 neural stem cells cell transfected by ROP18 recombinant adenovirus

注:*P<0.05
Western blot檢測結果顯示:ROP18重組腺病毒轉染組,C17.2神經干細胞內的caspase-3蛋白的表達量(0.519 7±0.064 81)較腺病毒空載體對照(0.177 7±0.093 08)和細胞對照組(0.034 0±0.013 53)均有明顯升高。
3討論
弓形蟲作為人獸共患病的病原體,可以入侵所有的有核細胞,孕婦感染弓形蟲后會造成胎兒的畸形、流產或死胎。國內外的文獻資料[11-13]顯示弓形蟲感染有嗜中樞性,對于中樞神經系統修復來說神經干細胞是一個有力的工具,而在成年哺乳動物腦特定區域內多功能干細胞的數量是有限的[14]。鑒于此,我們選擇了C17.2神經干細胞系作為研究對象,此細胞是小鼠小腦祖細胞內所形成的永生化細胞系,具有神經干細胞的所有特征,是目前研究移植治療神經系統疾病的神經干細胞較好的細胞系[15-16]。有研究表明弓形蟲的排泄分泌抗原ESAs[17]對神經干細胞C17.2有促凋亡的作用,而ROP18蛋白作為ESAs中重要的蛋白分子,是否對神經干細胞C17.2有直接的誘導凋亡的作用尚不明確。

注:***P<0.01
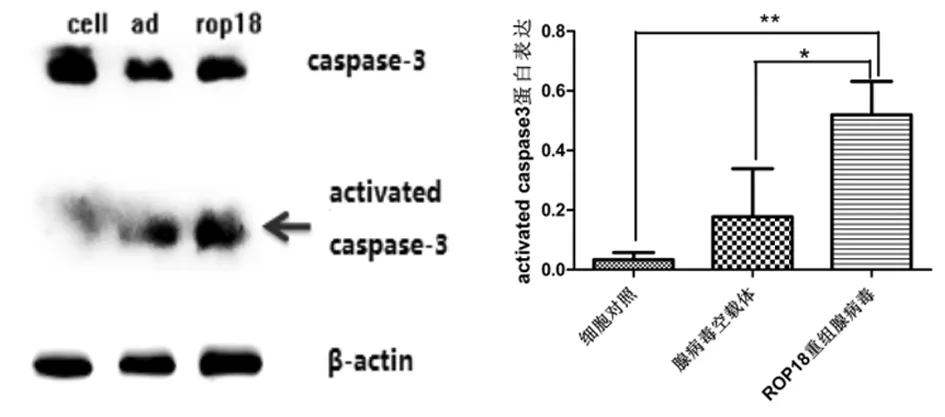
注:*P<0.05,**P<0.01
本實驗選擇MOI=70的ROP18重組腺病毒轉染C17.2神經干細胞。CCK-8法檢測轉染48h的細胞增殖能力,結果顯示,ROP18重組腺病毒組相對于細胞對照組、腺病毒空載體組能夠明顯的抑制神經干細胞C17.2的增殖活力。同時,用流式細胞術檢測轉染24 h細胞凋亡的情況,結果顯示,ROP18重組腺病毒組C17.2神經干細胞的早期細胞凋亡率有明顯升高。Caspase-3是凋亡信號通路中一個重要的蛋白酶,也是凋亡的關鍵執行分子,在凋亡的早期階段,它被激活[18]。本研究采取定量的WB測定ROP18重組腺病毒刺激細胞24 h的細胞凋亡蛋白caspsae-3的表達量,結果顯示ROP18重組腺病毒caspase-3被激活并且表達量明顯高于其他兩組。上述結果表明ROP18重組腺病毒可以誘導神經干細胞C17.2的凋亡。
Wang等人[8]研究發現ESAs可以通過內質網應激信號通路(endoplasmic reticulum stress, ERS)來介導細胞的凋亡,在此次實驗中選用的是感染弓形蟲速殖子小鼠的原代神經干細胞。Zhou等人[9]將前期實驗進一步優化,研究對象轉為神經干細胞系C17.2,發現同樣通過ERS途徑來介導細胞的凋亡。在本實驗中我們發現ROP18重組腺病毒可以介導C17.2的凋亡,但是否同樣通過ERS信號通路來發揮促凋亡的作用有待于進一步的研究和驗證。
綜上所述,本研究成功構建了ROP18重組腺病毒并轉染神經干細胞C17.2,結果表明ROP18蛋白對神經干細胞C17.2有促凋亡的作用。該研究對于明確弓形蟲致中樞神經系統的損傷機制有著重要的意義。
參考文獻:
[1]Dubey JP. Toxoplasmosis of animals and humans[M]. Boca Raton: CRC Press, 2009: 313.
[2]Kravetz JD, Federman DG. Toxoplasmosis in pregnancy[J].Am J Med,2005,118(3):212-216.DOI:10.1080/10647440500068305
[3]Yu ES, Gan SB, Chen GJ. Toxoplasmosis in China[M]. Hong Kong: Asian Medical Press, 2000: 32-33. (in Chinese)
于恩庶,甘紹白,陳觀今.中國弓形蟲病[M].香港:亞洲醫藥出版社,2000: 32-33.
[4]el-Sagaff S, Salem HS, Nichols W, et al. Cell death pattern in cerebellum neurons infected withToxoplasmagondii[J]. J Egypt Soc Parasitol, 2005, 35(3): 809-818.
[5]Wang S, Xu ZH. Progress in the study of molecular mechanisms of developmental cortex malf or mations mechanisms of developmental cortex malformations[J]. Chin J Cell Biol, 2011, 33(8): 837-846. (in Chinese)
王碩,許執恒. 大腦皮質發育畸形及分子遺傳機理研究進展[J]. 中國細胞生物學學報,2011, 33(8):837-846.
[6]El Hajjh H, Demey E, Poncet J, et al. The ROP2 family ofToxoplasmagondiirhoptry proteins: proteomic and genomic characterization and molecular modeling[J]. Proteomics, 2006, 6(21): 5773-5784.DOI:10.1002/pmic.200600187
[7]El Hajj H, Lebrun M, Arold ST, et al. ROP18 is a rhoptry kinase controlling the intracellular proliferation ofToxoplasmagondii[J]. PLoS Pathog, 2007, 3(2): e14.DOI:10.1371/journal.ppat.0030014
[8]Wang T, Zhou J, Yu L, et al.Toxoplasmagondiiinduce apoptosis of neural stem cells viaendoplasmic veticulum stress pathway[J]. Parasitology, 2014, 144 (7): 988-995.DOI:10.1017/S0031182014000183
[9]Zhou J, Gan X, Wang T, et al.Toxoplasmagondiiprevalent in China induce weaker apoptosis of neural stem cells C17.2 via endoplasmic veticulum stress (ERS) signaling pathways[J]. Parasit Vectors, 2015(8): 73.DOI:10.1186/s13071-015-0670-3
[10]Snyder EY, Deitcher DL, Walsh C, et al. Multipotent neural cell lines can engraft and participate in development of mouse cerebellum[J]. Cell, 1992, 68: 33-51.
[11]Doetsch F. The glial identity of neural stem cells[J]. Nat Neurosci, 2003, 6: 1127-1134.DOI:10.1038/nn1144
[12]Lopes FM, Goncalves DD, Mitsuka-Bregano R, et al.Toxoplasmagondiiinfection in pregnancy[J]. Braz J Infect Dis, 2007, 11(5): 496-506.
[13]Dearbhaile D, Pia V, Sven H, et al. Immunopharmacological intervention for successful neural stem cell therapy: New perspectives in CNS neurogenesis and repair[J]. Pharmacol Therapeutics, 2014, 141(1): 21-31.DOI:10.1016/j.pharmthera.2013.08.001
[14]Osunkalu VO, AKanmu SA, Ofomah NJ, et al. Seroprevalence ofToxoplasmagondiiIgG antibody in HIV-injected patients at the Lagos University Teaching Hospital[J]. HIV AIDS (Auck1), 2011, 3: 101-105.DOI:10.2147/HIV.S15532
[15]Riess P, Zhang C, Saatman KE, et al. Transplanted neural stem cells survive, differentiate, and improve neurology-icalmotor function after experimental traumatic brain injury[J]. Neurosurgery, 2002, 51(4): 1043-1052.
[16]Cheng A, Chan SL, Milhavet O, et al. p38 MAP kinase mediates nitric oxide-Induced apoptosis of neural progenitor cells[J]. J Biol Chem, 2001, 276(46): 43320-43327.DOI:10.1074/jbc.M107698200
[17]Daray F, Deslee D, Santoro F, et al. Induction of a protective antibody dependent response against Toxoplasmosis by in vitro excreted/secreted antigens from tachyzoites ofToxoplasmagondii[J]. Parasite Immunol, 1988, 10(5): 553-567.
[18]Sun Y, Guan Y, Li F, et al. Effects of rat cytomegalovirus on the nervous system of the early rat embryo[J]. Virol Sin, 2012, 27(4): 234-240.DOI: 10.1007/s12250-012-3250-0
DOI:10.3969/j.issn.1002-2694.2016.03.005
通訊作者:余莉,Email:lilyyu33@126.com
中圖分類號:R382.5
文獻標識碼:A
文章編號:1002-2694(2016)03-0234-06
Corresponding author:Yu Li, Email:lilyyu33@126.com
收稿日期:2015-07-15;修回日期:2015-12-08
Construction of Toxoplasma ROP18 recombinant adenovirus vector and its effect on the apoptosis of C17.2 stem cells
ZHANG Xian1,2,GAN Xiao-feng1,2,CHENG Zheng-yang1,2,DU Jian3,LUO Qing-li1,2,SHEN Ji-long1,2,YU Li1,2
(1.DepartmentofMicrobiologyandParasitology,AuhuiMedicalUniversity,Hefei230032,China;2.AnhuiKeyLaboratoryofZoonoses,AuhuiMedicalUniversity,Hefei230032,China;3.DepartmentofBiochemistry,AuhuiMedicalUniversity,Hefei230032,China)
Abstract:To study the effect of Toxoplasma rhoptry kinase 18 (ROP18) on the apoptosis of C17.2 neural stem cells, Toxoplasma gondii ROP18 was subcloned from PEGFP-G2-ROP18 into pHBAd-MCMV-GFP. The recombinant adenovirus vector pHBAd-MCMV-GFP-ROP18 was comfirmed by PCR and sequencing, and the identified recombinant adenovirus vector was transfected into 293 cells for packaging with skeleton plasmid. After amplification, ROP18 recombinant adenovirus (MOI=70) was transfected into C17.2 neural stem cell. The proliferation of C17.2 cells at 48 horus Post-treatment was detected using CCK-8 kit and the apoptosis of C17.2 cells at 24 hours Post-treatment was detected by flow cytometer. Western blot was used to determine the expression levels of caspase-3. ROP18 recombinant adenovirus was expressed effectively in C17.2 neural stem. Compared with the control group, proliferation of C17.2 cells was significantly decreased (P<0.05) in the ROP18 recombinant adenovirus group at 48 hours while the apoptosis of C17.2 cells was significantly increased in the ROP18 recombinant adenovirus (P<0.001) at 24 hours Post treatment and the caspases-3 expression levels was significantly increased (P<0.05). ROP18 recombinant adenovirus was successfully constructed and was highly expressed in C17.2 neural stem cells. ROP18 recombinant adenovirus induced the apoptosis of C17.2 neural stem cells.
Keywords:Toxoplasma gondii; rhoptry protein 18; neural stem cells C17.2; Toxoplasma ROP18 recombinant adenovirus; cell apoptosis Supported by the National Natural Science Foundation of People’s Republic of China (No.81572022) and the program for Excellent Talents in Anhui Medical University (No.0113014104)
國家自然科學基金(No. 81572022)資助;安徽醫科大學青年拔尖人才支持計劃項目(No.0113014104)資助

