甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的合成及結構表征
——推薦一個綜合藥物合成實驗
劉美艷 曾佑林(湖南師范大學藥物合成實驗教學中心,長沙410081)
?
·化學實驗·
甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的合成及結構表征
——推薦一個綜合藥物合成實驗
劉美艷 曾佑林*
(湖南師范大學藥物合成實驗教學中心,長沙410081)
摘要:介紹一個綜合藥物合成實驗——甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的合成及結構表征。以D-甘露糖為原料,經費歇爾糖苷化和苯甲酰化合成甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷。用薄層色譜監測反應進程,采用過濾、洗滌、濃縮、萃取、干燥、柱層析等操作對中間體和目標產物進行分離純化,并通過熔點和旋光度測定、核磁共振、紅外光譜對其結構進行表征。
關鍵詞:反應進程監測;D-甘露糖結構表征;藥物合成實驗
藥物合成實驗是制藥工程專業的重要教學內容之一。該課程以強化學生實驗操作技能、全面系統地訓練和提高學生的綜合能力、使學生初步具備獨立從事新藥開發和研究的能力為培養目標。在藥物合成實驗開課之前,學生已經完成了無機化學實驗、分析化學實驗、有機化學實驗、物理化學實驗、儀器分析實驗、化工基礎實驗等基礎實驗課程的學習,并已掌握了藥物合成實驗所需的基本知識和技能。因此,藥物合成實驗內容不應是基礎實驗的重復,而應以綜合性和專業性為甄選依據,突出基礎知識和技能在藥物開發和研究領域的綜合應用,著力培養學生分析、解決實際問題的能力。為實現培養制藥工程專業學生的獨立科研與獨立工作能力,開設綜合性藥物合成實驗作為藥物合成實驗教學改革的一項新措施,已越來越受到各高校藥物合成實驗教學工作者的重視[1-4]。
寡糖是許多藥物的重要結構單元,含糖藥物已涵蓋了抗生素類、心腦血管類、抗腫瘤類、激素類等19個門類[5],臨床藥物達132種。寡糖結構的多樣性與復雜性,增加了含糖藥物全合成難度。含糖藥物的全合成,取決于寡糖的高立體選擇性、高區域選擇性、高收率合成,涉及有機合成化學、糖化學、保護基化學、分離過程化學、分析化學等學科知識[6]。筆者結合在寡糖合成領域所取得的經驗,經反復篩選、實踐,將甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的合成轉化為綜合性藥物合成實驗。該綜合性實驗的設計體現了藥物合成研究(合成→分離純化→結構表征)的特點,不僅可使學生掌握藥物合成基本技能以及常見的分離純化方法和化合物結構表征方法,還能提高學生綜合應用化學基本原理和實驗技能解決實際問題的能力。
1 實驗目的
①了解藥物合成過程中的保護基化學。
②鞏固回流、過濾、萃取、濃縮等基本操作。
③掌握旋轉蒸發儀、旋光儀、紅外光譜、核磁共振的原理與使用方法。
④掌握薄層色譜和柱色譜的基本原理,利用薄層色譜法示蹤有機反應進程,利用柱層析法分離純化目標產物。
⑤掌握有機化合物結構表征的常用方法,如紅外光譜法和核磁共振法;學會分析紅外圖譜、1H NMR和13C NMR一維譜、H-H相關和C-H相關二維譜。
⑥利用比旋光度和核磁偶合常數定性表征化合物的立體結構。
2 實驗原理
①薄層色譜、柱色譜的基本原理與操作(略)。
②紅外光譜、核磁共振、旋光儀的基本原理與操作(略)。
③合成原理:D-甘露糖在無水酸性條件下經費歇爾糖苷化反應,立體選擇性合成甲基α-D-吡喃甘露糖苷。反應混合物經過濾、洗滌等后處理過程分離純化得到精品甲基α-D-吡喃甘露糖苷。以提純后的甲基α-D-吡喃甘露糖苷為原料,以吡啶為反應溶劑和縛酸劑,以苯甲酰氯為酰化試劑進行酯化反應,對甲基α-D-吡喃甘露糖苷的四個羥基進行保護。通過水解(或醇解)破除過量的苯甲酰氯,通過濃縮除去大部分吡啶,通過稀鹽酸(或飽和硫酸銅溶液)洗滌除去少部分吡啶和大部分吡啶鹽酸鹽,通過柱層析得到精品甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷。合成路線如圖1所示。
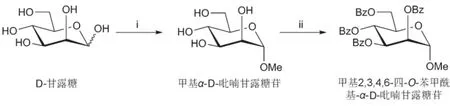
圖1 甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的合成路線
3 試劑和材料
D-甘露糖,無水甲醇,乙酰氯,苯甲酰氯,吡啶,二氯甲烷,飽和硫酸銅溶液(或10%鹽酸溶液),無水硫酸鈉,4-N,N-二甲氨基吡啶(DMAP),二次蒸餾水,氯仿,氘代氯仿,重水,顯色劑:30%硫酸-乙醇溶液,展開劑(A):V乙酸乙酯:V甲醇=5:3,展開劑(B):V乙酸乙酯:V石油醚=1:4,洗脫劑:V乙酸乙酯:V石油醚=1:5,HF254薄層色譜板(規格2.5 cm×5.0 cm,100片左右,保存在干燥器中),層析硅膠(200-300目)。
4 儀器設備
CL-2型集熱式磁力攪拌器,回流冷凝管,攪拌磁子,鐵架臺,燒瓶夾,冷凝管夾,抽濾瓶,布氏漏斗,100 mL三頸燒瓶,100 mL單口茄形燒瓶,100 mL玻璃層析缸,19#空芯塞,顯色劑霧化器,培養皿(內徑15 cm),玻璃刀,100 mL量筒,10 mL量筒,2 mL刻度滴管,濾紙,剪刀,鉛筆,直尺(學生自帶),封閉式電爐,循環水式多用真空泵,三用紫外燈(2臺),旋轉蒸發器,層析柱(d=3.0 cm,l=40 cm),500 mL溶劑球,玻璃棒(80 cm),脫脂棉,鋁質試管架,試管(d=1.2 cm,l=15 cm),漏斗,燒杯,藥用熔點儀,封端熔點管,旋光儀,紅外光譜儀,核磁共振儀,核磁樣品管,50 mL容量瓶。
5 實驗進度安排
實驗分4個階段進行,具體安排如下:
第一階段為甲基α-D-吡喃甘露糖苷的合成。教師利用反應等待時間講解薄層色譜與柱色譜的基本原理、薄層色譜法示蹤反應進程的操作方法。
第二階段為甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的合成。教師利用反應等待時間講解有機化合物結構表征常見方法的基礎知識。
第三階段為柱色譜分離純化甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷。
第四階段為甲基-α-D-吡喃甘露糖苷和甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的比旋光度及紅外光譜的測定以及甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的1H NMR、13C NMR一維譜、H-H相關和C-H相關二維譜的測定。教師對結構表征結果進行解析。該階段實驗按如下方案實施:①組織學生參觀核磁共振實驗室和紅外光譜室,簡要介紹實驗室情況;②將學生分成A、B兩組,A組先在一名教師指導下完成甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的核磁共振實驗,再在另一教師指導下完成熔點測定、比旋光度測定和紅外光譜的實驗;B組先在一名教師指導下完成甲基α-D-吡喃甘露糖苷的熔點測定、比旋光度測定和紅外光譜的實驗,再在另一教師指導下完成核磁共振實驗;③匯總實驗結果,對結構表征結果進行解析。
6 實驗步驟
6.1 第一階段
在干燥的100 mL三頸燒瓶中加入攪拌磁子和無水甲醇(10 mL),然后將其安裝至集熱式磁力攪拌器上。室溫攪拌下緩慢滴加乙酰氯(1 mL,用刻度滴管滴加)。然后一次性加入D-甘露糖(3.0 g,16.7 mmol),裝上回流冷凝管,側口用空芯塞塞上,加熱回流反應。用TLC(展開劑:V乙酸乙酯:V甲醇= 5:3,顯色方法為硫酸碳化法)監測反應(每小時監測一次)至原料基本消失,3小時左右反應基本完全,此時反應混合物為固液混合物。冷卻至室溫,過濾,抽干得白色固體(若產品帶顏色,可用少量甲醇洗滌至白色)。用TLC檢驗產品純度合格(單一斑點)固體稱重后,將各組產品合并。將各組濾液合并,濃縮至1/2體積,有固體析出,過濾得白色固體,該固體經TLC純度檢測合格后,將兩部分產品合并,真空干燥后備用。
6.2 第二階段
稱取甲基α-D-吡喃甘露糖苷(0.5 g,2.57 mmol)置于100 mL單口茄形瓶中,加入吡啶(10 mL)和催化劑DMAP(50 mg,也可不加)。室溫攪拌下緩慢加入苯甲酰氯(1.5 mL,12.6 mmol),加完讓其繼續反應。用TLC(V石油醚:V乙酸乙酯=3:1,先在紫外燈照射下用鉛筆描出熒光斑點,再用硫酸碳化顯色)監測。若1.5小時仍未反應完全,可通過加熱(70°C)促進反應;若加熱半小時仍未反應完全,可補加少量苯甲酰氯。待TLC監測反應完全后,加入少量甲醇(約1 mL,若無甲醇,可加1 mL水)反應數分鐘。濃縮去除溶劑,往燒瓶中依次加入自來水(50 mL)和二氯甲烷(50 mL)將殘留物溶解,將混合物轉入分液漏斗中,分液。有機層依次用10%稀鹽酸水溶液(約100 mL,也可用飽和硫酸銅溶液)、自來水(約150 mL)萃取。有機層用無水Na2SO4干燥。過濾,將各組濾液合并上交教師保存備用。
6.3 第三階段
將玻璃層析柱固定在鐵架臺上,下端用燒瓶夾托住,上端用冷凝管夾固定。在層析柱底部填充少量脫脂棉,并用玻璃棒壓住,再往層析柱中加適量洗滌劑(高度約5 cm),鐵架臺上放一250 mL燒杯,用于收集流出液。另取適量硅膠置于燒杯(500 mL,可幾組共用)中,加洗脫劑將硅膠浸濕。然后將硅膠轉至層析柱中,使硅膠高度達到約20 cm。將層析柱中液面放低至與硅膠層相切,然后用雙手輕輕拍擊層析柱中部,此時硅膠層下降(若硅膠層高度不夠20 cm,應補加硅膠)。將第二階段實驗所得有機溶液濃縮(使殘留漿狀物具有一定流動性,太黏或太稀均影響柱分離效果),然后將層析柱中液面放低至與硅膠層相切,用滴管將殘留漿狀物轉移至層析柱中,使殘留漿狀物厚度為5 mm(注意:盡量將殘留漿狀物送至硅膠上水平面,不要將硅膠沖起),并覆蓋整個硅膠。打開閥門,將殘留漿狀物上水平面放低至與硅膠層相切,關閉閥門,在層析柱中加入2-3 cm厚的無水硫酸鈉(食鹽亦可)。然后向層析柱中加洗脫劑使液面接近層析柱上口部位,打開閥門,套上溶劑球,再往溶劑球中加更多的洗脫劑。此時用試管收集流出液,并用TLC監測流出液組成成分情況。(注意:最初不需將TLC板展開,只要觀察是否有熒光斑點出現;當出現熒光斑點時,此時將TLC板展開。)當TLC顯示為單一目標產物時(由教師確定),合并該部分洗脫液(可與其他組合并),濃縮回收產品及洗脫劑,其他洗脫液直接回收。當流出液不含單一目標產物時,停止柱層析操作,并回收層析柱內的洗脫劑。所有產物濃縮后,真空干燥備用。
6.4 第四階段
①甲基α-D-吡喃甘露糖苷的比旋光度測定。
準確稱取甲基α-D-吡喃甘露糖苷(0.5000 g),用二次蒸餾水溶解并定容至50 mL。用二次蒸餾水做背景消除,再測定樣品的旋光度,復測4次,求5次測定的平均值。平均值乘以100即為甲基α-D-吡喃甘露糖苷的比旋光度。
②甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的比旋光度測定。
以氯仿為溶劑,按照甲基α-D-吡喃甘露糖苷的比旋光度測定方法進行測定。
③甲基α-D-吡喃甘露糖苷的紅外光譜測定。
將溴化鉀研細后放置于紅外燈下,取少量甲基α-D-吡喃甘露糖苷與溴化鉀研磨混勻,并在紅外燈下烘烤數分鐘。壓制背景片和樣品片,用背景片做背景消除后,測定樣品紅外光譜。
④甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的紅外光譜測定。
按照甲基α-D-吡喃甘露糖苷的紅外光譜測定方法進行測定。
⑤甲基α-D-吡喃甘露糖苷的核磁共振譜測定。
往核磁管中加入適量甲基α-D-吡喃甘露糖苷(約10-20 mg)和重水(0.5 mL),用核磁共振儀測定甲基α-D-吡喃甘露糖苷的1H NMR、13C NMR一維譜、H-H相關和C-H相關二維譜。
⑥甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的核磁共振譜測定。
以氘代氯仿(0.5 mL)為溶劑,測定甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的1H NMR、13C NMR一維譜、H-H相關和C-H相關二維譜。
⑦甲基α-D-吡喃甘露糖苷的熔點測定。
⑧甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的熔點測定。
7 結果與討論
7.1 紅外光譜
7.1.1 甲基α-D-吡喃甘露糖苷的紅外光譜
由圖2可知,3455 cm-1是O―H伸縮振動峰(分子間氫鍵),3293 cm-1是O―H伸縮振動峰(締合),2946 cm-1是C―H伸縮振動峰,1403 cm-1是C―H彎曲振動峰,1122、1033、971 cm-1是C―O伸縮振動峰。
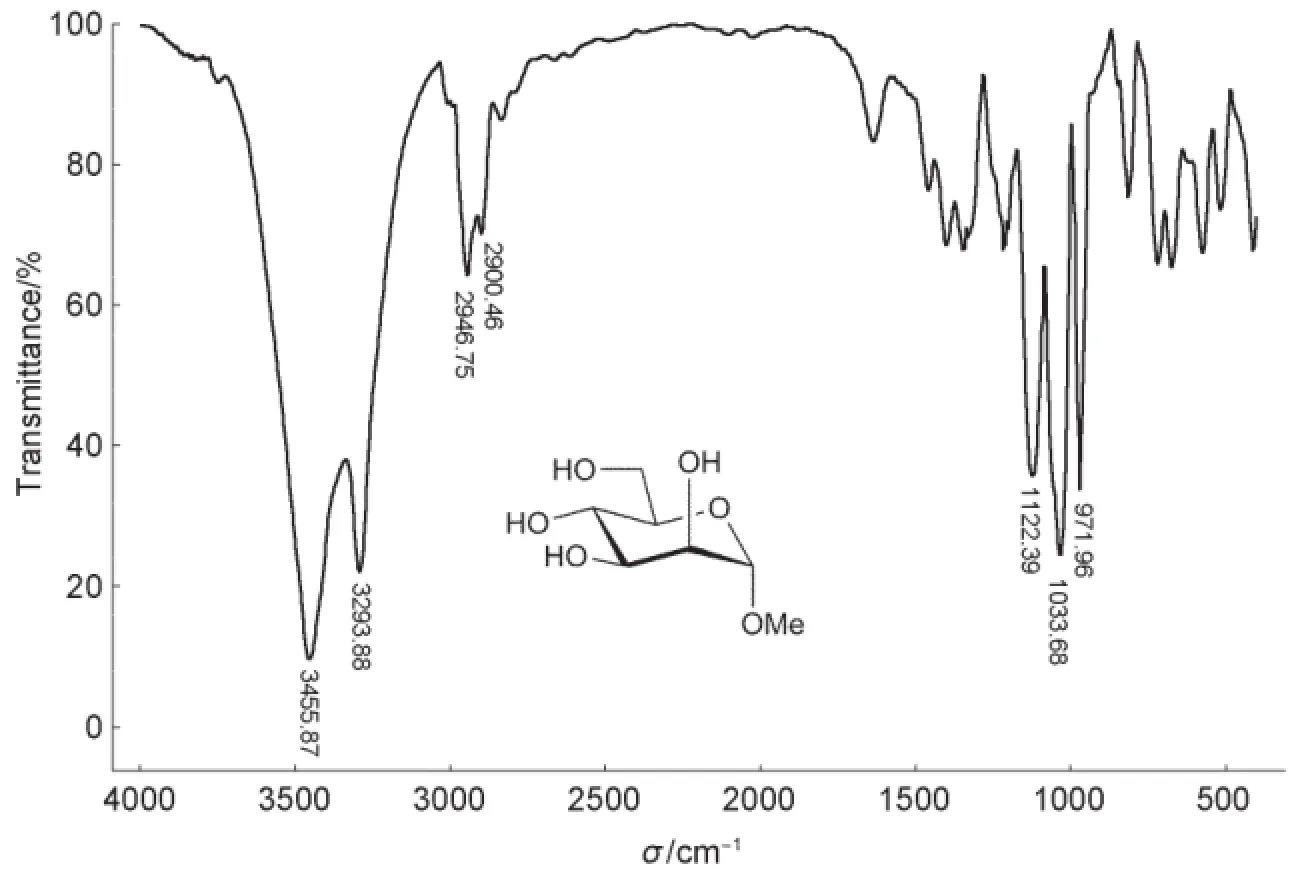
圖2 甲基α-D-吡喃甘露糖苷的紅外光譜圖
7.1.2 甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的紅外光譜
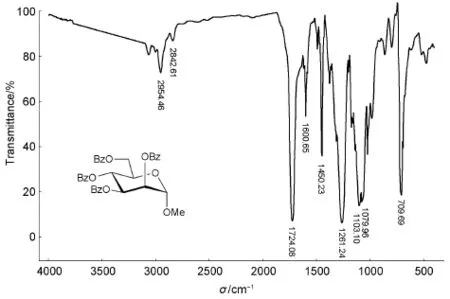
圖3 甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的紅外光譜圖
由圖3可知,2954、2842 cm-1是C―H伸縮振動峰,1724 cm-1是C=O伸縮振動峰,1600-1450 cm-1是苯環骨架振動峰,1261、1103、1079 cm-1是C―O伸縮振動峰,709 cm-1是單取代苯環上的C―H面外彎曲振動峰。
對比圖2和圖3,C=O伸縮振動峰和苯環骨架振動峰證實羥基已被苯甲酰化。
7.2 核磁共振、旋光度和熔點
甲基α-D-吡喃甘露糖苷和甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的核磁共振、旋光度和熔點數據如下:
由1H NMR可知,3.30處為3個氫的單峰,為甲基氫,說明甘露糖成功甲基化。耦合常數J1,2=1.5 Hz和1JC-1,H-1=172.0 Hz共同說明糖苷鍵為a鍵,即糖苷化產物為α-異構體。
②甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷[α=-66.2°(c 1,HCCl3)。1H NMR(500 MHz,DCCl3):δ 8.15-7.82(m,8H,4 o-Ph-H),7.61-7.25(m,12H,4 m-and p-Ph-H),6.12(dd,1H,J4,3=J4,5=10.2 Hz,H-4),5.92(dd,1H,J3,4=10.2 Hz,J3,2=3.0 Hz,H-3),5.71(dd,1H,J1,2=1.0 Hz,J2,3=3.0 Hz,H-2),5.01(d,1H,J1,2=1.0 Hz,H-1),4.72(dd,1H,J6a,5=2.5 Hz,J6a,6b=12.0 Hz,H-6a),4.52(dd,1H,J6b,5=4.5 Hz,J6b,6a=12.0 Hz,H-6b),4.42(ddd,1H,J4,5=10.2 Hz,J5,6a=2.5 Hz,J5,6b=4.5 Hz,H-5),3.55(s,3H,H-OMe)。13C NMR(125 MHz,DCCl3):δ 166.2,165.5,165.4 (4C,4 PhCO-C,one signal overlapped),133.5,133.2,133.1,129.9,129.8,129.7,129.3,129.1,129.0,128.6,128.5,128.3(24 C,4 Ph-C,some signals overlapped),98.7(1C,1JC-1,H-1=174.1 Hz,C-1),70.4(1C,C-2),70.1(1C,C-3),68.8(1C,C-5),66.9(1C,C-4),62.9(1C,C-6),55.6(1C,C-OMe)。m.p.133.9-134.8°C。
1H NMR中8.15-7.25區間內有20個氫,為4個苯甲酰基苯環上的氫;13C NMR中166.2、165.5、165.4處共有4個C,為苯甲酰基的羰基碳,說明甲基α-D-吡喃甘露糖苷的四個羥基均成功酯化。偶合常數J1,2=1.0 Hz和1JC-1,H-1=174.1 Hz共同說明糖苷鍵為a鍵,即目標產物為α-異構體。
8 思考題
(1)將醛或酮轉化為相應的縮醛或縮酮的反應條件應為干燥氯化氫氣體的醇溶液,費歇爾糖苷化的實質是半縮醛羥基醚化形成縮醛,為何采用甲醇與乙酰氯就能實現甘露糖的糖苷化?
(2)甘露糖的甲基苷化的主要產物是α-異構體,β-異構體為痕量產物。從反應機理和空間電子效應角度出發,對甘露糖的甲基苷化反應的立體選擇性進行解釋。
(3)如何用薄層色譜監測反應進程,判斷費歇爾糖苷化和苯甲酰化反應是否完全(或達到平衡狀態)的依據分別是什么?如何促使苯甲酰化反應更徹底?
(4)如何選擇柱層析的流動相?
(5)影響柱層析分離效果的因素有哪些?
(6)在測定物質的比旋光度時,背景消除時儀器示數非常穩定,但測定樣品時出現儀器示數不穩定現象,如何解決?
(7)以氘代氯仿為核磁溶劑時,為何13C NMR譜圖在77.3處有三重峰(溶劑峰)?若以氘代二甲亞砜為核磁溶劑,則13C NMR譜圖中溶劑峰是幾重峰?
(8)甲基α-D-吡喃甘露糖苷的分子式為C7H14O6,但從1H NMR譜圖獲知氫的積分值之和為10,缺失4個氫,試解釋其原因?
(9)如何確定中間體和目標產物均為α-異構體?
(10)如何對核磁共振譜圖中的氫或碳進行歸屬,如何計算偶合常數?
(11)dd峰、t峰(三重峰)、q峰(四重峰)之間有何區別與聯系?
9 結論
本文介紹的甲基2,3,4,6-四-O-苯甲酰基-α-D-吡喃甘露糖苷的合成及結構表征實驗源于科學研究,涵蓋了藥物合成研究的合成、分離純化、結構表征3個重要環節。該實驗內容新穎,所用藥品、試劑和材料便宜易得,實驗重現性好,不僅適合制藥工程專業實驗教學,也適合于有機合成專業實驗教學。通過實驗,能加深學生對多步合成、官能團保護、立體選擇性和區域選擇性、反應進程監測與判斷、薄層色譜和柱色譜的應用、結構表征等相關知識的理解,也能提高學生的實驗技能、科研興趣和創新能力。本實驗已在湖南師范大學化學化工學院制藥工程專業本科生的藥物合成實驗課程中進行了5年的教學實踐,取得了良好的教學效果。
參考文獻
[1]徐凌云,趙靜國,陳 平,鄭衛平,胡明秀.藥學教育,2014,30,69.
[2]吳勝昔,胡 勇,陳忠敏.科學咨詢(科技·管理),2014,14,127.
[3]劉小平,徐海星,李湘南,申永存,馬定桂.實驗室科學,2009,69,15.
[4]李元祥,林紅衛.廣東化工,2010,37,177.
[5]杜曉光,耿美玉.生命科學,2011,23,671.
[6]孔繁祚.糖化學.北京:科學出版社,2005.
中圖分類號:O6-3;G64
doi:10.3866/PKU.DXHX20160460www.dxhx.pku.edu.cn
*通訊作者,Email:youlinzengcn@gmail.com
基金資助:國家自然科學基金面上項目(21272064);湖南省教育廳資助科研項目(12C0249);湖南師范大學實習基地項目(043-008)
Synthesis and Structural Characterization of Methyl 2,3,4,6-tetra-O-benzoyl-α-D-mannopyrannoside
LIU Mei-Yan ZENG You-Lin*
(Drug Synthesis Experiment Teaching Center,Hunan Normal University,Changsha 410081,P.R.China)
Abstract:A new comprehensive drug synthesis experiment was introduced in this article.From commercially available D-mannose,methyl 2,3,4,6-tetra-O-benzoyl-α-D-mannopyrannoside was synthesized via Fischer-Helferich glycosylation followed by benzoylation.The intermediate and the target compound were purified by filtration,washing,concentration,extraction,drying,and silicon column separation.The structure was characterized by the infrared spectrum(IR),nuclear magnetic resonance (NMR)spectrum,measurements of melt point and optical rotation of the compound.
KeyWords:Reactionmonitoring;D-mannose;Structuralcharacterization;Drugsynthesisexperiment

