花生蛋白飲料中花生蛋白免疫檢測方法的建立
王 宇,戚 平,肖 劍,梁智安,王成龍
(廣州市食品檢驗所,廣東廣州 510410)
花生蛋白飲料中花生蛋白免疫檢測方法的建立
王宇,戚平,肖劍,梁智安,王成龍
(廣州市食品檢驗所,廣東廣州510410)
建立基于競爭酶聯(lián)免疫分析(ELISA)的花生蛋白飲料中花生蛋白定量方法。以變性的花生Ara h 1,Ara h 2,Ara h 9為抗原,分別制備抗這3種蛋白的多克隆抗體,構建競爭ELISA方法。分析了9個花生品系的Ara h 1,Ara h 2和Ara h 9的含量。基于花生Ara h 1與可溶蛋白的比例關系,得出了植物蛋白飲料中花生蛋白含量的計算方法。該方法線性范圍均為1.0~50.0 μg/mL(R2=0.99);花生Ara h 1蛋白含量除以系數(shù)0.15可換算得到蛋白飲料中花生蛋白含量;使用巴氏殺菌、超高溫瞬時滅菌和高壓滅菌的蛋白平均回收率分別為95%,93%,80%;方法相對標準偏差<14%。
花生;蛋白飲料;ELISA;定量
0 引言
花生(Arachis hypogaea L.)是一種營養(yǎng)豐富的食物,脂肪含量高且多為不飽和脂肪酸,蛋白質(zhì)含量豐富,氨基酸構成比例合理,含有人體必需的氨基酸及具有促進腦細胞發(fā)育、增強記憶功能的營養(yǎng)元素[1]。同時,花生蛋白具有易于消化、易被人體吸收、穩(wěn)定血糖和保持心臟健康等優(yōu)點,使其成為理想的植物蛋白飲料原料。
花生蛋白飲料作為消費量較大的植物蛋白飲料之一,因其味道香甜深受消費者喜愛。現(xiàn)行國家衛(wèi)生標準(GB 16322—2003)或企業(yè)產(chǎn)品標準(QB/T 2438—2006) 均規(guī)定植物蛋白飲料中的蛋白質(zhì)含量應該不低于0.5 g/100 mL。目前,針對蛋白質(zhì)含量的測定方法主要有凱氏定氮法、雙縮脲法、紫外吸收法等化學法和光譜法,但由于其靈敏度較低、操作步驟繁瑣,且容易受到外部添加物質(zhì)的干擾,同時一些不法商販受利益驅(qū)使在食品中使用非法添加物,給傳統(tǒng)蛋白質(zhì)檢測方法在實際樣品檢測中的應用帶來了挑戰(zhàn)。當前,在植物蛋白飲料中可冒充蛋白使用的物質(zhì)眾多,并且存在使用廉價的大豆蛋白、牛奶蛋白冒充高價蛋白的可能。因此,必須要有針對性地對食品中和原料相關的特定蛋白含量進行檢測。目前,醫(yī)學上腫瘤標志物的研究方法已越來越多的用于食品中特定蛋白質(zhì)的檢測[2-7],即通過蛋白質(zhì)組學尋找物種蛋白定量標志物。這些定量標志物在物種中穩(wěn)定存在,具有熱穩(wěn)定性,且易于提取,因此可通過對其定量和推算,得出該物種蛋白在食品中的含量。
1 材料和方法
1.1材料
1.1.1試劑和樣品
四甲基聯(lián)苯胺(TMB)、弗氏完全佐劑和弗氏不完全佐劑、二硫蘇糖醇(DTT),購自Sigma公司;其余試劑均為國產(chǎn)分析純,購自廣州化學試劑公司。ELISA反應檢測用試液和配制方法,參照冷泉港實驗室手冊[4];其他花生蛋白飲料,隨機采購于廣州市場和網(wǎng)絡銷售平臺。
1.1.2主要儀器設備
iMARK酶標分析儀,BIORAD公司產(chǎn)品;VCX750型超聲破碎儀,Sonics and Materials公司產(chǎn)品;Kjeltec 8400型蛋白測定儀,F(xiàn)oss公司產(chǎn)品;高速離心機,Sigma公司產(chǎn)品;精密電子天平等常規(guī)儀器。
1.2試驗方法
1.2.1抗體的制備
Ara h 1,Ara h 2,Ara h 9分別按照參考文獻[5-7]提供的方法進行純化,即將Ara h 1,Ara h 2,Ara h 9分別溶解于0.1%DTT的7 mol/L尿素中進行變性處理,免疫前使用0.01 mol/L pH值7.4的PBS緩沖液稀釋10倍,配制成質(zhì)量濃度為1 mg/mL的免疫試劑。皮下免疫新西蘭大白兔,每只劑量0.1 mL。多克隆抗體制備方法參考冷泉港實驗室手冊的方法進行[4],使用硫酸銨沉淀法純化抗體[8]。
1.2.2ELISA標準品
分別配制10 mg/mL花生Ara h 1,Ara h 2,Ara h 9的PBS緩沖溶液,于沸水浴中加熱30 min。加入固體DTT和尿素,使其形成含有0.1%DTT的7 mol/L尿素溶液,經(jīng)超聲處理10 min,再用0.01 mol/L pH值7.4的PBS緩沖液稀釋。
1.2.3競爭ELISA操作
在96孔微孔板中,每孔加花生Ara h 1,Ara h 2,Ara h 9蛋白包被液100 μL,于4℃下孵育過夜。次日甩掉包被液,用洗滌液清洗1次,每孔加入200 μL封閉液,于37℃下孵育3 h,甩掉封閉液。每孔加50 μL酶標多克隆抗體和50 μL樣品(或為蛋白標準溶液),陰性對照孔用PBS代替。于37℃下反應0.5 h,反應完后用PBST洗3次。加底物液,于37℃下反應10 min,加10%的H2SO4溶液終止反應后酶標儀讀數(shù)。采用棋盤法試驗優(yōu)化包被抗原和酶標抗體的最佳稀釋倍數(shù),建立花生蛋白分析方法。以蛋白質(zhì)量濃度為橫坐標,A/A0為縱坐標繪制標準曲線(A為樣品或標準品的吸光度,A0為空白溶液的吸光度),使用Origin 7.5軟件四參數(shù)擬合計算標準曲線的IC50。
1.2.4ELISA檢測抗體特異性
選擇其他植物蛋白飲料中常見的蛋白作檢測對象,采用競爭ELISA方法檢測抗體與其他蛋白之間的交叉反應,交叉反應率按照花生蛋白半抑制率與其他蛋白半抑制率的百分比計算。
1.2.5花生可溶蛋白提取
花生可溶蛋白的提取方法參照董貝森[9]報道的方法并略作改進,具體如下:干花生于40℃鼓風干燥箱內(nèi)繼續(xù)干燥48 h后,使用錘式旋風磨進行細粉碎,確保90%以上通過60目篩。稱取10 g粉碎的花生粉,于40℃恒溫條件下,使用1 000 mL蒸餾水分5次超聲提取花生蛋白,每次提取時間為1 h。將5次提取的提取液合并,然后使用GB 5009.5—2010食品安全國家標準食品中蛋白質(zhì)的測定中規(guī)定的凱氏定氮法測定可溶蛋白含量;使用1.2.4建立的酶聯(lián)免疫法測定花生Ara h 1,Ara h 2,Ara h 9蛋白含量。其他用于交叉反應測試的堅果和豆類可溶蛋白均使用該方法提取。
1.2.6檢測樣品前處理
固體蛋白飲料采用含0.1%DTT的7 mol/L尿素作為樣品提取液,提取固體蛋白飲料中的蛋白成分。采用搗碎、研磨等方法對固體樣品進行均質(zhì)處理,稱取5 g樣品,使用樣品提取液定容至100 mL。超聲提取10 min后離心,分離上清液,使用0.01 mol/L pH值7.4 PBS適當稀釋至ELISA標準曲線線性范圍(為避免變性劑和還原劑對ELISA的影響,至少需稀釋100倍)。液體蛋白飲料直接加入DTT和尿素,使其添加量和終濃度分別為0.1%和7 mol/L,后續(xù)處理步驟同固體蛋白飲料。
1.2.7樣品模擬熱加工試驗
花生的模擬熱加工工藝參考張彩等人[10]的報道方法:采用蒸餾水對花生勻漿處理1 h,加入8%的蔗糖,0.08%的單甘油脂肪酸酯,0.12%的蔗糖脂肪酸酯,0.04%的黃原膠和0.05%的海藻酸鈉;繼續(xù)勻漿1 h后,以轉(zhuǎn)速3 000 r/min離心10 min,保留上清液,分別采用巴氏殺菌(65℃,30 min)、超高溫瞬時滅菌(137℃,4 s)、高壓滅菌(121℃,15 min)進行熱加工;采用1.2.6所述的前處理方法和1.2.4建立的ELISA方法進行檢測。
2 結果與討論
2.1ELISA方法
蛋白質(zhì)是物種基因表達的產(chǎn)物,同樣承載了大量的遺傳信息。因此,通過蛋白質(zhì)組學研究尋找物種蛋白的定量標志物是可行的。蛋白特異性定量的靈敏度和準確性一定程度上取決于蛋白定量標志物的選擇是否準確。同時,由于免疫反應大多數(shù)在水系中進行,因此蛋白定量標志物必須為組織中的高豐度蛋白,且能溶于水。此外,在加工食品中,物種蛋白定量標志物必須具有熱穩(wěn)定性。由于花生是人類可食用蛋白質(zhì)的重要來源之一,研究較為透徹。花生Ara h 1,Ara h 2,Ara h 9是花生中具有水溶性、熱穩(wěn)定性,且有著較高豐度的3種蛋白質(zhì)[11]。ELISA是蛋白質(zhì)定量檢測的經(jīng)典方法。在ELISA方法中,雙抗夾心法因其具有特異性高、反應靈敏等優(yōu)勢,是檢測大分子蛋白的經(jīng)典反應模式,常被用于過敏原檢測。然而在熱處理過程中,部分蛋白發(fā)生水解使其不能同時被2個抗體結合。張世偉和王士峰等人[12-13]證明,競爭法檢測經(jīng)過熱處理的蛋白比雙抗夾心法定量更為準確。在競爭ELISA方法中,1個抗原分子只結合1個抗體,大分子蛋白即使被水解,只要抗原決定簇不受破壞,仍然可被抗體識別。因此,本研究基于競爭ELISA法,建立了檢測花生Ara h 1,Ara h 2,Ara h 9蛋白的ELISA方法。
花生Ara h 1,Ara h 2,Ara h 9的競爭ELISA標準曲線見圖1。

圖1 花生Ara h 1,Ara h 2,Ara h 9的競爭ELISA標準曲線
傳統(tǒng)方法進行蛋白抗體制備往往使用天然蛋白免疫實驗動物,但本研究的目的主要是用于檢測熱加工食品,因此使用熱處理后的變性蛋白更有利于篩選到識別熱加工蛋白的特異性抗體。因此,本研究采用經(jīng)還原劑和變性劑處理過的花生Ara h 1,Ara h 2,Ara h 9蛋白作為抗原,分別制備出相應的多克隆抗體,并以變性處理的蛋白為標準分析物建立了ELISA標準曲線。由圖1可知,抗體檢測花生Ara h 1,Ara h 2,Ara h 9蛋白的IC50分別為8.6,34.3,2.6 μg/mL;線性范圍分別為1.0~50.0 μg/mL,5.0~100 μg/mL和0.2~10.0 μg/mL,相關系數(shù)均大于0.99。
2.2食品中花生蛋白的測定方法
根據(jù)方法選定的蛋白定量標志物,推算所檢測對象中總蛋白含量的前提是定量標志物和總蛋白的比例不因物種的品系和產(chǎn)地差異而變化較大,然而基于花生品系之間這3種蛋白含量的差異尚未見報道。本研究通過市場、網(wǎng)絡銷售平臺采集了來自國內(nèi)9個品系的花生樣品,主要研究蛋白定量標志物和可溶蛋白的比值,通過評估其比值變化以確定蛋白定量標志物,通過建立的ELISA方法分析其花生Ara h 1,Ara h 2,Ara h 9蛋白含量,通過凱氏定氮法測定其可溶蛋白含量。
不同花生品系中Ara h 1,Ara h 2,Ara h 9含量(n=6)見表1。

表1 不同花生品系中Ara h 1,Ara h 2,Ara h 9含量(n=6)
由表1可知,這3個蛋白在這9個品系中的相對標準偏差分別為7.0%,30.8%和34.1%。Ara h 2,Ara h 9品系間含量差異過大,因此不適合作為花生蛋白的定量標志物。本研究采用花生Ara h 1蛋白作為定量標志物,植物蛋白飲料中花生蛋白含量可使用以下公式計算:
C花生蛋白含量=C花生Ara h 1蛋白含量/0.15.
單位均為mg/g(固體)或mg/mL(液體)。
2.3方法的特異性
植物蛋白飲料可能同時存在幾種植物蛋白和乳蛋白[14]。交叉反應試驗結果表明,所建立的檢測方法特異性較好,與包括其他種子蛋白和乳蛋白均無交叉反應。
與其他蛋白的交叉反應率見表2。

表2 與其他蛋白的交叉反應率
2.4熱加工對蛋白定量的影響
由于蛋白在高溫加熱中會發(fā)生變性、水解、聚集等作用,這些作用將不同程度影響到定量的準確性。參照張世偉等人[12]報道的方法,本研究使用含0.1%DTT的7 mol/L尿素溶液溶解變性蛋白,將不同變性程度的蛋白還原為較為統(tǒng)一的狀態(tài),模擬花生蛋白飲料的加工工藝考察了3種殺菌方式對蛋白測定的影響,從而獲得更準確的定量結果。
不同加熱方式的花生蛋白ELISA檢測結果比較見圖2。
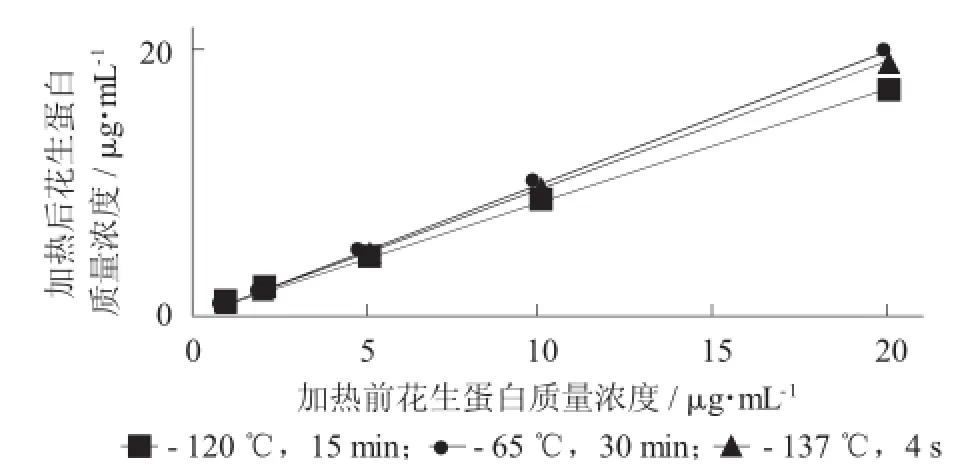
圖2 不同加熱方式的花生蛋白ELISA檢測結果比較
由圖2可知,基于以上優(yōu)化的前處理方法和ELISA反應模式,對巴氏殺菌、超高溫瞬時滅菌和高壓滅菌的蛋白平均回收率分別為95%,93%和80%,結果說明本方法對熱加工的花生蛋白定量較為可靠,但劇烈的熱加工方式會對花生蛋白的定量結果準確性產(chǎn)生一定的影響。
2.5實際樣品檢測
從廣州市場和網(wǎng)絡銷售平臺隨機購買花生乳、速溶花生粉樣品,采用所建立的ELISA方法和國標GB 5009.5—2010規(guī)定的凱氏定氮法進行檢測。
市售樣品中花生蛋白含量檢測結果(n=6)見表3。
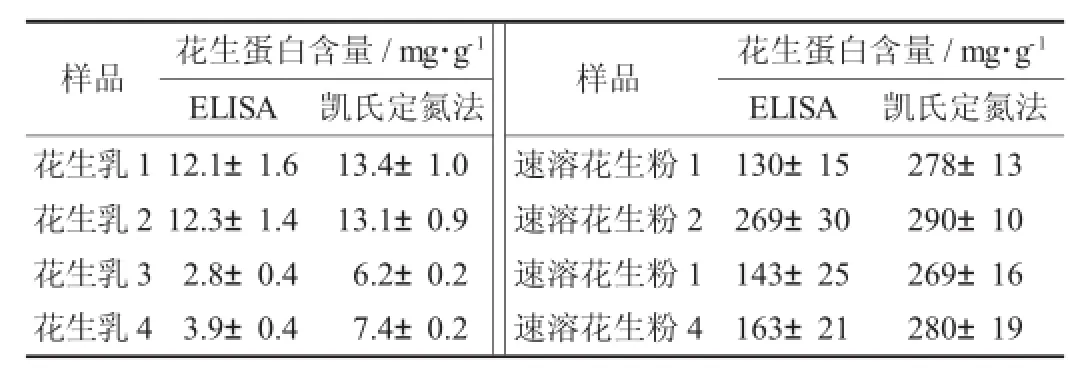
表3 市售樣品中花生蛋白含量檢測結果(n=6)
由表3可知,4款花生乳按凱氏定氮法檢測蛋白含量均合格(≥5 mg/g),然而通過特定蛋白定量發(fā)現(xiàn),2款產(chǎn)品的花生蛋白含量遠小于5 mg/g;速溶花生粉也有3款和凱氏定氮法有較大差異,說明其添加有其他種類的蛋白。盡管ELISA方法的相對標準偏差接近14%(大于凱氏定氮法),但是使用ELISA方法仍然能夠檢測出其中花生蛋白所占的比例,一定程度上反應出食品中特定原料的使用情況。
3 結論
植物蛋白飲料的特點是主要原料來源于特定的植物種子,然而QB/T 2438—2006規(guī)定其蛋白測定方法為凱氏定氮法,不能反映其原料的生物屬性,因此存在使用廉價的牛奶蛋白、大豆蛋白配合香精香料冒充花生蛋白的可能。基于蛋白質(zhì)組中蛋白定量標志物的定量方法,為珍貴的食用蛋白定量檢測提供了可行的技術路線,也為食品摻偽檢測提供了有效的技術手段。
[1]徐滿清,鄭為完.花生蛋白飲料的現(xiàn)狀與展望 [J].食品研究與開發(fā),2002,23(6):6-9.
[2]Ayako Y,Yutaka T,Takahiro N.Enzyme immunoassay for phycocyanin as the main component of Spirulina color in foods[J].Biosci Biotech Biochem,1996,60(1):57-60.
[3]Zhang S,Lai X,Liu X,et al.Competitive enzyme-linked immunoassay for sialoglycoprotein of edible bird's nest in food and cosmetics[J].J Agric Food Chem,2012,60(14):3 580-3 585.
[4]HarlowE,LaneD.Antibodies:Alaboratorymanual[M].New York:Cold Spring Harbor Laboratory Press,Cold Spring Harbor Laboratory Press,1988:139-242.
[5]Maleki S,Kopper R D,Park C,et al.Structure of the major peanut allergen Ara h 1 may protect IgE-binding epitopes from degradation[J].Journal of Immunology,2000,164(11):5 844-5 849.
[6]張英坤,陳紅兵.離子交換層析法分離花生過敏原Ara h2的研究 [J].食品科學,2006,27(12):259-262.
[7]Lauer I,Dueringer N,Pokoj S,et al.The non-specific lipid transfer protein,Ara h 9,is an important allergen in peanut[J].Clinical&Experimental Allergy,2009,39(9):1 427-1 437.
[8]Wengatz I,Stoutamire D,Gee S J,et al.Development of an enzymelinked immunosorbent assay for the detection of the pyrethroid insecticide fenpropathrin[J].J Agric Food Chem,1998,46(6):2 211-2 221.
[9]董貝森.花生蛋白粉的制取及在食品工業(yè)中的應用 [J].中國油料作物學報,1998(3):85-89.
[10]張彩,童華榮,章道明,等.植物蛋白飲料配方優(yōu)化研究 [J].西南農(nóng)業(yè)大學學報,2006,28(2):197-200.
[11]隗嘯南,高金燕,李欣,等.花生過敏原蛋白分離純化方法研究進展 [J].食品科學,2011,32(17):371-375.
[12]張世偉,賴心田,洪曉明,等.競爭酶聯(lián)免疫法測定食品中雞蛋過敏原 [J].檢驗檢疫學刊,2012(6):41-43.
[13]王士峰,張世偉,賴心田,等.高靈敏間接競爭ELISA檢測羊乳樣本中的牛乳成分 [J].中國乳品工業(yè),2015,43(10):41-43.
[14]Zhang S,Lai X,Yang G.Enzyme-linked Fab'fragment based competitive immunoassay for ovalbumin in hot-processed food[J].Journal of Immunoassay and Immunochemistry,2013,34(4):393-403.◇
Development of Immunoassay for the Determination of Peanut Protein in Peanut Protein Beverage
WANG Yu,QI Ping,XIAO Jian,LIANG Zhian,WANG Chenglong
(Guangzhou Institute for Food Control,Guangzhou,Guangdong 510410,China)
The aim of this research is to develop competitive enzyme linked immunosorbent assay(ELISA)for quantitation of peanut protein in peanut protein beverage.Denatured Ara h 1,Ara h 2,Ara h 9 are used as antigen respectively to prepare polyclonal antibody and establish competitive ELISA.Ara h 1,Ara h 2,Ara h 9 content in peanut of 9 strains is detected. Based on the proportionate relationship between the soluble protein content and the Ara h 1 content,the calculation method of peanut protein in peanut protein beverage is given.The linear detection range of the competitive ELISA are all 1.0~50.0 μg/mL (R2=0.99) .The peanut protein content in peanut protein beverage could be calculated by dividing the Ara h 1 content by 0.15.The average recovery rates are 95%,93%and 80%under the sterilization condition of pasteurization,ultra high temperature treated and autoclaved sterilization,respectively.The relative standard deviations of the assay are<14%.
peanut;protein beverage;enzyme linked immunosorbent assay;quantitation
TS27
A
10.16693/j.cnki.1671-9646(X).2016.06.031
1671-9646(2016)06b-0016-04
2016-04-12
廣州市科技計劃項目(201510010035)。
王宇(1980— ),男,博士,中級工程師,研究方向為食品質(zhì)量安全。

