玻璃減薄蝕刻工序產生的含氟廢水處理工藝研究
招霖濟 肖俊賢 李景超(東莞市和利精細化工有限公司, 廣東 東莞 523000)
?
玻璃減薄蝕刻工序產生的含氟廢水處理工藝研究
招霖濟 肖俊賢 李景超(東莞市和利精細化工有限公司, 廣東 東莞 523000)
摘要:根據東莞某公司在電子玻璃面板減薄蝕刻工序產生的含氟廢水,在分析其成分及含量的基礎上,探討該類含氟廢水的處理原理及工藝流程,相應實驗表明: 該類廢水首先用鈉鹽NaCl為沉淀劑,沉淀出部分的氟離子,然后將沉淀生成物Na2SiF6通過離心和過濾去除,然后濾液用熟石灰調節pH值,加入氯化鈣沉淀濾液中的氟離子,最后加入混凝劑PAC處理,廢水的氟離子濃度經處理后下降到10mg / L 以下, 達到國家污水綜合排放的一級標準。
關鍵詞:含氟廢水; 原理; 工藝; 氯化鈉; 混凝劑;氟離子
1 研究背景
隨著小米、I-PHONE等智能手機的普及,產品日趨輕薄化,智能手機等便攜式設備中廣泛應用玻璃顯示屏,顯示屏的厚度越來越低,甚至降低至了0.3mm以下。玻璃基板中的蝕刻減薄工藝成了重要的環節,減薄效果直接影響產品的質量,目前通常使用以氫氟酸為主要成分的蝕刻液進行玻璃蝕刻減薄處理,隨著反應的不斷深化,會使腐蝕溶液中的HF濃度降低,但H2SiF6含量增加,濃度達到10%~15%時,此時蝕刻液粘度會有所增加,導致薄蝕刻效果變差,無法繼續蝕刻最終變為了危廢液體,需要進行無害化處理。
查閱《污水綜合排放標準》(GB8978-1996),規定了廢水中氟離子濃度排放限值:一級標準10mg/L。因此,需要對含氟廢水進行處理,達標后才能排放。
當前,處理的含氟廢水方法與工藝非常多,化學沉淀法、吸附法、離子交換法、混凝沉淀法是非常常見的,但是各有優缺點。本論文以上述特定的含氟廢水為研究目標,在對相關廢液的成分及含量進行分析基礎上,對減薄蝕刻原理及氟離子脫除原理的進行研究,并經實驗證實,初步組合了一套有效的無害化處理工藝,保證了處理后的氟離子濃度達到國家規定的一級排放標準要求(10mg/L)。
2 玻璃減薄蝕刻的反應原理與過程
當前,酸蝕刻處理方法較為常用的是玻璃減薄蝕刻法,應用的原理為:準備HF混酸溶液,與玻璃中二氧化硅和其他金屬氧化物反應,會在玻璃表面進行剝離,這樣就實現了對玻璃的減薄與強化的效果。化學反應方程式為:
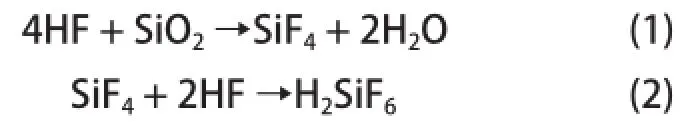
玻璃減薄液基本的配比方法為:15%~30%HF、1%~5%H2SO4、3%~10%HCl以及5%~20%NH4HF2,由(1)、(2)式可以發現,隨著減薄溶液中的HF含量度降低,H2SiF6含量不斷增加,其濃度達到了10%~15%的范圍時,將增加蝕刻液粘度,導致減薄處理效果減弱,需更換新的蝕刻液,產生的廢蝕刻液較為常見的組成有:8%~13%HF、10%~15%H2SiF6、5%~6%H2SO4、2%~3%HCl以及5%~8%的NH4HF2。
蝕刻液加入硫酸和鹽酸的原因是在蝕刻反應進行一段時間后,玻璃表面會生成不溶物氟硅酸鹽,阻止蝕刻反應,玻璃表面會蝕刻不均勻,而硫酸和鹽酸可溶解不溶物,蝕刻效果會更好。玻璃的蝕刻主要是HF酸溶液能與二氧化硅反應,但不會與其他硅基材和多晶硅反應。
鑒于氫氟酸會對二氧化硅刻蝕速率難以進行控制,一般使用稀釋后的氫氟酸溶液,或者可以在其中添加緩沖劑形成混合液,緩沖劑成分為氟化氫氨,可以補充消耗的氟化物離子確保刻蝕速率能夠更加穩定。
3 脫除氟離子的反應原理
3.1 氟離子的去除機理
氟離子機理包含的內容有兩部分,分別是生成難溶的氟化物質,處理工藝一經開始就會將氟離子濃度降低;使用同離子效應,并添加強化電解質,使氟離子濃度進一步降低,確保廢水排放更加穩定。
(1)固化沉淀脫除氟離子
該類廢液如果直接采用石灰中和處置,廢液中的F-、SiF62-離子以及pH值等可以達到排放標準,但會產生大量的CaSO4、CaF2的混合固體,屬于危險廢物,后續處置的成本極高。基于此點,本工藝分成兩步沉淀,分別選擇使用不同沉淀劑,詳細處理機理如下。
第一步沉淀:使用NaCl或KCl使廢液中H2SiF6以Na2SiF6或K2SiF6形成沉淀,Na2SiF6和K2SiF6在酸液中不溶解,分離后酸液可以循環再利用,還可以對固體Na2SiF6、K2SiF6進一步處理,生成其他含氟的產品,這樣在處理中就基本實現了“零排放”,該工藝具有較好的前景。
第二步沉淀:將剩下的游離氟離子形成溶解度低的氟化物鹽,并對其進行固化,使其形成沉淀從溶液去除,對各種氟化物研究發現,最適宜的選擇是CaF2,原因是:溶度積小,Ksp=4.0×10-11(25℃);來源較廣、價格較低和具有較低的廢水的處理成本。
將25℃作為計算參數,可將CaF2溶解反應的溶度積公式得出:
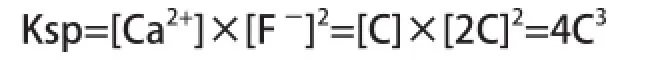
式中:[Ca2+]、[F-]分別為:平衡濃度—Ca2+、F-,mol/L;CaF2的平衡濃度—C,mol/L。將CaF225℃時的Ksp=4.0×10-11代入公式中得出:C=2.15×10-4mol/L,此時的CaF2溶解反應達到平衡時F-的濃度為:
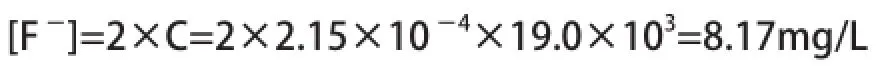
8.17mg/L為氟離子水中的理論濃度(25℃時),但是實際含氟廢水存在復雜性,這就導致了處理以后的廢水氟離子濃度會超出理論值,需要再次深度處理氟離子。
(2)借助同離子效應,能夠使氟離子濃度再次降低,相關理論為:
向難溶電解質的飽和溶液添加含有共同離子的強電解質,使平衡向沉淀方向發生移動,降低其體系中難溶電解質的離子濃度,以25℃ CaF2溶解體系為例:在平衡體系中加入易溶電解質CaCl2,加入CaCl2的量為1.0mol/ L且 完 全 電 離,則 溶 液 中Ca2+濃 度 為:[Ca2+]=1.0+C,根據Ksp=[Ca2+]×[F-]2=[1.0+C]×[2C]2, 因為Ksp數值很小,導致C的值也很小,因此[1.0+C]≈1.0,可得:Ksp≈4.0×10-11=1.0×4C2由此C=3.16×10-6mol/ L,此時,進而能夠得出平衡體系的溶液中氟離子質量濃度:[F-]=2×C=2×3.16×10-6×19.0×103=0.12mg/L依此類推可得,當加入CaCl2的量為0.1mol/L時,[F-]=0.38mg/ L;當 加 入CaCl2的 量 為0.01mol/L時,[F-]=1.2mg/L;當加入CaCl2的量為0.001mol/L時,[F-]=3.8mg/L。由此,在CaF2溶解反應的平衡體系中,增大共同離子電解質CaCl2的量,就會降低平衡體系溶液氟離子濃度,由此,在深化進行含氟廢水處理過程中,適當增加強電解質CaCl2,這對于降低氟離子濃度有著顯著作用。
3.2 氟離子進行兩次沉淀和同離子效應加強沉淀后,需要對生成的沉淀物CaF2
從溶液中分離出來。從徐金蘭[7]的文獻中可知,反應生成的CaF2沉淀物是一種細微分散的膠體顆粒,其粒徑較小,通常都低于3um,占總顆粒比重的60%左右。由斯托克斯定律可知,顆粒的半徑與其沉降速率成正相關,其粒徑越小,沉降速率越慢。因此,CaF2自然沉降速度緩慢,需要加強固液分離效率與效果,這樣才能將處理效率與效果增強。
增強CaF2沉淀物從溶液中分離效率與效果過程為:在CaF2沉淀物生成后,在廢水中添加適量的混凝劑,能夠將微粒溶液沉降速度增加,從而更好的去除懸浮物。混凝是水中膠體和細小懸浮物聚集的過程,是凝聚和絮凝的總稱。在加入強電解質后產生壓縮雙層電層作用,導致膠體顆粒失去穩定性產生凝聚作用;膠體脫穩以后,高分子物質在膠體顆粒之間架橋,產生絮凝作用。當使用的是PAC混凝劑時,能跟氟離子生成鋁氟絡合物,能夠將氟離子進一步去除。
4 實驗過程
4.1 應用的主要儀器設備
實驗使用的攪拌器為JB-1型磁力攪拌器、配合使用PXS-215 型數字型離子計、使用氟化鑭單晶膜氟離子電極、222型甘汞參比電極、 pHS-25型 pH計、天平為T500型的。
4.2 應用的主要藥劑
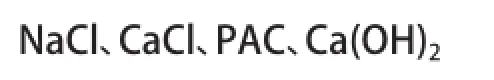
4.3 含氟廢水水樣
使用的含氟廢水水樣來自于廣東某公司,其pH值為2~3,氟離子濃度為16784mg /L左右。
4.4 實驗步驟
(1)加氯化鈉沉淀的實驗
用藥匙取6.48g氯化鈉,溶于適量水中,并攪拌至全部溶解,后將溶液稀釋至32.4g備用。
取400g含氟廢水溶液,將32.4g備用的氯化鈉溶液加入至上述溶液中,并用攪拌15min。
將上述溶液經過濾得到清液后,將溶液分成兩份,其中一份裝入樣品瓶中,標簽為樣品1,另一份備用。(附樣品1的檢測報告)

(2)加入氯化鈣沉淀的實驗
取4.4(1)實驗中備用的一份溶液,將12.4g氫氧化鈣加入溶液中調節PH值,并攪拌10min,最后取4g氯化鈣加入到溶液,并攪拌5min后過濾。
經過過濾得到清液后,將溶液分成兩份,其中一份裝入樣品瓶中,標簽為樣品2。(附樣品2的檢測報告)另一份備用。

(3)加入混凝劑PAC的實驗
取4.4(2)實驗中備用的一份溶液,逐量加入混凝劑PAC,先快速攪拌2min,再慢速攪拌4min,倒入100ml量筒中,靜置30min,觀察沉淀物和上清液的分離情況
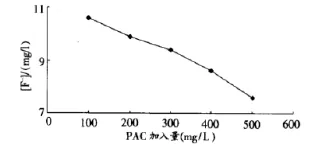
PAC的加入量和F-離子濃度的曲線圖為:
5 實驗結果與討論
5.1 氯化鈉合適加入的結論
氯化鈉加入的作用:通過Na+離子與氟硅酸生成氟硅酸鈉(Na2SiF6)沉淀,去除90%氟硅酸的F-離子,剩余主要為氫氟酸的F-離子。這部分廢液可以回用于玻璃蝕刻。
5.2 CaCl2加入的結論
加入熟石灰后攪拌10min,將pH值調為11.65,再向廢水樣中加入氯化鈣,攪拌5min;經過濾后,F-離子含量降為0.0011%,即11mg/L,基本上已經達到了國家的排放標準10mg/L并且根據同離子效應原理,加入過量的CaCl2可以抑制CaF2中F-離子的水解,進一步降低溶液中F-離子的濃度。
5.3 混凝劑 PAC加入的結論
在確定的pH值和氯化鈣加量的廢水樣([F-]=11.0mg/ L,pH=7.41)中,加入混凝劑PAC量至400mg。進一步沉淀CaF2,使溶液中F-離子的濃度降低為8.6mg/L。
有研究表明[7]:投加PAC的效果的優于Al2(SO4)3,要達到相同的效果,PAC的投加量要遠遠小于Al2(SO4)3的投加量,因此,本工藝選用投加PAC
6 含氟廢水處理的工藝流程設計
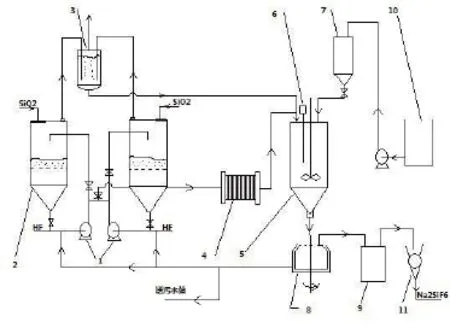
廢水處理流程示意圖
其中:(1)為F25-16型耐腐蝕泵;(2)為襯鉛的3m3的反應釜;(3)為尾氣吸收槽,內盛有H2O;(4)為壓濾機;(5)為PVC材料的Na2SiF6反應槽;(6)為工業pH計;(7)為NaOH溶液高位槽;(8)為SX800型離心機,電機型號為JO2-41-4,額定功率4kW;(9)為烘干機;(10)為NaOH溶液儲槽;(11)為磨粉機。
第一,用泵將回收的含氟廢水加入襯鉛的裝有石英砂的氟硅酸反應槽(2)中,并讓其在泵與反應槽之間循環流動1h。循環后應控制廢水中的反應產物H2SiF6的濃度為10%~15%,若濃度過高,則可用上批處理后的廢水來稀釋。
第二,用泵將氟硅酸反應槽(2)中生成的濃度為10%~15% H2SiF6溶液抽出,并經過壓濾機(4)向帶攪拌,裝有工業pH計的氟硅酸鈉(Na2SiF6)反應槽(5)加入H2SiF6溶液。
加入H2SiF6溶液后,在攪拌的情況下,向反應槽中滴加NaCl溶液(20%)至pH計顯示為中性,并取樣檢驗。
檢驗方法:取20ml溶液,并滴加NaCl溶液(10%)數滴,搖勻后不出現沉淀為合格。
如有沉淀物生成,則說明NaCl滴加不夠,此時應再滴加適量的Cl,并反復上述操作至檢驗合格為反應完畢。
第三,將上述反應完畢后的上層清液送污水站或者送蒸發器處理。反應槽(5)中生成的Na2SiF6送入離心機(8),以離心過濾的方式進行固液分離,預計含水率≤3%,離心清液回
用。除去回用水,其余為送污水處理站處理廢水。甩干后的Na2SiF6經烘干磨粉后包裝,化驗合格后為成品出售。
7 結語
本工藝通過分析含氟廢水中氟離子的去除機理和氟化鈣沉淀物的固液分離強化機理,用實驗研究和確認了加入氯化鈉、熟石灰、沉淀劑氯化鈣和混凝劑PAC對去除氟離子的效果;對于特定水樣,當氯化鈉加入量為16.2g/L攪拌15min過濾后廢水殘留[F-]=7600mg/L;當熟石灰加入量為62g/L沉淀劑氯化鈣加40g/L,沉淀15min過濾后,廢水殘留[F-]=11mg/ L;加入混凝劑PAC加400mg/L后,F-離子的濃度為8.6mg/L。取得了滿意的處理效果,與此同時設計了一套更加可行、科學、易于實現的廢水處理工藝流程,應用效果顯著。
參考文獻:
[1]程秀錦.含氟廢水處理工藝的技術改造[J].工業水處理,2007,27(6):84-86.
[2]張超杰,周琪.含氟廢水處理研究進展[J].給水排水,2002,28(2):26-29.
[3]劉鴻儀,劉立群,徐九根,等.石灰-硫酸鋁-聚丙烯酰胺法處理含氟廢水的試驗研究[J].工業水處理,1988,8(1):27.
[4]盧建杭,肖克鈴.含氟廢水治理研究進展[J].化工環保,1999,19(6):341-344.
[5]唐文浩,劉強.稀土工業酸性含氟廢水處理研究[J].中國環境科學,1996,16(4):267-269.
[6]張祥麟.無機化學(上)[M].長沙:湖南教育出版社,1988:126-148.
[7]徐金蘭,王寶泉,王志盈,等.石灰沉淀-混凝沉淀處理含氟廢水的試驗[J].水處理技術,2003,29(5):282-285.
[8]顧夏聲,黃銘榮,王占生,等.水處理工程[M],北京:清華大學出版社,1985:62-80.

