室旁核中血管緊張素Ⅱ通過活性氧介導慢性間歇性低氧大鼠的升壓作用
唐志強,范一菲,汪金麗,程文慧,沈 兵,鐘明奎
室旁核中血管緊張素Ⅱ通過活性氧介導慢性間歇性低氧大鼠的升壓作用
唐志強,范一菲,汪金麗,程文慧,沈 兵,鐘明奎
目的 研究室旁核(PVN)中血管緊張素Ⅱ(AngⅡ)-活性氧(ROS)通路在慢性間歇性低氧(CIH)大鼠的升壓作用。方法 將雄性SD大鼠隨機分為對照組和慢性間歇性低氧組(CIH組)(8h/d,連續15d)。用立體定位儀進行PVN核團定位微量注射,采用頸動脈插管法在體測量大鼠平均動脈壓(MAP),ELISA法測量PVN中AngⅡ、ROS含量,Westernblot法測定PVN中血管緊張素Ⅱ1型受體(AT1R)的蛋白表達,應用試劑盒(羥胺法)測定PVN中的總超氧化物歧化酶(T-SOD)活力。結果 與對照組比較,CIH組大鼠PVN中ROS(P<0.05)和AngⅡ含量顯著升高(P<0.01),AT1R的表達顯著增加(P<0.05),而T-SOD活力則明顯下降(P<0.01)。雙側PVN內微量注射AngⅡ(0.3 nmol)可升高兩組大鼠的MAP,而CIH大鼠MAP升高更顯著(P<0.01);超氧陰離子清除劑Tempol 可降低兩組大鼠的MAP,而CIH大鼠 MAP降低更顯著(P<0.01);Tempol預處理可抑制AngⅡ對兩組大鼠的升壓作用,且在CIH組中抑制作用更加明顯(P<0.01)。結論 室旁核中ROS介導了AngⅡ在CIH大鼠中的升壓作用。
室旁核;活性氧;血管緊張素Ⅱ;慢性間歇性低氧;高血壓
網絡出版時間:2016-3-88:29:01 網絡出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.006.html
2015-12-21接收
睡眠呼吸暫停綜合癥(sleepapneasyndrome,SAS)與高血壓有密切的聯系,SAS會增加患中風、心衰等一些高血壓相關疾病的風險[1]。SAS因為慢性間歇性低氧(chronicintermittenthypoxia,CIH)從而導致了交感神經的興奮,內皮功能的紊亂以及血管的炎癥[2],因此CIH被認為是引起高血壓最重要的因素。交感神經活動的過度增強是各種高血壓的重要特征之一。研究[3]顯示,CIH引起高血壓的發病機制與持續增強的交感神經興奮有關。下丘腦室旁核(paraventricularnucleus,PVN)是整合心血管活動的重要核團,其下行纖維投射到延髓頭端腹外側區和脊髓中間外側柱控制著交感結前神經元,因此其功能異常可能是導致 CIH時交感神經活動增強的重要原因。研究[4-5]表明中樞活性氧(reactive oxygen species,ROS)及某些氣體信號分子與高血壓時交感神經活動的增強密切相關,腦內血管緊張素Ⅱ(angiotensinⅡ,AngⅡ)作為調節交感神經活動和動脈血壓的重要神經遞質,與高血壓的發生也有著密切的關系。研究[6]表明,中樞ROS介導了AngⅡ引起的心交感傳入反射增強、腎交感神經放電增加等作用。該研究旨在探討在CIH大鼠中,下丘腦PVN中ROS介導的AngⅡ的升血壓效應及其機制,為防治SAS引起的高血壓提供科學實驗和理論依據。
1 材料與方法
1.1 動物 雄性健康SD大鼠,190~230 g,清潔級,由安徽醫科大學實驗動物中心提供。大鼠分籠飼養,飲水、攝食自由,通風良好,室溫(20±5)℃。
1.2 儀器 間歇性低氧艙(CYS-1型,南京新飛分析儀器制造有限公司);PowerLab 8/30數據采集分析處理系統(澳大利亞ADInstrument公司);酶標儀(美國Themo scientific公司);單臂數字式立體定位儀、顱骨鉆(深圳市瑞沃德生命科技有限公司);醫用壓縮氧氣(濃度>99.9%)、壓縮氮氣(濃度>99.99%)由合肥眾益化工產品有限公司充裝。
1.3 試劑 4-羥基-2,2,6,6-四甲基氧基哌啶(Tempol)、AngⅡ購自美國Sigma公司;兔抗血管緊張素Ⅱ 1型受體(angiotensinⅡ type 1 receptor,AT1R)、鼠抗β-actin購自美國Santa Cruz公司;Ang ⅡELISA檢測試劑盒購自美國RD公司;總超氧化物歧化酶(total-superoxide dismutase,T-SOD)檢測試劑盒購自南京建成生物工程研究所。
1.4 模型的制作 大鼠適應環境飼養1周后進行實驗,隨機分為對照組(n=6)和CIH組(n=6),對照組除不充入氮氣和氧氣外,其余均與CIH組做相同處理。通過充入氮氣稀釋氧濃度的原理,CIH組放入間歇性低氧艙中,校準艙內的氧氣濃度至環境濃度即21%,隨后關閉艙門,在低氧艙內循環充入氮氣和氧氣,保證一個循環充氮4 min后充氧5 min,在此期間用氧探頭監測艙內氧氣濃度,調節充氣流量使每一個循環中艙內最低氧氣濃度達到6%,并持續約45 s,然后充入氧氣使氧濃度逐漸恢復至21%,艙內氮氣與氧氣的切換通過定時電路程序控制,實驗每天早上9時開始,重復約8 h,連續15 d。
1.5 在體血流動力學指標檢測 腹腔注射麻醉劑烏拉坦(800 mg/kg)和α-氯醛糖(40 mg/kg)混合麻醉,仰臥位固定大鼠,依次進行氣管、左頸外靜脈、左頸總動脈插管手術。左頸外靜脈與注入混合麻醉溶液的滅菌注射器連接,方便實驗中及時補充麻醉藥量;壓力換能器與左頸總動脈通過充有肝素鈉生理鹽水溶液的聚乙烯管相連,并連接powerlab 8/30數據采集分析處理系統,實時記錄動脈血壓、平均動脈壓(mean arterial blood pressure,MAP)。藥物對MAP的改變水平以注射藥物前后實測值之差表示,ΔMAP=注射后MAP-注射前MAP。
1.6 PVN立體定位及微量注射 將麻醉后大鼠頭部俯臥位固定在立體定位儀上,沿矢狀中線切開頭皮,暴露前囟,根據Paxinos和Watson的大鼠腦立體定位圖譜進行定位,雙側PVN具體位置為:前囟后1.8 mm,中線旁開0.4 mm,背側面深7.9 mm,定位后運用顱骨鉆鉆孔,插入內徑為0.3 mm的插管。采用微量進樣器沿插管位置雙側注射藥物體積均為50 nl。生理鹽水(normal saline,NS)+AngⅡ大鼠和Tempol+AngⅡ大鼠中AngⅡ均在前一藥物注射5 min后注射。在所有藥物注射完成后再沿插管位置注射50 nl的2%伊文斯藍溶液對注射部位染色,左頸外靜脈推入過量麻醉劑處死大鼠,迅速斷頭取腦,腦組織用10%福爾馬林溶液固定,通過切片鑒定注射位點是否正確,如經鑒定注射位點不在PVN區域內的數據則不進行統計處理。
1.7 PVN組織標本的制備 大鼠過量麻醉后迅速斷頭取腦,立即置于液氮中冷凍固定,用冰凍切片機做大腦冠狀切片,根據大鼠腦立體定位圖譜確定PVN位置,用刀片垂直切取約2 mm厚腦片,再使用內徑為1.5 mm的針頭,用打孔法在腦片上取出PVN區,稱重后置EP管中,-80℃保存備用。
1.8 Western blot法檢測PVN中AT1R 取適量RIPA裂解液與PVN組織標本在玻璃勻漿器中研磨,勻漿成均一體系后離心(4℃、3 000 r/min離心20 min),取上清液。采用SDS-PAGE電泳分離蛋白。電泳(濃縮膠:60 V、30 min;分離膠:120 V、1.5 h);轉膜(150 mA、2 h),一抗(4℃、過夜):兔抗AT1R(1∶350)、鼠抗β-actin(1∶1 000),二抗(常溫搖床、2 h):辣根過氧化物酶標記的羊抗兔(1∶20 000)、羊抗鼠(1∶40 000)。采用化學發光底物顯影。使用Quantity One軟件分析各蛋白條帶的灰度值,通過與內參β-actin的比值,分析AT1R的蛋白相對表達水平。
1.9 ELISA試劑盒測定PVN中AngⅡ及ROS含量 取適量NS與PVN組織標本在玻璃勻漿器中研磨,勻漿成均一體系后離心(4℃、3 000 r/min離心10 min),取上清液。在預先包被有抗體的微孔中,依次加入標準品、待測樣品、辣根過氧化物酶標記的檢測抗體,經過溫育并徹底洗滌,用底物TMB顯色,用酶標儀在450 nm波長下測定光密度(optical density,OD)值,繪制標準曲線,根據公式計算樣品濃度。
1.10 統計學處理 采用SPSS 17.0軟件進行分析,數據以±s表示。兩組均數間的比較采用t檢驗。
2 結果
2.1 CIH對大鼠PVN中AngⅡ含量及AT1R蛋白表達的影響 與對照組比較,ELISA法檢測結果顯示,CIH組大鼠PVN中AngⅡ含量[(186.599± 9.329)pg/mgprot vs(246.650±7.031)pg/mgprot,t =-5.141,P<0.01]顯著升高;Western blot法顯示AT1R蛋白表達[(0.729±0.090)vs(1.020± 0.065),t=-2.608,P<0.05]顯著增加。見圖1。
2.2 CIH對大鼠PVN中 ROS含量及T-SOD活力的影響 ELISA法檢測結果顯示,與對照組比較,CIH組大鼠PVN中ROS含量顯著升高[(196.848 ±8.151)U/mgprot vs(242.538±16.086)U/mgprot,t=-2.534,P<0.05]。T-SOD活力檢測結果顯示,與對照組比較,CIH組大鼠PVN中總SOD活力明顯下降[(125.081±2.612)U/mgprot vs (95.204±4.269)U/mgprot,t=5.970,P<0.01]。
2.3 PVN內微量注射Tem pol對AngⅡ升壓作用的影響 雙側PVN內微量注射AngⅡ(0.3 nmol)兩組大鼠的MAP皆升高,與對照組比較,CIH大鼠MAP升高更顯著[(1.489±0.152)kPa vs(2.400± 0.298)kPa,t=-2.724,P<0.05];超氧陰離子清除劑Tempol兩組大鼠對MAP皆降低,而CIH大鼠MAP降低更顯著[(-0.333±0.046)kPa vs(-1.556±0.250)kPa,t=4.813,P<0.01];用Tempol對兩組大鼠預處理,可抑制 AngⅡ的升壓作用[NS +AngⅡ vs Tempol+AngⅡ,對照組:(1.444± 0.080)kPa vs(0.800±0.077)kPa,t=5.800,P<0.01;CIH組:(2.222±0.174)kPa vs(0.778± 0.121)kPa,t=6.799,P<0.01]。見圖2。

圖1 CIH對大鼠 PVN中 AngⅡ含量及AT1R蛋白表達的影響A:ELISA法檢測各組 PVN中 AngⅡ含量;B:Western blot法檢測各組PVN中 AT1R蛋白表達;與對照組比較:*P<0.05,**P<0.01
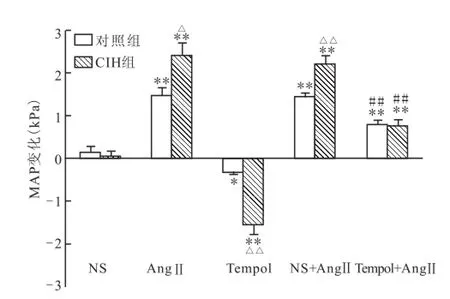
圖2 PVN中分別微量注射 NS、AngⅡ、Tempol對大鼠血壓的影響與同組NS比較:*P<0.05,**P<0.01;與同組 NS+AngⅡ比較:##P<0.01;與對照組比較:△P<0.05,△△P<0.01
3 討論
睡眠呼吸暫停是神經源性和難治性高血壓的主要原因之一。CIH是睡眠呼吸暫停最重要的病理生理學特征及引起機體各器官損傷的主要機制,CIH引起高血壓的具體機制還不十分清楚,但交感神經系統過度激活在高血壓的發生、發展中起了重要的作用[3,7]。CIH時,反復刺激頸動脈體化學感受器,使其敏感性增加,從而誘導交感神經活動的過度增強。PVN是調節交感神經活動和動脈血壓的重要中樞結構之一,通過與化學感受性反射中樞(孤束核和延髓腹側面頭端)的纖維聯系對化學感受性反射進行調節。研究[8]顯示,與對照組大鼠比較,注射γ-氨基丁酸A型受體激動劑抑制PVN神經元活動,引起CIH大鼠血壓和交感神經活動下降更為顯著。CIH大鼠,PVN內血管升壓素能神經元釋放血管升壓素,通過V1a受體作用于延髓腹外側頭端引起交感神經活動增強[9]。光遺傳學和逆行示蹤技術顯示,在CIH/高CO2暴露大鼠,PVN投射到腦干副交感核的興奮性通路被抑制,使心迷走神經活動減弱[10]。這些研究[9-10]顯示,PVN在CIH時交感神經活動過度增強中起著重要作用。
腎素-血管緊張素系統在CIH時被激活,Ang II通過外周和中樞途徑升高血壓,系統或中樞應用AT1受體阻斷劑氯沙坦可抑制CIH引起的高血壓[11-12]。本研究表明,CIH大鼠PVN內AngⅡ水平及AT1受體表達顯著增加;雙側PVN內微量注射AngⅡ使對照組和CIH組大鼠的MAP皆升高,不過CIH大鼠MAP升高更為顯著。長期應用γ-氨基丁酸A型受體激動劑可抑制PVN神經元活動或AT1的受體阻斷劑可顯著抑制CIH大鼠血壓的升高[13]。這些結果表明,室旁核中AngⅡ及AT1R功能上調在CIH誘發大鼠高血壓中起重要作用。
CIH類似于缺血和再灌注損傷作用,導致氧化應激和ROS產生增多,與高血壓的產生密切相關[14],在中樞 ROS可作為第二信使介導AngⅡ引起的交感興奮和升壓作用[15]。本實驗向PVN內注射一種可以透過細胞膜的SOD類似物Tempol,可降低對照組和CIH組大鼠的動脈血壓,CIH大鼠降低更顯著;并且用Tempol預處理可抑制AngⅡ對兩組大鼠的升壓作用,而且在CIH組中的抑制作用更加明顯;CIH大鼠PVN中總SOD活性檢測顯著降低。提示PVN中ROS介導了AngⅡ在CIH大鼠中的升壓作用。AngⅡ引起ROS增加可能與參與ROS代謝的酶的活性變化有關。產生ROS系統包括NAD (P)H氧化酶、黃嘌呤氧化酶、線粒體鏈和非耦合的一氧化氮合酶等,其中NAD(P)H氧化酶是高血壓病時引起ROS增多的關鍵酶。PVN中ROS升高可能與NAD(P)H氧化酶活性增加而SOD活性降低有關,即產生ROS的能力增加和(或)清除ROS的能力下降引起了ROS的增多。
PVN中AngⅡ-ROS信號通路在CIH引起交感神經活動過度激活及高血壓的具體機制還不清楚。可能的推測是:CIH引起RAS激活,中樞的AngⅡ和PVN內AT1受體結合,通過PKC/c-Src途徑激活NAD(P)H氧化酶產生ROS。一方面,ROS改變細胞膜對Ca2+或K+通透性使PVN神經元興奮,或通過p38 MAPK途徑促進PVN投射到延髓腹外側頭端的神經纖維末梢釋放興奮性遞質谷氨酸,引起交感神經興奮和血壓升高;另一方面,ROS經ERK信號途徑調節轉錄因子NF-κB、AP-1或HIF的活性,使AngⅡ、AT1受體、NAD(P)H氧化酶表達上調,SOD表達下調,引起血壓長期增加[15]。
綜上所述,PVN中AngⅡ-ROS通路在CIH引起高血壓中起著及其重要的作用,PVN中AngⅡ、ROS及其相關的酶或受體可能成為治療CIH誘發的高血壓的潛在靶點。
[1] Floras J S.Hypertension and Sleep Apnea[J].Can JCardiol,2015,31(7):889-97.
[2] Silva A Q,Schreihofer A M.Altered sympathetic reflexes and vascular reactivity in rats after exposure to chronic intermittenthypoxia [J].JPhysiol,2011,15,589(Pt 6):1463-76.
[3] 李 艷,鐘明奎,鄒 坤,等.慢性間歇性低氧對大鼠血壓和交感神經活動的影響[J].中國老年學雜志,2012,32(23):5162-4.
[4] Sun H J,Zhou H,Feng XM,etal.Superoxide anions in the paraventricular nucleusmediate cardiac sympathetic afferent reflex in insulin resistance rats[J].Acta Physiol(Oxf),2014,212(4):267-82.
[5] 鄒 坤,李 艷,王烈成,等.室旁核中活性氧在高血壓大鼠交感神經活動過度增強中的作用[J].安徽醫科大學學報,2012,47(7):753-7.
[6] Braga V A,Medeiros IA,Ribeiro T P,etal.Angiotensin-Ⅱ-induced reactive oxygen species along the SFO-PVN-RVLM pathway:imp lications in neurogenic hypertension[J].Braz JMed Biol Res,2011,44(9):871-6.
[7] Xing T,Pilowsky PM,Fong A Y.Mechanism of sympathetic activation and blood pressure elevation in humans and animals following acute intermittent hypoxia[J].Prog Brain Res,2014,209:131-46.
[8] Sharpe A L,Calderon A S,Andrade M A,et al.Chronic intermittent hypoxia increases sympathetic control of blood pressure:role of neuronal activity in the hypothalamic paraventricular nucleus[J].Am J Physiol Heart Circ Physiol,2013,305(12):H1772-80.
[9] Kc P,Balan K V,Tjoe SS,et al.Increased vasopressin transmission from the paraventricular nucleus to the rostralmedulla augments cardiorespiratory outflow in chronic intermittenthypoxia-conditioned rats[J].JPhysiol,2010,588(Pt 4):725-40.
[10]Dergacheva O,Dyavanapalli J,Pinol R A,et al.Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem[J].Hypertension,2014,64(3):597-603.
[11]KnightW D,Saxena A,Shell B,etal.Central losartan attenuates increases in arterial pressure and expression of FosB/ΔFosB along the autonomic axis associated with chronic intermittent hypoxia [J].Am JPhysiol Regul Integr Comp Physiol,2013,305(9):R1051-8.
[12]余孝海,李 艷,丁 揚,等.室旁核血管緊張素Ⅱ在慢性間歇性低氧誘發大鼠高血壓中的作用及機制[J].中國藥理學通報,2015,31(5):716-20.
[13]da Silva A Q,Fontes M A,Kanagy N L.Chronic infusion of angiotensin receptor antagonists in the hypothalamic paraventricular nucleus prevents hypertension in a ratmodel of sleep apnea[J]. Brain Res,2011,1368:231-8.
[14]Braga V A,Medeiros IA,Ribeiro T P,et al.Angiotensin-II-induced reactive oxygen species along the SFO-PVN-RVLM pathway:imp lications in neurogenic hypertension[J].Braz JMed Biol Res,2011,44(9):871-6.
[15]Chan SH,Chan JY.Angiotensin-generated reactive oxygen species in brain and pathogenesis of cardiovascular diseases[J].Antioxid Redox Signal,2013,19(10):1074-84.
AngiotensinⅡ inparaventricular nucleus contributes to hypertension in chronic interm ittent hypoxia rats by reactive oxygen species
Tang Zhiqing,Fan Yifei,Wang Jinli,etal
(Dept of Physiology,Anhui Medical University,Hefei 230032)
Objective To investigate the effect of Ang II-ROS signal pathway in the hypothalamic paraventricular nucleus(PVN)on chronic intermittent hypoxia(CIH)induced-hypertension in rats.Methods Male SD ratswere randomly divided into control and CIH groups.The control rats were exposed to continuous normoxia,while the CIH rats were submitted to CIH(8 h per day for 15 days).Ratswere fixed on the stereotaxic instrument to conduct microinjection in the PVN according to Paxinos and Watson rat atlas.Mean arterial pressure(MAP)was recorded in vivo on a PowerLab data acquisition system.We used ELISA kit tomeasure the content of AngⅡ,ROS,totalsuperoxide dismutase(T-SOD)and Western blot tomeasure AngⅡtype 1 receptor(AT1R)protein expression in PVN.Resu lts The contents of PVN ROS(P<0.05)and AngⅡ(P<0.01)were significantly higher than that in control rats,alongwith increased AT1R protein expression(P<0.05).The activity of PVN T-SOD in CIH ratswas significantly lower than that in control rats(P<0.01).Microinjection of AngⅡ(0.3 nmol)in bilateral PVN increased MAP in both CIH and control rats,and this response was significantly augmented in CIH rats(P<0.01). ROS scavenger Tempol caused significant MAP decreases in CIH rats than that in control group(P<0.01).Tempol prevented AngⅡ-induced increases in MAP in both CIH and control rats,and this response was significantly augmented in CIH rats(P<0.01).Conclusion The results suggest that the ROS in PVNmediates the increased blood pressure induced by AngⅡin CIH induced-hypertension rats.
paraventricular nucleus;reactive oxygen species;angiotensinⅡ;chronic intermittenthypoxia;hypertension
R331.36
A
1000-1492(2016)04-0472-05
國家自然科學基金資助項目(編號:81070066);安徽省教育廳自然科學重點科研項目(編號:KJ2010A176);安徽醫科大學博士科研基金(編號:XJ201221)
安徽醫科大學生理學教研室,合肥230032
唐志強,男,碩士研究生;
鐘明奎,男,博士,教授,碩士生導師,責任作者,E-mail:zhongmkcn@aliyun.com

