miRNA-16對肺腺癌A549細胞增殖和VEGF-A表達水平的影響
徐 勝,束 軍,李曉峰,程 宇,沈繼龍
miRNA-16對肺腺癌A549細胞增殖和VEGF-A表達水平的影響
徐 勝1,束 軍1,李曉峰1,程 宇1,沈繼龍2
目的 探討miRNA-16作用不同時間對體外培養的人肺腺癌A549細胞增殖的影響,以及對VEGF-A表達水平的影響。方法 將50 nmol/L的miRNA-16和陰性對照序列用Lipofectamine 2000轉染進人肺腺癌A549細胞中,通過qRT-PCR法檢測轉染后A549細胞中miRNA-16的表達水平,MTT法檢測轉染miRNA-16后細胞的增殖抑制情況,ELISA法檢測轉染m iRNA-16后細胞VEGF-A表達水平。結果 轉染培養24 h后,測得轉染組miRNA-16表達水平明顯高于空白對照組和陰性對照組(P<0.05);轉染組細胞增殖抑制率明顯高于空白對照組和陰性對照組(P<0.05);轉染組細胞VEGF-A表達水平較陰性對照組和空白對照組明顯降低(P<0.05)。結論 miRNA-16能引起細胞增殖抑制,并且可能與下調VEGF-A的表達有關。
肺腺癌;VEGF-A;miRNA-16;細胞增殖
網絡出版時間:2016-3-8 8:29:01 網絡出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.014.htm l
肺癌是當今世界男性、發達國家女性癌癥引起的死亡原因最高的病種,在發展中國家女性病死率僅次于乳腺癌[1]。其發病率在中國也呈逐年上升趨勢,造成了沉重的社會負擔。非小細胞肺癌包括鱗癌、腺癌、大細胞癌等,占肺癌總數的80%。而肺腺癌又是占比最多的非小細胞肺癌類型。微小RNA(miRNAs)在人類多種疾病特別是癌癥發生、發展過程中扮演重要角色,通過對基因的轉錄后調節實現對癌細胞增殖、凋亡等進程的影響,從而在腫瘤生長、侵襲及遷移方面發揮重要作用。該研究旨在探討miRNA-16對血管內皮生長因子(vascular endothelial growth factor,VEGF)-A是否存在作用,以及是否通過這種作用引起肺腺癌A549細胞增殖情況發生變化。
1 材料與方法
1.1主要試劑和儀器 人肺腺癌A549細胞株由安徽醫科大學基礎醫學院提供。hsa-miRNA-16 mimics和陰性對照以及miRNA-16 qPCR Quantitation Kit和U6 snRNA qPCR Normalization Kit均由上海吉瑪制藥技術有限公司合成。hsa-miRNA-16 mimics上游引物:5′-UAGCAGCACGUAAAUAUUGGCG-3′,下游引物:5′-CCAAUAUUUACGUGCUGCUAUU-3′;陰性對照上游引物:5′-UUCUCCGAACGUGUCACGUTT-3′,下游引物:5′-ACGUGACACGUUC GGAGAATT-3′。胎牛血清購自杭州四季青生物有限公司;DMEM培養基購自美國HyClone公司;MTT、DMSO購自美國 Sigma公司;人 VEGF-A ELISA試劑盒購自上海源葉生物有限公司;Lipofectamine 2000轉染試劑盒購自美國Invitrogen公司;無菌無酶槍頭購自美國Axygen公司;TRIzol試劑購自杭州諾唯贊公司;CO2細胞培養箱購自德國Heraeus公司;ELX800UV酶標儀購自美國Bio-Tek公司;ABI PRISM 7300熒光定量PCR儀購自美國Applied Biosystems公司;NanoDrop 2000c超微量紫外分光光度計購自美國Thermo公司;電熱恒溫水浴鍋購自上海天平儀器有限公司;超凈工作臺購自蘇州安泰空氣技術有限公司。
1.2細胞培養 人肺腺癌A549細胞株用含2 mmol/L的谷氨酰胺和10%胎牛血清的DMEM培養基,在37℃、5%CO2及飽和濕度的培養箱內常規傳代培養,待細胞生長融合至覆蓋瓶底80%~90%時用胰酶消化并反復吹打,分瓶傳代培養。
1.3qRT-PCR法檢測轉染miRNA-16后肺腺癌A549細胞miRNA-16的表達水平 取對數生長期細胞(2×105/孔)接種于6孔板,待細胞貼壁且融合度達到50%左右進行轉染,轉染miRNA-16 mimics濃度為50 nmol/L。轉染按照Lipofectamine 2000說明書進行。實驗分3組,轉染了miRNA-16 mimics的細胞(轉染組),轉染了陰性對照序列的細胞(陰性對照組),未做轉染處理的細胞(空白對照組)。轉染后置于37℃,5%CO2細胞培養箱內繼續培養。6 h后去掉含轉染液的培養基。加入含10%胎牛血清的1640培養基繼續培養。轉染24 h后,開始提取RNA。提取RNA的步驟按照TRIzol說明書進行。在紫外分光光度儀上測吸光度(absorbance,A)值,A260及 A280值。計算RNA濃度和純度。計算A260/A280,取其值在1.8~2.0之間用于qRT-PCR法檢測。實驗分逆轉錄和PCR擴增兩個階段。反應以U6做內參。逆轉錄為20μl反應體系,逆轉錄反應條件:25℃、30 min,42℃、30 min,85℃、5 min。PCR擴增反應條件:、95℃預變性3 min;PCR反應階段為95℃、12 s,62℃、40 s,共40個循環。通過qRT-PCR儀進行檢測,得出Ct值。實驗結果計算以U6為內參,空白對照組為基準,ΔCt=(hsa-miR-16)Ct-(U6)Ct,ΔΔCt=[(hsa-miR-16)Ct-(U6)Ct]轉染組-[(hsa-miR-16)Ct-(U6)Ct]空白對照組,表達水平按照2-ΔΔCt計算。
1.4MTT法檢測轉染后細胞增殖抑制情況
0.25%胰酶消化對數期細胞,終止消化后1 000 r/ min離心5 min收集,用培養液制成細胞懸液,細胞計數調整其濃度至5×104/ml。實驗分為轉染組、陰性對照組和空白對照組。取每孔100μl接種于96孔板。邊緣孔加無菌PBS。置于37℃、5%CO2培養24 h后進行轉染。轉染后分別在24、48、72 h 3個時間點進行檢測。每孔內加入10μl MTT,繼續培養4 h后,形成結晶后棄去培養液,每孔加入150 μl DMSO,搖床振蕩10 min,置于酶標儀于490 nm處檢測光密度(optical density,OD)值。每組設置5個副孔,組內取平均值。比較組間差異,實驗重復3次。
1.5ELISA法檢測上清中VEGF-A的表達水平
轉染48 h后,收集空白對照組、陰性對照組以及轉染組的肺腺癌A549細胞上清液。從4℃冰箱取出ELISA試劑盒,室溫放置30 min,按照說明書稀釋標準品,將其配制成不同濃度,檢測時設空白孔、待測樣品孔和標準品孔。待測樣品即3組A549細胞的上清液,以空白孔作為調零,然后使用酶標儀在450 nm處進行各孔OD值的測定,通過EXCEL工作表繪制出標準品線性回歸曲線,再根據各樣品孔的OD值按照曲線方程計算出各個樣品濃度值。該檢測方法的靈敏度為1 pg/ml(最低檢測濃度小于1 pg/m l)。
1.6統計學處理 采用SPSS 16.0軟件進行分析。計量資料以±s表示。多個樣本均數比較采用單因素方差分析,兩兩比較比較采用SNK-q檢驗。時間因素對MTT實驗的影響采用重復測量資料的方差分析。
2 結果
2.1轉染m iRNA-16對于細胞內m iRNA-16表達水平的影響 轉染并培養24 h后,轉染組細胞內miRNA-16表達水平與陰性對照組和空白對照組比較明顯升高。其表達水平約為空白對照組的(467.59±35.47)倍,差異有統計學意義(F= 407.149,P<0.05)。而陰性對照組與空白對照組比較,差異無統計學意義,見圖1。
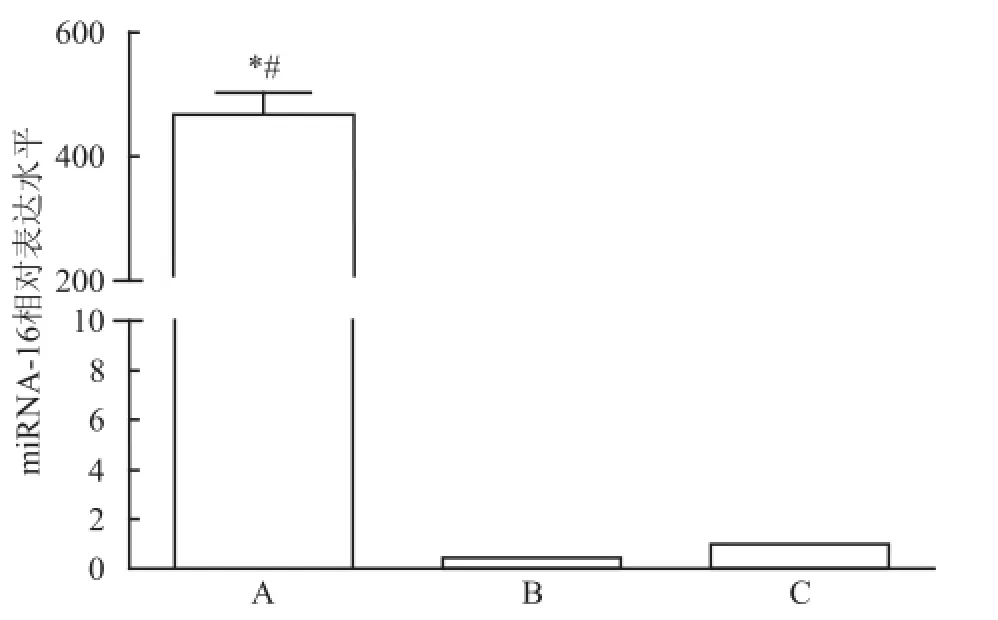

圖1 轉染24 h后各組 A549細胞內 m iRNA-16表達水平A:轉染組;B:陰性對照組;C:空白對照組;與陰性對照組比較:*P<0.05;與空白對照組比較:#P<0.05
2.2轉染m iRNA-16對細胞增殖的影響 為了研究轉染miRNA-16后細胞增殖是否受到抑制,本實驗采用MTT法檢測miRNA-16對于細胞增殖的影響。轉染24、48、72 h后檢測3組OD值,見表1。經球形檢驗χ2=1.981,P=0.371,表明符合球形分布,以一元方差結果為準。不同測試時間點間OD值不同,受時間影響(F=1037,P<0.05)。測試時間組與組別間有交互作用(F=53.212,P<0.05)。組別間OD值差異有統計學意義(F=145.455,P<0.05)。同時間點miRNA-16轉染組的OD值明顯低于空白對照組,差異有統計學意義(F24h= 70.234、F48h=181.009、F72h=1 211.030,P<0.05)。而陰性對照組和空白對照組比較,差異無統計學意義。
2.3A549細胞上清液中VEGF-A含量的檢測
轉染48 h后,檢測各組VEGF-A濃度結果可得:空白對照組(146.43±7.71)pg/ml,陰性對照組(152.07±6.41)pg/m l,轉染組(55.56±6.04)pg/ m l。轉染組細胞上清液中有少量的VEGF-A表達,且與空白對照組和陰性對照組相比顯著下降,差異具有統計學意義(F=192.59,P<0.05),空白對照組和陰性對照組比較VEGF-A表達差異無統計學意義。見圖1。
表1 轉染m iRNA-16 m im ics對A549細胞24、48、72 h增殖的影響(n=5,±s)
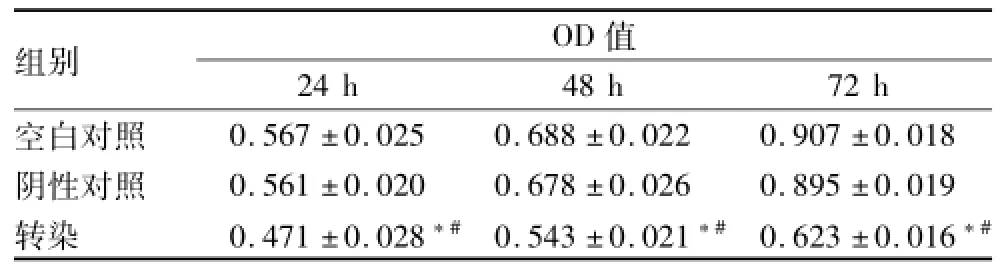
表1 轉染m iRNA-16 m im ics對A549細胞24、48、72 h增殖的影響(n=5,±s)
與陰性對照組比較:*P<0.05;與空白對照組比較:#P<0.05
OD值組別24 h 48 h 72 h空白對照0.567±0.025 0.688±0.022 0.907±0.018陰性對照 0.561±0.020 0.678±0.026 0.895±0.019轉染 0.471±0.028*# 0.543±0.021*# 0.623±0.016*#
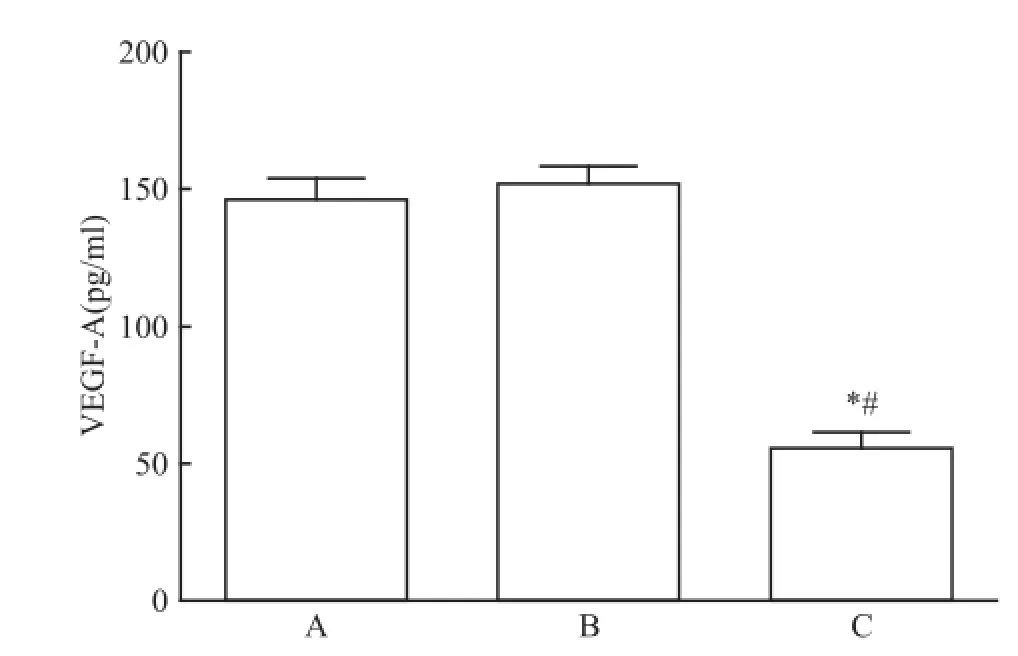

圖1 轉染 m iRNA-16后各組細胞上清液中VEGF-A表達水平A:空白對照組;B:陰性對照組;C:轉染組;與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05
3 討論
肺癌是世界范圍內最常見的惡性腫瘤之一,其中非小細胞肺癌約占肺癌總數的80%[2],肺腺癌占非小細胞肺癌的比例逐年升高,現已超過肺鱗癌成為最大的一類非小細胞肺癌。大多數的肺癌患者在最終確診時已處于癌癥晚期,發生了遠處轉移和擴散,失去了最佳治療時機。盡管疾病監控與臨床治療措施取得了很大的進展,但是患者術后5年生存率卻依然在30%~60%。潛在的調節肺癌發生發展的分子生物學機制成為相關領域研究的熱點之一。
miRNAs是一大類存在于生物體內長約19~22個核苷酸的非編碼小分子RNA,通過結合靶mRNA 的3′-UTR,導致翻譯停滯或者mRNA的降解,從而達到抑制基因表達的效果,是一種基因表達的轉錄后調節。既往大量研究表明,miRNAs與多種疾病的調節有關,在多種腫瘤如肝癌、結腸癌[3]以及結締組織病如骨性關節炎[4]中均有異常表達,并誘導癌細胞產生增殖抑制、侵襲性和轉移能力下降等生物學行為,從而在癌癥發生發展進程中扮演重要作用。在肺癌領域也有關于miRNAs的作用研究。Let-7是第一個被發現在肺癌中表達失調的miRNA。Takamizawa etal[5]曾報道Let-7在肺癌中的表達通常是下降的。miRNA-152能引起非小細胞肺癌細胞增殖抑制、凋亡、抑制癌細胞遷移和侵襲等[6]。
既往曾有關于miRNA-16在卵巢癌[7]和慢性粒細胞性白血病[8]中的研究,亦有一項研究[9]表明miRNA-16在肺癌組織中的表達較自身的健康肺組織中的表達是下調的。為了研究轉染后非小細胞肺癌A549細胞內miRNA-16表達水平是否升高,本研究通過qRT-PCR法檢測得出轉染miRNA-16 mimics的細胞miRNA-16表達水平明顯高于空白對照組。為了研究miRNA-16高表達對于細胞增殖是否有抑制作用,本實驗采用MTT法檢測顯示轉染組和空白對照組相比細胞增殖明顯受抑制。
血管能為腫瘤的生長提供所需營養物質,而腫瘤在生長過程中也會有大量新生血管生成,這是內皮細胞遷移并增殖產生的結果,大量新生血管的形成也導致了腫瘤的快速生長。腫瘤的血液轉移是轉移的主要途徑之一,能使癌細胞擴散至其它器官引起癌變。通過抑制新生血管的形成來達到治療惡性腫瘤的目的已成為近些年研究熱點之一。VEGF是目前公認的最強也是最有效的一種促血管生長的特異性因子。VEGF家族主要分為 VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E五大類。其中VEGF-A基因位于6號染色體的6q21上,主要作用是促進血管內皮生長[10]。研究[11]表明,VEGF能直接刺激非小細胞肺癌細胞的增殖。通過targetscan等miRNA靶基因預測軟件,分析 VEGF-A可能是 miRNA-16靶基因。為了驗證這一分析推斷,本研究采用ELISA法檢測了經轉染miRNA-16的細胞的VEGFA表達水平,結果顯示轉染組較空白對照組明顯下降。
通過以上實驗結果可以推斷,miRNA-16可能通過抑制A549細胞內VEGF-A的表達而達到抑制細胞增殖的效應。該結果也提示miRNA-16可能是一種抑癌基因,與miRNA-16在其它系統的腫瘤疾病的研究結果一致。但是miRNAs是一大類RNA,其所能調控的靶mRNA也紛繁復雜,VEGF-A也可以被其它miRNA所調控。故而miRNA-16在肺腺癌A549細胞中的作用機制仍需進一步研究。
[1] Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012[J].CA Cancer JClin,2015,65(2):87-108.
[2] TravisW D,Brambilla E,NoguchiM,et al.International association for the study of lung cancer/american thoracic society/european respiratory society internationalmultidisciplinary classification of lung adenocarcinoma[J].JThorac Oncol,2011,6(2):244-85.
[3] 龍騰云,余昌俊,張 敏,等.miRNA-139在結直腸癌中的表達及其對癌細胞生長的影響[J].安徽醫科大學學報,2015,50(9):1258-61.
[4] 鄒 磊,周圓家,饒 峰,等.miRNA-140、MMP-3在OA關節滑液中的表達及相關性研究[J].安徽醫科大學學報,2015,50(9):1289-92.
[5] Takamizawa J,KonishiH,Yanagisawa K,etal.Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival[J].Cancer Res,2004,64(11):3753-6.
[6] Cheng Z,Ma R,TanW,etal.MiR-152 suppresses the proliferation and invasion of NSCLC cells by inhibiting FGF2[J].Exp Mol Med,2014,46:e112.
[7] 韓文君,崔竹梅,唐 蕊,等.miRNA-16抑制人卵巢癌在裸鼠皮下移植瘤生長的研究[J].海南醫學院學報,2012,18(7):880-7.
[8] Rogalinska M,Kilianska ZM.Targeting Bcl-2 in CLL[J].Curr Med Chem,2012,19(30):5109-15.
[9] Bandi N,Zbinden S,Gugger M,et al.miR-15a and miR-16 are implicated in cell cycle regulation in a Rb-dependentmanner and are frequently deleted or down-regulated in non-small cell lung cancer[J].Cancer Res,2009,69(13):5553-9.
[10]Yang S,Zhao Z,Wu R,et al.Expression and biological relationship of vascular endothelial growth factor-A and matrixmetalloproteinase-9 in gastric carcinoma[J].J Int Med Res,2011,39(6):2076-85.
[11]Devery A M,Wadekar R,Bokobza SM,etal.Vascular endothelial growth factor directly stimulates tumor cell proliferation in nonsmall cell lung cancer[J].Int JOncol,2015,47(3):849-56.
Effect of m iRNA-16 on proliferation and expression of VEGF-A in A549 cells
Xu Sheng,Shu Jun,Li Xiaofeng,et al
(Deptof Respiratory Medicine,The Fourth Affiliated Hospital of AnhuiMedical University,Hefei 230022)
Objective To observe the effects ofmiRNA-16 on the proliferation and expression of VEGF-A of A549 cells.Methods Human lung adenocarcinoma A549 cells were transfected with 50 nmol/L miRNA-16 mimics or negative controlwith Lipofectamine 2000.24 hours after transfection,the expression level ofmiRNA-16 wasmeasured using qRT-PCR.Cell proliferation wasmeasured by methylthiazol tetrazolium(MTT)assays.The expression level of VEGF-A was tested with enzyme-linked immunosorbent assay(ELISA).Resu lts The expression level of miRNA-16 in A549 cellswas significantly up-regulated compared with the blank control group and negative control group(P<0.05).The proliferation of A549 cellswas obviously inhibited(P<0.05).The expression of VEGF-A in A549 cellswas decreased inmiRNA-16 mimics group conpared with other two groups(P<0.05).Conclusion
lung adenocarcinoma;VEGF-A;miRNA-16;cell proliferation
R 734.2
A
1000-1492(2016)04-0489-04
2016-01-08接收
安徽省自然科學基金面上項目(編號:1308085MH141);
安徽醫科大學科研基金資助項目(編號:2010xkj115)
1安徽醫科大學第四附屬醫院呼吸內科,合肥 2300222安徽病原生物學省級實驗室和人獸共患病安徽省重點實驗室、安徽醫科大學基礎醫學院病原生物學教研室,合肥230032
徐 勝,男,碩士研究生;
束 軍,男,醫學博士,碩士生導師,責任作者,E-mail:J. Shu@126.com
The results indicate thatmiRNA-16 inhibits the proliferation of A549 cells,which might be associated with the down-regulation of the reduced expression of VEGF-A.

