鹽酸標準溶液標定的不確定度分析
周路明(德陽市產品質量監督檢驗所,四川 德陽 618000)
?
鹽酸標準溶液標定的不確定度分析
周路明(德陽市產品質量監督檢驗所,四川 德陽 618000)
本文主要針對鹽酸溶液的標定進行闡述,按照測量不確定度進行評定和表示,然后構建對應的數學模型,最后得到標定鹽酸標準溶液的拓展不確定度以及合成不確定度。
鹽酸溶液;標定;不確定度
對于理化分析,所有的檢測數據都存在一定的不確定度。鹽酸標準溶液是比較常見的化學定量對比溶液,該鹽酸溶液的標定值的大小對常規分析質量有著巨大的影響,所以我們應該對鹽酸標準溶液標定值的不確定度進行詳細分析。
1 不確定度相關知識
1.1不確定度的定義
測量不確定度它的定義是能夠讓被測量數據有著一定的分散性,同時和測量的結果存在一定關聯的數據。這樣的定義充分體現了技術人員可以確定被測量能夠被準確賦值的大小。
1.2不確度的來源
在實際情況下,由于受到很多因素的影響,使得測量結果有著很多的不確定性,比如像取樣不合理、環境因素、質量以及容器的不確定度、測量方式、評估假定和隨機因素等。
2 鹽酸標準溶液的不確定度
2.1HCl溶液配制及標定
(1)將基準Na2CO3(99.95~100.05%)在270~300℃條件下干燥至恒重。對于30mL0.05mol/L的鹽酸溶液,滴定所要的碳酸鈉大概是:
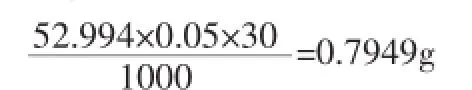
必須要選擇0.1mg的天平來稱取。
(2)配置 0.05mol/L的鹽酸溶液:在 1000mL的蒸餾水里面加入4.5mL的濃鹽酸。
(3)把已經準備好的碳酸鈉加入到50mL的蒸餾水,然后用0.05mol/L的鹽酸滴定,并按照指示劑的顏色來進行滴定。
2.2數學模型
這里的被測量,就是鹽酸溶液的濃度,其濃度的大小主要受到碳酸鈉質量、分子量、純度以及所需要的鹽酸溶液體積的影響。

式中:CHCI——HCl溶液的濃度;
mNa2CO3——稱取Na2CO3的質量,單位為克(g);
VT——加入HCl溶液的體積,單位為毫升(mL);
MNa2CO3——Na2CO3的摩爾質量,單位為克每摩爾(g/ mol)MNa2CO3=52.9941;
PNa2CO3——Na2CO3的純度,用質量分數來表示;
1000——由mL轉為L換算系數。
2.3不確定度的來源分析和確定
從數學模型(1)可以看出,HCl溶液濃度影響因素有Na2CO3的質量、純度、摩爾質量和鹽酸溶液的體積,用因果圖表示如圖1。
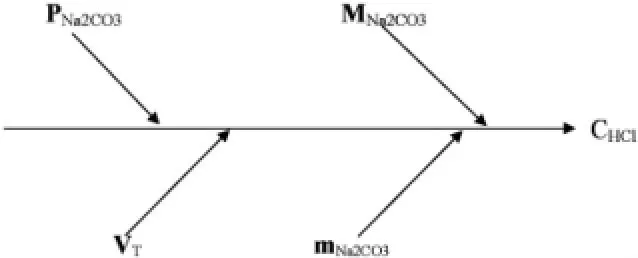
圖1 HCl溶液濃度的影響因素
2.3.1質量mNa2CO3在實際的試驗中,當選擇電子秤來稱取碳酸鈉的質量,在這過程中,存在很多隨機因素以及天平自身校準的問題,使得出現很多不確定度。電子天平自身的校準存在幾個不確定度,比如像自身的靈敏度以及校準函數。在實際過程中,每次都會選擇相同的電子天平來稱取所需要的質量,同時稱取的質量不是很大,因此其靈敏度所導致的不確定度則可以忽略。
2.3.2純度PNa2CO3
在基準物質Na2CO3產品標簽上,其標示的純度應該位于99.95~100.5%之間,所以基準物質碳酸鈉的純度位于1.0000± 0.0005。如果干燥過程按標準規定進行,則無其它不確定度來源。2.3.3摩爾質量MNa2CO3
碳酸鈉摩爾質量所引起的不確定度則能夠根據原子量的不確定度來進行計算。根據國際純粹化學與應用化學聯合會(IUPAC)在《純粹和應用化學雜志》上發表的原子量的不確定度,則能夠根據其計算出碳酸鈉的摩爾質量。
2.3.4HCl溶液的滴定體積VT
鹽酸溶液的滴定體積主要存在3個不確定度,分別是體積校準的不確定度、滴定體積的重復性、環境的溫濕度和滴定校準時的溫度存在差異而導致的不確定度。
與此同時,終點檢測對鹽酸溶液的標定也存在著三個不確定度,分別是:
(1)終點檢測的重復性,其不同于滴定體積的重復性。
(2)滴定過程中吸入的CO2產生的滴定終點的不確定度,終點與等當點可能存在的系統誤差。
(3)使用指示劑引入的誤差。
以上各項均標明在圖2上。
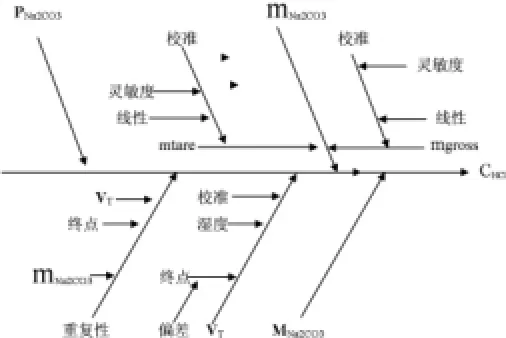
圖2 HCl溶液標定的不確定度來源
2.4不確定度分量的定量
將各不確定來源進行量化,并轉化為標準不確定度。
一般情況下,幾乎有所的實驗都存在稱量操作的重復性以及滴定管滴定的重復性,所以把每個分量看做總實驗的分量,并利用方法確認的數值將其量化是合理的。該方法能夠表明實驗的重復性是0.05%,能夠直接把其用作不確定度的計算。
2.4.1質量mNa2CO3
相關稱量有:三角瓶的質量:54.1267g(觀測);
三角瓶和Na2CO3的質量:54.2074g(觀測);
mNa2CO3:0.0807g(計算)。
對于之前已經確定好的合成重復性,所以這里就不需要計算稱量的重復性,另外由于天平量程存在的系統偏移則會抵消,所以稱取碳酸鈉質量的不確定度則就是電子天平的線性不確定度。
根據電子天平計量檢定證書上的說明,電子天平的線性是±0.2mg,表示稱取碳酸鈉的質量和電子天平的最大誤差不能夠超過±0.2mg。電子天平本身的不確定度則用矩形分布線性分量轉變成標準不確定度,電子天平的線性分量是0.12mg。由于每一次稱量均為獨立的觀測結果,兩者的線性影響間是不相關的,因此上述線性分量必須計算兩次。
則碳酸鈉的標準不確定度是:
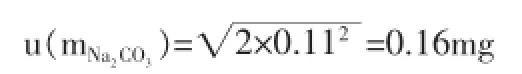
2.4.2純度PNa2CO3
PNa2CO3是1.0000±0.0005,因為在包裝中找不到相應的信息,因此把其不確定度看做矩形分布,它的標準不確定度是u(PNa2CO3)=0.0005/=0.00029。
2.4.3摩爾質量MNa2CO3
在國際純粹化學與應用化學聯合會(IUPAC)的原子量表中得知碳酸鈉的每個元素的不確定度、標準不確定度以及原子量大小,如表1所示。
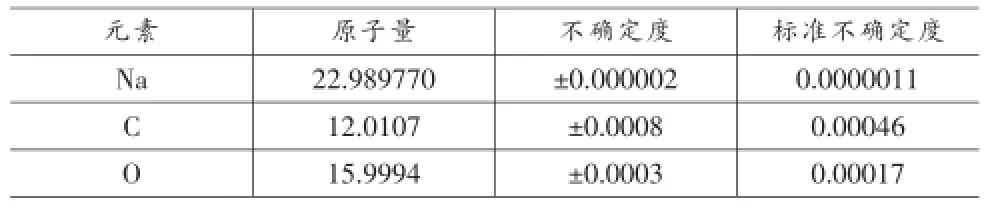
表1 Na、C、O的原子量、不確定度和標準不確定度
將國際純粹化學與應用化學聯合會(IUPAC)所標明的不確定度視為矩形分布,然后計算出各原子量的標準不確定度,標準不確定度則是所查相應數值的1/3。
碳酸鈉中元素的摩爾質量和標準不確定度如表2所示。
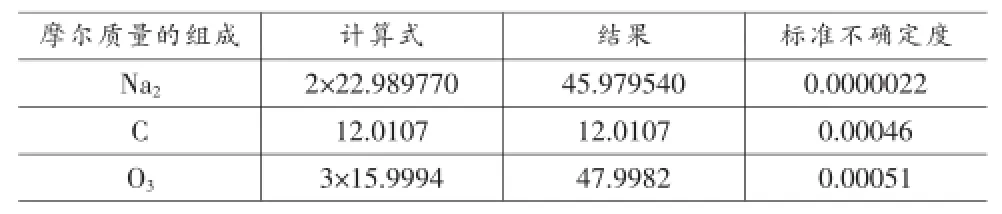
表2 Na2CO3摩爾質量的組成和不確定度分量
Na2CO3的摩爾質量為:
MNa2CO3=45.979540+12.0107+47.9982=105.972240g/mol
2.4.4體積VT
體積VT的不確定分量主要有滴定體積的重復性、校準、溫度、終點檢測誤差以及指示劑引入的誤差等。
(1)滴定體積的重復性:其重復性已經通過合成重復性考慮。
(2)校準:由該滴定管檢定證書給定體積30mL的準確值為29.946,誤差為0.054mL。假定該校準值為三角分布,標準不確定度則是0.054/=0.031mL。
(3)溫度:溫度波動為矩形分布,則標定的溫度在±3℃以內進行變化,然后按照水的膨脹系數,就能夠計算出體積VT的溫度不確定度分量:
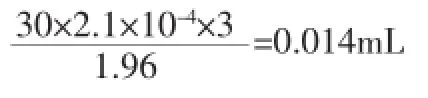
(4)終點檢測誤差:在測定時,用煮沸的方法排除CO2的干擾,因此該項不確定度可以忽略。
(5)指示劑引入的誤差:使用溴甲酚綠-甲基紅作指示劑,其變色范圍為pH5.1。有研究顯示,使用指示劑代替自動滴定裝置會額外引入0.05mL的誤差。
根據直觀判斷終點的不確定度是0.03mL。
鹽酸溶液的滴定體積是30.30,然后將每個不確定度的分量進行求和,就能夠得到體積VT的不確定度:
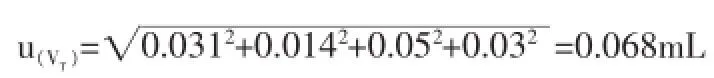
2.5合成標準不確定度的計算
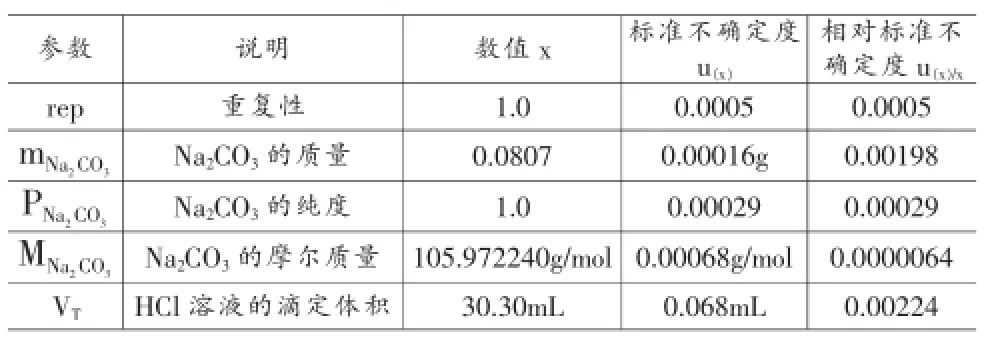
表3 各參數的數值、標準不確定度及相對標準不確定度
將表3中的值代入2.2中的(1)計算,可得到:
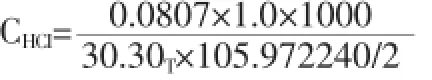
=0.05027mol/L
其標準不確定度u(CHCl)為:
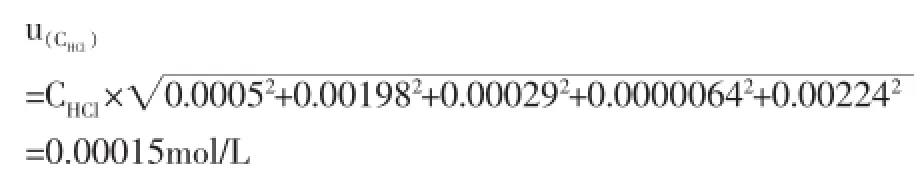
2.6鹽酸標準溶液的濃度
合成標準不確定度與包含因子2的乘積即可得到HCl標準溶液的濃度拓展不確定度U(CHCl)。
U(CHCl)=0.00015×2=0.00030mol/L
鹽酸標準溶液的濃度是0.05027±0.00030mol/L。
3 結語
通過對鹽酸標準溶液結果不確定度的分析及評定,可以得出鹽酸標準不確定度主要來源。對于主要來源加以重視,可以有郊的降低標液的不確定度。
[1]中國實驗室國家認可委員會.《化學分析中不確定度的評估指南》.中國計量出版社,2002.
[2]國家質量監督檢驗檢疫總局.《JJF1059.1-2012測量不確定度評定與表示》.
[3]張 英.植物油過氧化值測定結果不確定度的分析與評定.糧食與食品工業,2013(5).
[4]余奇飛.對凱氏定氮法測定食品中蛋白質含量的測量不確定度評定.農產品加工學刊,2006(11).
[5]周德慶,張雙靈.鹽酸副玫瑰苯胺法測量食品中亞硫酸鹽的不確定度評定.現代測量與實驗室管理,2004(04).
周路明(1976-),男,工程師,大學本科,主要從事食品檢驗及實驗管理工作。
O652
A
2095-2066(2016)16-0248-02
2016-5-2

