鎳離子對人血管內皮細胞增殖影響的研究*
韋樂華,孫婧媛,任慧文,劉健博,高與遠,李黎明
(東北大學生命科學與健康學院生物技術研究所,遼寧 沈陽 110819)
?
鎳離子對人血管內皮細胞增殖影響的研究*
韋樂華,孫婧媛,任慧文,劉健博,高與遠,李黎明
(東北大學生命科學與健康學院生物技術研究所,遼寧沈陽110819)
探索了鎳離子對人血管內皮細胞增殖的影響。本研究以人臍靜脈內皮細胞為研究對象,從細胞生長活性、細胞形態等幾個方面入手,運用MTT、姬姆薩染色等方法探索不同濃度的鎳離子對血管內皮細胞增殖的影響。通過研究發現,氯化鎳對人臍靜脈內皮細胞的半數致死濃度為260 mg/L。在鎳離子作用下,HUVEC細胞增殖受到抑制,細胞形態有中毒樣改變,在觀察濃度及時間范圍內,呈現濃度依賴和時間依賴趨勢。
鎳離子;血管內皮細胞;細胞增殖;細胞毒性
冠狀動脈內植入支架治療自20世紀80年代中期臨床應用以來,得到了迅速的發展,已成為治療動脈粥樣硬化的主要方法之一。目前在臨床使用的金屬支架材料中,主要為316L不銹鋼、鈷鉻合金L605和NiTi合金等,其通常含有10%~14%的鎳元素[1]。
鎳是一種潛在的致敏因子,鎳及其化合物對人類最常見的損害是鎳接觸性皮炎。同時,早在20世紀30年代,就發現長期接觸鎳使癌癥發病率較高。同時鎳的毒性和致癌性還與其催化羧基、過氧化氫、氧氣等物質產生自由基有關[2]。醫用金屬材料植入人體后,與血液發生直接接觸,所以支架的腐蝕會導致金屬離子釋放到臨近的組織中。
有研究表明,不銹鋼支架中鎳離子的釋放會導致過敏和再狹窄,而內皮細胞可以在血管腔的表面形成一個抗凝血和抗血栓系統,維持血液在血管中的正常流動的支架上的內皮細胞有利于減輕和修復支架置入后損傷的血管內皮,弱化誘發再狹窄的始動因素,避免金屬支架與血流直接接觸,使血流平穩,減少不良刺激,從而減輕細胞增殖引起的支架內再狹窄和術后血栓的形成[3]。
本研究通過模擬體內支架材料對血管內皮細胞的影響,即模擬鎳離子析出,觀察不同濃度的鎳離子對血管內皮細胞的影響。主要從細胞生長、形態、細胞毒性等幾個方面探索不同濃度的鎳離子對血管內皮細胞的影響。通過本研究,可以更深入地探討位于體內的支架材料的鎳離子析出對于血管內皮細胞的影響,從而為金屬支架的設計制造和優化提供理論依據。
1 實 驗
1.1材料和試劑
實驗所用細胞為人臍靜脈內皮細胞(Human Umbilical Vein Endothelial Cell,HUVEC),購于南京凱基生物科技發展有限公司;實驗用標準胎牛血清、RPMI-1640培養基、姬姆薩染液以及MTT,均購于國內生物公司。
1.2細胞培養
HUVEC用RPMI-1640培養基培養,添加10% 標準胎牛血清(TBD)和1%的青鏈霉素,置37 ℃,5%CO2培養箱中培養。
1.3細胞形態觀察
取對數生長期細胞,接種至24孔培養板中,細胞數目為2×104。設對照組和實驗組,對照組加入新鮮的細胞培養液,實驗組則加入不同濃度的氯化鎳培養液使得終濃度為7.813、15.625、31.25、62.5、125、200、250、400、500 mg/L。相同條件下繼續培養24 h、48 h、72 h后分別取出棄去培養液,加入 PBS清洗2次。用4%的多聚甲醛固定,然后加入姬姆薩溶液染色15 min。在倒置顯微鏡下觀察不同藥物濃度下的細胞形態并拍照[8]。
1.4MTT測定細胞相對增值率
取對數生長期細胞,接種至96孔培養板中,細胞數目為4×103個細胞,終體積為100 μL。設空白組和實驗組,空白對照組加入新鮮的細胞培養液,實驗組加入不同濃度的氯化鎳培養液,使得終濃度為7.813、15.625、31.25、62.5、125、200、250、400、500 mg/L[4-5]。每個實驗組設5個復孔。在37 ℃恒溫培養箱中繼續培養24 h后,加入MTT溶液(5 mg/L) 20 μL再繼續培養4 h。吸出孔內液體,每孔加入DMSO 150 μL。使用酶聯免疫檢測儀在550 nm處檢測各孔的吸光值。致死率計算,致死率=(對照組吸光度值-實驗組吸光度值)/對照孔吸光度值×100%。根據致死率和濃度關系做出致死曲線,通過線性關系得出半數致死濃度[6-7]。并計算細胞相對增值率(relative growth rate,RGR),計算公式為:RGR=(實驗組吸光度值/對照組吸光度值)×100%。實驗重復3次。可根據RGR值,按照其與材料毒性級別的對應關系對結果進行分級。
1.5統計學方法
實驗數據以均數(x±s)標準差表示。采用SPSS 進行統計分析,P<0.05為有統計學意義。
2 結果與討論
2.1鎳離子對血管內皮細胞形態的影響
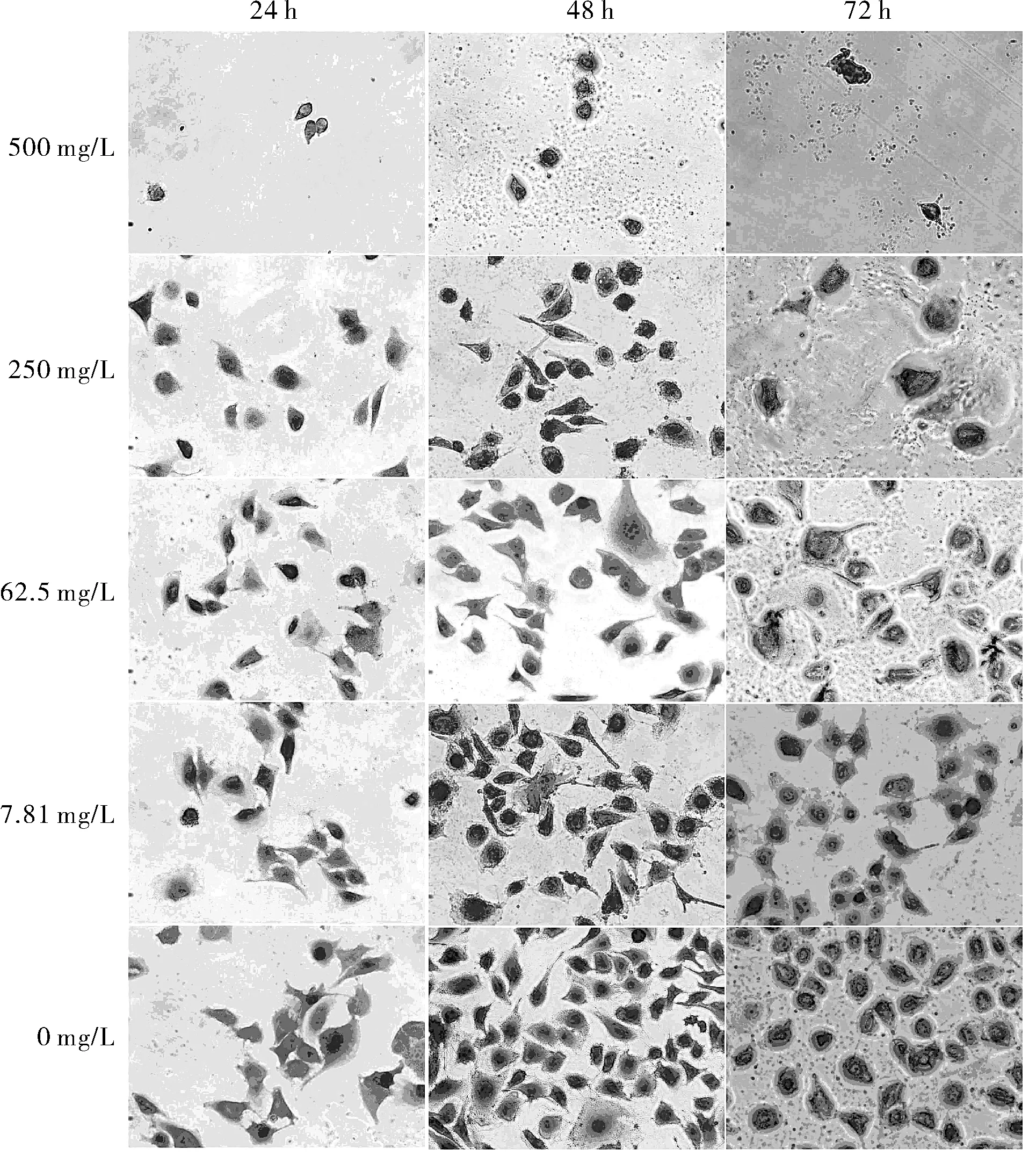
圖1 不同濃度的鎳離子在不同時間下對細胞形態的影響
經不同濃度鎳離子分別處理24 h、48 h和72 h后,通過姬姆薩染色觀察HUVEC的細胞形態(圖1)。對照組細胞貼壁生長狀態良好,細胞排列規則密集。從細胞數量上看,隨著鎳離子濃度的升高,細胞的數量逐漸減少。細胞逐步呈現中毒狀態,活細胞比例降低,細胞胞體變小,成固縮狀態,貼壁能力下降。從作用時間上看,隨著鎳離子作用時間的延長,細胞在結構上逐漸呈現固縮的趨勢,細胞形態逐漸由細胞形態不規則到細胞固縮,細胞膜破裂,細胞質消失,直至僅剩下細胞核。
2.2鎳離子對血管內皮細胞的半數致死濃度
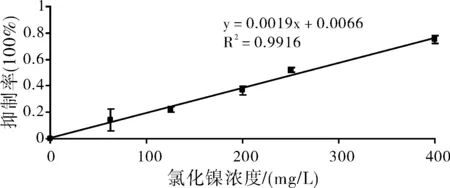
圖2 血管內皮細胞在不同鎳離子濃度下的抑制率
鎳離子對HUVEC的抑制率如圖2所示,可看出鎳離子與抑制率在一定范圍內為線性關系,將該線性關系擬合后得出公式:y=0.0019x+0.0066,其中R2=0.9916,可見鎳離子濃度在62.5~400 mg/L之間與抑制率具有十分良好的線性關系,由此公式可計算出24 h時氯化鎳對人臍靜脈內皮細胞的半數致死濃度為260 mg/L。
2.3鎳離子對血管內皮細胞增殖的影響
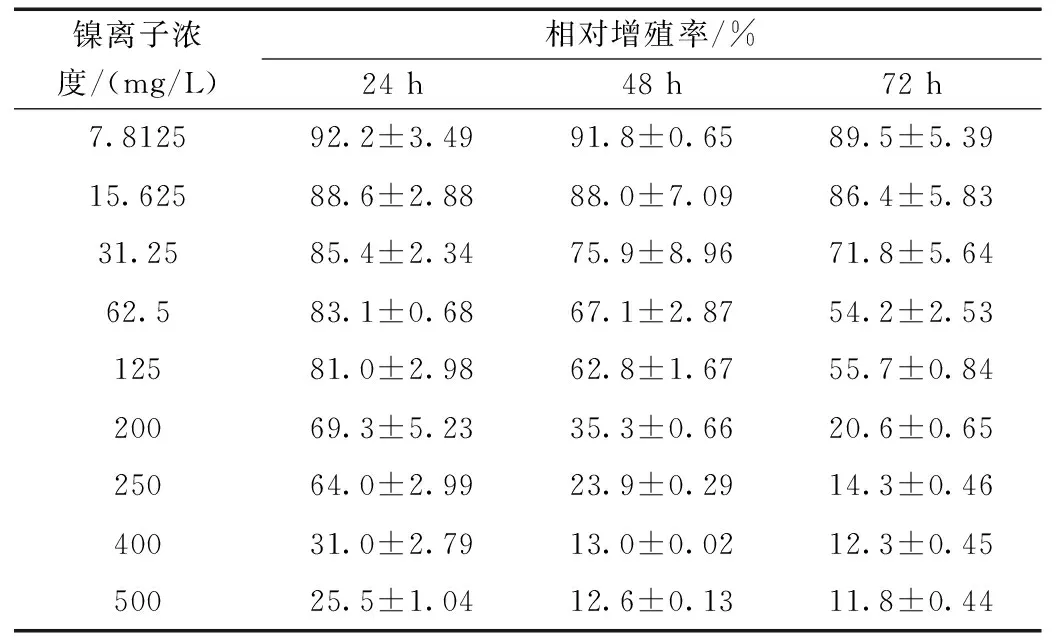
表1 血管內皮細胞在不同時間和不同鎳離子濃度下的相對增殖率
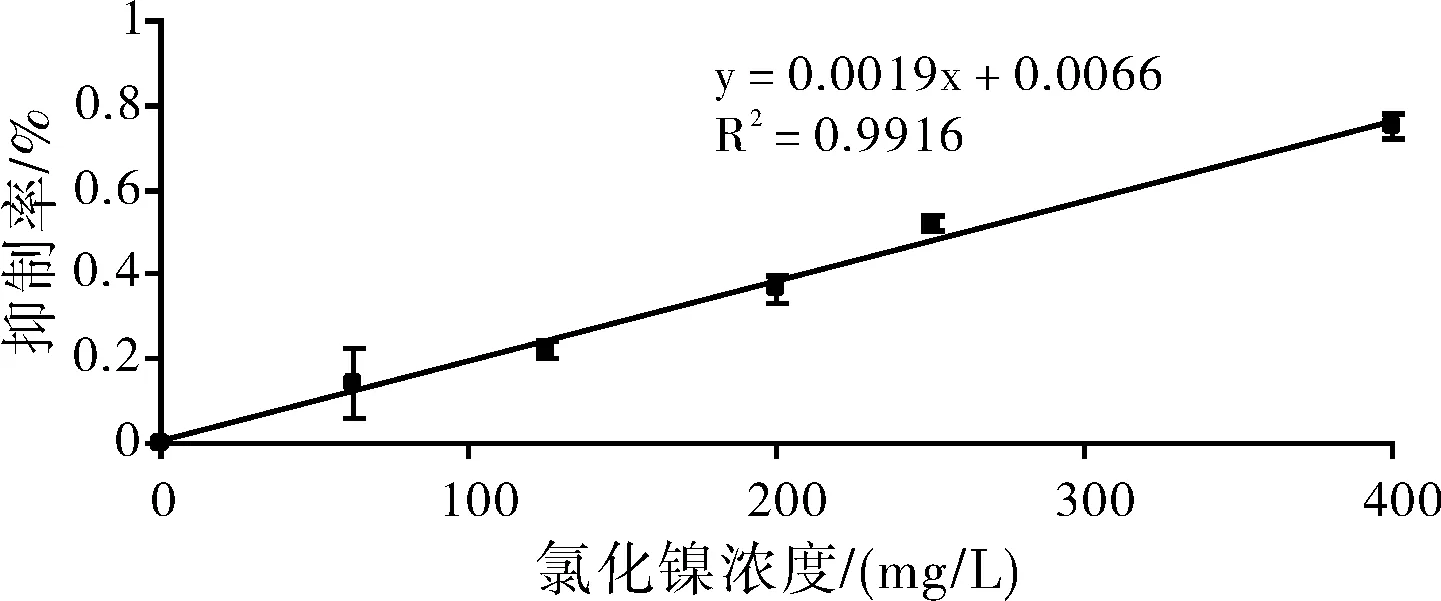
圖3 血管內皮細胞在不同時間不同鎳離子濃度下的相對增殖率

級別相對增殖率/%0≥100180~99250~79330~4940~29
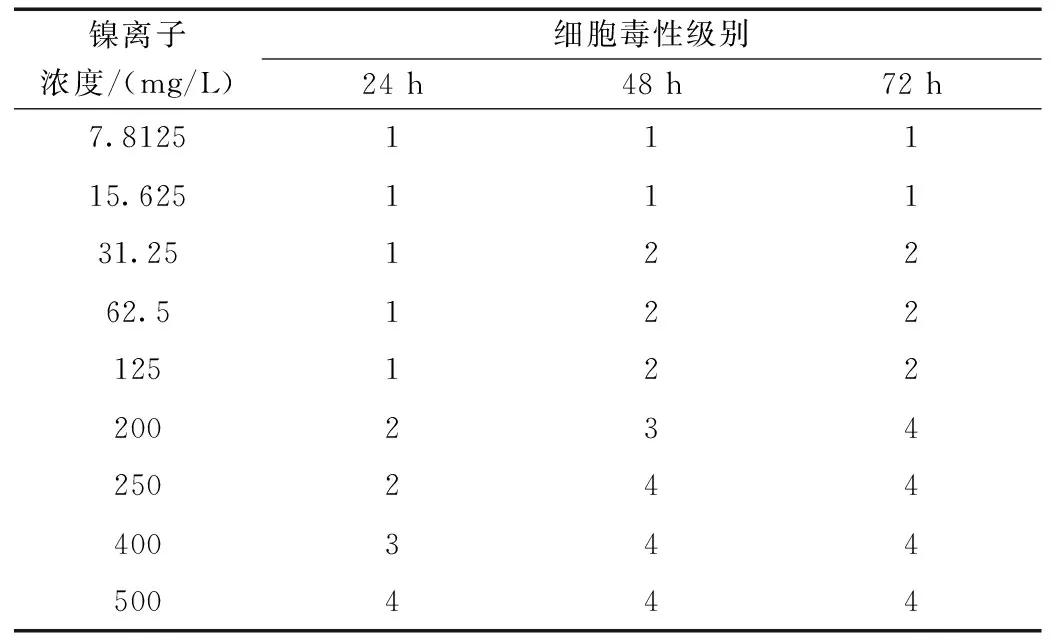
表3 血管內皮細胞在不同時間和不同鎳離子濃度下的細胞毒性級別
根據各不同鎳離子濃度組的細胞相對增殖率,依據細胞毒性評價標準(表2)對各組結果進行分級(表3)。根據結果可以看出,除對照組外,其余各濃度組均表現出細胞毒性,且隨著濃度的增加及作用時間的延長,相應的細胞毒性等級也出現增加的趨勢。當鎳離子濃度較高時400 mg/L及500 mg/L,細胞的毒性等級集中于3~4級,均表現出較強的細胞毒性。當鎳離子濃度不大于15.625 mg/L時,細胞毒性均不大于1級,當鎳離子濃度為31.25 mg/L及以上時,所有細胞毒性級別均為2級以上。
3 結 論
本研究從細胞生長活性、細胞形態和細胞毒性等幾個方面入手,運用MTT、Giemsa染色等方法了觀察了不同濃度的鎳離子對HUVEC細胞增殖的影響。
目前許多研究表明,在介入治療過程中存在著內皮細胞的損傷。而且還有學者針對該損傷提出了“內皮損傷—反應”學說并得到廣泛的支持,該學說認為動脈粥樣硬化是動脈壁對血管內皮損傷所作出反應的結果,導致動脈粥樣硬化的各種危險因素,最終都是通過不同途徑損傷動脈內膜。
通過對HUVEC細胞形態的觀察發現,在不同濃度的刺激下,細胞形態和亞結構均出現不同程度的損害,如細胞回縮、胞漿空泡性改變、線粒體腫脹和細胞核形態不規則等改變,且隨著濃度的增大,破壞更加明顯[9]。
MTT法是日前常用的細胞毒性評價方法,其吸光度值大小可反應活細胞數量的多少及細胞代謝活性的強弱。由結果分析可得,鎳離子對HUVEC細胞增殖活力具有明顯抑制作用,隨著濃度增加,時間延長,活細胞數量大幅減少。評價金屬離子的細胞毒性通常根據TC50,即可導致細胞半數死亡的離子濃度。對于HUVEC細胞,通過MTT實驗,可以得出氯化鎳對HUVEC的TC50值大約為260 mg/L,此結果與前人的研究結果相一致[10]。而且隨著鎳離子濃度的增加,鎳離子對HUVEC的抑制率越高,并且在一定鎳離子濃度范圍內呈現出線性趨勢,同時隨著作用時間的延長,鎳離子對HUVEC的抑制率也逐漸上升。
本實驗發現,隨著鎳離子濃度的增加,作用時間的延長,HUVEC細胞增殖受到明顯的抑制。提示時間和濃度是鎳離子細胞毒性效應的兩個重要指標。在對鎳離子的細胞毒性進行評價時,需綜合考慮以上兩種因素的影響。
鎳離子溶出是使用含鎳支架的一個不可回避的問題,本研究觀察了鎳離子對HUVEC細胞增殖的影響。本研究僅從細胞增殖和細胞形態的改變對鎳離子的細胞毒性作一評價,全面認識鎳離子的細胞毒性仍需從機制角度進行進一步探討。
[1]任尹賓, 楊柯, 梁勇. 醫用金屬材料中的鎳危害[J]. 生物醫學工程學雜志, 2005,22(5):1067-1069.
[2]劉靜, 程寧. 鎳化合物細胞毒理學研究的某些進展[J]. 工業衛生與職業病, 2010,36(5):306-308.
[3]張海燕. 血管支架致血管再狹窄的體外實驗研究[D]. 成都:西南交通大學, 2006.
[4]Taira M, Toguchi M S, Hamada Y, et al. Studies on cytotoxic effect of nickel ions on three cultured fibroblasts[J]. Materials In Medicine, 2001, 12(5):373-376.
[5]Cortijo J, Milara J, Mata M, et al. Nickel induces intracellular calciummobilization and pathophysiological responses in human cultured airway epithelial cells[J]. Chemico-Biological Interactions, 2010, 183(1): 25-33.
[6]Ahamed M, Akhtar M J, Siddiqui M A. Oxidative stress mediated apoptosis induced by nickel ferrite nanoparticles in cultured A549 cells[J]. Toxicology, 2011, 283(2-3): 101-108.
[7]Ahamed M. Toxic response of nickel nanoparticles in human lung epithelial A549 cells[J]. Toxicology in Vitro, 2011, 25(4): 930-936.
[8]Laine L, Lewin D N, Naritoku W, et al. Prospectivecomparison of H&E Giemsa and Genta stains for the diagnosis of Helicobacterpylori[J]. Gastrointest Endosc, 1997, 45(6): 463-467.
[9]王琛, 夏露, 陳亞明. 鎳離子對小鼠成纖維細胞毒性的實驗研究[J]. 口腔醫學, 2012,32(4):226-229.
[10]張貴, 程彩霞, 祁鳳君, 等. 鎳對體外培養內皮細胞的影響[J].現代生物醫學進展, 2010,10(2):224-228.
Study on Influence of Nickel Ions on the Proliferation of Vascular Endothelial Cells*
WEILe-hua,SUNJing-yuan,RENHui-wen,LIUJian-bo,GAOYu-yuan,LILi-ming
(College of Life and Health Sciences, Northeastern University, Liaoning Shenyang 110819, China)
The influence of nickel ions on the proliferation of HUVEC cells (Human Umbilical Vein Endothelial Cells) was evaluated. MTT and Giemsa stein were used to assess the cell viability and cell morphology under different concentrations of nickel ions. According to our research, the lethal dose 50 of Nickel Chloride was 260 mg/L. Inhibition rate increased with the increasing of concentrations of nickel ions and also increased with the time exposure to nickel ions. Ultrastructural alterations were observed including irregular shaped nuclei and the phenomena were dose dependent. Cellular proliferation of HUVEC was obviously inhibited by nickel ions. Cellular morphology of HUVEC became to be toxic state, and that was dose dependent and time dependent.
nickel ions; vascular endothelial cells; cell proliferation; cytotoxicity
遼寧省博士啟動基金(No。20141010);中央高校基本科研業務費(N152004001)。
李黎明(1977-),女,博士,主要從事生物材料方向的研究。
TH142.2
A
1001-9677(2016)010-0070-03
共同第一作者:韋樂華,孫婧媛。

