重組單克隆抗體的純化研究
鄒有土
·質量控制·
重組單克隆抗體的純化研究
鄒有土
重組單克隆抗體是新一代生物工程技術產品,其通過特定的靶點發揮藥效[1]。隨著大規模哺乳動物細胞培養技術的發展,工業化細胞培養液體積可達 1 萬升以上,抗體表達量可達 5 g/L 以上,極大地加重了重組單抗下游純化的壓力[2-3],下游純化成為限制重組單抗工業化擴大的主要因素[4-6]。重組單抗雜質控制濃度指標見表 1,這些指標必須通過離心、過濾和色譜層析純化后控制在一定濃度以下[7-10]。重組抗體的純化一般可以分為細胞培養液澄清、抗體捕獲、抗體精制純化、病毒滅活和純化工藝的放大等流程。

表1 重組單抗雜質控制濃度以及去除方法
1 細胞培養液澄清
在細胞培養過程中,在重組單抗分泌到培養液的同時,培養液中也含有大量的細胞顆粒、碎片、細胞器及細胞DNA[11]。工業化規模的細胞培養液澄清通常由三個步驟完成,具體步驟見圖 1[12]。第一步處理通常設置為離心,培養液中的細胞和細胞碎片通過離心去除后可大大減輕后續深層過濾或者微濾步驟的負荷。離心操作可分為批處理模式和連續流模式。批處理模式適用于實驗室規模,而連續流模式可以處理更大的培養液體積,更適用于工業化規模。隨著低離心剪切力離心機的發展,離心、過濾的混合型離心機在細胞澄清步驟的應用已經越來越廣泛[7]。在細胞培養液中加入一定的絮凝劑,可以使細胞懸浮物如細胞碎片等更易離心去除,進一步改善細胞培養液的澄清度,減少深層過濾的步驟。而微濾在細胞培養液澄清中,其效果要好于離心機,且其成本較低,但微濾會擴大料液體積 3 ~ 4 倍,導致后續純化負擔增加,不利于工業化生產[4]。
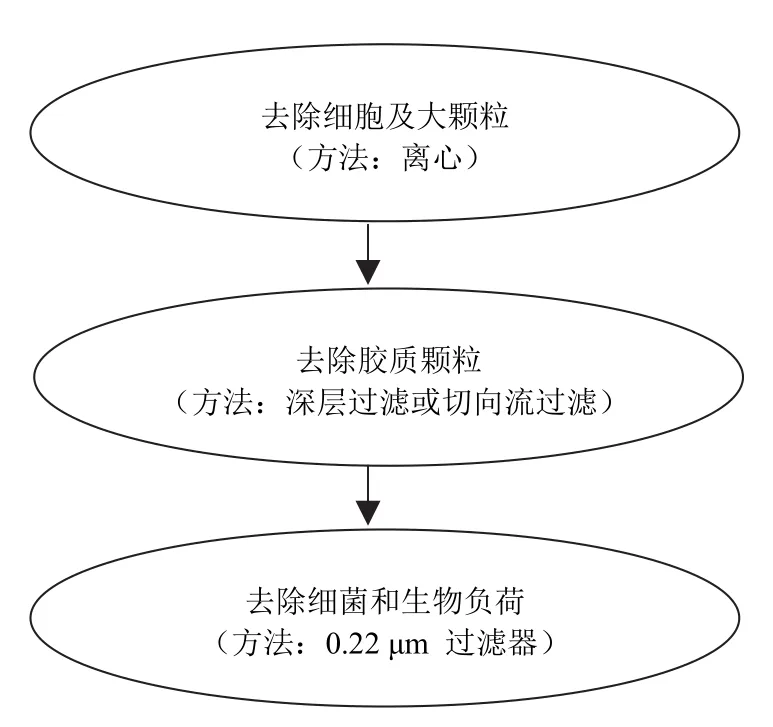
圖1 細胞培養液澄清三步驟
深層過濾和切向流過濾通常在澄清過程的第二步使用。對于大規模純化,深層過濾處理的體積相對比較小,而切向流過濾則具有更大的處理能力,并兼具濃縮的功能。但深層過濾使用方便、清潔、高效,在重組單抗的工業純化中應用廣泛。深層過濾屬于非均相分離,能夠使料液通過整個多孔介質而不僅僅是表面過濾,并且可以很好地防止下游層析柱的堵塞。在生物醫藥工業中,深層過濾器通常由纖維素或聚丙烯纖維組成的濾床以及硅藻土組成的支架構成。深層過濾的主要目的是去除細胞培養液中的細胞碎片、部分色素、細胞器等物質,可以在過濾固體含量比較小的懸浮體中使用,也可以在固體含量比較大的情況下使用。在深層過濾中增加排阻和電吸附作用,則能更有效地截留污染物[4]。澄清的最后一步是 0.22 μm 的膜過濾,能有效地去除固體顆粒和細菌,有報道指出在深層過濾器末端增加 0.22 μm 的過濾膜,能減少澄清過濾的操作步驟[13]。
2 抗體捕獲
捕獲的目的是濃縮和獲得高純度的蛋白,這個步驟通常使用離子交換或親和層析法。離子交換的原理是基于蛋白質分子的表面電荷和色譜基質上相反電荷的基團之間的相互作用。結合在基質上的蛋白質可以通過改變 pH 或者鹽濃度進行分離。離子交換是最常用的分離和純化蛋白質的色譜技術,其具有高容量、長壽命、低成本等特點,且操作簡單、易于控制,但其通常只能將蛋白純化至中等純度。親和層析是根據蛋白與配基之間的可逆的特異性作用進行抗體的捕獲,高特異性是其主要特征。使用親和層析一步純化不僅可以得到有針對性的高收益抗體,同時細胞培養液中的宿主細胞蛋白質、DNA 等物質可以大量的去除,且多種抗體類型都能找到其相應的親和填料[3]。
隨著層析介質載量和重復利用性能的不斷優化,目前親和層析已經成為重組單抗純化的首要選擇[14-15]。最成功的例子就是用 Protein A 捕獲單克隆抗體,該法具有很多的優點[15]:①特異性好,一步純化所得抗體的純度大于 95%;②具有濃縮的作用,洗脫液的抗體濃度高于 10 g/L,大大減少了后續純化溶液處理體積;③低 pH 洗脫并孵育,可以有效滅活病毒;④適用于所有人源的(除 IgG3)抗體和Fc 融合蛋白。但同時也存在一定的局限性:①Protein A 凝膠價格昂貴,比普通色譜介質的價格高數倍;②低 pH 條件下洗脫,抗體分子容易形成聚集體和沉淀;③Protein A 配基脫落,需在后續純化中去除。可以采用以下策略解決上述問題:①適當提高抗體洗脫緩沖液的 pH 值,更有利于重組單抗的穩定;②在洗脫緩沖液中加入一些蛋白穩定劑,如精氨酸、尿素等,能夠有效抑制聚集體的形成;③在低溫條件下進行層析操作,也可降低重組單抗的聚集。
親和層析介質非常多,以下幾種親和層析介質在重組單抗的純化中有廣泛的應用,其中 Protein A 是從金黃色葡萄球菌細胞壁分離的一種蛋白質,它能夠特異性地與哺乳動物 IgG 的 Fc 區域結合;Protein G 是從 G 類鏈球菌中分離出來的胞壁蛋白,能與 IgG Fc 區域相結合。天然的Protein G 和血漿中的白蛋白有親和力,因此通過基因工程重組的 Protein G 去掉了白蛋白的親和位點;Protein L 對不同的 IgG、IgM、IgA、IgE 以及 IgD 都有親和力。輕鏈的Kappa 區域可以和 Protein L 結合,但是和 lambda 區域沒有親和作用,純化方法建立之前,需要鑒定抗體的類型,以便選擇正確的層析填料來分離純化。不同抗體類型在選擇親和層析介質上面也有差異:①嵌合抗體、人源化抗體可以選擇 Protein A 或者 Protein G 親和填料;②Fc 融合蛋白選擇 Protein A 層析填料;③Fab 片段或 scFv 單鏈選擇Protein L;④單區域抗體 sdAb 通常有 VH 區域,可以使用 Protein A 作為捕獲步驟。
3 抗體精制純化
雖然親和層析可以快速去除大量雜質,但很難將這些雜質去除到規定濃度以下,后續可以采用精制色譜方法,如陽離子交換層析(CEX)、陰離子交換層析(AEX)、疏水作用層析(HIC)等,來去除宿主細胞蛋白質、高分子聚合物、DNA、內毒素和脫落的親和配基等雜質[16-17]。
陽離子交換層析通常采用吸附-洗脫模式,主要的目的在于去除 DNA、宿主細胞蛋白質、脫落的親和配基和內毒素。在洗脫過程中,雜質與陽離子介質結合力弱而被除去,而重組單抗則吸附在填料上,再通過改變 pH 或者增加鹽離子濃度將目的蛋白洗脫下來。陰離子交換層析一般采用流穿模式進行純化,去除殘留的 DNA、內毒素及聚合物。在流穿模式中,用脫鹽或者稀釋的方式將溶液的鹽離子濃度調低,使重組單抗流穿而微量雜質保留在柱子上,以此達到去除內毒素和 DNA 的目的。陰離子交換層析有處理量大、動態載量高、操作簡單的優勢,適合最后精制步驟除去痕量雜質。疏水作用層析是采用高鹽上樣,低鹽洗脫模式,通過強離子濃度變化進行目的蛋白與雜質之間的分離,能有效除去宿主細胞蛋白、DNA 和病毒等雜質。
通常情況下,會選用兩步柱層析作為精細純化步驟,一方面是為了獲得高純度的樣品,一方面是保證足夠高的產品得率。AEX 和 HIC 通常采用流穿模式,這是因為單抗的等電點通常比較高,而且這種模式具有比結合-洗脫模式更高的載量。然后將流穿的樣品再用 CEX 進行純化,CEX 可采用梯度洗脫模式,使單抗樣品的純度達到最大值。
4 病毒滅活
在抗體純化過程中除了要考慮回收率和純度外,還需考慮如何有效地滅活清除病毒,FDA Q5A 指導性文件要求使用額外的兩個不同步驟來去除病毒,以確保實現重組哺乳動物細胞產品的安全性[10]。
不同類型的病毒清除有不同的方法,其中加熱和輻射清除病毒是最有效的,但這些方法在重組單抗等生物制品中不適用。低 pH 孵育是重組單抗純化中最常用的病毒滅活方法,通過將 Protein A 洗脫液的 pH 調節至低于 3.8 并孵育一定時間,可以有效地去除脂質包膜病毒[18]。但是將重組單抗溶液調至低 pH 容易導致重組單抗失活及聚集。經研究表明,在溶液中加入 0.3 ~ 2 mol/L 的精氨酸,可以達到穩定重組單抗及減少聚集的作用。還有一些重組單抗溶液在中和 pH 的過程中,會產生渾濁沉淀,但沉淀中不一定含有重組單抗,在這種情況下,可用 0.45 μm 或者 0.22 μm的濾膜過濾去除沉淀,也可用深層過濾的方法來去除這些沉淀。另外,非包膜病毒如鼠細小病毒由于具有較高的化學溶液耐受性,必須采用物理的方法來去除,其中吸附法和小孔徑膜過濾法均被廣泛應用。病毒過濾既可以采用切向流過濾,也可以采用盲端過濾,但采用切向流過濾往往導致樣品濃度過低,因此盲端過濾法更為合適。病毒過濾器分為過濾逆轉錄病毒級別(< 50 nm)和過濾細小病毒級別(< 20 nm)。病毒過濾的步驟可以設計在精制過程中的任意步驟之后,通常在恒定的壓力下進行。由于病毒過濾器的孔徑特別小,尤其是細小病毒級別的過濾器,在樣品含有聚集體情況下很容易造成堵塞,必須增加過濾的操作壓力來解決這一問題。
5 純化工藝放大
目前細胞的培養規模越來越大,從 12 000 ~ 15 000 L到在建的 20 000 L 細胞培養規模,同時多個細胞培養罐并行運行。這些極大地推動了大規模蛋白質純化技術的發展:從批產幾公斤,年產幾十公斤重組單抗發展到批產幾十公斤,年產上十噸的規模。同時,新型凝膠技術、更大規模的純化生產系統技術和膜過濾技術的發展,縮短了重組單抗純化時間,進一步節約了投資,提高了產能和產率。目前商品化的 Protein A 填料在線性流速大于 500 cm/h,結合時間小于 2.4 min 的條件下,動態載量高達 38 mg/ml。離子交換工業層析柱在直徑 60 cm、柱高 30 cm 的情況下線性流速可高達 500 cm/h。這些純化技術的發展不僅有利于工藝放大后大規模層析柱的填裝,還大大提高了生產效率,縮短操作時間,能夠有效避免抗體分子產生各種變體和聚集體。
治療所需的高品質重組單抗需要高效的上游和下游的制造流程。當生物反應器從搖瓶放大到試生產規模,下游工藝也必須按比例增加[4, 19]。純化工藝放大通常包括兩個步驟:第一步從實驗室到中試規模增加 50 ~ 100 倍,第二步從試生產規模到全生產規模增加 10 ~ 50 倍。下游工藝的放大不僅是單純增加大小和實驗室設備的體積,大規模純化過程中使用的管道尺寸變大、過濾器變大、泵類型不同、死體積增大均會導致純化放大出現困難[20]。且不同的親和填料應進行篩選以實現高的生產速率,同時必須具有高的動態結合載量并能夠在低反壓下工作。柱體積根據所需結合能力必須計算出最佳柱床高度、流速和動態能力。停留時間等于該柱床的高度除以流體的線速度,線速度必須保持恒定。運行流量不應該超過最大流量的 70%。按比例放大之前,需選擇那些壽命長,一致性好,穩定的層析填料[21]。比例放大時,柱體積應保持柱床高度的恒定而只增加柱徑,每單位填料的蛋白質載量應該是相同的,線性流動速度也應該相同[22]。
目前主要使用的常規色譜層析方法在工藝放大方面具有較高的限制,當前重組單抗純化的下游處理能力已不能滿足細胞培養液體積快速提高的需求,同一批細胞培養液往往需要通過多次色譜純化才能完成。工藝放大的瓶頸突出表現在緩沖液及純化中間體的儲罐大小有限,還有層析柱直徑超過 2 m 后常常出現液流分配問題和裝柱問題。近年來出現了一些如選擇性沉淀或高選擇性液液分離的非色譜純化技術,以及模擬移動床色譜、雙水相萃取、膜色譜等各方面技術,處理能力可達 10 kg/L 以上,大幅度提高了單次樣品的處理量。這些新技術的出現,將彌補常規色譜技術處理量方面的不足。
[1] Reichert JM. Antibodies to watch in 2016. MAbs, 2016, 8(2):197-204.
[2] Singh N, Arunkumar A, Chollanqi S, et al. Clarification technologies for monoclonal antibody manufacturing processes: current state and future perspectives. Biotechnol Bioeng, 2016, 13(4):698-716.
[3] Langer ES. Trends in capacity utilization for therapeutic monoclonal antibody production. MAbs, 2009, 1(2):151-156.
[4] Girard V, Hilbold NJ, Ng CK, et al. Large-scale monoclonal antibody purification by continuous chromatography, from process design to scale-up. J Biotechnol, 2015, 213 (10):65-73.
[5] Zydney AL. Continuous downstream processing for high value biological products: A Review. Biotechnol Bioeng, 2016, 113(3):465-475.
[6] Klutz S, Holtmann L, Lobedann M, et al. Cost evaluation of antibody production processes in different operation modes. Chem Eng Sci,2016, 17(141):63-74.
[7] Rathore AS, Aqarwal H, Sharma AK, et al. Continuous processing for production of biopharmaceuticals. Prep Biochem Biotechnol, 2015,45(8):836-849.
[8] Gagnon P. Technology trends in antibody purification. J Chromatogr A,2012, 1221:57-70.
[9] Baur D, Angarita M, Müller-Sp?th T, et al. Optimal model-based design of the twin-column CaptureSMB process improves capacity utilization and productivity in protein A affinity capture. Biotechnol J,2016, 11(1):135-145.
[10] Ecker DM, Jones SD, Levine HL. The therapeutic monoclonal antibody market. MAbs, 2015, 7(1):9-14.
[11] Dutta AK, Tran T, Napadensky B, et al. Purification of monoclonal antibodies from calrified cell culture fluid using Protein A capture continuous countercurrent tangential chromatography. J Biotechnol,2015, 213:54-64.
[12] Singh N, Pizzelli K, Romero JK, et al. Clarification of recombinant proteins from high cell density mammalian cell culture systems using new improved depth filters. Biotechnol Bioeng, 2013, 110(7):1964-1972.
[13] Ayyar BV, Arora S, Murphy C, et al. Affinity chromatography as a tool for antibody purification. Methods, 2012, 56(2):116-129.
[14] Tong HF, Lin DQ, Chu WN, et al. Multimodal charge-induction chromatography for antibody purification. J Chromatogr A, 2016,1429:258-264.
[15] Shamashkin M, Godavarti R, Iskra T, et al. A tandem laboratory scale protein purification process using Protein A affinity and anion exchange chromatography operated in a weak partitioning mode. Biotechnol Bioeng, 2013, 110(10):2655-2663.
[16] Schilling K, Krause F. Analysis of antibody aggregate content at extremely high concentrations using sedimentation velocity with a novel interference optics. PLoS One, 2015, 10(3):e0120820.
[17] Manna L, Di Febo T, Armillotta G, et al. Production of monoclonal antibodies in serum-free media. Monoclon Antib Immunodiagn Immunother, 2015, 34(4):278-288.
[18] Lin SY, Chiu HY, Chiang BL, et al. Development of EV71 virus like particle purification processes. Vaccine, 2015, 44(33):5966-5973.
[19] Xenopoulos A. A new, integrated, continuous purification process template for monoclonal antibodies: process modeling and cost of goods studies. J Biotechnol, 2015, 213:42-53.
[20] Holenstein F, Eriksson C, Erlandsson I, et al. Automated harvesting and 2-step purification of unclarified mammalian cell-culture broths containing antibodies. J Chromatogr A, 2015, 1418:103-109.
[21] Liu BN. The progress of therapeutic antibody drug and the industrial key technology of antibody production. China Biotechnol, 2013, 33(5):132-138. (in Chinese)
劉伯寧. 治療性單抗與抗體產業關鍵技術. 中國生物工程雜志,2013, 33(5):132-138.
[22] Ladd Effio C, Hahn T, Seiler J, et al. Modeling and simulation of anion-exchange membrane chromatography for purification of Sf9 insect cell-derived virus-like particles. J Chromatogr A, 2015, 1429:142-154.
10.3969/j.issn.1673-713X.2016.04.019
“重大新藥創制”國家科技重大專項(2011ZX09401-017)
361009 廈門,未名生物醫藥有限公司研發中心,Email:120508351@qq.com
2016-04-28

