乙酰木聚糖酯酶協同木聚糖酶降解木聚糖的研究
朱天地,何 瑤,楊 標,劉加馳,鄔敏辰*
(1.江南大學 生物工程學院 江蘇 無錫214122;2.江南大學 無錫醫學院 江蘇 無錫214122)
乙酰木聚糖酯酶協同木聚糖酶降解木聚糖的研究
朱天地1,何 瑤1,楊 標2,劉加馳2,鄔敏辰*2
(1.江南大學 生物工程學院 江蘇 無錫214122;2.江南大學 無錫醫學院 江蘇 無錫214122)
探討了宇佐美曲霉(Aspergillus usamii)乙酰木聚糖酯酶和第10、11家族木聚糖酶之間的協同作用。利用作者所在實驗室構建保藏的3株工程酵母Pichia pastoris GS115/Auaxe、GS115/ Auxyn11A和GS115/Auxyn10A進行甲醇誘導發酵,分別獲得重組乙酰木聚糖酯酶和木聚糖酶。在木聚糖酶最適pH、40℃、料液質量體積比1 g∶60mL、水解2 h的條件下分別研究了不同加酶量作用于小麥麩皮時生成的還原糖量。結果表明,乙酰木聚糖酯酶與第11家族木聚糖酶有更好的協同作用,并在添加量比(酶活力比)為5∶1時所測協同效果最好,還原糖生成量較木聚糖酶單獨作用增加了46%。因此,在乙酰木聚糖酯酶的作用下,木聚糖上乙酰基的去除,對提高木聚糖酶對木聚糖的水解效率具有重要作用。
乙酰木聚糖酯酶;木聚糖酶;協同作用;木聚糖
半纖維素是自然界中除纖維素以外最豐富的可再生生物資源,木聚糖是植物細胞壁中半纖維素的重要組成成分,約占植物細胞干重的15%-35%[1]。木聚糖是連接木質素和纖維素的“橋梁”。在果膠等物質的參與下,木聚糖的側鏈基團和木質素以化學鍵相互連接,并與纖維素結合,形成致密的結構,這種致密結構是細胞壁穩定的基礎[2]。木質纖維素中的木聚糖主要可分為硬木木聚糖 (被子植物)和軟木木聚糖(裸子植物和一年生植物)[3]。硬木木聚糖以O-乙酰-4-O-甲基葡萄糖醛酸木聚糖的形式存在,聚合度在150~200之間,通常在木糖的C-3位點高度乙酰化。與硬木木聚糖不同,軟木木聚糖為阿拉伯-4-O-甲基葡萄糖醛酸木聚糖,聚合度小,在70~130之間,以α-L-阿拉伯呋喃糖基替代乙酰基,并通過α-1,3-糖苷鍵與木糖殘基相連[4]。木聚糖的結構也是多種多樣,通常包含不同的側鏈基團,如阿拉伯糖、O-乙酰基、阿魏酸、4-O-甲基葡萄糖醛酸和香豆酸等[5]。這些側鏈基團是影響其被水解的因素之一,產生空間障礙,限制了主鏈降解酶和主鏈的接觸,降低了可及性[6-7]。
廣義上來講,木聚糖酶(Xylanase)指的是一類具有將木聚糖水解為低聚木糖及木糖作用的酶的總稱。由于木聚糖的來源及其結構復雜性不同,其完全降解需要多種酶的協同作用,其中主要包括β-1,4-內切木聚糖酶(β-1,4-endoxylanase,EC 3.2.1.8)、β-1,4-外切木聚糖酶(β-1,4-exoxylanase,EC 3.2.1.37)和β-木糖苷酶3種。此外,還有一些作用于木聚糖支鏈的水解酶,如α-L-呋喃阿拉伯糖苷酶、乙酰木聚糖酯酶、阿魏酸酯酶和p-香豆酸酯酶等[8]。基于酶蛋白一級結構的同源性及疏水簇分析,絕大多數木聚糖酶都屬于糖苷水解酶(Glycoside Hydrolase,GH)10和11家族[9]。GH11家族木聚糖酶具有底物特異性高、相對分子質量小(<30 000)和等電點一般為中性等特點。GH10家族木聚糖酶具有作用底物廣泛、高相對分子質量(>30 000)及等電點偏酸性等特點。由于木聚糖的徹底降解需要多種酶的協同作用,Faulds等[10]人做了關于阿魏酸酯酶與GH11和GH10協同作用釋放酚酸方面的研究。Várnai等[11]人報道了關于木聚糖酶與甘露聚糖酶協同作用于軟木的相關研究。迄今為止,關于乙酰木聚糖酯酶與木聚糖酶之間的協同作用鮮有報道。
乙酰木聚糖酯酶(EC 3.1.1.6,Acetyl Xylan Esterase,AXE)能夠消除乙酰化木聚糖中木糖殘基C-2和C-3位的O-乙酰取代基。作者利用實驗室構建保藏的 3株工程酵母 Pichia pastoris GS115/ Auaxe、GS115/Auxyn10A和 GS115/Auxyn11A進行甲醇誘導發酵,分別獲得重組乙酰木聚糖酯酶、GH10和GH11家族木聚糖酶,雙酶協同降解小麥麩皮。作者為酶法高效水解農業廢棄物奠定了一定的基礎。
1 材料與方法
1.1菌株和培養基
P.pastoris GS115/Auaxe、GS115/Auxyn11A 與GS115/Auxyn10A工程菌株均由江南大學無錫醫學院分子生物學實驗室構建和保藏;YPD、BMGY和BMMY培養基參考 Multi-Copy Pichia Expression Kit(Invitrogen公司)操作手冊。
1.2材料和試劑
生物素、酵母提取物、YNB、胰蛋白胨均購自上海Sangon公司;櫸木木聚糖購自美國Sigma公司;麩皮購自農貿市場,去淀粉麩皮的處理按照Mukherjee等[12]和龔燕燕等[13]提供的方法,每次處理做3組平行實驗,每次預處理后并沒有發現統計學差異;其它化學試劑均為國產或進口分析純。
1.3乙酰木聚糖酯酶和木聚糖酶粗酶液的制備
分別挑取 GS115/Auaxe、GS115/Auxyn11A和GS115/Auxyn10A單菌落接種到25 mL液體BMGY中,30℃、220 r/min條件下振蕩培養24 h,室溫靜置約1~2 h,棄上清,加入30 mL的BMMY,于同樣條件下培養至72 h,每隔24 h添加體積分數1%的甲醇進行誘導。酵母發酵液于8 000 r/min離心10 min,收獲上清即分別為重組乙酰木聚糖酯酶和木聚糖酶粗酶液。
1.4酶活的測定
以對硝基苯酚醋酸酯為底物,用分光光度法測定經重組乙酰木聚糖酯酶(reAuAxe)水解后產物中對硝基苯酚的吸光值。具體步驟按Krastanova等[14]提供的方法稍作修改:取0.04 mL 100 mmol/L的底物 (DMSO溶解)與0.86mL 100mmol/L的磷酸鹽緩沖液(pH 6.0)混勻,加入0.1 mL適當稀釋的酶液,50℃下準確反應10 min后加入3 mL甲醇終止反應,再加入2 mL去離子水,測定A410。在上述反應條件下,1個酶活性單位 (U)定義為每分鐘產生1 μmol對硝基苯酚所需的酶量。
采用改進的DNS法[8]測定木聚糖酶酶活,2.4 mL 0.5%木聚糖溶液 (pH 4.6)加入0.1 mL適當稀釋倍數的酶液,于50℃下反應15 min,加入2.5 mL DNS試劑,沸水浴中顯色7min,測定A540nm。在上述反應條件下,一個酶活性單位(U)定義為每分鐘產生1μmol還原糖所需的酶量。
1.5乙酰木聚糖酯酶與木聚糖酶協同作用的研究
1.5.1不同加酶量的協同作用為了研究乙酰木聚糖酯酶與木聚糖酶之間是否有協同作用,先確定木聚糖酶單獨作用去淀粉小麥麩皮時的添加量,然后再研究乙酰木聚糖酯酶添加量的影響。分別準確稱取0.5 g去淀粉小麥麩皮于100mL搖瓶中,加入不同單位木聚糖酶(50~200 U),以100 mmol/L、pH 5.0磷酸鈉緩沖液將反應體系補至終體積為30 mL,置于40℃恒溫振蕩器中酶解2 h后沸水浴10 min終止反應。水解液于10 000 r/min離心10 min,然后測定上清液中還原糖的含量。
1.5.2不同加酶順序的協同作用為了驗證乙酰木聚糖酯酶和木聚糖酶是否有協同作用,均以0.5 g去淀粉小麥麩皮為底物,分別設計了以下反應體系:1)只添加緩沖液反應2 h;2)只加入木聚糖酶反應2 h;3)只加入乙酰木聚糖酯酶反應2 h;4)先加木聚糖酯反應2 h,酶滅活后再加乙酰木聚糖酯酶反應2 h;5)同時加入乙酰木聚糖酯酶和木聚糖酶反應2 h;6)先加木聚糖酶反應2 h,酶滅活后再加乙酰木聚糖酯酶反應2 h。
1.5.3不同酶量比的協同作用分別準確稱取0.5 g去淀粉小麥麩皮于100 mL搖瓶中,加入不同酶量比的reAuAxe和11家族重組木聚糖酶(reAuXyn11A)酶液,以100mmol/L、pH 5.0磷酸鈉緩沖液將反應體系補至終體積為30mL,置于40℃恒溫振蕩器中酶解2 h后沸水浴10min終止反應。水解液于10 000 r/min離心10 min,然后測定上清液中還原糖的含量。以底物中只加緩沖液的相同體系經相同處理的樣品作為對照。為防止反應體系中微生物對還原糖的降解,在反應體系中添加了終質量濃度為100mg/mL的氨芐青霉素。
不同酶量比(酶活力比)的reAuAxe和10家族木聚糖酶 (reAuXyn10A)反應體系除100mmol/L、pH 5.5磷酸鈉緩沖液外其他條件均與上述相同。
2 結果與分析
2.1乙酰木聚糖酯酶和木聚糖酶的酶學性質
Koseki[15]等人克隆表達了來自米曲霉的乙酰木聚糖酯酶,此乙酰木聚糖酯酶的最適溫度和pH分別是45℃和6.0,在40~50℃、pH 6.0~7.0范圍內酶活性穩定。黃孢原毛平革菌的乙酰木聚糖酯酶酶活大小為39.86 U/mg,最適溫度及pH分別為30~35℃和7.0[16]。根據1.4中酶活的測定方法,reAuAxe的酶活為35.6 U/mL,reAuXyn11A的酶活則為582 U/mL,reAuXyn10A的酶活則為 170 U/mL。reAuAxe、reAuXyn11A及reAuXyn10A酶學性質[17-18]如表1所示。來自宇佐美曲霉的第10家族木聚糖酶和第11家族木聚糖酶的最適pH分別是5.5和5.0,而乙酰木聚糖酯酶在pH在4.5~7.0范圍內仍有較高活性,所以乙酰木聚糖酯酶和第10和11家族木聚糖酶協同作用時反應pH分別為5.5和5.0。與米曲霉乙酰木聚糖酯酶比較可見,reAuAxe的最適溫度更高一些,且pH穩定性范圍更廣。與黃孢原毛平革菌乙酰木聚糖酯酶比較,reAuAxe的酶活性更高并且最適溫度比前者高近20℃。將3種不同來源的乙酰木聚糖酯酶的相關酶學特性進行比較可見,reAuAxe有著酶活性更高、pH穩定性范圍更廣的優勢。
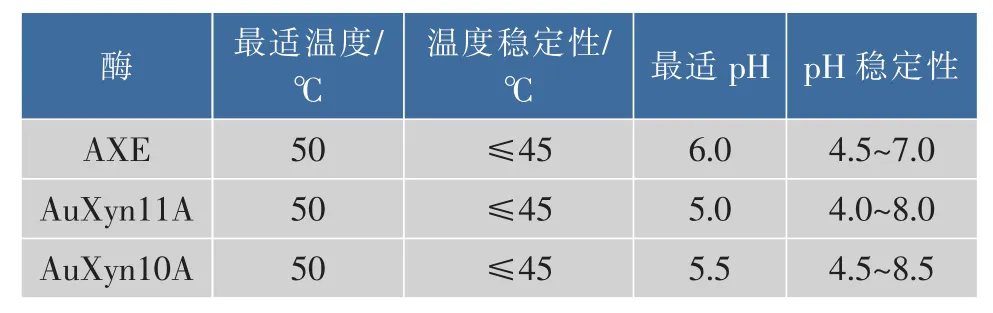
表1 reAuAxe、reAuXyn11A及reAuXyn10A的酶學性質Table 1 Enzymatic properties of reAuAxe,reAuXyn11A and reAuXyn10A
2.2乙酰木聚糖酯酶與GH11家族木聚糖酶的協同降解作用
2.2.1不同加酶量的協同作用按照1.5.1中的方法,考察最佳木聚糖酶添加量,結果如圖1所示,在50~200 U之間,還原糖量隨著酶添加量的增加而逐漸升高。當酶量為150 U時,生成的還原糖量為0.75mg/mL,但當酶添加量大于150 U時,還原糖量趨于平穩。因此,最佳木聚糖酶添加量為150 U。確定木聚糖酶添加量后,再研究乙酰木聚糖酯酶的添加量。
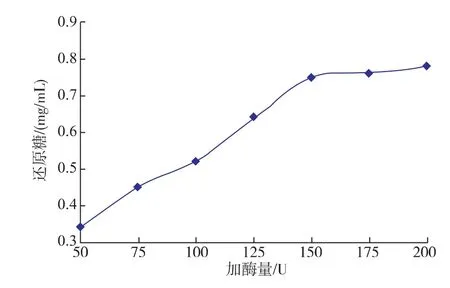
圖1 不同加酶量對還原糖釋放量的影響Fig.1 Effects of enzyme concentration on the release of reducing sugar
2.2.2不同加酶順序的協同作用如圖2所示,在反應體系中只添加緩沖液或乙酰木聚糖酯酶均沒有檢測到還原糖的釋放(方案1和3)。如方案4、5 和6所示,在反應體系中先添加reAuXyn11A、同時添加兩種酶、先添加reAuAxe,分別釋放出0.78、0.89、1.00mg/mL的還原糖,比單獨添加reAuXyn11A時還原糖的產生量分別提高了5.0%、20.2%和35.1%。方案4與方案2相比,方案4中還原糖量略高一點,可能是由于木聚糖酶作用木聚糖主鏈生成不同大小的片段,然后乙酰木聚糖酯酶作用于這些片段,使其結構疏松,暴露出少量的還原端,所以還原糖量會增加但是增加量不大。方案5比方案2還原糖量增加了20.2%,說明雙酶在協同降解去淀粉小麥麩皮的過程中有一定的協同作用。方案6比方案5生成的還原糖量多,可能是由于乙酰木聚糖酯酶先作用于木聚糖,能更充分的消去側鏈的乙酰基團,使得木聚糖酶有更多的機會作用于木聚糖主鏈,并且總的反應時間也比方案5時間長,所以生成的還原糖量要更多。
2.2.3不同酶量比(酶活力比)的協同作用按照
1.5.2中的方法研究不同酶量比時 reAuAxe與reAuXyn11A的協同作用,結果如圖3所示,不同酶量比產生還原糖的量不同。隨著 reAuAxe與reAuXyn11A比例的增加,還原糖的產量也逐漸增加,但是還原糖增加量的趨勢變緩,可能是由于加酶量達到飽和。當reAuAxe與reAuXyn11A的添加酶量比為5∶1時協同效果較好,還原糖生成量比木聚糖酶單獨作用增加了46%。該結果表明,去淀粉麩皮中木聚糖上乙酰基的去除,對提高木聚糖酶的水解效率具有重要作用。Huy[16]等人分別以樺木木聚糖、櫸木木聚糖和阿拉伯糖基木聚糖為底物研究黃孢原毛平革菌的乙酰木聚糖酯酶和木聚糖酶的協同作用,結果還原糖的增加量分別提高了19.4%,11.2%和6.3%。綜上所述,來自宇佐美曲霉的乙酰木聚糖酯酶和GH11家族木聚糖酶的協同作用效果更好。
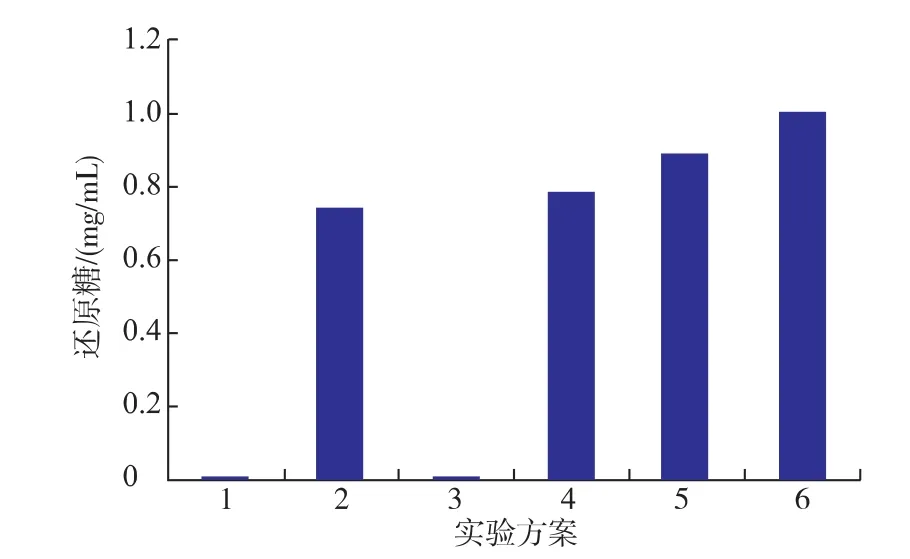
圖2 加酶順序對還原糖釋放量的影響Fig.2 Effects of the addition order on the release of reducing sugar
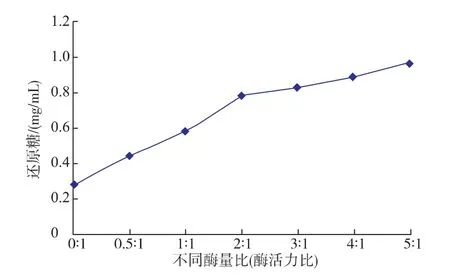
圖3 不同酶量比對還原糖釋放量的影響Fig.3 Effects of different enzyme ratios on the release of reducing sugar
2.3乙酰木聚糖酯酶與GH10家族木聚糖酶的協同降解作用
2.3.1不同加酶順序的協同作用如圖4所示,在反應體系中只添加緩沖液或乙酰木聚糖酯酶均沒有檢測到還原糖的釋放(方案1和3)。如方案4、5 和6所示,在反應體系中先添加reAuXyn10A、同時添加兩種酶、先添加reAuAxe,均能釋放出還原糖,比單獨添加reAuXyn10A時還原糖的產生量分別提高了5.3%、6.6%和14.6%。方案5與方案6的還原糖生成量均低于reAuAxe與reAuXyn11A作用生成還原糖的量。
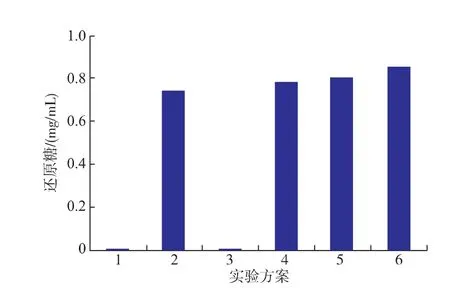
圖4 加酶順序對還原糖釋放量的影響Fig.4 Effects of the addition order on the release of reducing sugar
2.3.2不同酶量比(酶活力比)的協同作用按照1.5.2中的方法測不同酶量比時 reAuAxe與reAuXyn10A的協同作用大小,結果如圖5所示,不同的酶質量比例產生的還原糖量不同,隨著reAuAxe和reAuXyn10A比例的增加產生的還原糖量逐漸增加,由于加酶量達到飽和,增加趨勢平緩。當reAuAxe和reAuXyn10A添加量比為5∶1時協同效果較好,還原糖生成量比木聚糖酶單獨作用增加了16%。比reAuAxe與reAuXyn11A協同作用還原糖增加量小,可能是受限于小麥麩皮組織縫隙的大小,使得分子量小的reAuXyn11A更容易進入組織水解木聚糖[19],另外由于11家族木聚糖酶空間位阻比較大,而10家族木聚糖酶的空間位阻較小,所以木聚糖側鏈的乙酰基團的去除對于reAuXyn11A的影響比較大,綜上所述,reAuAxe與reAuXyn11A的協同作用效果要更好。
3 結語
中國是農業大國,每年都產生很多的農業廢棄物,如小麥麩皮、玉米芯、谷物類及甘蔗渣,都是地球上豐富的可再生有機碳源。中國近年來小麥的年產量超1億多噸,隨之每年產生高達2 000多萬噸的副產品-麩皮,多被丟棄或用作動物飼料。麩皮是一種含量豐富的工業副產物,它可以進一步被降解利用,生產寡糖及發酵所需的糖。由于麩皮中木聚糖結構的復雜性,僅僅利用單個的酶作用很難高效、徹底地將其降解。木聚糖側鏈上的乙酰基團的存在對木聚糖酶降解木聚糖產生了阻礙作用,進而影響底物的水解效率。乙酰木聚糖酯酶能夠消除乙酰化木聚糖中木糖殘基C-2和C-3位的O-乙酰取代基,從而提高木聚糖酶對主鏈的可及性,提高酶解效率。
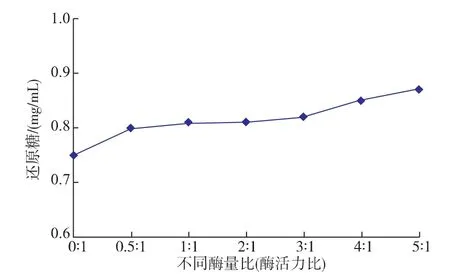
圖5 不同酶量比對還原糖釋放量的影響Fig.5 Effects of different enzyme ratios on the release of reducing sugar
作者以去淀粉小麥麩皮為研究對象,經試驗確定reAuAxe和GH11家族reAuXyn11A在酶量比為5∶1,酶解時間為2 h,酶解溫度為40℃,pH為5.0,料液質量體積比為1 g∶60mL時還原糖的生成量比木聚糖酶單獨作用增加了46%。而 reAuAxe和GH10家族reAuXyn10A酶活力比為5∶1時在pH 5.5、40℃、料液質量體積比1 g∶60 mL、水解2 h的條件下還原糖的生成量比木聚糖酶單獨作用增加了16%。由此可見,乙酰木聚糖酯酶與GH11家族reAuXyn11A協同作用效果更好。
[1]謝響明,孫曉霞,吳玉英,等.綠色糖單孢菌產木聚糖酶規律及其耐堿耐熱性的初步研究 [J].生命科學研究,2005,9(1):55-59. XIE Xiangming,SUN Xiaoxia,WU Yuying,et al.Studies of xylanase from Saccharomonospora viridis and analysis of its thermostability and alkali-tolerance[J].Life Science Research,2005,9(1):55-59(in chinese).
[2]Beg Q K,KapoorM,Mahajan L,etal.M icrobialxylanasesand their industrialapplications:a review[J].Applied M icrobiology and Biotechnology,2001,56(3-4):326-338.
[3]Sunna A,Antranikian G.Xylanolytic enzymes from fungiand bacteria[J].Critical Reviews in Biotechnology,1997,17(1):39-67.
[4]Puls J.Chem istry of hemicelluloses:relationship between hem icellulose structure and enzymes required for hydrolysis[J]. Macromolecular Symposia,1997,120(1):183-196.
[5]Tang CD,Guo J,Wu M C,etal.Cloning and bioinformaticsanalysisof a novelacidophilicβ-mannanase gene,Auman5A,from Aspergillus usamii YL-01-78[J].W orld Journal of M icrobiology and Biotechnology,2011,27(12):2921-2929.
[6]De Vries R P,Visser J.Aspergillus enzymes involved in degradation of plant cellwall polysaccharides[J].M icrobiology and M olecular Biology Reviews,2001,65(4):497-522.
[7]Biely P,Cote G L,Kremnicky L,etal.Action ofacetylxylan esterase from Trichoderma reesei on acetylatedmethylglycosides[J]. FEBS Letters,1997,420(2):121-124.
[8]Wang JQ,Zhang H M,Wu M C,et al.Cloning and sequence analysis of a novel xylanase gene,Auxyn10A,from Aspergillus usamii[J].Biotechnology Letters,2011,33(5):1029-1038.
[9]Cantarel B L,Coutinho PM,Rancurel C,et al.The Carbohydrate-Active EnZymes database(CAZy):an expert resource for glycogenom ics[J].Nucleic Acids Research,2009,37(1):233-238.
[10]Faulds C B,MandalariG,Curto RB L,etal.Synergy between xylanases from glycoside hydrolase family 10 and family 11 and a feruloyl esterase in the release of phenolic acids from cereal arabinoxylan[J].App lied M icrobiology and Biotechnology,2006,71(5):622-629.
[11]Várnai A,Huikko L,Pere J,et al.Synergistic action of xylanase and mannanase improves the total hydrolysis of softwood[J]. Bioresource Technology,2011,102(19):9096-9104.
[12]Mukherjee G,Singh R K,M itra A,et al.Ferulic acid esterase production by Streptomyces sp[J].Bioresource Technology,2007,98(1):211-213.
[13]Gong Y Y,Yin X,Wu M C,etal.Cloning,expression of a feruloylesterase from Aspergillus usamii E001 and itsapplicability in generating ferulic acid from wheatbran[J].Journal of IndustrialM icrobiology and Biotechnology,2013,40(12):1433-1441.
[14]Krastanova I,Guarnaccia C,Zahariev S,etal.Heterologousexpression,purification,crystallization,X-ray analysisand phasing of the acetyl xylan esterase from Bacillus pumilus[J].Biochim ica et Biophysica Acta:Proteins and Proteom ics,2005,1748(2):222-230.
[15]Koseki T,M iwa Y,Akao T,et al.An Aspergillus oryzae acetyl xylan esterase:Molecular cloning and characteristics of recombinantenzyme expressed in Pichia pastoris[J].Journal of Biotechnology,2006,121(3):381-389.
[16]Huy N D,Thiyagarajan S,Kim DH,et al.Cloning and characterization of a novel bifunctional acetyl xylan esterase w ith carbohydrate bindingmodule from Phanerochaete chrysosporium[J].Journal of Bioscience and Bioengineering,2013,115(5):507-513.
[17]Zhang H M,Wang J Q,Wu M C,et al.Optimized expression,purification and characterization of a family 11 xylanase (AuXyn11A)from Aspergillus usamii E001 in Pichia pastoris[J].Journal of the Science of Food and Agriculture,2014,94 (4):699-706.
[18]Wang JQ,Yin X,Wu M C,etal.Expression of a family 10 xylanase gene from Aspergillus usamii E001 in Pichia pastoris and characterization of the recombinantenzyme[J].Journal of IndustrialM icrobiology&Biotechnology,2013,40(1):75-83.
[19]FauldsCB,MandalariG,Lo Curto RB,etal.Synergy between xylanases from glycoside hydrolase fam ily 10 and fam ily 11 and a feruloyl esterase in the release of phenolic acids from cereal arabinoxylan[J].App lied M icrobiology and Biotechnology,2006,71(5):622-629.
Combinative Degradation of Xylan with Acetyl Xylan Esterase and Xylanase
ZHU Tiandi1,HE Yao1,YANG Biao2,LIU Jiachi2,WUMinchen*2
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi214122,China)
The synergetic effect of the recombinant acetylxylan esterase and xylanase from Aspergillus usamii(abbreviated as reAuAxe,reAuXyn11A,reAuXyn10A,respectively)was investigated.Thefermentationof PichiapastorisGS115/Auaxe,GS115/Auxyn11Aand GS115/Auxyn10A was carried out using methanol as inducer and reAuAxe,reAuXyn11A and reAuXyn10A were successfully expressed.The amounts on the release of reducing sugar were optim ized w ith enzyme concentration when incubated for 2 h at the optimal pH under 40℃w ith the solid-liquid ratio of 1 g∶60m L.A better synergistic effectwas found when acetylxylan esterase and reAuXyn11A were combined.Comparing to use xylanase alone,the released reduce sugar could increaseby 46%when reAuAxeand reAuXyn11A wereaddedw ith a ratio of5∶1.The removalof the O-acetylgroups from the xylose residuesby acetylxylan esterasewasnecessary and important for the efficiency improvementof xylan hydrolysis.
acetylxylan esterase,xylanase,synergistic effect,xylan
Q 55
A
1673—1689(2016)03—0375—06
2014-07-01
國家自然科學基金項目(31101229)。
鄔敏辰(1962—),男,江蘇無錫人,理學博士,教授,博士研究生導師,主要從事酶工程與基因工程研究。E-mail:biowmc@126.com

