鋰離子電池電解質鋰鹽的研究進展
劉 旭,楊續來(合肥國軒高科動力能源股份公司,安徽合肥230011)
鋰離子電池電解質鋰鹽的研究進展
劉旭,楊續來
(合肥國軒高科動力能源股份公司,安徽合肥230011)
按照鋰離子電池對電解液的要求,即較高的離子電導率、良好的熱穩定性、較低的化學活性和優良的環境適應性,總結了鋰離子電池電解液中無機鋰鹽和有機鋰鹽的研究進展,對未來的鋰鹽發展進行了展望。
鋰離子電池;電解液;鋰鹽
電解液[1-2]作為鋰離子電池的四大關鍵材料之一,其發展制約著鋰離子電池性能的提升。對于鋰離子電池電解液來說,理想的電解質鋰鹽應至少滿足以下要求:(1)完全溶解并解離于非水溶劑中,解離的離子能夠在介質中自由遷移;(2)陰離子在正極不發生氧化分解;(3)陰離子不與電解液溶劑發生反應;(4)陰離子和陽離子不與電池其他組分發生反應;(5)陰離子應無毒并具有較高的熱力學穩定性。本文對鋰離子電池電解質鋰鹽的研究進展進行綜述,并對其發展前景進行展望。
1 無機電解質鋰鹽
由于鋰離子的半徑較小,大多數結構簡單的鋰鹽比如鹵化鋰LiX(X=Cl,F)和Li2O在非水有機溶劑中很難滿足最小溶解度的要求,當陰離子被路易斯軟堿取代時(Br-,I-,S2-, R-CO2-),鋰鹽的溶解度增加,但氧化穩定性降低 (<4 Vvs. Li),同樣不能達到鋰電池電解液的使用要求。滿足最小溶解度要求的鋰鹽大多具備復雜的陰離子基團,這些陰離子基團由被路易斯酸穩定的簡單陰離子組成,包括LiPF6、LiClO4、LiBF4、LiAsF6。
1.1六氟磷酸鋰(LiPF6)
與其他無機鋰鹽相比,LiPF6的單一性質并不是最好的,比如在一般的碳酸酯類溶劑中,LiPF6的離子電導率低于LiAsF6[3],解離常數低于LiIm,離子遷移率低于LiBF4,熱力學穩定性較其他大多數鋰鹽差,氧化穩定性低于LiAsF6[4],與Li-ClO4、LiIm、LiTf相比,更易與水起反應。但除了LiPF6之外,任何一種鋰鹽都不能同時滿足非水電解液電解質的各種要求:較高的溶解度和解離度,較大的離子電導率,較好的熱力學和化學穩定性,較高的電化學穩定性。LiPF6的缺點是對水分、溫度和溶劑非常敏感,當微量水分存在時,LiPF6會發生下列反應:
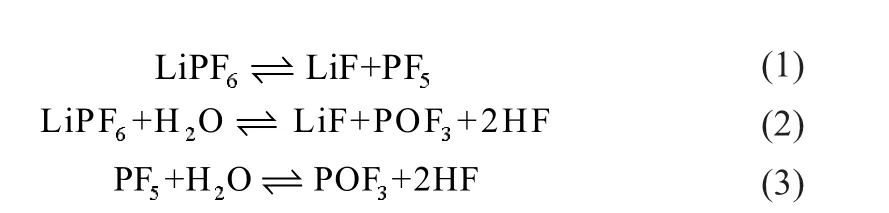
盡管LiPF6的化學敏感性限制了其應用范圍,但其仍是商業鋰離子電池鋰鹽的首選。自1990年Sony生產第一代商業鋰離子電池起,如EC是不可或缺的溶劑組分一樣,LiPF6是鋰離子電池電解液溶質不可缺少的組分[5]。
1.2四氟硼酸鋰(LiBF4)
與其他鋰鹽相比,LiBF4作為鋰鹽具有毒性低、安全性高等優點,且BF4-具有較高的遷移率,但LiBF4的解離常數較低,導致LiBF4基電解液的離子電導率較低,阻礙了其工業化應用。同時,LiBF4的抗氧化電位在5.0 V左右,略低于LiPF6[4]。Zhang[6]將鋰離子電池中的LiPF6替換為LiBF4,制備的鋰離子電池不僅能夠承受50℃的高溫,而且低溫性能得到改善。
1.3高氯酸鋰(LiClO4)
基金支持:“863”計劃(2012AA110407);安徽省科技攻關計劃(1301021011)
LiClO4的溶解度和電導率較高,它的EC/DMC溶液的電導率約為9.0 mS/cm(20℃),并且在尖晶石結構的正極表面上可以承受5.1 V的高電壓[3]。研究發現,在LiClO4基電解液中,石墨負極或鋰負極表面均可形成SEI膜,其阻抗小于LiPF6或LiBF4電解液的SEI膜[7]。與其他鋰鹽相比,LiClO4對水的敏感性較低。然而,高氯酸鹽中氯的化合價為+7價,屬于強氧化劑,在高溫或大電流充電時,易與有機溶劑發生劇烈反應,阻礙了實際應用[8],但由于容易處理且價格便宜,LiClO4仍用于各種實驗室測試。
1.4六氟砷酸鋰(LiAsF6)
在碳酸酯類溶劑中,LiAsF6具有較高的離子電導率,且LiAsF6基電解液也會在鋰或石墨負極上生成SEI膜,其組成主要包括烷基碳酸鹽或Li2CO3,與LiAsF6結構相似的LiPF6或LiBF4的SEI膜成分中則含有LiF,這是因為較強的As-F鍵阻止了LiAsF6的水解反應[9]。研究表明,陰離子AsF6-的氧化穩定性較高,在合適的酯溶劑中,含有LiAsF6的電解液在不同的正極表面可以承受4.5 V的高壓而保持穩定[3]。對于鋰離子電池來說,LiAsF6較高的還原和氧化穩定性使之成為非常具有前景的鋰鹽,但LiAsF6的毒性阻礙了其在商業電池中的應用。目前,LiAsF6主要應用在實驗室的電池測試中。
2 有機電解質鋰鹽
這類鋰鹽通常包括全氟代烷基磺酸鋰和氟代烷基磺酰基鋰。與無機電解質鋰鹽相比,有機電解質鋰鹽在較低介電常數的溶劑中,仍具有較高的解離常數,且強吸電子基能夠促進該類鋰鹽在非水溶劑中的溶解。
2.1全氟代烷基磺酸鋰
與LiPF6相比,全氟代烷基磺酸鋰具有較高的抗氧化性、熱力學穩定性、無毒且對溶劑中的微量水分不敏感等優點[4]。三氟甲基磺酸鋰(LiTf)作為電解質鋰鹽的一個主要缺點是其在非水溶劑中的離子電導率較其他鋰鹽低。這是LiTf較低的解離常數與溶劑較低的介電常數,以及LiTf中等的離子遷移數共同導致的[10]。Ishikawa M等[11]利用碳纖維作負極,含有LiTf的不同溶劑體系作電解液,制備的鋰電池表現出優異的庫侖效率和放電容量。然而,當LiTf用作電解質鋰鹽時,鋁箔集流體在~2.7 V時就會發生氧化反應,其電流密度約為20 mA/cm2,導致嚴重的腐蝕,阻礙了LiTf在鋰離子電池電解液中的應用[12]。
2.2二(三氟甲基磺酰基)亞胺鋰(LiIm)及其衍生物
LiIm具有安全、離子電導率較高等優點,且熱力學穩定性非常好,該鹽的分解溫度為360℃。Ue[13]對LiIm的離子進行了研究,結果發現即使在低介電常數溶劑中,LiIm也能夠很好地解離,但由于陰離子空間結構較大,導致在給定的溶劑體系中,含有LiIm電解液的粘度高于含有其他鋰鹽的電解液,因此LiIm的離子電導率處于中等水平。Ue等[4]在GC電極上對LiIm的電化學穩定性進行了測試,結果表明,其可承受的氧化電壓為5.0 V(vs.Li),低于LiBF4和LiPF6的氧化電壓上限。阻礙LiIm應用的是含有該鋰鹽的電解液會嚴重腐蝕鋁箔[12]。研究人員通過添加能夠鈍化鋁箔的鹽作為LiIm的添加劑,或者延長全氟代烷基鏈的長度對亞胺陰離子進行結構修飾等,改善了LiIm對鋁箔的腐蝕[14]。雖然LiIm還沒有在鋰離子電池中得到應用,但它仍受到研究人員的廣泛關注,尤其是在聚合物電解質領域[15]。
2.3三(三氟甲烷磺酰基)甲基化鋰(LiMe)
該鋰鹽含有三個全氟代的甲磺酰基,因此陰離子的負電荷高度離域,鋰鹽LiMe可以在多種非水介質中溶解,其溶液的離子電導率高于LiIm溶液[16]。LiMe的熱重分析(TGA)研究表明,其在340℃以下不會分解,相應地,含有該鋰鹽的電解液在100℃可以保持穩定。在THF溶液中,GC電極的循環伏安結果顯示,LiMe主要的氧化分解發生在4.0 V左右,這種分解反應可能是由溶劑THF引起而非鋰鹽陰離子,但LiMe在其他更穩定溶劑中的電化學穩定性還缺乏相關報道[16]。研究表明,在各種LiMe基電解液中,當電位在4.5 V以上時,Al箔發生了腐蝕,但腐蝕的程度不如LiIm電解液中嚴重[17]。
2.4攜帶芳環配體的硼酸鋰
20世紀90年代中期,Barthel研發了一類新型鋰鹽,這種鋰鹽含有與各種芳環配體螯合的硼酸陰離子[18]。這類鋰鹽熱力學性質穩定,但對水分敏感,它們在非水介質中的溶解度與芳環配體的取代基有關,而離子電導率則分布在0.6~11.1 mS/cm。研究發現未取代的硼酸鹽氧化分解電位在3.6 V,而含有氟代或磺酰基芳環配體硼酸鹽的氧化分解電位在4.60 V[18],表明硼酸鹽陰離子的吸電子取代基越多,氧化電位越高,穩定性越好。同時,鋰鹽的分解產物能夠有效地鈍化電極表面。因此,雖然這些鋰鹽陰離子本來的氧化電位不高(~4.0 V),但在隨后的掃描中,它們的穩定性可以保持到4.50 V。
2.5攜帶非芳環配體的硼酸鋰
與含芳環配體的硼酸鋰相比,非芳環配體的取代基體積較小,具有較高的離子電導率和氧化穩定性,而熱力學穩定性則與不含芳環的硼酸鋰相當。這些鋰鹽易溶于具有中等介電常數的介質中,其離子電導率略低于目前應用的電解液[19]。這類鋰鹽離子電導率與鋰鹽濃度的關系也和人們所熟悉的LiPF6或LiBF4溶液中的拋物線關系不同:在鋰鹽濃度0.5~1.0 mol/L范圍內,硼酸鋰溶液的離子電導率幾乎保持不變,這種離子電導率與濃度無關的現象有利于該類物質的實際應用。這類鋰鹽的代表是二草酸硼酸鋰LiBOB。研究發現LiBOB與碳酸酯混合溶劑組成的電解液能夠完全滿足鋰離子電池的一系列嚴格要求:(1)它在復合正極材料表面的氧化穩定性高達4.3 V;(2)它在石墨負極材料表面上能夠形成SEI保護膜,支持鋰離子的可逆嵌入/脫嵌;(3)它使Al箔集流體的穩定電位高達6.0 V。同時LiBOB還具有熱力學穩定、制造成本低、環境友好等優點。鋰離子全電池的長期循環測試表明,LiBOB基電解液的穩定性良好:在~200周的循環中,鋰電池的容量沒有衰減[20]。
此外,LiBOB具有獨特的化學還原特性。在LiBOB之前,單獨的電解液溶質不能使PC和石墨負極聯用,然而LiBOB與純PC組成的溶液成功實現了鋰離子在多種石墨負極材料上可逆地嵌入/脫嵌,且電池容量利用率和庫侖效率與目前使用的電解液相當,這是因為BOB陰離子通過單電子還原機理參與了SEI膜的形成[21]。
2.6螯合磷酸鋰
如果將各種硼酸鋰鹽看作是對全氟代硼酸鋰(LiBF4)的結構改性,那么LiPF6也可以進行類似的結構修飾。Handa等[22]報道了螯合磷酸鋰的合成:六價磷(Ⅵ)被三個具有雙配位基的配體螯合。這種磷酸鹽的熱力學穩定性與相應的硼酸鋰類似,且在非水介質中的離子電導率處于中等。該鋰鹽的氧化電位在3.7 V以下,適用于V2O5等低電位正極材料,電池的實際容量接近于理論值。同時,芳環配體的氟化有助于離子電導率和氧化穩定性的提升,比如含有全氟代芳環配體的磷酸鹽與EC/DEC制備的電解液,其在Pt電極上的氧化分解電位為4.3 V。
2.7氟代烷基磷酸鋰(LiFAP)
氟代烷基磷酸鋰通過全氟代烷基部分取代氟原子對PF6-陰離子進行結構改性,以惰性的P-C鍵替換活性較高的P-F鍵,提升鋰鹽的化學穩定性和熱力學穩定性,同時具備良好的溶解性和離子電導率。研究發現[23]帶有三個五氟乙基的氟代烷基磷酸鋰,其陰離子對水分的敏感性極大降低。LiFAP在碳酸酯混合溶劑中的離子電導率略低于LiPF6,但其在Pt電極上氧化穩定性與LiPF6相當,主要的氧化反應發生在~5.0 V。對比研究了[24]LiFAP、LiPF6和LiBeti基電解液在負極和正極材料上的界面特性,結果發現,在石墨負極和尖晶石正極材料上,LiFAP基電解液具有較高的容量利用率和較好的容量保持能力,但倍率性能較差,其原因是FAP陰離子參與了負極SEI膜和正極表面膜的形成,表面層的阻抗較大。
2.8基于雜環陰離子的鋰鹽
這類鋰鹽包括4,5-二氰基-1,2,3-三唑酸鋰[25]和2-(三氟化硼)咪唑啉鋰[LiId][26]。前者用作聚合物電解液比如PEO的鋰鹽,后者可看作是路易斯酸堿(LiBF4和弱有機堿)的加合物。這類鋰鹽極易溶于較低或中等介電常數的介質中,離子電導率與LiPF6基電解液相當。Barbarich[26]研究表明,與LiPF6相比,LiId的氧化穩定性高,與正極材料LiNi0.8Co0.2O2的兼容性更好。
3 總結
目前,LiPF6仍是商業鋰離子電池電解液中電解質鋰鹽的首選,其他無機鋰鹽和有機鋰鹽由于不能同時滿足離子電導率、熱穩定性和化學穩定性以及環境友好的要求,它們在鋰離子電池中的實際應用難以在短期內實現。然而,LiPF6與其他鋰鹽復配,以改善鋰離子電解液的各種性能,越來越受研究者的重視[21,27],這或許是提升鋰電池電解液性能的又一途徑。
[1]JOHN B,GOODENOUGH,YOUNGSIK K.Challenges for rechargeable Li batteries[J].Chemistry of Materials,2010,22:587-603.
[2]HAIK O,AMALRAJ F S,HIRSHBERG D,et al.Thermal processes in the systems with Li-battery cathode materials and LiPF6-based organic solutions[J].Journal of Solid State Electrochemistry,2014, 18(8):2333-2342.
[3]TARASCON J M,GUYOMARD D.New electrolyte compositions stable over the 0 to 5 V voltage range and compatible with the Li1+xMn2O4/carbon Li-ion cells[J].Solid State Ionics,1994,69(3/4): 293-305.
[4]UE M,MURAKAMI A,NAKAMURA S.Anodic stability of several anions examined by ab initio molecular orbital and density functional theories[J].Journal of the Electrochemical Society,2002,149 (12):A1572-A1577.
[5]XU K.Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J].Chemical Review,2004,104:4303-4417.
[6]ZHANG S S,XU K,JOW T R.A new approach toward improved low temperature performance of Li-ion battery[J].Electrochemistry Communications,2002,4(11):928-932.
[7]EIN-ELI Y,THOMAS S R,KOCH V R,et al.Ethylmethylcarbonate, a promising solvent for Li-ion rechargeable batteries[J].Journal of the Electrochemical Society,1996,143(12):L273-L277.
[8]JASINSKI R,CARROLL S.Thermal stability of a propylene carbonate electrolyte[J].Journal of the Electrochemical Society,1970, 117(2):218.
[9]AURBACH D,EINELY Y,ZABAN A.The surface-chemistry of lithium electrolytes in alkyl carbonate solutions[J].Journal of the Electrochemical Society,1994,141(1):L1-L3.
[10]MCKENZIE I,HARADA M,KIEFL R F,et al.Beta-NMR measurements of lithium ion transport in thin films of pure and lithium-salt-doped poly(ethylene oxide)[J].Journal of the American Chemical Society,2014,136(22):7833-7836.
[11]ISHIKAWA M,MORITA M,ASAO M,et al.Charge discharge characteristics of carbon-fiber with graphite structure in organic electrolytes containing lithium trifluoromethanesulfate and lithium hexafluorophosphate[J].Journal of the Electrochemical Society, 1994,141(5):1105-1108.
[12]KRAUSE L J,LAMANNA W,SUMMERFIELD J,et al.Corrosion of aluminum at high voltages in non-aqueous electrolytes containing perfluoroalkylsulfonyl imides;new lithium salts for lithiumion cells[J].Journal of Power Sources,1997,68(2):320-325.
[13]UE M.Mobility and ionic association of lithium and quaternary ammonium-salts in propylene carbonate and gamma-butyrolactone [J].Journal of the Electrochemical Society,1994,141(12):3336-3342.
[14]KANAMURA K,UMEGAKI T,SHIRAISHI S,et al.Electrochemical behavior of Al current collector of rechargeable lithium batteries in propylene carbonate with LiCF3SO3,Li(CF3SO2)2N,or Li-(C4F9SO2)(CF3SO2)N[J].Journal of the Electrochemical Society, 2002,149(2):A185-A194.
[15]TARASCON J M,ARMAND M.Issues and challenges facing rechargeable lithium batteries[J].Nature,2001,414(6861):359-367.
[16]DOMINEY L A,KOCH V R,BLAKLEY T,et al.Nonaqueous thin film batteries and“supercapacitors”employing Li/LiMOxredox couples[J].Electrochemica Acta,1992,37:1551-1554.
[17]YANG H,KWON K,DEVINE T M,et al.Aluminum corrosion in lithium batteries-an investigation using the electrochemical quartz crystal microbalance[J].Journal of the Electrochemical Society, 2000,147(12):4399-4407.
[18]BARTHEL J,SCHMID A,GORES H J.A new class of electrochemically and thermally stable lithium salts for lithium battery electrolytes V.synthesis and properties of lithium bis[2,3-pyridinediolato(2-)-O,O']borate[J].Journal of the Electrochemical Society,2000,147(1):21-24.
[19]VIDEA M,XU W,GEIL B,et al.High Li+self-diffusivity and transport number in novel electrolyte solutions[J].Journal of the Electrochemical Society,2001,148(12):A1352-A1356.
[20]XU K,ZHANG S S,LEE U,et al.LiBOB:is it an alternative salt for lithium ion chemistry?[J].Journal of Power Sources,2005,146 (1):79-85.
[21]ZHANG L F,CHAI L L,ZHANG L,et al.Synergistic effect between lithium bis(fluorosulfonyl)imide(LiFSI)and lithium bis-oxalato borate(LiBOB)salts in LiPF6-based electrolyte for high-performance Li-ion batteries[J].Electrochimica Acta,2014,127:39-44.
[22]HANDA M,SUZUKI M,SUZUKI J,et al.A new lithium salt with a chelate complex of phosphorus for lithium battery electrolytes[J]. Electrochemical and Solid State Letters,1999,2(2):60-62.
[23]SCHMIDT M,HEIDER U,KUEHNER A,et al.Lithium fluoroalkylphosphates:a new class of conducting salts for electrolytes for high energy lithium-ion batteries[J].Journal of Power Sources, 2001,97/98:557-560.
[24]GNANARAJ J S,ZINIGRAD E,LEVI M D,et al.A comparison among LiPF6,LiPF3(CF2CF3)3(LiFAP),and LiN(SO2CF2CF3)2(LiBETI)solutions:electrochemical and thermal studies[J].Journal of Power Sources,2003,119:799-804.
[25]EGASHIRA M,SCROSATI B,ARMAND M,et al.Lithium dicyanotriazolate as a lithium salt for poly(ethylene oxide)based polymer electrolytes[J].Electrochemical and Solid State Letters, 2003,6(4):A71-A73.
[26]Barbarich T J,Driscoll P F.A lithium salt of a lewis acid-base complex of imidazolide for lithium-ion batteries[J].Electrochemical and Solid State Letters,2003,6(6):A113-A116.
[27]SANCHEZ R N,MARTINS V L,ANDO R A,et al.Physicochemical properties of three ionic liquids Containing a tetracyanoborate anion and their lithium salt mixtures[J].Journal of Physical Chemistry B,2014,118(29):8772-8781.
Research status of lithium salt for lithium ion battery
LIU Xu,YANG Xu-lai
(Hefei Guoxuan High-Tech Power Energy Co.,Ltd.,Hefei Anhui 230011,China)
According to the requirements of electrolyte for Lithium ion battery,which were high ionic conductivity,good thermal stability,low chemical activity and good environmental adaptability,the research progress of inorganic lithium salt and organic lithium salt for nonaqueous liquid electrolyte were summarized.The future of lithium salt for Lithium ion battery was prospected.
lithium ion battery;electrolyte;lithium salt
TM 912
A
1002-087 X(2016)01-0218-03
2015-06-18
劉旭(1988—),男,安徽省人,碩士,主要研究方向為鋰電池電解液。

