乙異羥肟酸對Fe(Ⅲ)與羥胺反應動力學的影響
石四維,左 臣,鄭衛芳,晏太紅,呂洪彬,劉 方,朱冬冬
中國原子能科學研究院 放射化學研究所,北京 102413
?
乙異羥肟酸對Fe(Ⅲ)與羥胺反應動力學的影響
石四維,左臣,鄭衛芳*,晏太紅,呂洪彬,劉方,朱冬冬
中國原子能科學研究院 放射化學研究所,北京102413
采用分光光度法,對硝酸體系中羥胺(HAN)還原Fe(Ⅲ)的動力學進行了研究,得出了反應速率方程為-dc(Fe(Ⅲ))/dt=k·c0.56(Fe(Ⅲ))·c0.88(HAN),表觀速率常數k=-(4.08±0.15)×10-4(mol/L)-0.44·s-1;并研究了乙異羥肟酸(AHA)與Fe(Ⅲ)絡合對該氧化還原反應的影響,結果顯示,反應速率方程變為-dc(Fe(Ⅲ))/dt=-(2.83×10-4-536c3(AHA))·c0.76(Fe(Ⅲ))·c0.60(HAN),反應速率常數隨AHA濃度增大而降低,且與AHA濃度的3次方成線性關系,Fe(Ⅲ)濃度對反應速率影響增大,而HAN濃度對反應速率影響減小。
Fe(Ⅲ);羥胺;乙異羥肟酸;絡合;氧化還原反應
-dc(Fe(Ⅲ))/dt=k·c0.56(Fe(Ⅲ))·c0.88(HAN)
The apparent rate constant is -(4.08±0.15)×10-4(mol/L)-0.44·s-1. The effects of acethydroxamic acid on the reaction were also studied. The apparent rate equation is converted into:
-dc(Fe(Ⅲ))/dt=-(2.83×10-4-536c3(AHA))·c0.76(Fe(Ⅲ))·c0.60(HAN)
The apparent rate constant decreases with the increase of the concentration of AHA and is linearly related to the cubic of the concentration of AHA. The effect of the concentration of Fe(Ⅲ) on the apparent rate increases, while that of the concentration of HAN decreases.
羥胺(HAN)是在核燃料后處理流程中應用廣泛的還原劑[1],其主要作用是將易被TBP萃取劑萃取的Pu(Ⅳ)還原為不易被萃取的Pu(Ⅲ),實現鈾、钚的分離以及后續钚的凈化與濃縮。但在實際后處理過程中,由于酸對設備的腐蝕,料液中會含有少量的Fe3+。Fe3+將會與羥胺發生氧化還原反應。Bengtsson[2]研究了高氯酸體系中無催化和使用Cu(Ⅱ)催化劑時HAN還原Fe3+的動力學。Vittal[3]研究了1,10-菲羅啉與Fe3+絡合后與HAN反應的動力學,并推測了其反應機理。
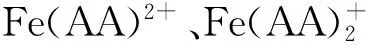
在后處理流程中,當Fe3+與AHA發生配位后,對HAN還原Fe3+的反應動力學影響的研究尚未見報道。本工作擬通過分光光度法研究硝酸體系中AHA與Fe3+的配位對Fe3+與HAN氧化還原反應的影響,為研究后處理流程中AHA對其他金屬離子的配位、還原等性質的影響提供參考。
1 實驗部分
1.1主要試劑與儀器
九水合硝酸鐵(Fe(Ⅲ))、硝酸、羥胺(HAN)、乙異羥肟酸(AHA)均為國藥集團生產試劑,分析純。
Lambda45分光光度計,美國PE公司;HX-101恒溫水浴槽,北京長流科學儀器公司。
1.2實驗方法
1.2.1操作步驟將含有一定濃度Fe(Ⅲ)的硝酸溶液或Fe(Ⅲ)-AHA的硝酸溶液放入光程為1 cm的石英比色皿中,將比色皿放入分光光度計的恒溫測量樣品室中,向比色皿中再加入一定濃度的HAN溶液,攪拌后,以0.1 mol/L硝酸溶液為參比,連續測量Fe(Ⅲ)在最大吸收波長處(289 nm)的吸光度值。
1.2.2計算方法Fe3+與HAN反應的方程式為:
其反應速率方程為(維持氫離子濃度不變且Fe濃度較低的情況下不考慮H+及Fe2+的影響):
將式兩端同時取對數得lnr=lnk+nlnc(Fe(Ⅲ))+mlnc(HAN),其中k為表觀速率常數,n為Fe(Ⅲ)的反應級數,m為HAN反應級數。在上式中,k、m、n均為常數,因此當維持初始HAN濃度不變,即c0(HAN)不變時,反應速率方程可寫成:
lnr0=nlnc0(Fe(Ⅲ))+(lnk+mlnc0(HAN))
改變初始Fe(Ⅲ)濃度,此時初始反應速率的對數lnr0與初始Fe(Ⅲ)濃度的對數值lnc0(Fe(Ⅲ))呈線性關系,斜率為n;同樣,當維持初始Fe(Ⅲ)濃度不變,即c0(Fe(Ⅲ))不變時,改變初始HAN濃度,此時初始反應速率的對數lnr0又與初始HAN濃度的對數值lnc0(HAN)應為線性關系,斜率為m。據此則可分別測量并擬合線性方程得到Fe(Ⅲ)與HAN的反應級數。
2 結果與討論
2.1Fe(Ⅲ)與HAN反應動力學
2.1.1Fe(Ⅲ)-硝酸溶液的標準曲線配制一系列Fe(Ⅲ)初始濃度分別為2.5、2.2、2.0、1.8、1.5、1.2、1.0 mmol/L,硝酸初始濃度均為0.1 mol/L的硝酸鐵-硝酸溶液。將上述硝酸鐵-硝酸溶液分別置于比色皿中測定250~800 nm區間吸光度值,示于圖1。由圖1可知,在所測區間Fe(Ⅲ)只有一個吸收峰,最大吸收波長為289 nm。根據溶液中Fe(Ⅲ)濃度及最大吸光度值得到Fe(Ⅲ)-硝酸溶液的標準曲線,示于圖2。由圖2看出,該標準曲線解析式為A=340c(Fe(Ⅲ))+0.117,R2=0.997。
2.1.2Fe(Ⅲ)濃度對反應速率的影響在20 ℃、0.1 mol/L硝酸條件下,配制一系列Fe(Ⅲ)初始濃度分別為1.0、1.2、1.5、1.8、2.0、2.2、2.5 mmol/L,羥胺初始濃度為0.02 mol/L,硝酸初始濃度為0.1 mol/L的溶液,測定溶液中Fe(Ⅲ)在289 nm處的吸光度值隨時間的變化。將吸光度值換算為濃度值后,得到20 ℃下、初始Fe(Ⅲ)濃度為2.5 mmol/L、初始HAN濃度為0.02 mol/L時,Fe(Ⅲ)濃度隨時間變化曲線,示于圖3。由圖3可見,Fe(Ⅲ)濃度隨時間增加而降低,下降趨勢近似指數衰減,因此本工作采用指數衰減方程對Fe(Ⅲ)濃度降低20%時間內曲線進行擬合,得到形為c=a×exp(-t/b)+p的指數衰減表達式,其中a、b、p為常數,得到的擬合方程對t求導,則可得到t時刻時的反應速率rt。對不同Fe(Ⅲ)濃度隨時間變化曲線均擬合并求導,取時間t=0時,得到不同初始Fe(Ⅲ)濃度值時的初始反應速率r0。根據前述計算方法,以lnc0(Fe)對lnr0作圖(圖4),得到直線的斜率為0.56,R2=0.996,所以此反應對Fe(Ⅲ)為0.56級反應。
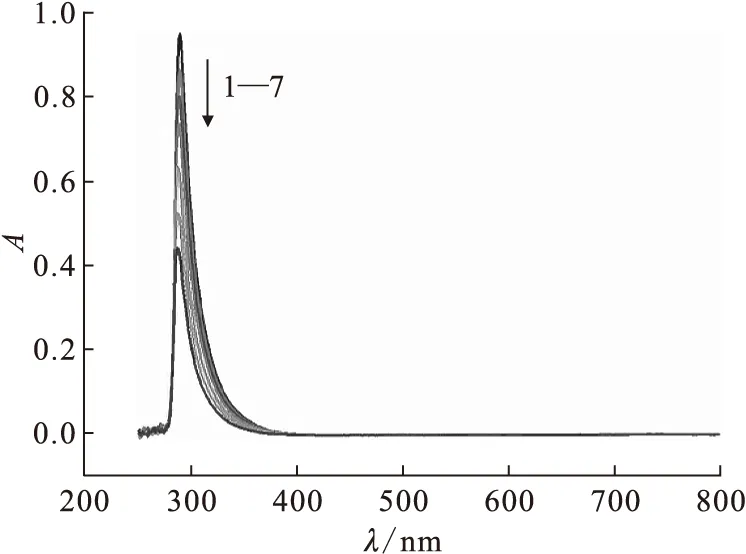
c0(Fe(Ⅲ)),mmol/L:1——2.5,2——2.2,3——2.0,4——1.8,5——1.5,6——1.2,7——1.0圖1 不同濃度Fe(Ⅲ)溶液吸收光譜(20 ℃)Fig.1 Absorbance spectrum of different Fe(Ⅲ) concentrations(20 ℃)

圖2 Fe(Ⅲ)標準曲線(20 ℃)Fig.2 Standard curve of Fe(Ⅲ)(20 ℃)

20 ℃,c0(Fe(Ⅲ))=2.5 mmol/L,c0(HAN)=0.02 mol/L,c0(HNO3)=0.1 mol/L圖3 Fe(Ⅲ)濃度隨時間變化曲線Fig.3 Variation of Fe(Ⅲ) concentration with time

20 ℃,c0(Fe(Ⅲ))=1.0~2.5 mmol/L,c0(HAN)=0.02 mol/L,c0(HNO3)=0.1 mol/L圖4 Fe(Ⅲ)的反應級數Fig.4 Reaction order of Fe(Ⅲ)
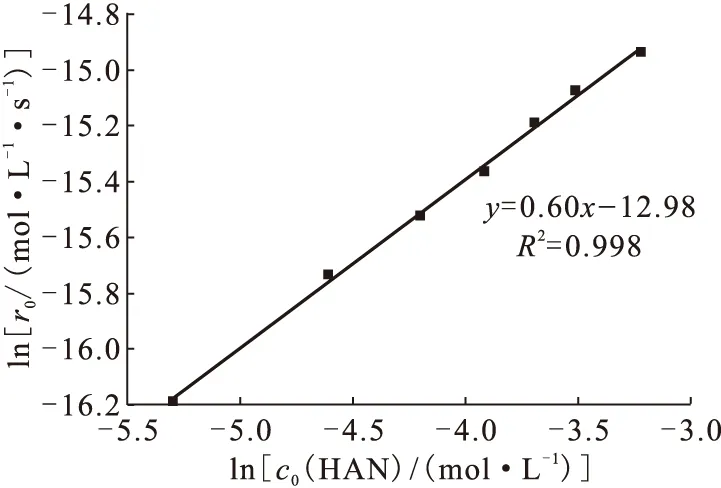
2.1.3羥胺初始濃度對反應速率的影響在20 ℃、0.1 mol/L硝酸條件下,用一系列初始濃度分別為5.0、10.0、15.0、20.0、25.0、30.0、40.0 mmol/L的HAN還原2.0 mmol/L Fe(Ⅲ),測定Fe(Ⅲ)在289 nm處的吸光度值隨時間的變化。依照前文所述,對Fe(Ⅲ)濃度隨時間變化曲線進行擬合,對得到的擬合方程求導,取時間t=0時,得到不同初始HAN濃度值時的初始反應速率。以lnc0(HAN)對lnr0作圖(圖5),得到直線的斜率為0.88,R2=0.998,所以此反應對HAN為0.88級反應。
綜上所述,反應速率方程為-dc(Fe(Ⅲ))/dt=k·c0.56(Fe(Ⅲ))·c0.88(HAN),計算得到不同起始條件下的表觀速率常數列于表1。實驗所得的反應速率方程與Bengtsson[10]、蘭天[11]等研究得到的反應速率方程均有所差異。Bengtsson[10]及蘭天[11]等研究的溶液體系中均存在一定量或大量Fe2+,Fe2+的存在對該氧化還原反應有極大的抑制作用,會影響該反應的速率,而本工作研究體系在反應起始階段未加入Fe2+,因此對反應的影響不同,同時蘭天研究的體系中酸度較高,H+是反應物之一,本工作在保持酸度不變的條件下忽略了其影響,但不同酸度條件下,H+對反應的影響可能有所不同,其具體影響機理尚待進一步的研究。

20 ℃,c0(Fe(Ⅲ))=2.0 mmol/L,c0(HAN)=5.0~40.0 mmol/L,c0(HNO3)=0.1 mol/L圖5 HAN的反應級數Fig.5 Reaction order of HAN
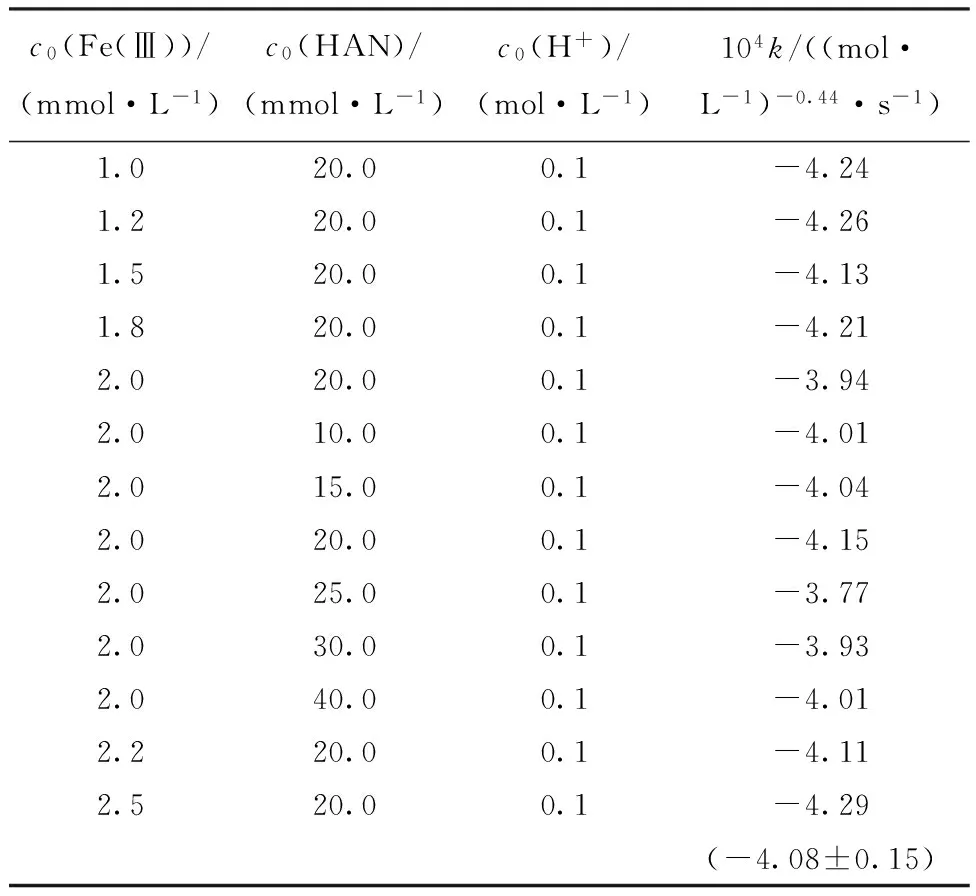
c0(Fe(Ⅲ))/(mmol·L-1)c0(HAN)/(mmol·L-1)c0(H+)/(mol·L-1)104k/((mol·L-1)-0.44·s-1)1.020.00.1-4.241.220.00.1-4.261.520.00.1-4.131.820.00.1-4.212.020.00.1-3.942.010.00.1-4.012.015.00.1-4.042.020.00.1-4.152.025.00.1-3.772.030.00.1-3.932.040.00.1-4.012.220.00.1-4.112.520.00.1-4.29(-4.08±0.15)
注:括號中數據為平均值
2.2加入配位劑AHA后對Fe(Ⅲ)與HAN反應的影響
2.2.1加入AHA后對吸光度值的影響由于AHA的加入,影響了Fe(Ⅲ)的吸收,Fe(Ⅲ)最大吸收峰偏移至288 nm,并在400~600 nm附近出現Fe(Ⅲ)-AHA配合物吸收峰,首先對標準曲線作校正再完成后續測量與計算。配制Fe(Ⅲ)初始濃度分別為2.5、2.2、2.0、1.8、1.5、1.2、1.0 mmol/L,硝酸初始濃度均為0.1 mol/L,AHA初始濃度均為4.0 mmol/L的溶液。將上述硝酸鐵-硝酸-AHA溶液分別置于比色皿中測定288 nm處溶液吸光度值(圖6)。根據溶液中Fe(Ⅲ)濃度及測得的吸光度值得到Fe(Ⅲ)-硝酸-AHA溶液的標準曲線,示于圖7。由圖7看出,該標準曲線解析式為A=436c(Fe(Ⅲ))+0.121,R2=0.999。

c0(Fe(Ⅲ)),mmol/L:1——2.5,2——2.2,3——2.0,4——1.8,5——1.5,6——1.2,7——1.0圖6 不同濃度Fe(Ⅲ)-4.0 mmol/L AHA溶液吸收光譜(20 ℃)Fig.6 Absorbance spectrum of different Fe(Ⅲ) concentrations with 4.0 mmol/L AHA(20 ℃)

圖7 Fe(Ⅲ)-4.0 mmol/L AHA溶液標準曲線(20 ℃)Fig.7 Standard curve of Fe(Ⅲ)-4.0 mmol/L AHA(20℃)
2.2.2Fe(Ⅲ)-AHA濃度對反應速率的影響在20 ℃、0.1 mol/L硝酸條件下,在一系列Fe(Ⅲ)初始濃度分別為1.0、1.2、1.5、1.8、2.0、2.2、2.5 mmol/L的溶液中加入4.0 mmol/L AHA,再分別與0.02 mol/L HAN反應,測定Fe(Ⅲ)在288 nm處的吸光度值隨時間的變化。依照前文所述,對Fe(Ⅲ)濃度隨時間變化曲線進行擬合,對得到的擬合方程求導,取時間t=0時,得到不同初始Fe(Ⅲ)-AHA濃度值時的初始反應速率。同樣以lnc0(Fe(Ⅲ))對lnr0作圖(圖8),得到直線斜率為0.76,R2=0.992,即加入AHA后,Fe(Ⅲ)表觀反應級數變為0.76。與未加入AHA時相比反應級數增大,即體系中加入AHA后,Fe(Ⅲ)濃度變化對反應速率影響增大。

20 ℃,c0(Fe(Ⅲ))=1.0~2.5 mmol/L,c0(HAN)=0.02 mol/L,c0(AHA)=4.0 mmol/L,c0(HNO3)=0.1 mol/L圖8 AHA存在時Fe(Ⅲ)反應級數Fig.8 Reaction order of Fe(Ⅲ) with the presence of AHA
2.2.3HAN初始濃度對Fe(Ⅲ)-AHA與HAN反應速率的影響在20 ℃、0.1 mol/L硝酸條件下,用初始濃度分別為5.0、10.0、15.0、20.0、25.0、30.0、40.0 mmol/L的HAN還原2.0 mmol/L Fe(Ⅲ)-4.0 mmol/L AHA,測定Fe(Ⅲ)在288 nm處的吸光度值隨時間的變化。依照前文所述,對Fe(Ⅲ)濃度隨時間變化曲線進行擬合,對得到的擬合方程求導,取時間t=0時,得到不同初始HAN濃度值時的初始反應速率。同樣以lnc0(HAN)對lnr0作圖,結果示于圖9。由圖9得到直線斜率為0.60,R2=0.998,即加入AHA后,HAN表觀反應級數變為0.60。與未加入AHA時相比反應級數降低,即體系中加入AHA后,HAN濃度變化對反應速率影響減小。AHA的加入使得反應速率方程變為-dc(Fe(Ⅲ))/dt=k′·c0.76(Fe(Ⅲ))·c0.60(HAN),計算得到AHA存在時不同起始條件下的表觀速率常數列于表2。
20 ℃,c0(Fe(Ⅲ))=2.0 mmol/L,c0(HAN)=5.0~40.0 mmol/L,c0(AHA)=4.0 mmol/L,c0(HNO3)=0.1 mol/L圖9 AHA存在時HAN反應級數Fig.9 Reaction order of HAN with the presence of AHA

c0(Fe(Ⅲ))/(mmol·L-1)c0(HAN)/(mmol·L-1)c0(H+)/(mol·L-1)c0(AHA)/(mmol·L-1)104k'/((mol·L-1)-0.36·s-1)1.020.00.14.0-2.311.220.00.14.0-2.331.520.00.14.0-2.271.820.00.14.0-2.392.05.00.14.0-2.502.010.00.14.0-2.582.015.00.14.0-2.482.020.00.14.0-2.442.025.00.14.0-2.542.030.00.14.0-2.552.040.00.14.0-2.452.220.00.14.0-2.312.520.00.14.0-2.31(-2.42±0.11)
注:括號中數據為平均值
2.2.4AHA初始濃度對Fe(Ⅲ)-AHA與HAN反應速率的影響在20 ℃、0.1 mol/L硝酸條件下,保持Fe(Ⅲ)初始濃度為2.0 mmol/L、HAN初始濃度為0.02 mol/L,分別加入初始濃度為6.0、5.0、4.5、4.0、3.5、3.0、2.5 mmol/L的AHA,測定Fe(Ⅲ)在288 nm處的吸光度值隨時間的變化。依照前文所述,對Fe(Ⅲ)濃度隨時間變化曲線進行擬合,并求導,當時間t=0時,得到不同初始AHA濃度值時的初始反應速率。以AHA濃度的3次方對反應速率的絕對值作圖(圖10),得到一條直線y=-0.466x+2.46×10-7,R2=0.996。將上述直線方程與AHA存在時的反應速率方程聯立可得表觀速率常數與AHA濃度關系為k′=-(2.83×10-4-536c3(AHA))。說明隨AHA濃度增大,反應速率降低,且k′與AHA濃度3次方成線性關系。

20 ℃,c0(Fe(Ⅲ))=2.0 mmol/L,c0(HAN)=0.02 mol/L,c0(AHA)=2.5~6.0 mmol/L,c0(HNO3)=0.1 mol/L圖10 AHA濃度對初始反應速率的影響Fig.10 Influence of AHA concentration on initial reaction rates
綜上,溫度為20 ℃、c0(HNO3)=0.1 mol/L時,反應速率方程變為:
文獻[10]報道當HAN過量時,Fe與HAN反應的機理為:
(1)
(2)
(3)
(4)
當加入AHA后,Fe(Ⅲ)與AHA發生絡合,溶液中自由Fe(Ⅲ)離子濃度降低,其電極電勢隨之降低,使得溶液中Fe(Ⅲ)離子氧化性變弱,進而會影響Fe(Ⅲ)與HAN的氧化還原反應,改變反應物的反應級數。在給定的Fe(Ⅲ)和AHA濃度比例和酸度條件下,溶液中主要以Fe3+和Fe(AA)2+形式存在[12-13],且AHA濃度越高,c(Fe(AA)2+)/c(Fe3+)比值越大。文獻[11]報道,當HAN過量時,Fe與HAN反應的速率控制步驟為反應(4)。根據實驗結果推測,當加入AHA后,反應速率控制步驟變為Fe(AA)2+的絡合與解離過程。
Fe(AA)2+的絡合與解離過程為:
當溫度和酸度一定時,Fe(Ⅲ)與HAN的反應速率主要受反應物濃度及AHA濃度影響。當AHA濃度增大時,一方面絡合物解離受到抑制,使得整體反應速率降低,另一方面c(Fe(AA)2+)/c(Fe3+)比值增大,自由Fe(Ⅲ)離子濃度降低,上述機理中方程式(2)的反應會受到Fe3+濃度比例降低的影響,也使得Fe(Ⅲ)與HAN的反應速率降低;當Fe3+濃度增大時,雖然解離過程也會受到抑制,但同時c(Fe3+)/c(Fe(AA)2+)比值也將增大,綜合結果有利于方程(2)的進行。加入AHA后,Fe3+反應級數由0.56增大為0.76,其物理意義表示Fe3+濃度變化對Fe(Ⅲ)與HAN反應速率的影響增大;而加入AHA后,HAN反應級數由0.88降低為0.60,其物理意義表示HAN濃度的變化對該絡合與解離過程的影響較小,HAN濃度的變化對Fe(Ⅲ)與HAN反應速率的影響減小。而AHA的加入既影響自由Fe3+離子濃度,同時對酸度也會有所影響,反應過程更加復雜,本工作目前只得到AHA濃度變化對反應速率方程影響數值上的關系,其內在機理尚待進一步的研究。
3 結 論
(1) 研究了HAN過量時,HAN與Fe(Ⅲ)的反應動力學。在20 ℃、c0(HNO3)=0.1 mol/L時,其反應速率方程為:
-dc(Fe(Ⅲ))/dt=
k·c0.56(Fe(Ⅲ))·c0.88(HAN),
表觀速率常數
k=-(4.08±0.15)×10-4(mol/L)-0.44·s-1。
(2) 研究了AHA對HAN與Fe(Ⅲ)反應動力學的影響。在20 ℃、c0(HNO3)=0.1 mol/L時,反應速率方程為:
-dc(Fe(Ⅲ))/dt=k′·c0.76(Fe(Ⅲ))·c0.60(HAN),
c(AHA)=4.0 mmol/L時表觀速率常數
k′=-(2.42±0.11)×10-4(mol/L)-0.36·s-1。
即體系中加入AHA后,Fe(Ⅲ)濃度變化對反應速率影響增大,而HAN濃度變化對反應速率影響減小。
(3) 在20 ℃、c0(Fe(Ⅲ))=2.0 mmol/L、c0(HAN)=0.02 mol/L、c0(HNO3)=0.1 mol/L時,HAN與Fe(Ⅲ)反應的表觀速率常數與AHA濃度關系為k′=-(2.83×10-4-536c3(AHA)),反應速率隨AHA濃度增大而降低,且與AHA濃度3次方成線性關系。
以上動力學方程可為進一步研究AHA在后處理萃取流程中的應用提供參考數據。
[1]任鳳儀,周鎮興.國外核燃料后處理[M].北京:原子能出版社,2004:148.
[2]Bengtsson G. A kinetic study of the reaction between iron(Ⅲ) and hydroxylamine in strongly acid perchloride solution[J]. Acta Chem Scand, 1973, 27: 1717-1724.
[3]Vittal A S P, Krishna Rao P V, Jagan Mohana Rao K. Kinetics of oxidation of hydroxylamine by iron(Ⅲ) in presence of 1, 10-phenanthroline[J]. React Kinet Catal Lett, 1983, 23: 175-179.
[4]Pereira C, Vandegrift G F, Regalbuto M C, et al. Lab-scale demonstrations of the UREX+1a process using spent fuel[C]∥Proceedings of WM-07, Tucson, A2, 2007.
[5]May I, Taylor R J, Brown G. Actinide complex-
ation in the PUREX process[J]. Czechoslovak Journal of Physics, 1999, 49: 597-601.
[6]Taylor R J, May I, Wallwork A L, et al. The application of formo- and aceto-hydroxamic acids in nuclear fuel reprocessing[J]. J Alloys Compds, 1998, 271-273: 534-537.
[7]Farkas E, Enyedy E A, Csoka H. A comparison between the chelating properties of some dihydro-xamic acids, desferrioxamine B and acetohydroxamic acid[J]. Polyhedron, 1999, 18: 2391-2398.
[8]Matteson B S, Tkac P, Paulenova A. Complexation chemistry of zirconium(Ⅳ), uranium(Ⅵ) and iron(Ⅲ) with acetohydroxamic acid[J]. Sep Sci Technol, 2010, 45: 1733-1742.
[9]Birus M, Bradic Z, Kujundzic N, et al. Stopped-flow and rapid-scan spectral examination of the iron(Ⅲ)-acetohydroxamic acid system[J]. Inrog Chem, 1985, 24: 3980-3983.
[10]Bengtsson G, Fronaus S, Bengtsson-Kloo L. The kinetics and mechanism of oxidation of hydroxylamine by iron(Ⅲ)[J]. J Chem Soc, Dalton Trans, 2002: 2548-2552.
[11]蘭天,張虎,羅方祥.電動勢法研究HAN與Fe3+氧化還原反應動力學[J].核化學與放射化學,2012,34:257-261.
[12]Farkas E, Kozma E, Petho M, et al. Equilibrium studies on copper(Ⅱ)- and iron(Ⅲ)- monohydroxamates[J]. Polyhedron, 1998, 17: 3331-3342.
[13]Andrieux F P L, Boxall C, Taylor R J. Acetohydroxamatoiron(Ⅲ) complexes: thermodynamics of formation and teperature dependent speciation[J]. J Solution Chem, 2008, 37: 1511-1527.
Effects of Acethydroxamic Acid on Kinetic of Reaction Between Hydroxylamine and Fe(Ⅲ)
SHI Si-wei, ZUO Chen, ZHENG Wei-fang*, YAN Tai-hong,LU Hong-bin, LIU Fang, ZHU Dong-dong
China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China
The kinetic of the reaction between hydroxylamine and Fe(Ⅲ) in nitric acid solution was studied by spectrophotometry. The apparent rate equation may be expressed as follows:
Fe(Ⅲ); hydroxylamine; acethydroxamic acid; complexation; redox reaction
2015-04-08;
2015-11-11
石四維(1989—),男,四川綿竹人,碩士研究生,核燃料循環與材料專業
*通信聯系人:鄭衛芳(1970—),男,江蘇金壇人,博士,研究員,核燃料循環與材料專業,E-mail: wfazh@ciae.ac.cn
O643.12
A
0253-9950(2016)04-0193-07
10.7538/hhx.2016.YX.2015027

