生物大分子
生物大分子
酵母核糖體組裝前體的高分辨冷凍電鏡結構
清華大學高寧研究組與合作者揭示了細胞核內的核糖體組裝前體結構揭示了裝配熟因子的功能多樣性,相關結果發表在《自然》雜志上。該研究報道了位于酵母細胞核內的一系列組成上和結構上不同的核糖體60S亞基前體復合物的冷凍電鏡結構,確定了近20種裝配因子在核糖體上的結合位置及其原子結構。真核核糖體的成熟是一個高度復雜的過程,包括核糖體蛋白裝配以及rRNA的剪切加工,需要76 snoRNAs和超過200種裝配因子的調控。然而絕大多數真核裝配因子的結構以及其行使功能的分子機理完全未知。這些數目眾多的裝配因子在組裝過程的不同時間點發揮作用,介導了核糖體組裝的全過程,包括核仁,核質、跨核孔復合物的運輸,以及胞質的裝配過程。
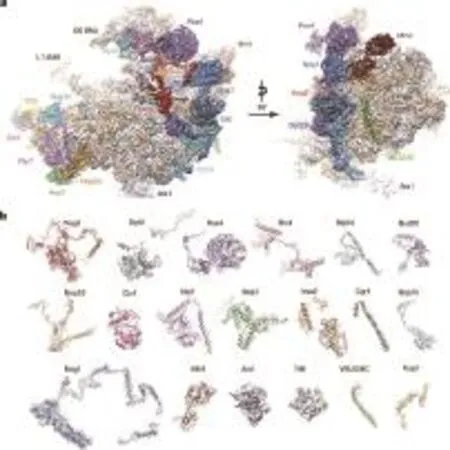
酵母核糖體大亞基組裝中間體的3

ITS2和相關因子的結構
人源NPC1蛋白結構及其介導膽固醇轉運和埃博拉病毒入侵的分子機制
中國疾控中心、中科院微生物所高福院士研究組與清華大學顏寧研究組合作,報道了人源膽固醇轉運蛋白NPC1的4.4埃分辨率冷凍電鏡結構,并探討了NPC1和NPC2介導細胞內膽固醇轉運的分子機制,研究論文發表于《細胞》。Niemann-Pick疾病是一類因為脂類代謝失常而導致的罕見遺傳疾病,目前還沒有有效的治療手段。NPC1功能異常是C型Niemann-Pick疾病的主要因素。人源NPC1是一個全長1278個氨基酸并含有13次跨膜螺旋的膜蛋白,新型的“隨機相位3D分類”方法從而將這一并不十分穩定的單體膜蛋白結構解析到4.4埃,有望推廣到對于類似生物大分子的結構解析。
抗埃博拉抗體被成功分離
中科院廣州生物醫藥與健康研究院與廣州醫科大學聯合共建的呼吸疾病國家重點實驗室陳凌研究員與清華大學張林琦教授等合作,通過單細胞克隆等技術,成功從獼猴體內分離出我國首例抗埃博拉病毒感染的高效單克隆中和抗體,研究論文發表于《科學報告》。埃博拉病毒是迄今為止人類所知的最致命傳染性病毒之一,平均病死率高達40%左右。從1976年在剛果民主共和國發現,一直在中部非洲國家和地區小范圍爆發和流行。2014年春季開始,埃博拉疫情在西部非洲幾內亞、利比里亞和塞拉利昂三國突然大范圍爆發,給人民生活、經濟發展和社會穩定帶來了災難性的打擊,對新形勢下的公共健康和安全提出了前所未有的挑戰。
新型內質網鈣通道
中科院動物研究所唐鐵山課題組與美國克利夫蘭州立大學周愛民課題組、中國科學院動物研究所陳佺課題組、中科院上海藥物研究所李揚課題組等合作,在闡釋細胞應對內質網鈣離子過載機制方面獲得進展,相關成果發表于《細胞》。胞內鈣庫的鈣釋放是鈣信號觸發的一個重要途徑。內質網是胞內的重要鈣庫,所以內質網中的鈣離子必須維持一個穩定的水平才能保證鈣信號的準確性。內質網中的鈣水平過高或過低都會造成鈣信號紊亂,進而導致細胞生理功能異常和疾病。內質網上的跨膜蛋白TMCO1可以感知內質網中過高的鈣濃度并形成具有鈣離子通道活性的四聚體,主動地將內質網中過多的鈣離子排出,從而消除內質網鈣過載給細胞帶來的多種威脅。
光合作用超級復合物
中科院生物物理研究所柳振峰研究組、章新政研究組與常文瑞/李梅研究組合作,通過單顆粒冷凍電鏡技術,在3.2埃分辨率下解析了高等植物(菠菜)光系統II-捕光復合物II超級膜蛋白復合體(PSII-LHCII supercomplex)的三維結構,相關結果發表在《自然》雜志上。光合作用為地球上幾乎所有生命體提供賴以生存的物質和能量。該項工作首次解析了CP29的全長結構和CP26的結構,并發現了這三個不同外周捕光復合物與核心復合物之間相互裝配和識別的機制和位點。在準確指認了外周捕光復合物與核心復合物界面上的三個小亞基的基礎上,解釋了它們在介導二者之間裝配以及穩定超級復合物方面的作用。對于進一步在分子水平理解PSII-LHCII超級復合物中的能量傳遞時間動力學和光保護機理具有重要意義。

P S I I–LHCII分子單顆粒cryo-EM分析

菠菜PSII外亞基
合成鏡像生物分子系統實現遺傳信息復制與轉錄
清華大學生命學院朱聽課題組與化學系劉磊課題組合作,通過化學合成鏡像聚合酶實現了中心法則中DNA的復制與轉錄這兩個關鍵步驟,研究論文發表于《自然-化學》。地球上已知所有生物都具有手性均一的特征,即構成生命的蛋白質幾乎均由L型氨基酸組成,而DNA和RNA均由D型核糖組成;迄今為止還沒有證據表明反手性生命系統在進化中曾經出現過。該研究結果表明鏡像DNA的復制與轉錄同樣遵循堿基互補配對原則,并具有良好的手性特異性。由該鏡像分子系統聚合得到的鏡像DNA核酶實現了與天然DNA核酶相同的自剪切功能。該研究有望被用來聚合實用反手性核酸大分子和實現構建鏡像生命系統邁。
第二類內含子及其逆轉錄酶復合體的結構
清華大學生命科學學院教授、清華-北大生命科學聯合中心研究員王宏偉研究組及其合作者報道了內源性的第二類內含子RNA蛋白復合物的3.8埃分辨率的冷凍電鏡結構,研究論文發表于《自然結構與分子生物學》。第二類內含子RNA大量存在于原核生物中,是真核細胞中剪接體的進化祖先。真核細胞中的絕大多數內含子剪接是通過由少量RNA和許多蛋白質組成的復雜核糖核蛋白復合物剪接體來完成的。而在原核生物第二類內含子的形成過程中,剪接是通過內含子RNA自身結構所產生的核糖酶活性獨立介導酯基轉移反應從而形成分離的內含子套索和拼接的外顯子,因而是相對簡單的剪接過程。第二類內含子RNA蛋白質復合體的研究對理解真核生物的剪接體與端粒酶的進化過程與分子機制具有重要意義。
ATM激酶精細三維結構
中國科學技術大學蔡剛課題組與南京農業大學王偉武課題組、中科大劉海燕課題組合作,揭示了毛細血管擴張共濟失調癥突變蛋白——ATM激酶的精細三維結構,相關成果發表于《自然-通訊》。ATM蛋白負責啟動細胞對DNA雙鏈斷裂損傷的響應,是調控基因組穩定性的最核心激酶,能直接磷酸化細胞內超過1000個重要底物。該研究解析了分辨率8.7埃的ATM激酶的三維結構,揭示了ATM激酶的各個結構域及其之間的相互作用;尤其是ATM同源二聚體呈現出張開翅膀的蝴蝶構象,二聚體的相互作用界面清晰可辨;激酶活性區域位于蝴蝶的頭部,分辨率相對較高,其原子結構模型得到構建,并顯示出底物結合的位點。

