烏雞肽對小鼠免疫調節作用影響的實驗研究
馮金秋,劉文穎,許 丹,朱小語,陳曉文,范愛琴,魯 軍,蔡木易,潘興昌,*,許雅君,*
(1.北京大學公共衛生學院營養與食品衛生學系,北京 100191;2.中國食品發酵工業研究院,北京市蛋白功能肽工程技術研究中心,北京 100015)
?
烏雞肽對小鼠免疫調節作用影響的實驗研究
馮金秋1,劉文穎2,+,許丹1,朱小語1,陳曉文1,范愛琴1,魯軍2,蔡木易2,潘興昌2,*,許雅君1,*
(1.北京大學公共衛生學院營養與食品衛生學系,北京 100191;2.中國食品發酵工業研究院,北京市蛋白功能肽工程技術研究中心,北京 100015)
目的:觀察并探討烏雞肽對小鼠免疫功能的影響。方法:以成年ICR雌性小鼠為動物模型,觀察不同劑量(0.5、1.0、2.0 g/kg BW)烏雞肽對小鼠體重、免疫器官相對重量、細胞免疫功能、體液免疫功能的影響,并從組織形態上觀察胸腺的微觀結構變化。結果:1.0、2.0 g/kg BW烏雞肽干預組的足趾腫脹度、2.0 g/kg BW烏雞肽干預組的溶血空斑數的對數轉換值顯著高于對照組(p<0.05)。與對照組相比,1.0、2.0 g/kg BW烏雞肽干預組小鼠胸腺皮質的淋巴細胞數量顯著增多(p<0.05)。各烏雞肽劑量組對小鼠體重增長、免疫器官指數以及血清半數溶血值均無顯著影響(p>0.05)。結論:烏雞肽對小鼠的免疫功能有一定的促進作用。
烏雞肽,細胞免疫,體液免疫,免疫器官
烏雞,作為我國特有的藥用保健雞種,已經有千余年的飼養與藥用的歷史。早在《神農本草經》中就有將丹雄雞列為“上品”的記載:“味甘微溫,主女人繃中漏下,赤血沃,補虛,溫中,止血”。現代醫學研究發現,烏雞內含豐富的黑色素、蛋白質、B族維生素和18種微量元素等,而膽固醇和脂肪含量卻很低。烏雞肉中粗蛋白含量高達63.79%,比普通大黃雞高1.52倍。鮮肉中氨基酸含量較高,必需氨基酸齊全,且甲硫氨酸、苯丙氨酸、半胱氨酸含量較高。
近年來,人們已經從多種動物以及植物體內提取出具有免疫調節活性的肽類物質[1-7]。本文以ICR小鼠為模型,研究烏雞肽對小鼠的免疫功能的影響,以期能夠為烏雞肽的開發與利用提供一定的實驗依據。
1 材料與方法
1.1材料與儀器
烏雞肽干粉由中國食品發酵工業研究院提供,烏雞肽是由烏雞蛋白經酶解制得的相對分子量低于1000 u的寡肽混合物。綿羊紅細胞(sheep red blood cell,SRBC),補體(豚鼠血清),Hank’s液,SA緩沖液,瓊脂糖,RPMI1640培養液,都氏試劑。
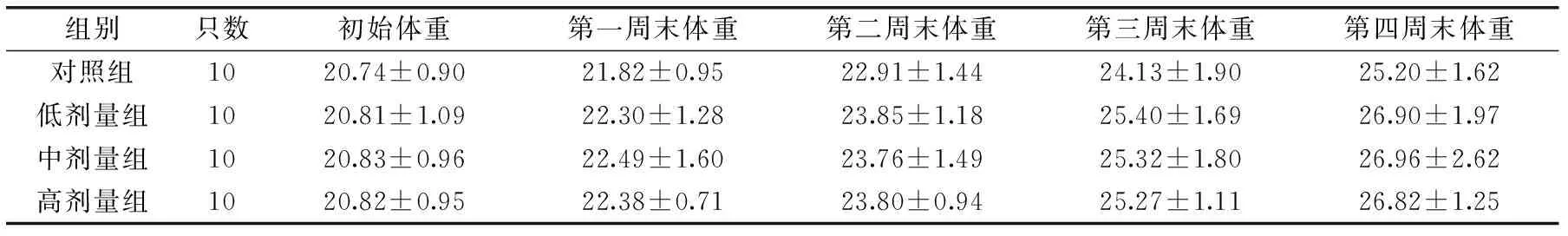
表1 小鼠每周體重情況(g)Table 1 The body weight of mice in every week
SPN3001F電子天平,游標卡尺,離心機,恒溫水浴箱,CO2培養箱,DNM-9602G酶標儀。
1.2實驗動物
SPF級ICR健康雌性小鼠,初始體重18~22 g,購自北京大學醫學部實驗動物科學部,合格證號:SCXK(京)2009-0008。飼養于屏障環境,溫度范圍為22±2 ℃,相對濕度為50%~60%,明暗交替時間為12 h:12 h,自由進食普通飼料、飲水。
1.3實驗方法
實驗動物適應性喂養3 d后,將實驗動物進行分組,分為對照組和烏雞肽低、中、高實驗組,每組10只動物。分別給予對照組酪蛋白2.0 g/kg BW、實驗組0.5、1.0、2.0 g/kg BW的烏雞肽。烏雞肽干粉用滅菌蒸餾水配制,灌胃給予,灌胃體積為0.1 mL/10 g鼠重,每天1次。每周需要測量體重來重新調整灌胃量。在實驗期間,動物自由進食、飲水。連續灌胃4周后,處死動物,進行相應的指標檢測。
1.4觀察指標
1.4.1臟器指數和胸腺組織形態學觀察灌胃4周后,動物禁食過夜,不禁水,第二天晨起對動物進行稱重后處死,分離胸腺和脾臟,稱重,計算各臟器指數,對各組的結果進行比較并觀察有無差異。將稱重完畢的各組小鼠胸腺浸泡于40 mL/L甲醛溶液固定24 h,流水浸洗30 min,經過750、850、950、1000 mL/L乙醇依次脫水6 h,甲苯處理3 h,石蠟液浸泡40 min后包埋、切片;將切片以蘇木素染色10 min,水洗后以1%鹽酸酒精(將1 mL濃鹽酸加入99 mL 70%酒精)處理40 s,水洗,5 mL/L氨水處理5 s,伊紅染色10 min,再由750、850、950、1000 mL/L乙醇依次脫色,經過甲苯透明15 min后以樹脂封片鏡檢。記錄各組胸腺組織結構的變化特點。
1.4.2遲發型變態反應(DTH)采用足跖腫脹法[8]。實驗動物灌胃4周后,注射2%(v/v)綿羊紅細胞(SRBC)來免疫小鼠。4 d后,用游標卡尺測量左后足跖部的厚度,然后在測量部位皮下注射20%(v/v)SRBC 20 μL(約1×108個SRBC),注射24 h后再次測量左后足跖部的厚度。遲發型變態反應的程度可以通過免疫前后兩次足跖部厚度的差值來表示。
1.4.3抗體生成細胞檢測采用Jerne改良玻片法[8]。注射2%(v/v)綿羊紅細胞(SRBC)來免疫小鼠。4 d后,制備脾細胞懸液,濃度為5×106個/mL。加熱溶解表層培養基(1%瓊脂糖)后,將其置于45~50 ℃水浴保溫,然后與等量的2倍濃度、pH7.2~7.4的Hank’s液進行混合,分裝小管,每管0.5 mL。向管內加入50 μL 10% SRBC(v/v)10 μL脾細胞懸液,快速對其進行混勻,傾倒在已涂有0.5%瓊脂糖薄層的玻片上。然后將凝固后的玻片扣置于片架上,放入CO2培養箱中孵育。1.5 h后,將SA緩沖液(水楊酸緩沖液)稀釋的補體(1∶8)加入玻璃架凹槽內,繼續孵育1.5 h。計算每組的溶血空斑數,用空斑數/5×106脾細胞來表示。
1.4.4血清溶血素測定采用半數溶血值法(HC50)法[8]。注射2%(v/v)綿羊紅細胞(SRBC)來免疫小鼠,4 d后,通過摘眼球的方法進行取血,分離出血清,用SA緩沖液稀釋200倍。取1 mL稀釋后的血清于試管中,逐步加入10% SRBC 0.5 mL、1∶8稀釋豚鼠補體1 mL。另設不加血清的對照管。放入37 ℃恒溫水浴中進行保溫,30 min后,冰浴終止反應,進行離心。取1 mL上清,加入3 mL都氏試劑,同時取10% SRBC 0.25 mL加入都氏試劑內至4 mL,充分將其混勻,作為SRBC半數溶血管。各管放置10 min后,在540 nm波長處測定OD值,溶血素的量用HC50來表示。HC50的計算公式如下:HC50=(樣品OD值/SRBC半數溶血時OD值)×稀釋倍數。
1.5數據統計
通過SPSS 21.0統計軟件對數據進行處理,結果以均數±標準差表示。采用單因素方差分析并進行方差齊性檢驗。若方差齊,則用LSD法;若方差不齊,則使用Tamhane’s T2檢驗。p<0.05時,認為結果有統計學意義。
2 結果與分析
2.1烏雞肽對小鼠體重及免疫器官相對重量的影響
通過表1以及表2,可以看出3個實驗組的初始體重、每周末體重、脾臟和胸腺臟器指數,與對照組比較差異無統計學意義(p>0.05)。
2.2烏雞肽對小鼠胸腺組織形態學的影響
如圖1所示,對照組和實驗組小鼠胸腺組織皮質和髓質界限均十分清楚,皮質較厚,有大量排列緊密的淋巴細胞,使皮質著色較深;而髓質部染色較淺,可見較多上皮網狀細胞和少量淋巴細胞。與對照組相比,可見烏雞肽中劑量組以及高劑量組小鼠胸腺皮質區增厚,淋巴細胞數量顯著增多。
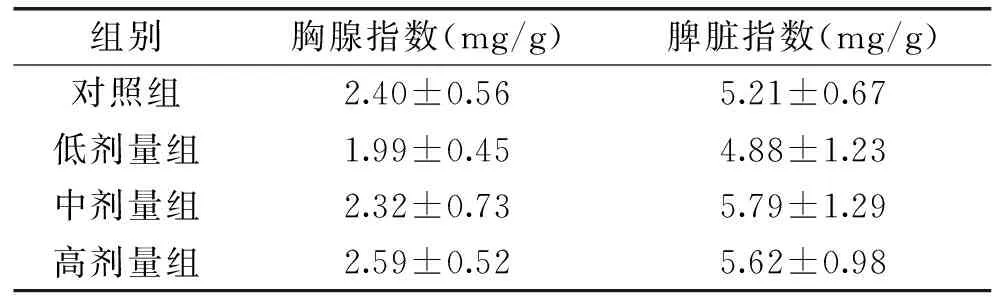
表2 烏雞肽對小鼠體重和免疫器官臟器指數的影響Table 2 Effects of Silky Fowl Peptide on immune organ index of mice
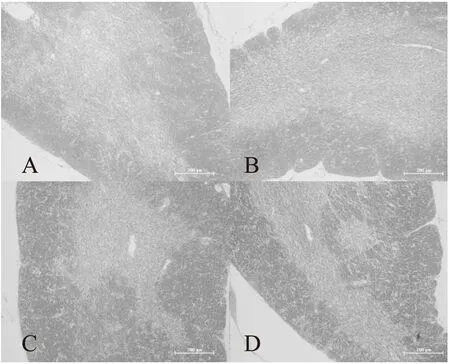
圖1 烏雞肽對小鼠胸腺結構的影響(100×)Fig.1 Effects of Silky Fowl Peptide on the microstructure of thymus in mice(100×)注:A.對照組;B.烏雞肽低劑量組; C.烏雞肽中劑量組;D.烏雞肽高劑量組。
2.3烏雞肽對小鼠細胞免疫功能的影響
觀察表3可知,與對照組相比,烏雞肽中劑量組和高劑量組的足跖腫脹度均有顯著性提高(p<0.05)。烏雞肽低劑量組與對照組的足跖腫脹度的差異無統計學意義(p>0.05)。

表3 烏雞肽對小鼠細胞免疫功能的影響Table 3 Effects of Silky Fowl Peptide on cellular immunity in mice
注:*與對照組相比,差異有顯著性(p<0.05),表4同。
2.4烏雞肽對小鼠體液免疫功能的影響
通過表4可以得知,與對照組相比,烏雞肽高劑量組的抗體生成細胞數有所增加且差異有顯著性(p<0.05),而實驗組的半數溶血值的差異無統計學意義(p>0.05)。
3 討論
胸腺是淋巴細胞轉化和成熟的重要場所,淋巴樣細胞在胸腺經過選擇后成熟,并輸送到外周發揮免疫調節作用[9]。淋巴細胞參與細胞免疫,具有監視免疫系統和維持免疫系統穩定的作用。脾臟內含有大量的免疫細胞,是全身最大的周圍淋巴器官。它還是產生記憶性T、B細胞和血源性抗原發生免疫應答的重要場所[10]。因此,胸腺指數、脾臟指數可從一定角度反映機體的免疫狀況。然而在本研究中,烏雞肽實驗組與對照組的胸腺指數、脾臟指數的差異無統計學意義。提示烏雞肽可能不通過此途徑來提高小鼠的免疫功能。
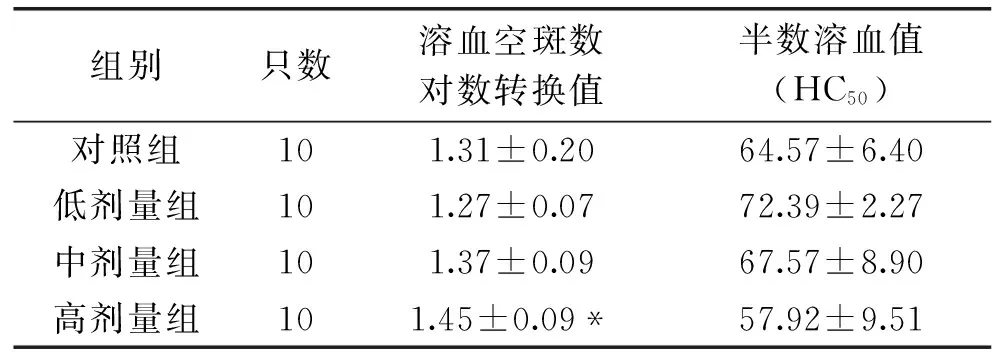
表4 烏雞肽對小鼠體液免疫的影響Table 4 Effects of Silky Fowl Peptide on humoral immunity in mice
遲發型變態反應可以反映機體的細胞免疫狀態[11]。實驗結果顯示,烏雞肽中劑量和高劑量能顯著促進正常小鼠的遲發型變態反應。說明烏雞肽可能具有對調節細胞免疫的作用。抗體生成細胞檢測及血清溶血素的測定反映了機體的體液免疫狀態。實驗結果顯示,只有烏雞肽高劑量組能顯著提高小鼠的抗體細胞生成數,提示相對于提高小鼠的細胞免疫功能,用烏雞肽提高小鼠的體液免疫功能可能需要更高的濃度。
鏡下觀察HE染色病理切片發現,與對照組相比,烏雞肽中劑量組和高劑量組小鼠胸腺皮質區增厚且淋巴數量顯著增多。提示烏雞肽能促進淋巴細胞的增殖,從而進一步調節機體的免疫力。
綜上所述,烏雞肽可能通過調節細胞免疫、體液免疫以及改善胸腺結構的途徑來增強小鼠的免疫功能。本實驗為進一步闡明烏雞肽的免疫調節功效提供了實驗依據,為烏雞肽的開發和使用提供了一定的參考數據。
4 結論
本實驗初步探究了烏雞肽對小鼠免疫功能的影響,結果提示烏雞肽對小鼠細胞免疫和體液免疫均有一定的調節作用。
[1]劉隆興,任興宏,湯禾靜,等.羊胎盤免疫活性小分子肽的分離純化[J].食品科學,2013,34(22):273-276.
[2]Feng Li-na,Liang Chen,Liang Rui-liang,et al.Pilot-scale production of low molecular weight peptides from corn wet milling byproducts and the antihypertensive effectsinvivoandinvitro[J]. Food Chemistry,2011,124(3):801-807.
[3]富校軼,孫茂成,高永欣,等.大豆肽免疫調節作用的研究進展[J].大豆科技,2014,1:38-42.
[4]Hou Hu,Fan Yan,Li Ba-fang,et al.Purificat-ion and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J].Food Chemistry,2012,
134(2):821-828.
[5]富校軼,李博群,張時瑩,等.超濾大豆蛋白肽對小鼠免疫功能的影響[J].食品工業科技,2012,33(7):375-378.
[6]代卉,樂國偉,孫進,等.小麥肽對受環磷酰胺免疫抑制小鼠的免疫調節及抗氧化功能[J].生物工程學報,2009,25(4):549-553.
[7]楊睿悅,張召鋒,裴新榮,等.海洋蛋白肽對小鼠免疫調節作用的實驗研究[J].中國預防醫學雜志2008,42(4):221-225.
[8]中華人民共和國衛生部.保健食品檢驗與評價技術規范.2003.
[9]楊寧波,吳愛勤,陳文,等.慢性心理應激小鼠胸腺免疫細胞凋亡損傷的研究[J].中國行為醫學科學,2006,15(11):986-988.
[10]李宗芳,張澎.脾臟的基礎研究進展與展望[J].西安交通大學學報(醫學版),2008,29(1):1.
[11]羅珍,黃萍,郭重儀,等.猴頭菇多糖增強免疫功能的實驗研究[J].中國實驗方劑學雜志,201l,17(4):182-183.
Study on the immunomodulating effect of Silky Fowl Peptide on mice
FENG Jin-qiu1,LIU Wen-ying2,+,XU Dan1,ZHU Xiao-yu1,CHEN Xiao-wen1,FAN Ai-qin1,LU Jun2,CAI Mu-yi2,PAN Xing-chang2,*,XU Ya-jun1,*
(1.Department of Nutrition and Food Hygiene,School of Public Health,Peking University,Beijing 100191,China;2.Beijing Engineering Research Center of Protein and Functional Peptides,China National Research Institute of Food and Fermentation Industries,Beijing 100015,China)
Objective:To observe the immunomodulating effect of Silky Fowl Peptide on mice.Methods:Female ICR mice were administered 0.5,1.0 g/kg BW or 2.0 g/kg BW Silky Fowl Peptide for 4 weeks,and then immune organs weight,cell-mediated immune functions,humoral immune functions and structural changes of thymuses were investigated.Results:Toes swelling degree in 1.0 g/kg BW and 2.0 g/kg BW Silky Fowl Peptide intervention groups were significantly increased in comparison with the value in control group(p<0.05).IgM-PFC number of Silky Fowl Peptide high dose group were higher than that in control group(p<0.05).The number of lymphocyte was increased in cortex of thymus compared with the number in control group.No obvious effects on weight increasing,the ratio of immune organ and body weight and the level of serum HC50were observed in Silky Fowl Peptide intervention groups.Conclusion:Silky Fowl Peptide could improve the immune functions in mice.
Silky Fowl Peptide;cell-mediated immune;humoral immune;immune organs
2015-10-30+并列第一作者
馮金秋(1992-),女,碩士在讀,研究方向:營養與疾病,E-mail:xwgwbd1992@sina.cn。
劉文穎(1984-),女,碩士研究生,研究方向:食源性低聚肽,E-mail:wenyinglin888@126.com。
潘興昌(1966-),男,博士,副主任醫師,研究方向:食源性低聚肽營養與功能評價,E-mail:nutripan@163.com。
許雅君(1976-),女,博士,教授,研究方向:生命早期營養與疾病,E-mail:xuyajun@bjmu.edu.cn。
國家十二五科技支撐項目(2012BAD33B04-02);國家高科技研究發展計劃(863計劃)項目(2013AA102205-02);科技北京百名領軍人才培養工程項目(Z131110000513026);北京市科委國家現代農業科技城成果惠民科技示范工程項目(Z131100003113010)。
TS201.4
A
1002-0306(2016)09-0349-04
10.13386/j.issn1002-0306.2016.09.060

