應用RT-PCR和dot-ELISA方法檢測單頭灰飛虱體內水稻條紋病毒
張水英, 蔣春和, 蘭平秀,3, 張雪峰, 李 凡*
(1. 云南農業大學農業生物多樣性與病蟲害控制教育部重點實驗室,昆明 650201; 2. 云南農業大學教務處,昆明 650201; 3. 云南農業大學動物科學技術學院, 昆明 650201; 4. 紅河學院,蒙自 661199)
?

應用RT-PCR和dot-ELISA方法檢測單頭灰飛虱體內水稻條紋病毒
張水英1,蔣春和2,蘭平秀1,3,張雪峰4*,李凡1*
(1. 云南農業大學農業生物多樣性與病蟲害控制教育部重點實驗室,昆明650201; 2. 云南農業大學教務處,昆明650201; 3. 云南農業大學動物科學技術學院, 昆明650201; 4. 紅河學院,蒙自661199)
本文比較了RT-PCR和dot-ELISA兩種方法對單頭灰飛虱攜帶水稻條紋病毒(Ricestripevirus,RSV)的檢出率、檢測靈敏度和檢測成本。結果表明,兩種方法均能檢測到單頭灰飛虱體內的RSV,RT-PCR檢測單頭灰飛虱體內RSV的陽性檢出率比dot-ELISA方法低11.79%~15.77%,但RT-PCR的檢測靈敏度比dot-ELISA高10倍,RT-PCR技術的檢測成本比dot-ELISA的高。結果暗示,對于單頭介體昆蟲中的病毒檢測,RT-PCR技術的檢出率不一定比dot-ELISA的高。綜合考慮后,如對室外大批量灰飛虱進行帶毒率檢測時可采用dot-ELISA方法,如需準確分析單頭灰飛虱體內RSV時可采用RT-PCR方法。
水稻條紋病毒;灰飛虱;RT-PCR;dot-ELISA;檢測
水稻條紋病毒(Ricestripevirus,RSV)引起水稻條紋葉枯病,自然界中可以由灰飛虱(Laodelphaxstriatellus)、白脊飛虱(Unkanodessapporona)、白帶飛虱(U.albifascia)和白條飛虱(Terthronalbovittatum)傳播,但主要依靠灰飛虱以持久方式經卵傳給后代[1]。水稻是RSV最主要的寄主,受侵染的水稻最典型的外部癥狀為出現褪綠的條紋斑點或斑塊,一般最早出現在嫩葉,根據具體表現癥狀可以分為卷葉型和展葉型兩類。水稻條紋葉枯病最早于1897年在日本關東地區發生,隨后在俄羅斯、朝鮮、韓國、前蘇聯和烏克蘭相繼發生[2]。我國自1963年首次在江蘇南部地區發生后,該病迅速擴及到18個省(市、自治區)的廣大稻區,并在江蘇、安徽、河南、山東、云南、北京、上海、臺灣等地暴發流行,病情嚴重的稻區甚至顆粒無收。自2006年以來,通過選育抗病品種、加強病害的預測預報、合理用藥等綜合治理措施,該病害發生面積已大幅下降[3],但是全國各地仍時有發生,因此對該病進行早期預測預報及有效防控仍很有必要。
灰飛虱的帶毒率與水稻條紋葉枯病的發生關系密切,快速、準確地檢測灰飛虱體內的RSV對水稻條紋葉枯病的預測預報和防治具有重要意義。要準確探明田間灰飛虱的帶毒率,需要對大量單頭灰飛虱攜帶RSV情況進行檢測。RSV的檢測方法有許多,包括 ELISA、DIBA、Western Blot、RT-PCR、Northern 雜交等[4-6],其中RT-PCR具有靈敏度高、特異性強、準確性好等特點。dot-ELISA除具有靈敏度高、特異性強等特點外,還具有成本低的優勢,適于大批量樣品檢測,且不需要特殊儀器設備,操作簡便,結果判定簡單易行,因此被廣泛應用于灰飛虱體內RNA病毒的檢測[7-9]。雖然目前利用RT-PCR和dot-ELISA檢測灰飛虱體內水稻病毒的報道有不少,但尚未見比較這兩種方法檢測單頭灰飛虱體內RSV的相關報道。本文比較了兩種方法對單頭灰飛虱體內RSV的檢出率、檢測靈敏度和檢測成本等,以期為單頭灰飛虱體內RSV以及其他蟲傳病毒的檢測提供參考。
1 材料與方法
1.1試驗材料
可能攜帶水稻條紋病毒的灰飛虱高齡若蟲和成蟲,在溫室用‘武育粳3號’飼養。
1.2試驗試劑
0.01 mol/L PBS緩沖液,百泰克公司的TRIpure總RNA提取試劑,TaKaRa公司的 Reverse Transcriptase M-MLV RNase H-反轉錄試劑盒,Tiangen公司的TaqDNA Polymerase試劑盒,美國KPL公司的辣根過氧化物酶標記羊抗鼠IgG二抗,Sigma公司的TMB顯色液,美國PALL公司的硝酸纖維素濾膜。RSV單克隆抗體由浙江大學周雪平教授惠贈。
1.3試驗方法
1.3.1樣品準備
在比較兩種方法的檢出率時,設置了兩個處理,處理1:同一頭灰飛虱,用PBS研磨后將上清液分成兩部分,一部分直接用于dot-ELISA檢測,另一部分提RNA后進行RT-PCR檢測,該處理設置3組重復,分別檢測灰飛虱20、30、20頭。處理2:不同的單頭灰飛虱分別進行RT-PCR和dot-ELISA檢測,均各自設置2組重復,分別檢測灰飛虱34、72頭。
1.3.2單頭灰飛虱體內RSV的RT-PCR檢測
根據已報道的RSV RNA4序列,設計特異性RSV檢測引物(RNA4dF1:5′-ACACAAAGTCCAGGGCATTT-3′,RNA4dR1:5′-CACACAAGAAGGTCAACCCAAAC-3′)。利用TRIpure試劑提取單頭灰飛虱上清液中的總RNA,取1 μL總RNA用ddH2O按100、10-1、10-2、10-3、10-4、10-5、10-6倍進行系列稀釋,然后分別按照Reverse Transcriptase M-MLV RNase H-反轉錄試劑盒和TaqDNA Polymerase試劑盒說明書進行RT-PCR擴增。
1.3.3單頭灰飛虱體內RSV的dot-ELISA檢測
dot-ELISA采用Xie等[10]的方法,略有改動。取1 μL用0.01 mol/L PBS緩沖液研磨單頭灰飛虱后的上清液,用0.01 mol/L PBS進行100、10-1、10-2、10-3、10-4、10-5、10-6系列稀釋;取2 μL稀釋液點到NC膜上,室溫干燥;用5%脫脂奶粉室溫封閉60 min,用含5%脫脂奶粉的PBST緩沖液按1∶8 000稀釋RSV單克隆抗體,將抗體與NC膜在室溫孵育60 min;洗膜后與用含5%脫脂奶粉的PBST緩沖液按1∶10 000的比例稀釋辣根過氧化物酶標記羊抗鼠IgG二抗室溫孵育60 min;洗膜后用TMB底物顯色液顯色,待NC膜上的陽性樣品呈現明顯藍色而陰性對照未顯色時棄顯色液終止反應,記錄結果并照相保存。
2 結果與分析
2.1RT-PCR和dot-ELISA方法對單頭灰飛虱體內RSV的檢出率
處理1中,RT-PCR的RSV平均陽性檢出率為55.56%,dot-ELISA的RSV平均陽性檢出率為67.35%,RT-PCR的RSV平均陽性檢出率比dot-ELISA方法低11.79%。處理2中,RT-PCR和dot-ELISA的RSV平均陽性檢出率分別為27.82%和43.59%,前者陽性檢出率比后者低15.77%。無論是同一頭灰飛虱同時進行RT-PCR檢測和dot-ELISA檢測,還是不同的單頭灰飛虱分別進行dot-ELISA和RT-PCR檢測,RT-PCR的RSV陽性檢出率都比dot-ELISA的低(表1)。
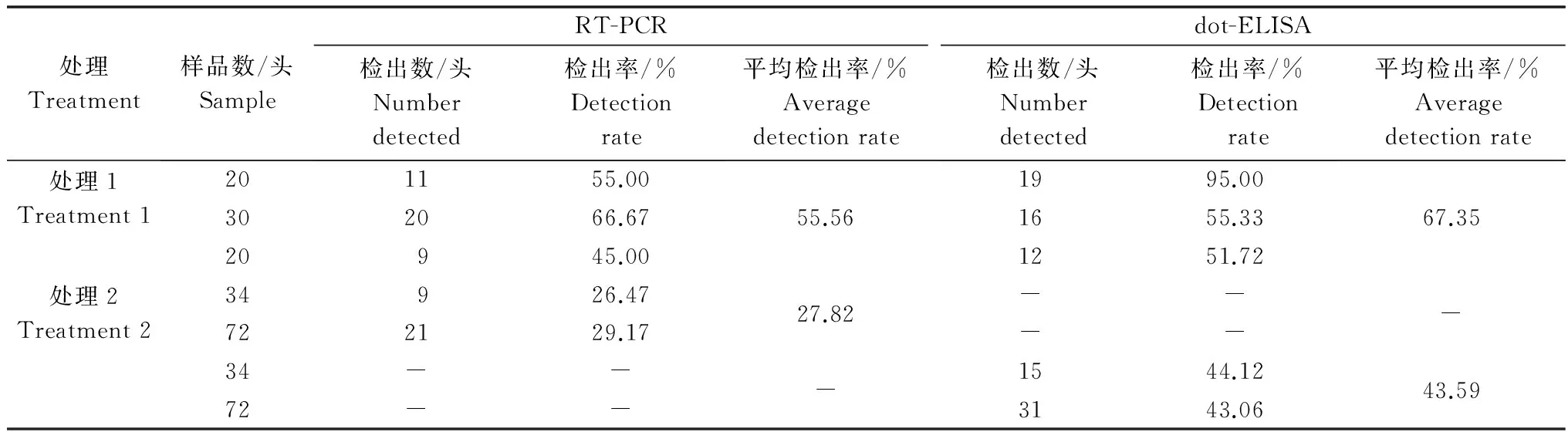
表1 RT-PCR和dot-ELISA對單頭灰飛虱體內RSV的檢出率1)Table 1 Detection rate of RSV in individual SBPHs by RT-PCR and dot-ELISA
1) 處理1:隨機采集的同一頭灰飛虱既進行RT-PCR檢測又進行dot-ELISA檢測;處理2:隨機采集的不同的單頭灰飛虱,一半進行RT-PCR檢測,另一半進行dot-ELISA檢測。
Treatment 1: RSV detection was conducted by both RT-PCR and dot-ELISA for the same individual SBPH; Treatment 2: RSV detection was conducted by RT-PCR or dot-ELISA for different individual SBPHs.
2.2RT-PCR和dot-ELISA對單頭灰飛虱體內RSV的檢測靈敏度
取一頭灰飛虱用PBS緩沖液充分研磨后得到上清液,一部分上清液用PBS按10×梯度進行稀釋后用于dot-ELISA檢測,稀釋倍數為100、10-1、10-2、10-3、10-4、10-5和10-6,隨著稀釋倍數增大,陽性顯色逐漸減弱,稀釋至10-2后便不再顯色(圖1),即dot-ELISA方法可以檢測到RSV的最大稀釋倍數為原液的100倍。另一部分上清液提RNA后用ddH2O 按10×梯度進行稀釋后用于RT-PCR檢測,稀釋倍數為100、10-1、10-2、10-3、10-4、10-5和10-6,隨著稀釋倍數增大,目標條帶逐漸減弱,稀釋至10-3后便檢測不到目標條帶(圖2),即RT-PCR方法可以檢測到RSV的最大稀釋倍數為原RNA濃度的1 000倍。

圖1 Dot-ELISA對單頭灰飛虱體內RSV的檢測靈敏度Fig.1 Detection sensitivity for RSV in individual SBPHs by dot-ELISA
2.3RT-PCR和dot-ELISA對單頭灰飛虱體內RSV的檢測成本比較
對單頭灰飛虱進行RT-PCR檢測時,如果選用較為便宜的TRIpure總RNA提取試劑、TaKaRa Reverse Transcriptase M-MLV反轉錄試劑盒和天根TaqDNA Polymerase試劑盒等,折算后檢測1個樣品的主要試劑、耗材成本約為20~30元;對單頭灰飛虱進行dot-ELISA檢測時,需用到硝酸纖維素濾膜、RSV單克隆抗體、辣根過氧化物酶標記羊抗鼠IgG二抗和TMB顯色液,折算后檢測1個樣品的試、耗材成本約為8~10元,約是RT-PCR檢測成本的1/3。由此可見RT-PCR檢測成本比dot-ELISA高許多。
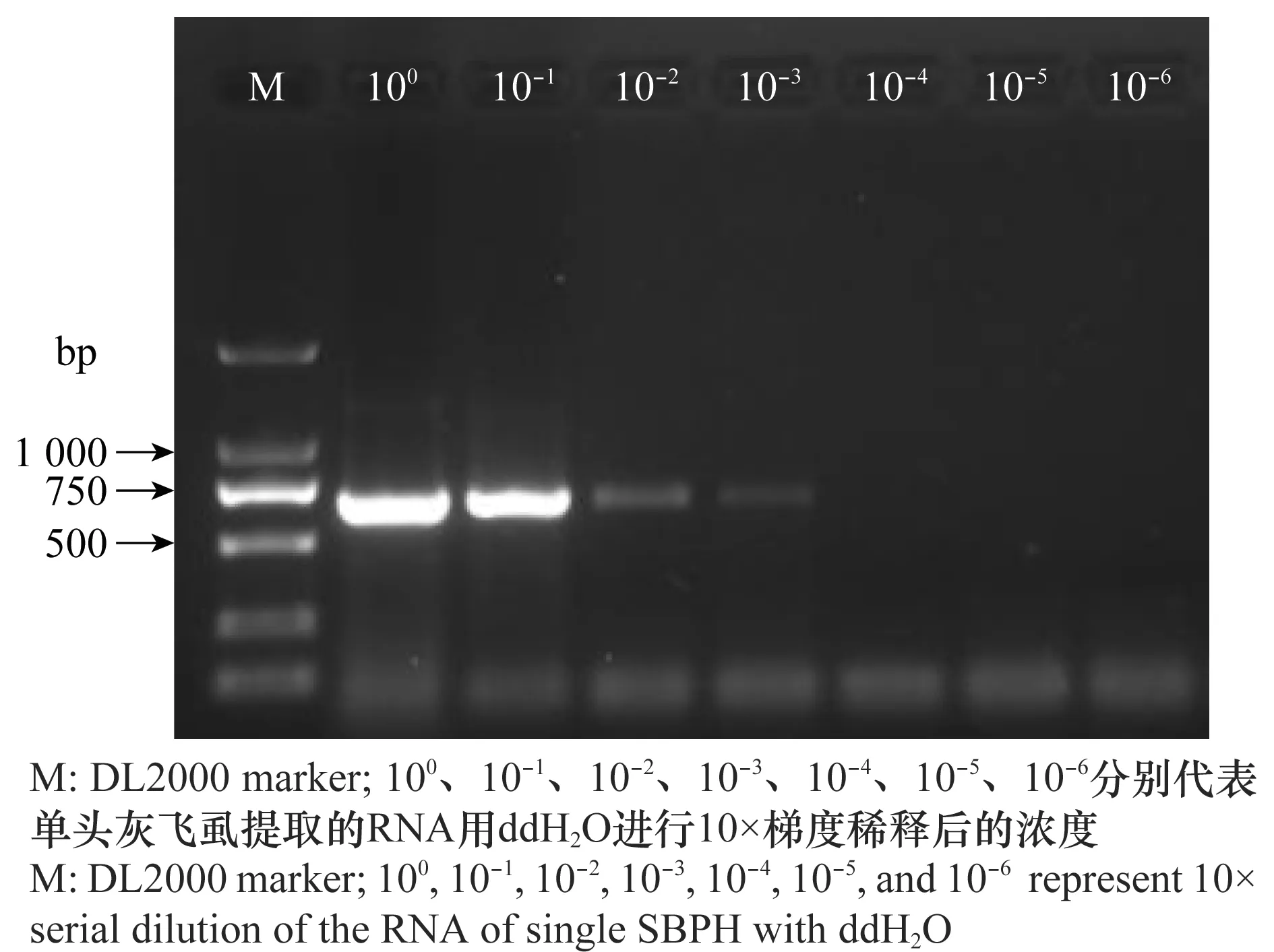
圖2 RT-PCR對單頭灰飛虱體內RSV的檢測靈敏度Fig.2 Detection sensitivity for RSV in individual SBPHs by RT-PCR
3 討論
劉珊珊等[11]、馬占鴻等[12]的研究結果表明RT-PCR檢測靈敏度比dot-ELISA的高,因此我們起初也一直認為RT-PCR的檢出率應該比dot-ELISA的高,但是經過多次試驗,結果都是RT-PCR的陽性檢出率比dot-ELISA的低,且存在RT-PCR檢測為陽性的樣品dot-ELISA檢測卻為陰性、dot-ELISA檢測為陽性的樣品RT-PCR檢測為陰性的現象。針對RT-PCR和dot-ELISA陽性檢出率不一致的現象,我們分別用TRIpure、RNAiso和Trizol 3種RNA提取試劑分別對單頭灰飛虱的RNA進行提取,發現3種試劑的提取效果差異不大,結果依然是RT-PCR的陽性檢出率比dot-ELISA的低,說明RNA的提取試劑不是造成RT-PCR檢出率比dot-ELISA低的主要原因。另外對兩種方法檢測結果出現雙向差異的這些樣品進行10、50、100、200倍稀釋后再檢測,發現結果仍然是RT-PCR的陽性檢出率比dot-ELISA的低。于是我們用IC-RT-PCR對這些樣品進行驗證,結果顯示RT-PCR和IC-RT-PCR的檢測結果基本一致,且IC-RT-PCR陽性檢出率比RT-PCR提高8%左右,依然存在部分陽性結果與dot-ELISA不吻合的現象。
饒黎霞等[13]的研究結果也表明,分別用RT-PCR和dot-ELISA檢測水稻上的南方水稻矮縮病毒、水稻矮縮病毒和水稻齒葉矮縮病毒時,從檢出率看,兩種方法的吻合率并不完全一致,并因病毒而異。另外嵇朝球等[14]、楊杰等[15]認為dot-ELISA是在蛋白質水平上檢測有無病毒的外殼蛋白,這種檢測法受到基因表達和環境條件等因素的影響,檢測結果假陽性較高,導致dot-ELISA的檢出率要高許多。另外在開展RT-PCR檢測前需要對單頭灰飛虱進行RNA提取,因蟲體很小,很容易在提取過程中發生RNA的降解及丟失,導致RT-PCR的檢出率要低一些,這些可能都是導致在對大批量單頭灰飛虱進行檢測時很難做到兩種方法的檢測結果完全吻合的原因。
在使用成本及實用性方面,RT-PCR方法所使用的儀器和試劑成本較高,需要專業人員進行操作,不利于大批量的樣品檢測。dot-ELISA方法的成本相對較低,靈敏度高、特異性強,不需要特殊儀器設備,適用于大批量的單頭灰飛虱樣品檢測,但可能存在假陽性現象。總的來說在進行田間大批量灰飛虱帶毒率的檢測時,dot-ELISA方法是一個不錯的選擇,而需要準確分析單頭灰飛虱體內RSV時,選擇RT-PCR方法較好,各單位可根據自己的條件及具體情況來選擇檢測技術[16]。
[1]白雪亮, 王金菊, 周維, 等. 水稻條紋葉枯病的研究進展[J]. 生物學通報, 2007, 42(8): 4-6.
[2]任春梅,程兆榜,季英華,等.灰飛虱來源的水稻條紋病毒病害特異性蛋白基因遺傳多樣性[J].華北農學報,2010,25(6):132-138.
[3]鄭璐平.水稻條紋病毒基因NS2致病作用機理分析[D].福州:福建農林大學,2013.
[4]周益軍,劉海建,王貴珍,等.灰飛虱攜帶的水稻條紋病毒免疫檢測[J].江蘇農業科學,2004(1):50-52.
[5]孫祥良,王華第,朱金良,等.灰飛虱攜帶水稻條紋葉枯病毒檢測研究[J].中國植保導刊,2007,27:7-9.
[6]Cai Lijun, Ma Xizhi, Kang Lin, et a1. DetectingRicestripevirus(RSV) in the small brown planthopper (Laodelphaxstriatellus) with high specificity by RT-PCR [J]. Journal of Virological Methods, 2003, 112: 115-120.
[7]王朝輝, 周益軍, 范永堅, 等. 從單頭灰飛虱中檢測水稻黑條矮縮病毒簡單快速的方法[J]. 上海交通大學學報(農業科學版), 2002, 20(4): 340-343.
[8]曲志才, 沈大棱. 單頭灰飛虱體內水稻條紋葉枯病毒的快速檢測[J]. 植物學通報, 2008, 25(4): 459-464.
[9]張開玉, 熊如意, 周益軍. 灰飛虱體內水稻條紋病毒的檢測[J]. 植物保護學報, 2008, 35(5): 410-414.
[10]Xie Yan, Jiao Xiaoyang, Zhou Xueping et a1. Highly sensitive serological methods for detecting tomato yellow leaf curl virus in tomato plants and whiteflies [J].Virology Journal,2013,10:142.
[11] 劉珊珊, 周倩, 高必達, 等. Dot-ELISA和RT-PCR檢測南方水稻黑條矮縮病毒靈敏度的比較[J]. 湖南農業科學, 2014(1): 51-54.
[12]馬占鴻, 常勝軍, 周廣和. 應用dot-ELISA和RT-PCR法檢測玉米花粉中玉米矮花葉病毒的研究[J]. 植物病理學報, 1999, 29(3): 247-249.
[13]饒黎霞,王震成,吳建祥,等.2011-2012年三種水稻矮縮病在我國的分布及發生調查[J].植物保護,2014,40(3):151-156.
[14]嵇朝球, 鐘環, 鐘佩英, 等. 水稻條紋葉枯病病毒RT-PCR快速檢測研究[J]. 上海交通大學學報(農業科學版), 2005, 23(2): 188-191.
[15]楊杰, 王軍, 陳志德, 等. 利用RT-PCR快速檢測水稻條紋葉枯病病毒[J]. 金陵科技學院學報, 2008, 24(1): 40-44.
[16]李海明,沈建國,吳祖建,等.3種方法檢測黃瓜綠斑駁花葉病毒的靈敏度對比分析[J].中國農學通報,2010,26(17):269-272.
(責任編輯:楊明麗)
Detection ofRicestripevirusin individual small brown planthoppers by RT-PCR and dot-ELISA
Zhang Shuiying1,Jiang Chunhe2,Lan Pingxiu1,3,Zhang Xuefeng4,Li Fan1
(1. Key Laboratory of Agricultural Biodiversity and Pest Management of Ministry of Education, Yunnan Agricultural University, Kunming650201, China; 2. Office of Teaching Affairs, Yunnan Agricultural University,Kunming650201, China; 3. College of Animal Science and Technology, Yunnan Agricultural University, Kunming650201, China; 4. Honghe University, Yunnan661199, China)
The detection rates, sensitivities and cost of RT-PCR and dot-ELISA methods were compared for the detection ofRicestripevirus(RSV) in individual small brown planthoppers (SBPH). The results indicated that RSV could be detected in single SBPH successfully by both methods. The RSV-positive detection rates in single SBPHs by RT-PCR were 11.79%-15.77% lower than that by dot-ELISA; however, the sensitivity of RT-PCR was 10 times higher than that of dot-ELISA. The cost of RT-PCR was also higher. The results suggested that the detection rate of RSV in individual insect vectors by RT-PCR might be lower than that by dot-ELISA. Therefore, dot-ELISA is recommended for the detection of RSV in individual SBPHs when large-scale field samples need to be tested, while RT-PCR is used for accurate analysis of the virus in single SBPHs.
Ricestripevirus;small brown planthopper;RT-PCR;dot-ELISA; detection
2015-01-30
2015-03-31
云南省教育廳科學研究基金重大專項(ZD2012005);云南省高校科技創新團隊支持計劃(云教科[2014]22號)
E-mail:zxf197927@163.com;fanlikm@126.com
Q 93-331, S435.111.42
A
10.3969/j.issn.0529-1542.2016.02.021

