擬南芥CPK10/CPK30雙突變體的構建及表型分析
謝 鑫,孫 寧,魏鳳菊
(河北農業大學 生命科學學院,河北省植物生理與分子病理學重點實驗室,河北 保定 071001)
?
擬南芥CPK10/CPK30雙突變體的構建及表型分析
謝鑫,孫寧,魏鳳菊
(河北農業大學 生命科學學院,河北省植物生理與分子病理學重點實驗室,河北 保定071001)
CDPKs是植物細胞內一類重要的鈣感受器,擬南芥CPK10屬于CDPK家族成員。為研究CPK10及與其同源性較高的CPK30是否共同參與逆境響應。首先構建了cpk10×cpk30雙突變體,然后進行多種逆境下的生理表現檢測,并利用RT-PCR方法分析2個基因的表達情況。結果顯示,模擬干旱、鹽、ABA處理擬南芥幼苗后,雙突變體與野生型無差異;成苗期雙突變體與單突變體對干旱敏感程度類似。轉錄水平檢測到,在干旱脅迫時雙突變體中RD29A的表達與野生型及單突變體趨勢相反,呈下降趨勢;響應ABA的OST1在雙突變體中受干旱誘導后0.5 h明顯表達上調。成功獲得了cpk10×cpk30雙突變體,由生理表型和表達分析結果推測CPK10與CPK30可能共同參與了依賴ABA的干旱逆境信號轉導過程,且二者之間存在功能冗余。
鈣依賴的蛋白激酶;雙突變體;逆境脅迫;表型分析
鈣依賴的蛋白激酶(Calcium-dependent protein kinases,CDPKs)作為生物體內重要的鈣信號感受器,在胞內鈣信號的級聯傳遞過程中起著重要的作用。植物CDPK屬于多基因家族,家族中許多成員在應答非生物逆境過程發揮重要功能。尤其在干旱、高鹽脅迫方面最為明顯,如擬南芥AtCPK10和AtCPK11可以受干旱和高鹽誘導表達[1-2];AtCPK27[3]參與植株對鹽脅迫的應答;過量表達AtCPK8[4]和AtCPK10[5]可以使植株耐旱力明顯增強;其他植物中如玉米ZmCPK4[6]、葡萄VaCPK20[7]、姜ZoCDPK1[8]過量表達后,植株對干旱脅迫的耐受性明顯增強;OsCPK12[9]正調控水稻應答高鹽脅迫。有些CDPK成員表現對逆境的負調控,如AtCPK21[10]的突變體表現出對逆境脅迫耐受力增強。由于多基因家族中結構域的保守性,會存在多個基因的功能冗余現象,如AtCPK4和AtCPK11共同介導了ABA信號轉導過程[11];AtCPK2和AtCPK20共同調控花粉管陰離子通道SLAH3[12]。煙草的NaCDPK4和NaCDPK5共同參與茉莉酸的早期合成過程,二者同時被沉默后,會導致茉莉酸的積累[13]。
前期研究發現,擬南芥CPK10參與對干旱脅迫的響應,通過ABA及鈣離子介導了對氣孔運動的調節[5]。在干旱處理條件下,Atcpk10突變體比野生型葉片失水萎蔫明顯。擬南芥CDPK家族中,AtCPK30與AtCPK10屬于同一亞家族,且序列相似性為家族最高,有研究顯示AtCPK30參與了擬南芥幼苗期ABA等激素信號途徑[14],而在應答逆境方面的研究未見報道。是否高度同源性的AtCPK30與AtCPK10基因存在相似或冗余的功能,這2個基因在同時缺失的情況下,對于逆境會發生怎樣的表型變化,它們在參與逆境過程中的作用有什么相關性,這些問題都尚不清楚。本研究分別以CPK10基因及CPK30基因單突變體為父母本,通過單突變體雜交獲得雙突變體,結合生理表型及逆境相關基因檢測,為深入探討AtCPK10及AtCPK30在非生物逆境中的功能提供理論依據。
1 材料和方法
1.1試驗材料
擬南芥cpk10(SALK_082441)及cpk30(SALK_087240)T-DNA插入突變體自SALK庫購得。植物總RNA提取試劑、反轉錄酶、Taq聚合酶、dNTP等購自大連寶生物公司(TaKaRa);膠回收試劑盒等購自天根生物科技公司(Tiangen);質粒提取試劑盒購自北京全式金生物技術(TransGen Biotech)有限公司。植物激素ABA、MOPS等購自Sigma公司。其他化學藥品為進口或國產分析純試劑。
1.2植物材料培養方法
1.2.1植物材料培養首先用0.5%次氯酸鈉消毒液(0.5%(V/V)NaClO+0.01%(V/V)Triton X-100)對擬南芥(Arabidopsisthaliana)種子進行消毒處理,4 ℃黑暗處理2~3 d,之后播種于MS培養基上生長約7 d。將幼苗移栽到土壤(蛭石∶營養土1∶1~1∶2)中培養(用透明塑料膜覆蓋保濕4~5 d)。溫室培養條件為:光/暗周期為16 h/8 h,溫度22 ℃,濕度60%,光照強度80~100 μmol/(m2·s)。
1.2.2雜交試驗采用常規的人工雜交方法獲得雙突變體。選取純合單突變體作為親本,雜交前去除母本已長角果和已開花以及未開花的花瓣和雄蕊,將父本的花粉涂布在母本未沾花粉的柱頭上。授粉10 h后柱頭毛萎蔫,3 d后角果形成并伸長,即為雜交成功。對雜交子代F1進行PCR檢測,獲得2個目的基因均雜合的個體,然后進行自交,分別從DNA和RNA水平對F2進行純合鑒定,最終獲得純合體。
1.2.3逆境生理表型試驗種子萌發階段表型篩選:將各種基因型的種子播種在MS篩選培養基上。每種篩選濃度均進行3次重復試驗。播種好的培養皿豎直放于溫室中培養,定期交換擺放位置,排除位置效應可能對試驗結果產生影響。培養14 d觀察并照相。
幼苗階段表型篩選:播種于MS培養基上的種子,豎直培養4 d。選取不同基因型長勢相同的幼苗移栽到MS篩選培養基上。每種篩選濃度均進行3次重復試驗。培養條件同上。生長14 d,觀察照相。
成苗階段表型篩選:溫室培養缽中生長21 d左右的幼苗,進行干旱、高鹽處理。定期交換培養缽位置,避免位置效應對試驗結果造成影響,觀察植株長勢并照相。
1.3分子試驗相關方法
1.3.1T-DNA插入檢測參照CTAB法提取成熟葉片基因組DNA,T-DNA插入突變體的鑒定引物依據Signal網站(http://siganl.salk.edu/tdnaprimers.html)的方法設計。以基因組DNA為模板,不同引物組合進行PCR擴增,檢測其T-DNA插入情況。
1.3.2總RNA的提取及RT-PCR利用TRIzol方法提取成熟葉片RNA,以反轉錄所得cDNA為模板擴增擬南芥組成型表達的持家基因EF1a,通過調整模板的加入量使得EF1a基因電泳檢測時條帶亮度基本一致。擴增目的基因,觀察分析目的基因的亮度變化。
1.4引物設計與合成
PCR引物由上海生工通過PAGE純化方式合成,各引物名稱及序列如表1所示。
2 結果與分析
2.1F1cpk10×cpk30雙突變雜合體的獲得擬南芥CDPK家族中,CPK30與CPK10的序列相似性為86%。是否這二者共同參與了幼苗期植株響應逆境的過程,通過純合單突變體雜交,構建cpk10×cpk30的雙突變體,以cpk10×cpk30雜交F1各株基因組DNA為模板檢測和篩選兩基因的雜合體,利用CPK30TF/LBa1進行PCR擴增,只有cpk10×cpk30雙突變雜合體能夠擴增出條帶。本試驗隨機選取約40棵F1植株進行檢測,其中1,6,36,38號植株為cpk10×cpk30雙突變雜合體,如圖1所示。

表1 引物序列

圖1 雙突變F 1雜合體鑒定
2.2F2雙突變純合體篩選
F1雜合體自交后,獲得4個F2株系分別標記為:H1、H6、H36、H38。對這4個株系進行DNA水平鑒定以獲得純合的雙突變體。首先檢測CPK10基因的純合情況。如果以CPK10TF和CPK10TR引物對進行PCR擴增,雜合體與野生型植株一樣可以擴增出CPK10基因的片段;利用LBa1與CPK10TF組成引物對擴增,雜合體與純合體植株均能擴增出條帶。利用上述PCR方法對H1(24個植株樣品)、H6(24個樣品)、H36(6個樣品)以及H38(18個樣品)4個株系的材料分別進行了CPK10基因鑒定(圖2-A)。結果顯示,H1株系的10棵植株;H6株系的3棵植株;H36株系的4號植株;H38株系的5棵植株為cpk10純合突變體(圖2-A)。
經鑒定為CPK10基因插入純合的植株再進行CPK30基因的插入突變鑒定。分別利用CPK30TF和CPK30TR、CPK30TF和LBa1 2對引物搭配進行PCR擴增。確定H1株系中1,3,4號植株;H38株系中5,7,13,15,17號植株;H36的4號植株為DNA水平上cpk10×cpk30雙突變純合體(圖2-B)。
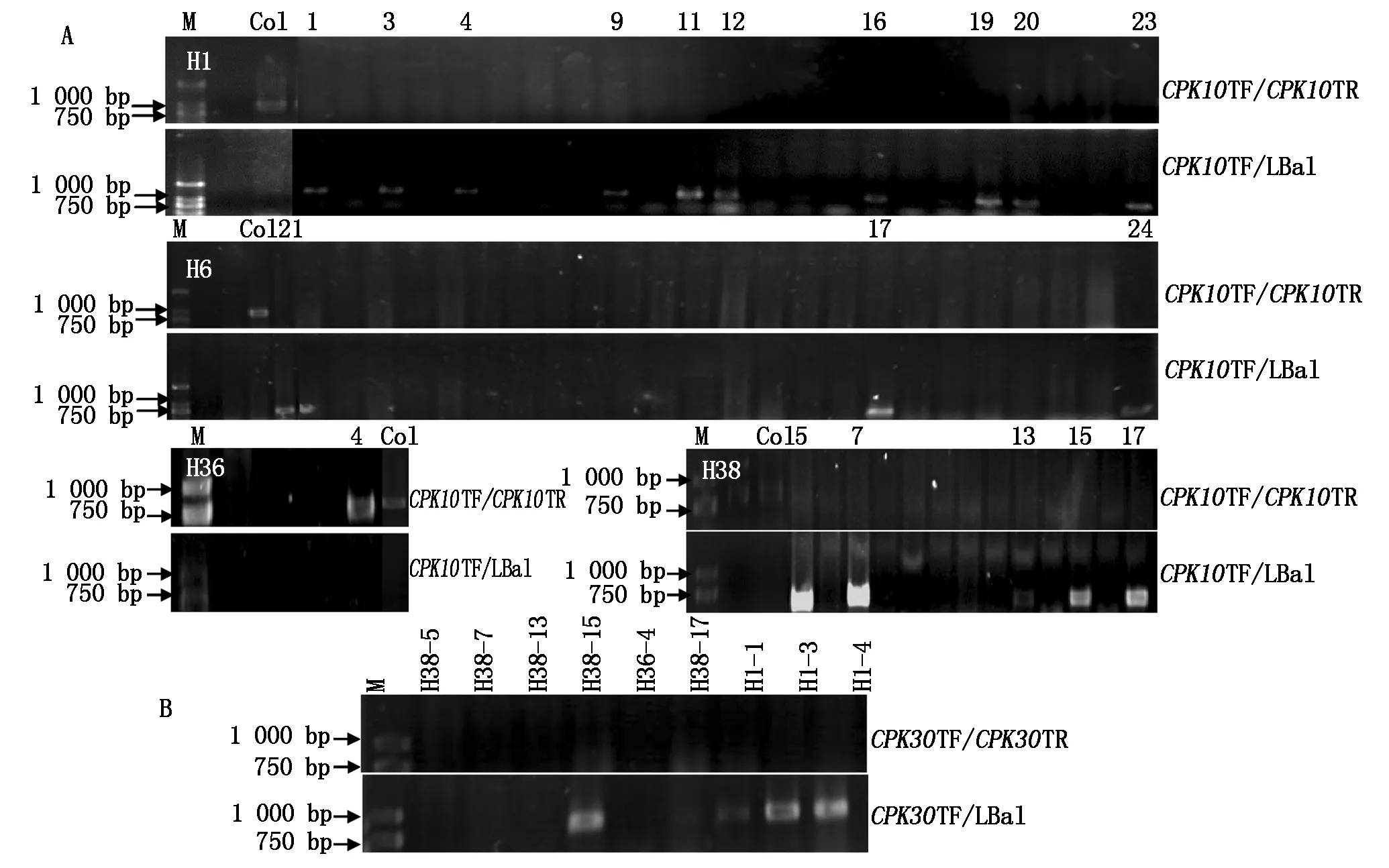
A.F2雙突變純合體CPK10基因純合鑒定;B.F2雙突變純合體CPK30基因純合鑒定。
2.3F3純合雙突變體的篩選
DNA水平上確定為CPK10和CPK30基因雙突變的純合體,接下來通過RT-PCR技術,在RNA水平檢查2個基因的轉錄情況。野生型材料中能檢查到特異擴增出的CPK10與CPK30基因片段(圖3);cpk10單突變體中能檢測到CPK30基因的片段,而沒有擴增出CPK10基因的特異性條帶;cpk30突變體材料中能夠擴增出CPK10特異片段,而不能擴增出CPK30基因片段;雙突變體材料中CPK10與CPK30 2個基因的目的片段都不能擴增出來。由以上結果得出,H1株系的4號植株為cpk10×cpk30的雙突變純合體。
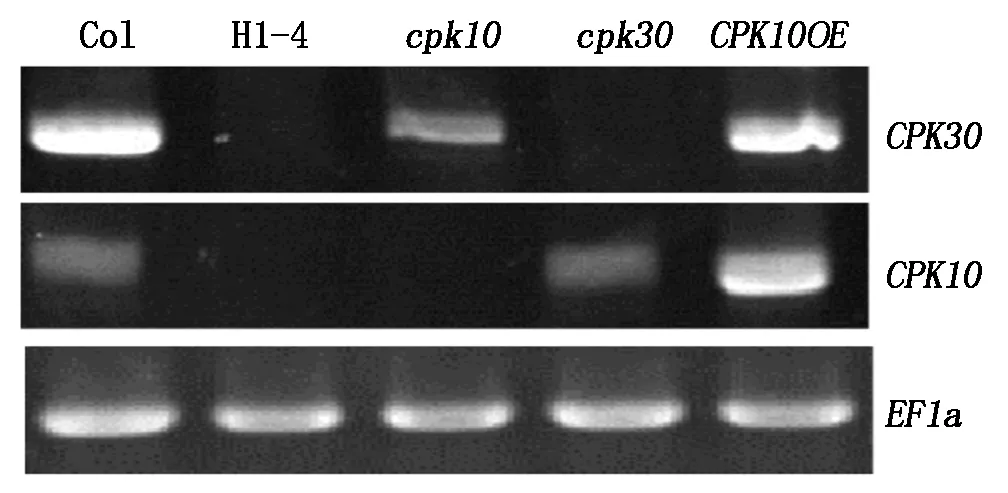
圖3 RT-PCR鑒定雙突變純合體
2.4雙突變的表型篩選
2.4.1萌發期表型觀察在含有ABA的MS篩選培養基上,雙突變體與單突變體均未見與野生型明顯差異的表型。在MS培養基中加入Mannitol,觀察各基因型在滲透物質處理條件下種子萌發情況,同樣沒有發現cpk10×cpk30雙突變體與cpk10、cpk30植株及野生型有明顯差異(圖4)。將雙突變體種子播種在含有100 mmol/L NaCl的MS篩選培養基上(圖4),與正常培養基相比,雙突變體、單突變體及野生型都表現為冠小發黃、根短;幾種材料與野生型相比無明顯差異。表型檢測結果表明,在種子萌發階段CPK10與CPK30可能不是擬南芥響應逆境脅迫過程中的關鍵基因。

圖4 雙突變在處理培養基上種子萌發表型觀察
2.4.2萌發后表型觀察把MS培養基上長勢相同的幼苗移到含有不同濃度的滲透物質(Mannitol)、ABA、NaCl的處理培養基上,雙突變體、單突變體與野生型之間長勢基本相同,無明顯差異(圖5)。這表明CPK10、CPK30基因的敲除,并沒有使植株對以上逆境的應答發生改變,證明這2個基因不是擬南芥幼苗生長期響應上述逆境的關鍵因子。

圖5 各基因型材料在處理培養基上表型觀察
2.4.3成苗期表型觀察正常生長14 d后的幼苗經干旱處理后,雙突變體表現出與單突變體相似的干旱敏感表型:葉片萎蔫,莖稈倒伏(圖6)。CPK10基因的缺失會導致植株耐旱能力減弱[11],雙突變體也變現同樣的表型,說明CPK30基因的缺失并沒有使雙突變體比cpk10對干旱更敏感。

圖6 雙突變體成苗期干旱脅迫表型觀察
2.5干旱相關基因轉錄水平分析
為了探討CPK10/CPK30是否共同參與了響應干旱脅迫的信號轉導過程,本研究通過雙突變體、單突變體及野生型植株進行干旱處理,利用RT-PCR技術對干旱逆境信號通路的關鍵基因表達情況進行了分析。對成苗蓮座葉片進行0,0.5,1.0,3.0 h的干旱處理,RT-PCR結果顯示,干旱脅迫響應的關鍵基因RD29A,隨著時間的變化在野生型及單突變體中呈現明顯的上升趨勢,而在雙突變體中呈現明顯的下降趨勢(圖7),表明CPK10/CPK30基因與水分脅迫響應相關。OST1是依賴于ABA的干旱脅迫信號途徑的關鍵基因。通過檢測發現,雙突變體中OST1基因在干旱處理0.5 h時表達量增加,而后又逐漸恢復到原來的水平;而在野生型與單突變體中OST1的表達量并沒有明顯變化(圖7)。這預示著CPK10與CPK30基因可能共同參與了ABA依賴的干旱脅迫信號轉導過程。那么,在該信號途徑中這2個基因是否參與了對ABA合成的調控。接下來,選擇了ABA合成關鍵基因ABA3和轉錄因子MYB2作為標記基因,結果顯示這2個基因在干旱處理下的表達趨勢在4種不同材料中并沒有明顯差異(圖7),推測CPK10與CPK30可能在植株響應干旱脅迫過程中只參與ABA信號的轉導,并未參與ABA的合成。

圖7 干旱逆境標記基因的RT-PCR分析
3 討論
對于多基因家族,一些成員表現為功能冗余,可使得植物對不良環境做出適應性調整。CDPKs家族成員在植物響應非生物逆境過程中發揮著重要作用,有些核心CDPKs對植物生存至關重要,序列同源性較高的CDPK基因,功能相似或冗余的可能性較大,如擬南芥CPK4、CPK5、CPK6和CPK11幾個成員共同參與調控早期MAMP信號途徑中基因的表達,4個成員同時缺失的突變體對flg22的抗性明顯減弱[15]。馬鈴薯StCDPK4和StCDPK5共同參與對NADPH氧化酶的磷酸化,進而促使活性氧爆發[16]。AtCPK4、AtCPK11[11]、AtCPK10、AtCPK30和AtCPK32[17]都能通過轉錄因子ABF4調控植物對ABA的響應。AtCPK10與AtCPK30具有高度的序列相似性,本研究通過構建二者的T-DNA插入雙突變體,進而分析探討二者響應非生物逆境方面的功能。結果表明,幼苗期各種處理條件下雙突變體與野生型無差異;成苗時期干旱處理條件下,雙突變體與cpk10單突變體沒有表型差異。由表型檢測結果推測,在植株成苗期對干旱逆境的應答過程中,CPK10和CPK30二者并不存在功能冗余。接下來的轉錄水平檢測顯示,CPK30參與了對干旱逆境的應答,表型檢測和轉錄水平檢測結果的不一致性,暗示著在應答干旱逆境過程中,可能還有該家族的其他成員發揮功能。
CDPK屬于鈣受體激酶,逆境脅迫引發的鈣信號經CDPK傳遞給下游哪些蛋白,這是探討CDPK作用機制的關鍵所在。AtCPK10和AtCPK30是CDPK家族中最早報道的正向調控ABA信號的蛋白因子[18-19]。本研究結果顯示,CPK10/CPK30在植株響應干旱脅迫過程中參與ABA信號的轉導過程,這與前人研究結果一致。體外試驗證明,AtCPK10、AtCPK30都能通過轉錄因子ABF4調控植物對ABA的響應,表明CDPK介導的ABA信號的轉錄調控可能是通過轉錄因子ABFs起作用。體內試驗也證實了這一點:AtCPK32可以體內激活ABF4并啟動下游基因的表達[17]。AtCPK4、AtCPK11可以調控ABF1和ABF4而影響逆境基因的表達,cpk4/cpk11雙突變體表現出耐旱力減弱,雙突變體中ABA響應的基因表達受到影響[11]。同樣水稻的OsCPK21[20]過表達后,ABA響應基因會因ABFs活性變化而改變。CPK10[5]與CPK30[14]二者均定位于細胞膜,它們在體內是否會直接影響到細胞核中ABFs的活性,它們如何通過磷酸化作用將干旱逆境信號向下傳遞,這是我們將來進一步探討的方向。
通過雜交獲得cpk10×cpk30雙突變體;表型檢測得出,在種子萌發過程和幼苗時期CPK10和CPK30可能不是參與非生物逆境響應的關鍵蛋白;在植株成苗期二者參與干旱脅迫響應,并在依賴ABA的逆境響應信號途徑中發揮功能。
[1]Qin L X,Nie X Y,Hu R,et al.Phosphorylation of serine residue modulates cotton Di19-1 and Di19-2 activities for responding to high salinity stress and abscisic acid signaling[J].Scientific Reports,2016,6:20371.
[2]Urao T,Katagiri T,Mizoguchi T,et al.Two genes that encode Ca2+dependent protein kinases are induced by drought and high-salt stresses inArabidopsisthaliana[J].Molecular & General Genetics,1994,244(4):331-340.
[3]Zhao R,Sun H,Zhao N,et al.The arabidopsis Ca2+dependent protein kinase CPK27 is required for plant response to salt-stress[J].Gene,2015,563(2):203-214.
[4]Zou J J,Li X D,Ratnasekera D,et al.Arabidopsiscalcium-dependent protein KINASE8 and CATALASE3 function in abscisic Acid-Mediated signaling and H2O2homeostasis in stomatal guard cells under drought stress[J].The Plant Cell,2015,27(5):1445-1460.
[5]Zou J J,Wei F J,Wang C,et al.Arabidopsis calcium-dependent protein kinase CPK10 functions in abscisic acid-and Ca2+-mediated stomatal regulation in response to drought stress[J].Plant Physiology,2010,154(3):1232-1243.
[6]Jiang S,Zhang D,Wang L,et al.A maize calcium-dependent protein kinase gene,ZmCPK4,positively regulated abscisic acid signaling and enhanced drought stress tolerance in transgenicArabidopsis[J].Plant Physiology and Biochemistry,2013,71:112-120.
[7]Dubrovina A S,Kiselev K V,Khristenko V S,et al.VaCPK20,a calcium-dependent protein kinase gene of wild grapevineVitisamurensisRupr.,mediates cold and drought stress tolerance[J].Journal of Plant Physiology,2015,185:1-12.
[8]Vivek P J,Tuteja N,Soniya E V.CDPK1 from ginger promotes salinity and drought stress tolerance without yield penalty by improving growth and photosynthesis inNicotianatabacum[J].PLoS One,2013,8(10):e76392.
[9]Asano T,Hayashi N,Kobayashi M,et al.A rice calcium-dependent protein kinase OsCPK12 oppositely modulates salt-stress tolerance and blast disease resistance[J].The Plant Journal:for Cell and Molecular Biology,2012,69(1):26-36.
[10]Franz S,Ehlert B,Liese A,et al.Calcium-dependent protein kinase CPK21 functions in abiotic stress response inArabidopsisthaliana[J].Molecular Plant,2011,4(1):83-96.
[11]Zhu S Y,Yu X C,Wang X J,et al.Two calcium-dependent protein kinases,CPK4 and CPK11,regulate abscisic acid signal transduction inArabidopsis[J].The Plant Cell,2007,19(10):3019-3036.
[12]Gutermuth T,Lassig R,Portes M T,et al.Pollen tube growth regulation by free anions depends on the interaction between the anion Channel SLAH3 and calcium-dependent protein kinases CPK2 and CPK20[J].The Plant Cell,2013,25(11):4525-4543.
[13]Hettenhausen C,Yang D H,Baldwin I T,et al.Calcium-dependent protein kinases,CDPK4 and CDPK5,affect early steps of jasmonic acid biosynthesis inNicotianatabacum[J].Plant Signaling & Behavior,2013,8(1):e22784.
[14]Yuan X,Deng K Q,Zhao X Y,et al.A calcium-dependent protein kinase is involved in plant hormone signal transduction inArabidopsis[J].Journal of Plant Physiology and Molecular Biology,2007,33(3):227-234.
[15]Boudsocq M,Willmann M R,Mccormack M,et al.Differential innate immune signalling via Ca2+sensor protein kinases[J].Nature,2010,464(7287):418-422.
[16]Witte C P,Keinath N,Dubiella U,et al.Tobacco calcium-dependent protein kinases are differentially phosphorylatedinvivoas part of a kinase cascade that regulates stress response[J].The Journal of Biological Chemistry,2010,285(13):9740-9748.
[17]Choi H I,Park H J,Park J H,et al.Arabidopsiscalcium-dependent protein kinase AtCPK32 interacts with ABF4,a transcriptional regulator of abscisic acid-responsive gene expression,and modulates its activity[J].Plant Physiology,2005,139(4):1750-1761.
[18]Simeunovic A,Mair A,Wurzinger B,et al.Know where your clients are:subcellular localization and targets of calcium-dependent protein kinases[J].Journal of Experimental Botany,2016,67(13):3855-3872.
[19]Sheen J.Ca2+-dependent protein kinases and stress signal transduction in plants[J].Science,1996,274(5294):1900-1902.
[20]Asano T,Hakata M,Nakamura H,et al.Functional characterisation of OsCPK21,a calcium-dependent protein kinase that confers salt tolerance in rice[J].Plant Molecular Biology,2011,75(1/2):179-191.
Construction and Phenotype Analysis of CPK10/CPK30 Double MutantinArabidopsis
XIE Xin,SUN Ning,WEI Fengju
(College of Life Sciences,Agricultural University of Hebei,Hebei Province Key Laboratory of Plant Physiology and Molecular Pathology,Baoding071001,China)
Calcium-dependent protein kinases (CDPKs) function as Ca2+sensor in various plant physiological processes.CPK10 was one member of CDPK family.In order to investigate the molecular mechanisms ofCPK10 and it′s high homologyCPK30 in response to stress,cpk10×cpk30 double mutant was firstly constructed.The phenotypes in response to various stress were detected,and the RT-PCR method was used to analyzed the two genes expression.The results showed that there was no difference in the seed germination stage between double mutant and wild-type plants in the treatment of drought,salt and ABA.In the mature stage,double mutant exhibited no difference to drought stress compared with wild-type and single mutant.Nevertheless,the expression levels ofRD29Awas decreased in the double mutant and showed opposite trend in wild-type and single mutant during drought stress.The expression of ABA-responsive geneOST1 was enhanced obviously in double mutant after drought stress 0.5 h.Thecpk10×cpk30 double mutant was successfully obtained.Our data indicated thatCPK10 andCPK30 might be involved in ABA-dependent signal transduction pathway,and showed redundant functions.
CDPK;Double mutant;Adversity stress;Phenotype analysis
2016-05-18
國家自然科學基金專項(31040052);國家自然科學基金青年基金項目(31101022);植物生理學與生物化學國家重點實驗室開放課題項目(SKLPPBKF1504)
謝鑫(1990-),女,河北邯鄲人,在讀碩士,主要從事植物逆境研究。謝鑫、孫寧為同等貢獻作者。
魏鳳菊(1979-),女,河北衡水人,講師,博士,主要從事植物抵抗逆境分子機制方面的研究。
Q78
A
1000-7091(2016)04-0094-06
10.7668/hbnxb.2016.04.016

