羧甲基纖維素鈉/坡縷石(CMC/PGS)復合材料的制備及其對Pb(II)的吸附
楊發翠,孫士淇,常 玥,2,3,查 飛
(1.西北師范大學化學化工學院,蘭州 730070;2.生態環境相關高分子材料教育部重點實驗室,蘭州 730070;3.甘肅省高分子材料重點實驗室,蘭州 730070)
?
羧甲基纖維素鈉/坡縷石(CMC/PGS)復合材料的制備及其對Pb(II)的吸附
楊發翠1,孫士淇1,常玥1,2,3,查飛1
(1.西北師范大學化學化工學院,蘭州730070;2.生態環境相關高分子材料教育部重點實驗室,蘭州730070;3.甘肅省高分子材料重點實驗室,蘭州730070)
堿性條件下,將羧甲基纖維素鈉(CMC)負載到γ-(2,3-環氧丙氧)丙基三甲氧基硅烷(KH-560)修飾的坡縷石(PGS)表面,得到羧甲基纖維素鈉/坡縷石(CMC/PGS) 復合材料,利用FT-IR、XRD和SEM/EDS對其進行表征。考察了溶液pH值、吸附時間、吸附溫度、Pb2+濃度對Pb2+吸附量的影響,當溫度為291 K時, 在初始質量濃度為100 mg/L 、pH=5.0的Pb2+水溶液中,加入10 mg 吸附劑對Pb2+的最大吸附量是97.8 mg/g,該吸附劑對Pb2+的等溫吸附曲線屬于Langmuir 型。
羧甲基纖維素鈉; 坡縷石; 吸附; Pb2+
1 引 言
坡縷石(PGS)是常見的硅酸鹽黏土之一,表面存在電荷不平衡現象,通過靜電作用或離子交換可吸附重金屬離子,是一種價廉高效的天然吸附劑[1-4]。但天然坡縷石的吸附容量較低,為提高它的吸附能力,可通過改性增加坡縷石的吸附活性位點,提高坡縷石的吸附容量,用于重金屬、有機污染物吸附處理[5-7]。
纖維素是目前已知儲量最多的天然高分子,由于它價廉、可生物降解對環境不會產生污染,適合用做生物質吸附材料。羧甲基纖維素鈉(CMC)為改性纖維素之一,含有羧基基團,具備陰離子聚電解質的特點,即:pH值敏感性、耐酸性及耐鹽性較強,所以,羧甲基纖維素適合作為重金屬離子污水處理的原料。但在實際應用中,由于CMC易溶于水且力學性能低限制了其廣泛應用,為解決這一問題,需要對CMC進行改性[8-11],較常見的方法是聚乙烯醇、殼聚糖、聚多胺等有機高分子與羧甲基纖維素鈉交聯[8,10,12]。黏土改性的吸附材料并不多見。
本實驗利用硅烷偶聯劑KH-560將羧甲基纖維素鈉固載到坡縷石表面,用于去除模擬廢水中的Pb2+,期望既提高羧甲基纖維素的力學性能,又提高坡縷石的吸附容量。
2 實 驗
2.1試劑及儀器
坡縷石(PGS),江蘇盱眙康隆礦業科技開發有限公司;γ-(2,3-環氧丙氧) 丙基三甲氧基硅烷(KH-560),南京曙光化工廠;羧甲基纖維素鈉(CMC),天津市凱通化學試劑有限公司;Pb(NO3)2,Ni(NO3)2,Cu(NO3)2,NaOH,HCl等均為AR,天津大茂化學試劑廠;水溶液均用二次蒸餾水配制。
Merlin FTS 3000 FTIR 紅外光譜儀(Digilab,American),KBr 壓片,4000~400 cm-1攝譜; JSM-3500 型掃描電鏡(JEOL,Japan);D/Max-2400 型XRD 射線衍射儀(Rigaku,Japan);Hitachi Z-2000 原子吸收儀(Hitachi,Japan);PB-10酸度計(Sartorius,Germany)。
2.2CMC/PGS復合材料的制備
坡縷石原土的酸化同文獻[7]的方法。坡縷石的羥化:分別量取25 mL H2O2、50 mL H2O裝入250 mL 燒瓶內,用Na2SiO3調pH值為10后,加入5 g酸化坡縷石,在50 ℃的水浴中攪拌7 h。過濾分離,產物用蒸餾水洗至中性,80 ℃下烘干,得到羥化坡縷石。
室溫下,將0.1 g CMC溶解在4 mL 1 mol/L 的NaOH溶液中,攪拌1 h后加入1 mL KH-560繼續攪拌4 h超聲30 min,加入上述制備的0.4 g羥化坡縷石,室溫下繼續攪拌6 h,過濾,固體干燥后,研磨,并用二次水洗至中性,80 ℃下烘干備用。
2.3吸附實驗
Pb2+標準儲備液(1000 mg/L)的配制:將1.599 g Pb(NO3)2加入到裝有100 mL二次水的1 L容量瓶內,振蕩溶解,再加入1 mL 50% HNO3水溶液(水∶HNO3=1∶1(體積比)),用二次水稀釋至刻度。其他質量濃度的Pb2+溶液均通過稀釋儲備液得到。
將10 mg CMC/PGS加入到100 mL 具塞錐形瓶中,移取10 mL 一定質量濃度的Pb2+溶液,置于振蕩器中振蕩2 h,吸附完成后將溶液過濾,用原子吸收儀測定濾液的Pb2+濃度。初始Pb2+溶液的不同pH值用0.1 mol/L HCl 或0.1 mol/L NaOH 調節。Pb2+的吸附量由下式計算得到:
式中:C0是Pb2+溶液的初始質量濃度(mg/L) ;Ce是吸附平衡時Pb2+溶液的質量濃度(mg/L) ;Qe是CMC/PGS對Pb2+的吸附量(mg/g) ;V是Pb2+溶液的體積(L) ;m是CMC/PGS的質量(g) 。
3 結果與討論
3.1CMC/PGS復合材料的表征
3.1.1紅外光譜分析
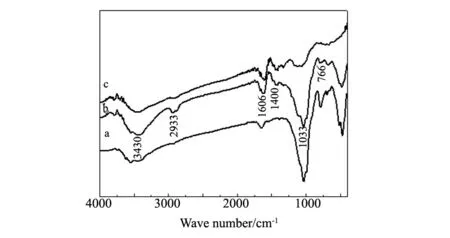
圖1 (a)PGS;(b)CMC/PGS;(c)CMC的FT-IR 譜圖Fig.1 FT-IR spectra of (a)PGS,(b)CMC/PGS and (c)CMC
PGS(a) 、CMC/PGS(b)和CMC(c)的紅外光譜圖如圖1所示,對比PGS(a)、CMC(c)的紅外吸收光譜,負載羧甲基纖維素鈉的坡縷石CMC/PGS(b),在3430 cm-1處的ν-OH比未負載前ν-OH增強,表明坡縷石負載CMC后-OH數目增多。同時,1033 cm-1、766 cm-1左右的Si-O 伸縮振動峰強度減弱,可能是坡縷石表面的羥基與CMC分子中的羥基、醚鍵以及羰基相互作用形成締合氫鍵的結果[8];2933 cm-1處的甲基、亞甲基伸縮振動吸收峰增強是硅烷偶聯劑KH-560的C-H與CMC中烷基的伸縮振動峰產生了疊加,1606 cm-1、1400 cm-1為COO-的伸縮振動及彎曲振動峰,說明羧甲基纖維素負載到坡縷石表面。
3.1.2電子掃描顯微鏡分析
PGS(a)、CMC/PGS(b) 的掃描電鏡照片及CMC/PGS(c)的EDS譜圖見圖2。棒狀PGS成束有序緊密地堆積在一起(圖2a),負載CMC后,PGS表面包覆著CMC,并且粘結在一起(圖2b),使PGS致密有序的晶束被打亂,表面粗糙度增大,可提高吸附性[19]。此外,在EDS譜圖中,碳與氧兩種元素的峰很強,表明CMC已被負載。

圖2 PGS(a),CMC/PGS(b) 的掃描電鏡照片及CMC/PGS(c)的EDS譜圖Fig.2 SEM images of PGS(a),CMC/PGS(b) and EDS of CMC/PGS(c)
3.1.3X射線粉末衍射分析
圖3是PGS(a)、CMC/PGS(b)、CMC(c)的X 射線粉末衍射譜圖,圖3a中2θ=8.6°、19.9°、26.6°、35.3°,分別對應坡縷石的(110)、(040)、(400)、(440)晶面[7]。當PGS負載CMC后,PGS的特征衍射峰位置沒有變化,表明負載在PGS表面的CMC對PGS的納米棒狀晶體結構沒有影響。由于CMC是無定型結構,CMC在2θ= 21°出現一個寬的衍射峰,通過KH-560將其固載到PGS表面后,PGS(a)的結晶度有所下降,13.6°、16.7°兩處的衍射峰幾乎消失。
3.2吸附性能
3.2.1體系pH值對金屬離子吸附量影響
溶液的pH值影響吸附劑表面電荷、官能團的離子度以及金屬離子的存在形式,因此,pH對溶液中金屬離子的去除有很大的影響[8](圖4)。291 K,初始質量濃度為100 mg/L 的Pb2+水溶液中,加入10 mg 吸附劑,Pb2+的吸附量隨體系pH值變大呈遞增趨勢。pH = 3.0 時, CMC/PGS對Pb2+的吸附量為69.4 mg/g,是pH = 2.5時吸附量的3倍;當體系pH 值增至5時,吸附量可達96.4 mg/g,而相同實驗條件下等量的坡縷石對Pb2+的吸附量為48.6 mg/g;比硅烷偶聯劑KH-560改性坡縷石及羧甲基纖維素鈉與坡縷石物理共混物的吸附量,分別增加了45.2、16.5 mg/g。該實驗結果表明,pH≤2.5時,溶液中大量的H+和 Pb2+競爭有限的吸附點,Pb2+吸附量小,而體系pH值的增大有利于對Pb2+的吸附,與羧甲基纖維素鈉中的-COOH、-OH的解離程度有關,溶液pH值較大時,體系中質子化羧基數目減少,引起官能團之間的靜電引力或靜電斥力的改變,其中COO-對Pb2+具有更強的靜電引力和螯合作用。同時這些基團具有兩性,可適當地緩沖反應介質pH值的變化[12],避免了氫氧化物沉淀的生成。因此,選擇溶液pH=5研究其他吸附條件對Pb2+吸附量的影響。
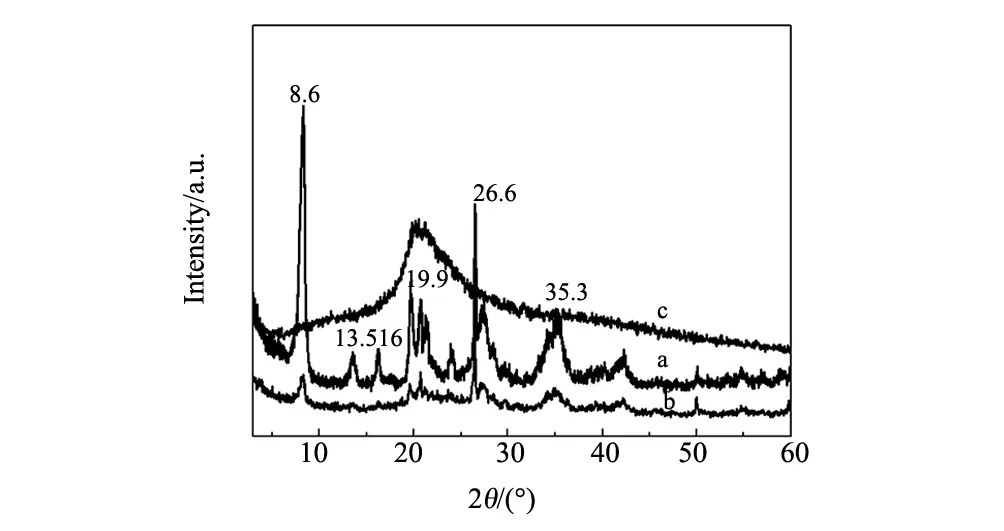
圖3 (a)PGS;(b)CMC/PGS;(c)CMC的XRD 曲線Fig.3 XRD patterns of (a)PGS,(b)CMC/PGS and (c)CMC
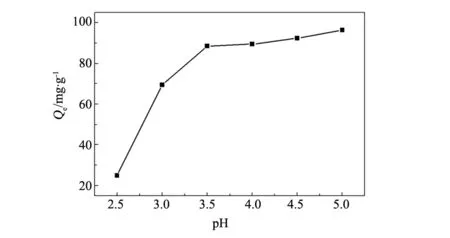
圖4 pH值對Pb2+吸附量的影響Fig.4 Effect of pH on adsorption capacity of Pb2+
3.2.2振蕩時間對吸附量的影響
291 K時,在初始質量濃度為100 mg/L、pH=5 的Pb2+溶液中加入10 mg CMC/PGS,考察吸附時間對吸附劑吸附量的影響,結果見圖5。CMC/PGS對Pb2+的吸附為快速吸附過程,開始2 min,吸附量可達77.2 mg/g,隨后增速減慢,吸附4 min時,吸附量增加到92.6 mg/g,在 15 min 時達到吸附平衡,吸附量是97.3 mg/g。可能是該吸附劑外層的羧甲基纖維素鈉是強的親水性聚合物,與水的親和力能使其快速溶脹,有利于Pb2+的去除。隨著吸附時間的延長,復合材料上的活性位點數量減少,吸附能力減弱,吸附量增加幅度變小。
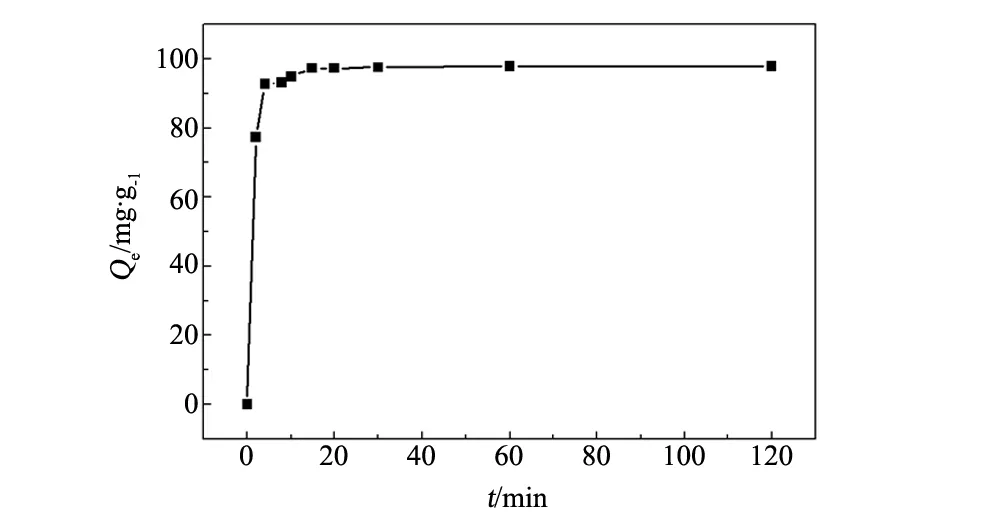
圖5 吸附時間對Pb2+吸附量的影響Fig.5 Effect of time on adsorption capacity of Pb2+
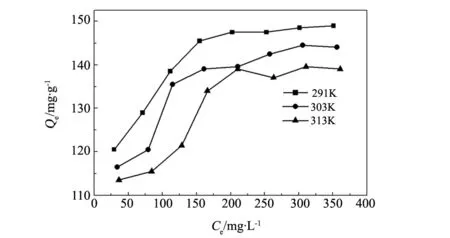
圖6 不同溫度下CMC/PGS吸附Pb2+的等溫吸附曲線Fig.6 Equilibrium isotherms of Pb2+ adsorption by CMC/PGS at different temperatures
3.2.3等溫吸附線
考察291、303和 313 K時,不同初始質量濃度的Pb2+溶液在 pH=5,加入CMC/PGS 10 mg ,吸附達到平衡時溶液濃度與吸附量的關系(圖6)。三種溫度下,CMC/PGS對 Pb2+的吸附量隨Pb2+初始濃度的增大而增加,當 Pb2+的初始質量濃度大于 300 mg/L時,Pb2+吸附量增加變緩,可認為達到吸附平衡。
實驗測得數據分別用Langmuir 方程和 Freundlich 方程對進行擬合(表 1)。
式中:Qe是平衡狀態時Pb2+的吸附量(mg/g),Qm是吸附劑對Pb2+的最大吸附量(mg/g),b為Langmuir方程的吸附系數,K(mg/g)為Freundlich方程的吸附常數,n描述等溫線的變化趨勢,n>1為優先吸附。
由表1的擬合數據R2可知,CMC/PGS的等溫吸附模型更符合Langmuir等溫吸附模型,CMC/PGS對Pb2+的理論最大吸附量為153.6 mg/g,表明CMC/PGS對Pb2+的吸附是單層吸附。溫度由291 K升至313 K,CMC/PGS的吸附量從153.6 mg/g下降至146.6 mg/g,Langmuir常數b也在降低,這表明吸附過程以物理吸附為主,Pb2+在低溫下更有利于吸附,該吸附劑對 Pb2+的吸附是一個放熱過程。
另外,利用無量綱的分離參數RL衡量了Langmuir等溫吸附過程是否容易進行。
RL= 1/(1+bC0)
式中:b是Langmuir常數,C0是的Pb2+初始質量濃度(mg/L)。當RL=0時,表明吸附過程不可逆;0
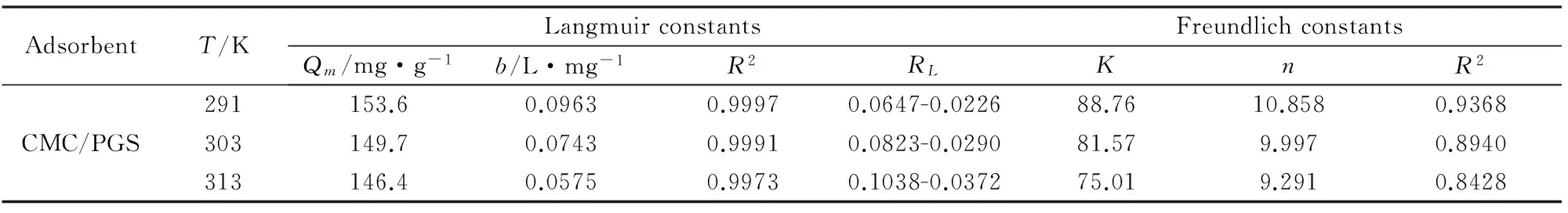
表1 不同溫度下CMC/PGS對Pb2+吸附的等溫吸附參數
4 結 論
291 K時,CMC/PGS復合材料在pH=5.0、初始質量濃度為100 mg/L的Pb2+溶液中,振蕩15 min達到吸附平衡,最大吸附量97.8 mg/g,大于相同條件下硅烷偶聯劑KH-560改性坡縷石[13]、羧甲基纖維素鈉與坡縷石共混物對Pb2+的吸附(前者51.2 mg/g,后者79.9 mg/g);該吸附劑對Pb2+的吸附等溫實驗符合Langmuir 模型,為放熱過程。CMC/PGS吸附劑對Pb2+的吸附容量較大,易于分離,可提高坡縷石對金屬離子的吸附量,也利于CMC在廢水處理中的應用,為二者的簡單改性吸附廢水中的重金屬離子提供依據。
[1] 陳浩,趙杰.凹凸棒與酸化凹凸棒對Pb(Ⅱ)和Zn(Ⅱ)的選擇吸附性差異[J].材料工程,2008,(10):154-157.
[2] Chen H,Zhao Y G,Wang A Q.Removal of Cu(II) from aqueous solution by adsorption onto acid-activated palygorskite[J].JournalofHazardousMaterials,2007,149(2):346-354.
[3] Wang W J,Chen H,Wang A Q.Adsorption characteristics of Cd(II) from aqueous solution onto activated palygorskite[J].SeparationandPurificationTechnology,2007,55(2):157-164.
[4] Fan Q H,Shao D D,Lu Y,et al.Effect of pH, ionic strength, temperature and humic substances on the sorption of Ni(II) to Na-attapulgite[J].ChemicalEngineeringJournal,2009,150(1): 188-195.
[5] 常玥,祁彩菊,魯峰,等.有機坡縷石吸附Cu(II) 的研究[J].硅酸鹽通報,2011,30(6):1268-1272.
[6] Wu J,Chen J.Adsorption characteristics of tannic acid onto the novel protonated palygorskite/chitosan resin microspheres[J].JournalofAppliedPolymerScience,2013,127(3):1765-1771.
[7] Ye H P,Chen F Z,Sheng Y Q,et al.Adsorption of phosphate from aqueous solution onto modified palygorskites[J].SeparationandPurificationTechnology,2006,50(3):283-290.
[8] Zohuriaan-Mehr M J,Pourjavadib A,Salehi-Rad M.Modified CMC.2.Novel carboxymethylcellulose-based poly(amidoxime) chelating resin with high metal sorption capacity[J].Reactive&FunctionalPolymers,2004,61(1):23-31.
[9] 王華,何玉鳳,何文娟,等.纖維素的改性及在廢水處理中的應用研究進展[J].水處理技術,2012,38(5):1-6.
[10] Kono H.Characterization and properties of carboxymethyl cellulose hydrogels crosslinked by polyethylene glycol[J].CarbohydratePolymers,2014,106:84-93.
[11] Zhou D,Zhang L N,Guo S L.Mechanisms of lead biosorption on cellulose/chitin beads[J].WaterResearch,2005,39(16):3755-3762.
[12] Sema Ekici.Intelligent poly(N-isopropylacrylamide)-carboxymethyl cellulose full interpenetrating polymeric networks for protein adsorption studies[J].JournalofMaterialsScience,2011,46(9):2843-2850.
[13] Liu Y,Liu Z C,Gao J,et al.Selective adsorption behavior of Pb(II) by mesoporous silica SBA-15-supported Pb(II)-imprinted polymer based on surface molecularly imprinting technique[J].JournalofHazardousMaterials,2011,186(1):197-205.
Preparation of Carboxymethyl Cellulose /Palygorskite(CMC/PGS) and Adsorption Property for Pb(II)
YANGFa-cui1,SUNShi-qi1,CHANGYue1,2,3,ZHAFei1
(1.College of Chemistry & Chemical Engineering,Northwest Normal University,Lanzhou 730070,China;2.Key Laboratory of Eco-Environment-Related Polymer Materials Ministry of Education,Lanzhou 730070,China;3.Key Laboratory of Polymer Material of Gansu Province,Lanzhou 730070,China)
The materials were prepared by combining sodium carboxymethyl cellulose and palygorskite using γ-(2,3-epoxypropoxy)propytrimethoxysilane(KH-560) as the crosslinking agent in alkaline solution. The materials were characterized by FT-IR, XRD and SEM/EDS analysis techniques. The effects adsorption ability of CMC/PGS for Pb2+were studied such as solution pH values, time of adsorption, temperature of adsorption and solution concentration of Pb2+. The results indicated that the maximum adsorption capacity for Pb2+was 97.8 mg/g at 291 K, pH 5.0 and the amount of the adsorbent was 10 mg when the initial concentration of Pb2+was 100 mg/L. The adsorption isotherms of Pb2+could be well described with the Langmuir equation.
sodium carboxymethyl cellulose;palygorskite;adsorption;Pb2+
國家自然科學基金(21161017)
楊發翠(1989-),女,碩士研究生.主要從事功能材料的制備及吸附性能方面的研究.
常玥,教授.
TQ085
A
1001-1625(2016)01-0025-05

