晚期垃圾滲濾液厭氧氨氧化脫氮及其抑制動力學(xué)
李 蕓,李 軍*,蔡 輝,陳 剛,侯愛月,胡 嘯,卞 偉,國瑞峰,劉一夫
?
晚期垃圾滲濾液厭氧氨氧化脫氮及其抑制動力學(xué)
李 蕓1,李 軍1*,蔡 輝2,陳 剛2,侯愛月1,胡 嘯2,卞 偉1,國瑞峰2,劉一夫2
(1北京工業(yè)大學(xué)建筑工程學(xué)院,北京市水質(zhì)科學(xué)與水環(huán)境恢復(fù)工程重點實驗室,北京 100124;2.中國城市建設(shè)研究院有限公司,北京 100012)
采用晚期垃圾滲濾液對UASB反應(yīng)器中無機環(huán)境培養(yǎng)條件下厭氧氨氧化菌進行馴化,探討基質(zhì)濃度和水力停留時間對系統(tǒng)運行性能的影響,通過批式試驗分別對基質(zhì)和垃圾滲濾液抑制厭氧氨氧化動力學(xué)進行測定并建立相應(yīng)的動力學(xué)模型.結(jié)果表明,經(jīng)過75d的運行,系統(tǒng)逐漸適應(yīng)垃圾滲濾液并實現(xiàn)高效脫氮.基質(zhì)的去除量隨進水基質(zhì)濃度的升高呈先升高后降低的變化趨勢.隨著HRT的延長,進水基質(zhì)及滲濾液濃度逐漸升高,系統(tǒng)脫氮效果降低.厭氧氨氧化基質(zhì)抑制的閾值是NH4+-N濃度為489.03mg/L和NO2--N濃度為192.36mg/L.當以銨鹽為抑制劑時,max(NH4+-N)為0.1893mg/(mg·d),半飽和常數(shù)為39.39mg/L,抑制動力學(xué)常數(shù)為3482.27mg/L.當以亞硝酸鹽為抑制劑時,max(NO2--N)為0.246mg/(mg·d),半飽和常數(shù)為43.19mg/L,抑制動力學(xué)常數(shù)為701.15mg/L.厭氧氨氧化受垃圾滲濾液影響尤為顯著,垃圾滲濾液條件下厭氧氨氧化活性被完全抑制的濃度為1450.69mg/L (以COD計) .
晚期垃圾滲濾液;厭氧氨氧化;脫氮;抑制動力學(xué)
垃圾填埋場所產(chǎn)生的垃圾滲濾液具有有機物和氨氮濃度大、高鹽度以及重金屬繁多等特點[1-2],如果處置不當則會對周圍的地表和地下水造成危害.垃圾滲濾液根據(jù)填埋時間的長短分為早期、中期和晚期,早期垃圾滲濾液中的碳氮比較高,且有機物大多易生化降解,在常規(guī)硝化反
硝化脫氮工藝中可為反硝化菌利用,從而節(jié)省碳源投加;而晚期垃圾滲濾液中的碳氮比較低,且大多為難降解有機物,在采用常規(guī)硝化反硝化工藝脫氮過程中需要補充大量碳源,造成處理成本增高[3].此外,常規(guī)硝化反硝化脫氮工藝會產(chǎn)生大量污泥,增加水廠運行負擔.實現(xiàn)晚期垃圾滲濾液的高效低耗脫氮是目前的難題之一.
厭氧氨氧化工藝是一種新興的高效節(jié)能脫氮工藝,其原理為厭氧氨氧化菌利用氨氮和亞硝氮為基質(zhì),并以無機碳作為碳源,以實現(xiàn)自養(yǎng)脫氮[4];該工藝是目前最為經(jīng)濟快捷的脫氮途徑[5-6],在污廢水生物脫氮領(lǐng)域(尤其是低有機碳高氨氮污廢水)應(yīng)用前景廣闊.對于晚期垃圾滲濾液來說采用厭氧氨氧化工藝進行脫氮是比較適合的[7].然而,厭氧氨氧化菌生長緩慢,繁殖周期長[8-9],且其活性易于被污廢水中的有機物[10-11]、鹽度[12-13]和重金屬[14]等毒性物質(zhì)抑制.此外,高濃度的基質(zhì)也會對其活性產(chǎn)生抑制作用[15-16],從而導(dǎo)致工藝難于高效穩(wěn)定的運行.
因此,本文擬采用晚期垃圾滲濾液對無機環(huán)境培養(yǎng)條件下厭氧氨氧菌化進行馴化,穩(wěn)定運行后分別提高基質(zhì)進水濃度和調(diào)節(jié)系統(tǒng)水力停留時間,考察基質(zhì)及垃圾滲濾液對系統(tǒng)運行性能的沖擊以及探討運行過程中的基質(zhì)及垃圾滲濾液抑制,并通過批試試驗分別對基質(zhì)及垃圾滲濾液的抑制動力學(xué)進行測定并建立相應(yīng)的動力學(xué)模型.以期為晚期垃圾滲濾液厭氧氨氧化工藝脫氮的實際應(yīng)用及運行提供參考和依據(jù).
1 材料與方法
1.1 試驗種泥和裝置
種泥為本實驗室升流式厭氧污泥床(up- flow anaerobic sludge blanket, UASB)厭氧氨氧化反應(yīng)器(有效體積為50L)中采用無機配水培養(yǎng)的ANAMMOX顆粒污泥,顏色為磚紅色,反應(yīng)器中ANAMMOX細菌種屬主要為(JX852965-JX8529 69), 該反應(yīng)器已穩(wěn)定運行2~3年.試驗接種污泥濃度(MLVSS)為5g/L左右.
圖1為試驗所采用的UASB反應(yīng)器,其有效容積為10L,采用黑色軟性材料包裹以避光,內(nèi)部上1/3部分添加直徑為10cm的球形填料以減少污泥的流失.進水由蠕動泵泵入反應(yīng)器底部,控制溫度為25℃左右,HRT為1.2h,進水pH值為7.5~8.0.
1.2 抑制動力學(xué)批試試驗
取UASB反應(yīng)器中厭氧氨氧化顆粒污泥(第74d),采用磷酸緩沖鹽溶液(phosphate buffer saline, PBS)清洗3遍以去除基質(zhì),經(jīng)濾紙過濾后用分析天平稱取濕污泥12g加入至500mL血清瓶,瓶口橡膠塞開有3個孔,分別用于取樣、水封及插溫度探頭.溫度控制在(25±1)℃,pH值為7.5~7.8,采用10mL注射器取樣,厭氧氨氧化活性和反硝化活性試驗用高純氮氣(99.999%)曝氣30min以脫氧.采用磁力攪拌器控制溶液混合均勻,磁力攪拌器轉(zhuǎn)子轉(zhuǎn)速控制在200r/min左右.以NH4+-N為單因子抑制的序批式試驗中,控制其他條件一定, NH4+-N所設(shè)梯度分別為:60,100, 150,200,300,500,700,900mg/L左右.以NO2--N為單因子抑制的序批式試驗中,同樣控制其他條件一定,而NO2--N所設(shè)梯度分別為:80,100,150, 200,250,300,400,500mg/L左右.滲濾液抑制序批式試驗中,以COD計,所取垃圾滲濾液濃度梯度分別為:0,120,230,460,780,980,1260mg/L左右,并以氯化銨調(diào)節(jié)各梯度NH4+-N濃度至460mg/L左右,以消除基質(zhì)濃度的影響.以碳酸氫鈉和鹽酸調(diào)節(jié)堿度和pH值恒定,在恒溫培養(yǎng)箱中進行試驗,每間隔1h取樣測定NH4+-N、NO2--N和NO3--N,反應(yīng)結(jié)束后,采用干燥稱重法求得MLSS,并計算氨氮和亞氮的去除速率.所有測試設(shè)3個平行并求平均值.
1.3 垃圾滲濾液與試驗水質(zhì)
試驗所用滲濾液取自北京某垃圾填埋廠(填埋年限大于5年),為晚期滲濾液,取回后密閉貯存于塑料桶中,平均每月更新一次.具體水質(zhì)如下: NH4+-N為900~1500mg/L, NO2--N為0~2mg/L,硝態(tài)氮為0~8mg/L,COD 2000~4000mg/L,pH值7.5~8.5,堿度6000~10000mg/L.試驗進水以自來水稀釋垃圾滲濾液至所需氨氮濃度,并配以適量的亞硝酸鈉以提供厭氧氨氧化所需的電子受體.
1.4 測試分析方法
采用納氏試劑光度法測定NH4+-N[17];采用N-(1-萘基)-乙二胺分光光度法測定NO2--N[17];采用麝香草酚分光光度法測定NO3--N[17];采用過硫酸鉀氧化—紫外分光光度計法測定TN[17];采用重量法測定懸浮固體(MLSS)[17];采用WTW/Multi3420便攜式測定儀測定pH值、DO、溫度.
2 結(jié)果與討論
2.1 晚期垃圾滲濾液對厭氧氨氧化菌的馴化
實驗接種污泥為無機環(huán)境下培養(yǎng)的ANAMMOX顆粒污泥,運行的前7d進水為無機模擬廢水,接種ANAMMOX菌活性較高,第7d時NH4+-N、NO2--N及TN去除率分別為94.96%、98.59%和79.73%;在第8d加入滲濾液,其COD容積負荷為0.63kg COD/(m3·d),如圖2所示,滲濾液中的有機物以及一些毒性物質(zhì)對反應(yīng)器中的ANAMMOX菌造成一定影響,NH4+-N、NO2--N及TN去除效果分別降低至71.51%、78.77%和64.14%;后經(jīng)過大約7d的培養(yǎng)運行,其去除效果逐漸恢復(fù)至86.46%、98.84%和85.56%,并連續(xù)7d在高效脫氮的狀態(tài)下穩(wěn)定運行;第25d時,提高系統(tǒng)進水滲濾液濃度,COD容積負荷為1.60kg COD/(m3·d),滲濾液濃度提高帶入大量的有機物及毒害物質(zhì)對污泥活性產(chǎn)生抑制,NH4+-N、NO2--N及TN去除率逐漸降低,在第33d時,其去除率僅為34.45%、47.60%和37.66%,而后活性污泥逐漸適應(yīng)該濃度滲濾液下的水質(zhì),其活性逐漸恢復(fù),到47d時,去除率恢復(fù)至70.69%、88.01%和72.62%;之前進水NO2--N/NH4+-N平均比值為1.16,低于厭氧氨氧化反應(yīng)理論比值1.32;且在加入垃圾滲濾液后,因為有機物的存在,有部分NO2--N會因系統(tǒng)內(nèi)的反硝化反應(yīng)同步去除,從而導(dǎo)致用于厭氧氨氧化的NO2--N不足;因此,第48d時在維持進水NH4+-N及進水滲濾液濃度不變的情況下,適當提高NO2--N的濃度,以滿足厭氧氨氧化所需的電子受體;進水NO2--N/NH4+-N平均為1.42,稍微高于厭氧氨氧化理論比值1.32;此階段,NH4+-N和NO2--N出水平均濃度分別為6.09mg/L和5.97mg/L,在后10d(65~75d)NH4+-N、NO2--N和TN的平均去除率分別為96.12%、95.24%和86.66%;由此可見,ANAMMOX菌已經(jīng)逐步適應(yīng)垃圾滲濾液,并獲得了較高的脫氮效果.
2.2 基質(zhì)濃度對厭氧氨氧化的影響
NH4+-N和NO2--N是厭氧氨氧化的基質(zhì),然而如果濃度過高也會抑制其活性.為考察反應(yīng)器運行效能及基質(zhì)濃度對系統(tǒng)的影響,通過投加氯化銨和亞硝酸鈉分階段提高進水基質(zhì)濃度,直至TN出水去除率低于50%,共6個階段,每個階段運行10d;6個階段進水基質(zhì)NH4+-N和NO2--N的平均濃度濃度分別為59.66mg/L和82.29mg/ L(階段Ⅰ)、81.22mg/L和110.74mg/L(階段Ⅱ)、105.49mg/L和147.11mg/L(階段Ⅲ)、153.17mg/L和199.75mg/L(階段Ⅳ)、180.35mg/L和243.48mg/L(階段Ⅴ)、206.31mg/L和266.36mg/ L(階段Ⅵ).由圖3可知,前面3個階段隨著基質(zhì)濃度的升高,反應(yīng)器對基質(zhì)NH4+-N和NO2--N的平均去除率均保持在93%以上,對TN的平均去除率也保持在86%以上;當進水NH4+-N和NO2--N平均濃度濃度升高至153.17mg/L和199.75mg/L時,反應(yīng)器對NH4+-N、NO2--N和TN的平均去除率分別為77.44%、82.49%和74.83%.逐步提高基質(zhì)濃度,至階段Ⅴ時NH4+-N、NO2--N和TN的平均去除率分別為62.10%、63.50%和58.11%,至階段Ⅵ時NH4+-N、NO2--N和TN的平均去除率分別為51.06%、54.84%和49.04%.由此可見,在整個基質(zhì)濃度提高實驗中(NH4+-N平均濃度由59.66mg/L提高至206.31mg/L,亞氮平均濃度由82.29mg/L提高至266.36mg/L),隨著進水基質(zhì)濃度的提高,各氮素的去除效率先是基本維持不變(階段Ⅰ~Ⅲ),再呈逐步降低的變化(階段Ⅳ~Ⅵ).此外,從表1中數(shù)據(jù)可以看出,在階段Ⅰ~Ⅳ,隨著基質(zhì)濃度的逐漸提高,NH4+-N、NO2--N和TN的去除量逐漸升高;至階段Ⅳ時,NH4+-N、NO2--N和TN的去除量分別為118.63,164.78, 229.61mg/L,說明該基質(zhì)濃度為系統(tǒng)達到最高去除負荷所需要的進水基質(zhì)濃度.在階段Ⅳ~Ⅵ,隨著基質(zhì)濃度的逐漸提高,NH4+-N、NO2--N和TN的去除量有所降低;其可能是基質(zhì)濃度的升高對厭氧氨氧化菌產(chǎn)生抑制所造成的[18-19].
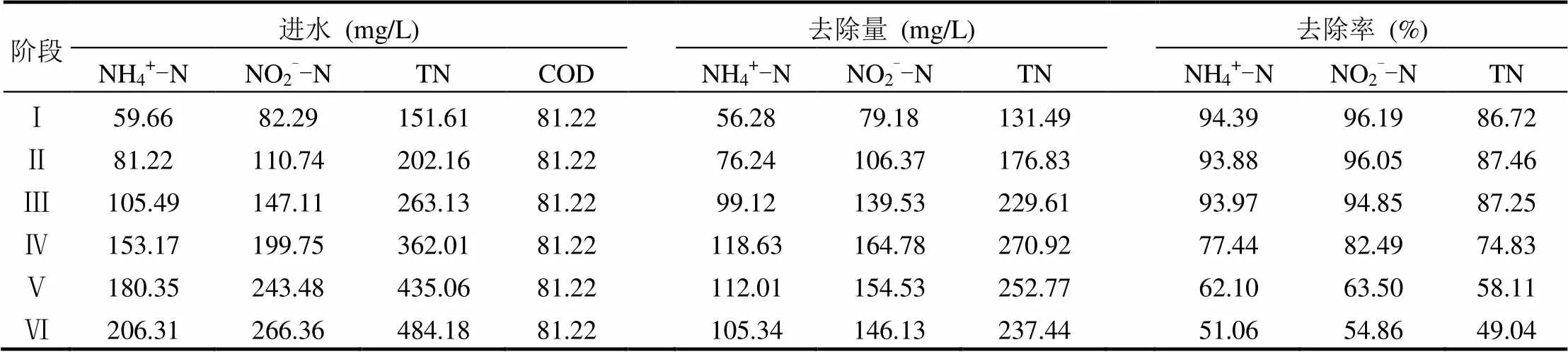
表1 基質(zhì)濃度實驗各階段氮素去除特性Table 1 The nitrogen removal characteristics in different stages of the substrate concentration experiment
2.3 水力停留時間對厭氧氨氧化的影響
基質(zhì)濃度實驗結(jié)束后,將進水基質(zhì)恢復(fù)至上述階段Ⅰ水平(NH4+-N和NO2--N的平均進水濃度分別為56.81,83.07mg/L),此時NH4+-N和NO2--N的平均去除量分別為54.31mg/L和79.10mg/L,NO2--N/NH4+-N的平均消耗比率為1.45,NH4+-N、NO2--N和TN的平均去除率分別為95.19%、93.21%和83.49%,可見在基質(zhì)溶度降低后,基質(zhì)抑制作用解除,厭氧氨氧化系統(tǒng)脫氮性能迅速恢復(fù).此后進行HRT實驗,實驗通過調(diào)節(jié)HRT和進水濃度維持進水總氮容積負荷()基本穩(wěn)定(NLRTN為2.7~3.1g/(L·d)),共分3個階段,第1、2和3階段HRT分別為1.20,1.75,3.70h,各運行15d.各階段進水基質(zhì)平均濃度如表2所示,在第1階段NH4+-N和NO2--N的平均去除率維持在95%以上,TN的平均去除率在85%以上.水力停留時間提高至1.75h,此時,進水NH4+-N和進水NO2--N平均濃度分別為85.02,113.48mg/L,與基質(zhì)濃度實驗的階段Ⅱ基本一致,該濃度下沒有基質(zhì)抑制現(xiàn)象,然而對比兩者各氮素的去除率可以明顯看出,HRT實驗較基質(zhì)濃度實驗大有降低,說明此時的抑制作用主要為垃圾滲濾液中毒性物質(zhì)的抑制.當水力停留時間提高至3.70h時,進水NH4+-N和進水NO2--N平均濃度分別為174.32,247.69mg/L,與基質(zhì)濃度實驗的階段Ⅴ基本一致,同樣HRT實驗中各氮素的去除率較基質(zhì)濃度實驗顯著降低,此時的抑制作用為基質(zhì)抑制和垃圾滲濾液中毒性物質(zhì)的抑制共同作用的結(jié)果.
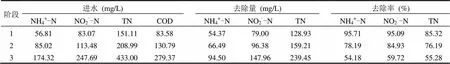
表2 HRT實驗各階段氮素去除特性Table 2 The nitrogen removal characteristics in different stages of HRT experiment
2.4 基質(zhì)和滲濾液對厭氧氨氧化的抑制及其動力學(xué)
厭氧氨氧化菌以無機碳為碳源, NH4+-N和NO2--N為基質(zhì),實現(xiàn)自養(yǎng)脫氮. NH4+-N和NO2--N作為厭氧氨氧化菌的底物,在較低濃度時厭氧氨氧化菌以其為基質(zhì),然而,在高濃度時則反而會抑制厭氧氨氧化菌的活性.此外,大多數(shù)有機物和重金屬等物質(zhì)都是厭氧氨氧化菌的抑制劑.垃圾滲濾液有高NH4+-N、高有機物和含有大量重金屬等特點,在利用厭氧氨氧化菌對其進行脫氮時,高濃度的基質(zhì)、有機物和重金屬等毒性物質(zhì)會抑制厭氧氨氧化菌的活性.通過批試實驗對反應(yīng)器中厭氧氨氧化污泥進行不同因子的抑制動力學(xué)測定并建立相應(yīng)的動力學(xué)模型.
2.4.1 基質(zhì)抑制及其動力學(xué) 基質(zhì)濃度對厭氧氨氧化活性的影響如表3所示,在實驗濃度范圍內(nèi),隨著基質(zhì)濃度的升高, NH4+-N和NO2--N的去除速率呈現(xiàn)先升高后降低的變化.在NH4+-N濃度為295.62mg/L時,厭氧氨氧化活性最高, NH4+-N的去除速率為0.154);而當NH4+-N濃度升高至930.51mg/L時, NH4+-N的去除速率降低至0.1455mg/(mg·d),為最高時的94.51%.在NO2--N濃度為151.10mg/L時, NO2--N的去除速率為0.1649mg/(mg·d),而當NO2--N濃度升高至497.82mg/L時, NO2--N的去除速率降低至0.1395mg/(mg·d),為最高時的84.59%.有研究認為,基質(zhì)NH4+-N和NO2--N對厭氧氨氧化的抑制實質(zhì)上是游離氨和游離亞硝酸的作用[20-21].銨根離子在水溶液中存在以下動態(tài)平衡:NH4++OH-NH3+H2O,同樣,亞硝酸鹽在水體中也存在電離平衡:HNO2NO2-+ H+,兩個動態(tài)平衡隨pH值的變化而變化.未質(zhì)子化的游離氨(FA)和游離亞硝酸(FNA)能夠通過脂質(zhì)細胞膜,而銨根離子(NH4+)和亞硝酸根離子則不易透過[22];并且多數(shù)學(xué)者認為氨(NH3)是微生物正真的基質(zhì)[23].
基質(zhì)抑制動力學(xué)可采用Haldane模型[24-25]來進行描述,Haldane模型方程為
式中:為基質(zhì)去除速率,mg/(mg·d);max為最大轉(zhuǎn)化速率,mg/(mg·d);為基質(zhì)濃度, mg/L;s為半飽和常數(shù), mg/L;h為Haldane抑制動力學(xué)常數(shù), mg/L.
厭氧氨氧化基質(zhì)抑制動力學(xué)特性如圖5所示,通過Origin8.0對所測銨鹽和亞硝酸鹽的抑制動力學(xué)數(shù)據(jù)分別進行Haldane模型擬合,所得擬合曲線的相關(guān)系數(shù)2分別為0.9901和0.9985,說明Haldane模型可以較好的描述兩種基質(zhì)對厭氧氨氧化的抑制動力學(xué)行為.當以銨鹽為抑制劑時,最大NH4+-N去除速率(max(NH4+-N))為0.1893mg/(mg·d),對NH4+-N的半飽和常數(shù)為39.39mg/L,抑制動力學(xué)常數(shù)為3482.27mg/L.當以亞硝酸鹽為抑制劑時,最大NO2--N去除速率(max(NO2--N))為0.246mg/(mg·d),對NO2--N的半飽和常數(shù)為43.19mg/L,抑制動力學(xué)常數(shù)為701.15mg/L.同時對比而言,在兩種基質(zhì)中厭氧氨氧化菌受NO2--N的抑制作用更為顯著.
2.4.2 滲濾液抑制及其動力學(xué) 垃圾滲濾液中成分十分復(fù)雜,其有機物種類就多達近百種,且大多數(shù)有機物對厭氧氨氧化菌具有毒害作用,此外還有大量重金屬和鹽離子等物質(zhì),均會抑制厭氧氨氧化菌的活性.垃圾滲濾液濃度以COD計,從表4可以看出,實驗考察了其濃度在0~ 1262.37mg/L之間時的厭氧氨氧化活性,隨著垃圾滲濾液濃度(COD)的升高,NH4+-N去除速率呈逐步降低的趨勢,當COD為1262.37mg/L時, NH4+-N去除速率降低至16.16%.
滲濾液對厭氧氨氧化的抑制實質(zhì)上是滲濾液中的毒性物質(zhì)的抑制, 滲濾液對厭氧氨氧化的抑制動力學(xué)模型引用乙酸降解時氯酚抑制作用的動力學(xué)模型[26],其方程如下:
式中:為基質(zhì)去除速率,g/(g·d);max為最大基質(zhì)去除速率,g/(g·d);為基質(zhì)濃度, mg/L;s為半飽和速率常數(shù), mg/L;0和1為抑制系數(shù).
抑制系數(shù)0和1按以下公式計算:
式中:為垃圾滲濾液濃度, mg/L;為垃圾滲濾液完全抑制濃度, mg/L;和為常數(shù).
通過引入速率比對上式進行經(jīng)修正,得出反映垃圾滲濾液對基質(zhì)去除速率的抑制方程為[27]
式中:=/0,為速率比;為垃圾滲濾液在各濃度下基質(zhì)去除速率,g/(g·d);0為未投加垃圾滲濾液條件下基質(zhì)去除速率,g/(g·d).該式可描述垃圾滲濾液濃度對基質(zhì)去除速率的抑制作用,其中,值越大說明需要更高濃度的垃圾滲濾液才能完全抑制微生物活性,其毒性越弱.當值相近時,和值越大說明垃圾滲濾液的抑制作用越弱.用修正的抑制方程[式(5)]對實驗結(jié)果進行擬合.
厭氧氨氧化垃圾滲濾液抑制動力學(xué)特性如圖6所示,通過Origin8.0對實驗數(shù)據(jù)分別進行模型擬合,所得擬合曲線的相關(guān)系數(shù)2為0.9714,說明修正的垃圾滲濾液抑制模型可以較好的描述垃圾滲濾液對厭氧氨氧化的抑制動力學(xué)行為.通過垃圾滲濾液抑制動力學(xué)模型可得在垃圾滲濾液條件下厭氧氨氧化活性被完全抑制的濃度為1450.69mg/L (以COD計),動力學(xué)常數(shù)和分別為2.49和0.99.
3 結(jié)論
3.1 采用晚垃圾滲濾液對厭氧氨氧化菌進行馴化,在進水NH4+-N和NO2--N濃度分別為50~ 60mg/L和70~80mg/L時,經(jīng)過75d的運行,系統(tǒng)逐漸適應(yīng)垃圾滲濾液實現(xiàn)高效脫氮.隨著進水基質(zhì)濃度的提高,基質(zhì)的去除量呈先升高后降低的變化趨勢,而去除效率則先是基本維持不變再呈緩慢降低的變化.隨著HRT的升高,各氮素的平均去除率逐漸降低.
3.2 厭氧氨氧化基質(zhì)抑制的閾值是NH4+-N濃度為489.03mg/L和NO2--N濃度為192.36mg/L.其對NH4+-N和NO2--N的半飽和常數(shù)分別為為39.39mg/L和43.19mg/L,抑制動力學(xué)常數(shù)分別為3482.27mg/L和701.15mg/L.厭氧氨氧化受垃圾滲濾液影響尤為顯著,在垃圾滲濾液條件下厭氧氨氧化活性被完全抑制的濃度為1450.69mg/L (以COD計).
3.3 在應(yīng)用厭氧氨氧化工藝處理高濃度晚期垃圾滲濾液過程中,應(yīng)同時關(guān)注基質(zhì)和滲濾液對厭氧氨氧化的抑制作用,并據(jù)此設(shè)置進水濃度.
[1] Micha? B, Ewa ? Moysa, Marlena Z, et al. Removal of organic compounds from municipal landfill leachate in a membrane bioreactor [J]. Desalination, 2006,198:16-23.
[2] Farah N A, Christopher Q L. Treatment of land?ll leachate using membrane bioreactors: A review [J]. Desalination, 2012,287: 41-54.
[3] Iaconi C D, Ramadori R, Lopez A. Combined biological and chemical degradation for treating a mature municipal landfill leachate [J]. Biochemical Engineering Journal, 2006,31:118-124.
[4] Van De Graaf A A, Mulder A, Bruijn P D, et al. Anaerobic oxidation of ammonium is a biologically mediated process [J]. Applied and Environmental Microbiology, 1995,61(4):1246- 1251.
[5] Jetten M S M, Wagner M, Fuerst J, et al. Microbiology and application of the anaerobic ammonium oxidation (anammox) process [J]. Current Opinion in Biotechnology, 2001,12:283-288.
[6] 叢 巖,黃曉麗,王小龍,等.厭氧氨氧化顆粒污泥的快速形成 [J]. 化工學(xué)報, 2014,65:664-671.
[7] Shen L D, Hu A H, Jin R C, et al. Enrichment of anammox bacteria from three sludge sources for the startup of monosodium glutamate industrial wastewater treatment system [J]. Journal of Hazardous Materials, 2012,199-200:193-199.
[8] Tang C J, Zheng P, Chen T T, et al. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process [J]. Water Research, 2011,45:201-210.
[9] Gilbert E M, Agrawal S, Karst S M, et al. Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater [J]. Environmental Science & Technology, 2014,48(15):8784-8792.
[10] Chamchoi N, Nitisoravut S, Schmidt J E. Inactivation of ANAMMOX communities under concurrent operation of anaerobic ammonium oxidation (ANAMMOX) and denitrifcation [J]. Bioresource Technology, 2008,99(9):3331-3336.
[11] Tang C J, Zheng P, Zhang L, et al. Enrichment features of anammox consortia from methanogenic granules loaded with high organic and methanol contents [J]. Chemosphere, 2010,79(6): 613-619.
[12] Dapena Mora A, Vázquez Padín J R, Campos J L, et al. Monitoring the stability of an Anammox reactor under high salinity conditions [J]. Biochemical Engineering Journal, 2010, 51(3):167-171.
[13] Kartal B, Koleva M, Arsov R, et al. Adaptation of a freshwater anammox population to high salinity wastewater [J]. Journal of Biotechnology, 2006,126(4):546-553.
[14] Jetten M S M, Strous M, Van De Pas Schoonen Kt, et al. The anaerobic oxidation of ammonium [J]. FEMS Microbiology Reviews, 1998,22(5):421-437.
[15] Isaka K, Sumino T, Tsuneda S. High nitrogen removal performance at moderately low temperature utilizing anaerobic ammonium oxidation reactions [J]. Journal of Bioscience and Bioengineering, 2007,103(5):486-490.
[16] Dapena Mora A, Fernandez I, Campos J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production [J]. Enzyme and Microbial Technology, 2007,40(4):859-865.
[17] 國家環(huán)保局.水和廢水監(jiān)測分析方法(第四版) [M]. 北京:中國環(huán)境科學(xué)出版社, 2002:238-366.
[18] Chen T T, Zheng P, Shen L D, et al. Kinetic characteristics and microbial community of Anammox-EGSB reactor [J]. Journal of Hazardous Materials, 2011,190:28-35.
[19] Jin R C, Xing B S, Yu J J, et al. The importance of the substrate ratio in the operation of the Anammox process in upflow biofilter [J]. Ecological Engineering, 2013,53:130-137.
[20] Waki M, Tokutomi T, Yokoyama H, et al. Nitrogen removal from animal waste treatment water by Anammox enrichment [J]. Bioresource Technology, 2007,98(14):2775-2780.
[21] Fernández I, Dosta J, Fajardo C, et al. Short- and long-term effects of ammonium and nitrite on the Anammox process [J]. Journal of Environmental Management, 2010,95:170-174.
[22] Kadam P C, Boone D R. Influence of pH on ammonia accumulation and toxicity in halophilic, methylotrophic methanogens [J]. Applied and Environmental Microbiology, 1996,62(12):4486-4492.
[23] Tang C J, Zheng P, Mahmood Q, et al. Effect of substrate concentration on stability of anammox bioflm reactors [J]. Journal of Central South University of Technology, 2010,17(1):79-84.
[24] Sheintuch M, Tartakovsky B, Narkis N, et al. Substrate inhibition and multiple states in a continuous nitrification process [J]. Water Research, 1995,29:953-963.
[25] Surmacz-Gorska J, Gernaey K, Demuynck C, et al. Nitrification monitoring in activated sludge by oxygen uptake rate (OUR) [J]. Water Research, 1996,30:1228-1236.
[26] Kim I S, Tabak H H, Young J C. Modeling of the fate and effect of chlorinated phenols in anaerobic treatment processes [J]. Water Science and Technology, 1997,36(6/7):287-294.
[27] 陳 皓,陳 玲,黃愛群,等.重金屬對2-氯酚厭氧降解的抑制動力學(xué)研究 [J]. 中國環(huán)境科學(xué), 2010,30(3):328-332.
* 責任作者, 教授, jglijun@bjut.edu.cn
Nitrogen removal and inhibition kinetics of ANAMMOX reactor fed with the mature landfill leachate
LI Yun1, LI Jun1*, CAI Hui2, CHEN Gang2, HOU Ai-yue1, HU Xiao2, BIAN Wei1, GUO Rui-feng2, LIU Yi-fu2
(1.The College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 1000124, China;2.China Urban Construction Design and Research Institute Co., Ltd., Beijing 100012, China)., 2016,36(5):1409~1416
The mature landfill leachate was adopted to cultivated anaerobic ammonia oxidation bacteria in the UASB reactor which fed with inorganic wastewater, the running performance of the system was explored in different substrate concentration and hydraulic retention time, the activity inhibition of anaerobic ammonia oxidation by substrate and landfill leachate and the inhibition kinetics were analyzed. The system adapted to the landfill leachate gradually and implement efficient denitrification when the system run 75d. The removal amount of substrate was increased at first and then decreased with the increasement of the substrate concentration. As the extension of HRT, the concentrations of substrate and landfill leachate was increased, the effect of denitrification was decline in system. The thresholds of substrate inhibition were that NH4+-N concentration was 489.03mg/L and NO2--N concentration of 192.36mg/L. when NH4+-N was inhibitor,max(NH4+-N)was 0.1893mg/(mg·d), the half-saturation constant was 39.39mg/L, the inhibiting kinetic constant was 3482.27mg/L; when NO2--N was inhibitor,max(NO2--N)was 0.246mg/(mg·d), the half-saturation constant was 43.19mg/L, the inhibiting kinetic constant was 701.15mg/L. Anaerobic ammonia oxidation is very susceptible especially by the landfill leachate, the activity of anammox was inhibited completely when the landfill leachate concentration was 1450.69mg/L (which calculated in COD).
mature landfill leachate;nitrogen removal;inhibition kinetics
X703.5
A
1000-6923(2016)05-1409-08
李 蕓(1985-),男,江西宜春人,北京工業(yè)大學(xué)博士研究生,主要研究方向為污水處理理論與技術(shù).發(fā)表論文5篇.
2015-10-21
國家水體污染控制與治理科技重大專項(2014ZX07201- 011);中國城市建設(shè)研究院院級課題(Y07H13074);建筑室外水系維護與節(jié)水關(guān)鍵技術(shù)研究(2013BAJ02B02);北京市教委委員會資助(PXM2015-014204-500271)

