Leptin介導AMPK信號通路對豬皮下前脂肪細胞脂類代謝調控的研究
黃英楊明華孔令富郝美林高士爭李永能趙素梅
(1.云南農業大學 云南省動物營養與飼料重點實驗室,昆明 650201;2.云南農業大學 動物科學技術學院,昆明 650201;3.云南農業大學 招生就業處,昆明 650201)
Leptin介導AMPK信號通路對豬皮下前脂肪細胞脂類代謝調控的研究
黃英1楊明華1孔令富2郝美林1高士爭1李永能3趙素梅1
(1.云南農業大學 云南省動物營養與飼料重點實驗室,昆明 650201;2.云南農業大學 動物科學技術學院,昆明 650201;3.云南農業大學 招生就業處,昆明 650201)
以體外培養的豬原代皮下脂肪細胞為研究材料,檢測Leptin介導AMPK信號通路中基因表達水平,旨在闡明Leptin介導AMPK信號通路對脂肪代謝調控的分子機制。用0和100 ng/mL Leptin分別處理脂肪細胞48 h,油紅O染色鑒定脂肪細胞,試劑盒測定細胞中甘油三酯和游離脂肪酸含量,Real-time PCR方法檢測皮下前脂肪細胞中AMPK信號通路中基因表達水平。研究結果表明,皮下前脂肪細胞中,Leptin組甘油三酯含量均顯著低于對照組(P<0.05),表明Leptin可以降低細胞中甘油三酯和游離脂肪酸含量。Leptin組中AMPK信號通路中的基因lepR、AMPK、CPT-1基因的表達量均顯著高于對照組(P<0.05),ACC基因表達量顯著低于對照組(P<0.05),表明Leptin通過調控AMPK信號通路中基因表達,啟動AMPK信號通路的信號傳遞。皮下前脂肪細胞中,lepR、AMPK和CPT-1基因表達量均與甘油三酯和游離脂肪酸含量呈顯著負相關(P<0.05);ACC基因表達量與甘油三酯和游離脂肪酸含量呈顯著正相關(P<0.05)。結果表明,Leptin通過激活AMPK信號通路,降低ACC基因的表達量,提高CPT-1基因表達水平,促進甘油三酯分解及脂肪酸的氧化,降低細胞中甘油三酯和游離脂肪酸的含量。
前皮下脂肪細胞;瘦素;AMPK;信號通路
腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)在真核生物中是一個重要的蛋白激酶,可加速脂肪酸氧化、葡萄糖轉運和糖酵解分解代謝途徑,同時能抑制糖異生、脂肪酸和膽固醇合成、蛋白質合成等合成途徑,以降低能量消耗,維持機體能量代謝平衡[1]。Leptin介導的AMPK信號通路在脂肪代謝的調節中起主要作用,能促進脂肪酸的氧化,減少脂肪沉積。本研究以體外培養的豬皮下前脂肪細胞為研究對象,用100 ng/mL Leptin處理48 h觀察Leptin對前脂肪細胞的影響。以油紅O染色觀察前脂肪細胞中脂滴的形成,從mRNA水平來研究Leptin對AMPK通路中各基因表達的影響,并通過檢測細胞中甘油三酯和游離脂肪酸的含量,闡明Leptin對脂類代謝的影響,為深入開展AMPK信號通路對脂肪代謝調節的信號轉導機制的研究提供參考。
1 材料與方法
1.1 材料
1.1.1 實驗動物及分組 取一頭15 kg仔豬的皮下脂肪組織,分離皮下前脂肪細胞,進行體外細胞培養,Leptin組和對照組均為6個重復。仔豬購自云南農業大學實驗豬場。
1.1.2 主要試劑 Trizol購自天根公司;反轉錄試劑盒購自北京全式金公司;SYBR?Premix Ex TaqTM購自大連寶生物;甘油三酯試劑盒購自北京北化康泰臨床試劑有限公司;游離脂肪酸試劑盒購自南京建成科技有限公司。
1.2 方法
1.2.1 豬前體脂肪細胞培養 無菌條件下切取15日齡仔豬背部皮下脂肪組織,PBS緩沖液沖洗3次,分離去除脂肪組織中可見的纖維及血管,剪碎后加入1 mg/mL 的Ⅰ型膠原酶消化液,置37℃振蕩搖床內震蕩消化1 h,用不銹鋼細胞篩過濾(200目),濾液以1 500 r/min離心10 min,棄上清,沉淀物用無血清培養液重懸,再次過濾離心10 min,棄上清,沉積的細胞團塊用基礎培養液制成細胞懸液,細胞以5.0×104個/cm2密度接種至培養板內,置于37℃,飽和濕度,5% CO2培養箱內培養,1 d后換液,此后每2 d換液一次。
1.2.2 豬皮下前脂肪細胞的誘導分化 待豬原代皮下脂肪細胞匯合度達60%時,更換培養液為以10 mg/L胰島素、0.25 μmol/L地塞米松和0.5 mmol/L 1-甲基3-異丁基黃嘌呤的分化培養液,分別在分化培養液中添加0和100 ng/mL Leptin 處理48 h(其中0 ng/mL為對照組),一部分細胞用于油紅O染色鑒定,一部分細胞用于甘油三酯和游離脂肪酸含量測定,其余細胞用于提取總RNA。
1.2.3 油紅O 染色 誘導分化2 d后的細胞,取出培養板,棄培養液,用PBS沖洗3次,10%甲醛固定30 min,PBS漂洗3次后,油紅O工作液染色40 min,移去染色液,PBS漂洗3次,鏡檢。
1.2.4 甘油三酯的測定 用甘油三酯試劑盒(北京北化康泰臨床試劑有限公司)測定皮下脂肪細胞中的甘油三酯濃度,操作方法按照試劑盒說明書執行。
1.2.5 脂肪酸含量的測定 用游離脂肪酸測試盒說明書(NEFA)(南京建成科技有限公司)測定皮下脂肪細胞中游離脂肪酸含量,操作方法按照試劑盒說明書執行。
1.2.6 總RNA提取 收集對照組和100 ng/mL Leptin處理48 h后的脂肪細胞,采用Trizol-A+Reagent提取總RNA,并用瓊脂糖凝膠電泳檢測其完整性,通過OD260nm/OD280nm測定其濃度。
1.2.7 Real-time PCR反應及條件 根據所測定的濃度,各取2 μg總RNA進行反轉錄,使用EasyScriptFirst-Strand cDNA Synthesis SuperMix(北京全式金生物技術有限公司)進行反轉錄,反應體系為20 μL,其中含有10 μL 2×ES Reaction Mix、1 μL EasyScript RT/RI Enzyme Mix、1 μL Anchored Oligo(dT),加入Rnase-free Water至20 μL。將這20 μL混合物42℃孵育30 min,85℃加熱5 min失活,EasyScript RT反轉錄后的cDNA單鏈可于-20℃中保存。
目的基因:瘦素受體(Leptin receptor,lepR),肝激酶B1(liver kinase B1,LKB1),腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK),乙酰輔酶A羧化酶(acetyl-CoA carboxylase,ACC),肉堿棕櫚酰轉移酶-1(carnitine palmitoyltransferase-1,CPT-1)和內參基因18S rRNA的引物使用Primer 5軟件設計,由上海生物工程有限公司合成。基因登錄號及引物序列見表1。
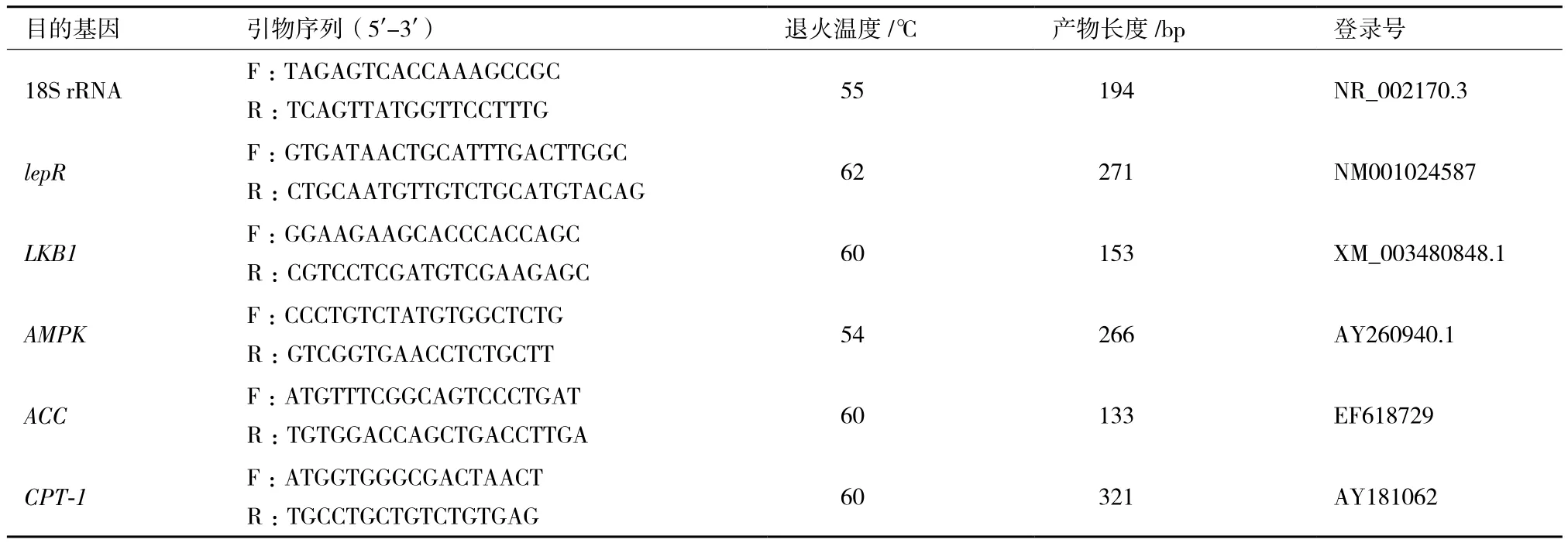
表1 內參基因與目的基因的引物序列、產物長度和登錄號
Real-time PCR反應體系(20 μL)為:1.5 μL反轉錄產物,10 μL SYBR Green,10 mmol/L的上下游引物各0.4 μL,加ddH2O至20 μL。每個重復做2個平行,同時用ddH2O代替RT產物和熒光試劑作空白對照,以檢驗是否有外源基因和基因組DNA 污染。1.2.8 數據分析 采用SAS9.0和Excel2003軟件對實驗數據進行統計分析,所有數據表示為平均值±標準差(±s),并對平均值進行方差分析,作顯著性檢驗(P<0.05)。
2 結果
2.1 Leptin對前脂肪細胞形態變化的影響
觀察豬皮下前體脂肪細胞的誘導分化結果發現,不同濃度的Leptin對前脂肪細胞形態變化無明顯影響。處理48 h后,可見部分細胞開始分化,細胞內可見少量球形脂滴。油紅O染色結果(圖1)顯示,Leptin組比對照組著色細胞數多。
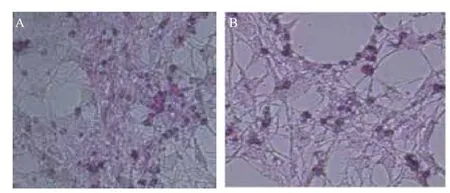
圖1 皮下前脂肪細胞油紅O染色(200×)
2.2 Leptin對前脂肪細胞甘油三酯和游離脂肪酸合成的影響
Leptin對豬前脂肪細胞甘油三酯和游離脂肪酸合成影響的結果(表2)顯示,Leptin組中甘油三酯含量顯著低于對照組(P<0.05);Leptin組中游離脂肪酸含量低于對照組,但沒有達到顯著水平(P>0.05)。

表2 甘油三酯和游離脂肪酸含量
2.3 Leptin介導AMPK信號通路中基因的表達水平
皮下前脂肪細胞中,Leptin介導AMPK信號通路中各基因相對表達水平結果(圖2)顯示,Leptin組lepR(圖2-A)、AMPK(圖2-B)和CPT-1(圖2-C)基因相對表達量顯著高于對照組(P<0.05),Leptin組中LKB1(圖2-D)基因相對表達量高于對照組,但沒有達到顯著水平(P>0.05)(圖2-D),Leptin組中ACC(圖2-E)基因相對表達量顯著低于對照組(圖2-E,P<0.05)。
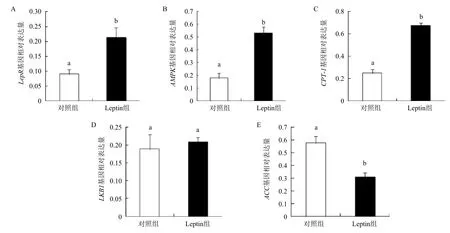
圖2 Leptin介導AMPK信號通路中基因的相對表達水平
2.4 皮下前脂肪細胞中AMPK信號通路中基因表達量與甘油三酯含量相關性
皮下前脂肪細胞中,Leptin介導的AMPK信號通路中各基因相對表達量與甘油三酯含量相關性結果顯示,lepR(圖3-A)、AMPK(圖3-B)和 CPT-1(圖3-C)基因的mRNA的表達水平與甘油三酯含量之間存在負相關且達到顯著水平(P<0.05),LKB1(圖3-D)基因的mRNA的表達水平與甘油三酯含量之間存在負相關但沒有達到顯著水平(圖3-D,P>0.05),ACC(圖3-E)基因的mRNA的表達水平與甘油三酯含量之間存在正相關且達到顯著水平(圖3-E,P<0.05)。
2.5 皮下前脂肪細胞中AMPK信號通路中基因表達量與游離脂肪酸含量相關性
皮下前脂肪細胞中,AMPK信號通路中各基因表達量與游離脂肪酸含量相關性結果(圖4)顯示,lepR(圖4-A)、AMPK(圖4-B)和 CPT-1(圖4-C)基因的mRNA的表達水平與游離脂肪酸含量之間存在強負相關(P<0.05),LKB1(圖4-D)基因的mRNA的表達水平與游離脂肪酸含量之間成負相關,但未達到顯著水平(P>0.05),ACC(圖4-E)基因的mRNA的表達水平與游離脂肪酸含量之間存在強正相關(P<0.05)。
3 討論
脂肪即甘油三酯,是動物機體內儲能的主要形式,是能源物質。當動物攝入的能源物質超過其所需要的消耗量時,就以脂肪的形式貯存起來。而當攝入的能源物質不能滿足生理活動需要時,則體內貯存的脂肪會氧化供能。脂肪細胞從血液中攝取脂肪酸和葡萄糖,合成甘油三酯,并以脂滴的形式貯存在細胞內部[2],這些富含甘油三酯的脂滴是機體能量的貯存單位。甘油三酯可被脂蛋白酯酶分解,釋放游離脂肪酸和單甘油酯。游離脂肪酸和單甘油酯被脂蛋白的膜外小葉轉運到脂肪細胞的內質網內,在脂肪細胞內單甘油酯可以繼續分解成游離脂肪酸和甘油[3]。而游離脂肪酸由于作為能量物質被消耗,將其作為衡量脂解的一個輔助指標。Leptin是肥胖基因(ob)的表達產物,主要由白色脂肪組織合成和分泌,在調節機體脂肪沉積和維持體重方面具有重要的作用。而Leptin能夠抑制食欲中樞,減少能量攝取,增加能量消耗,抑制脂肪合成,促進脂肪分解,減少體內脂肪沉積,從而發揮降低體重的功能[4]。Nogalska等[5]指出,Leptin的增加可在體內抑制白色脂肪組織中脂肪酸合成酶的基因表達,從而使白色脂肪組織中脂肪酸的合成速度下降并導致脂肪酸氧化,脂肪量降低。Gregory等[6]研究認為,Leptin對調節體內肌肉甘油三酯的含量具有重要作用,血漿中瘦蛋白水平的慢性升高可通過刺激脂肪酸氧化和甘油三酯的水解,以及降低脂肪酸的攝取,而使瘦型大鼠肌肉內甘油三酯含量減少。本研究表明,在皮下前脂肪細胞中,添加Leptin的Leptin組中的甘油三酯和游離脂肪酸含量均低于對照組,說明Leptin具有促進脂肪分解和抑制脂肪合成的作用。

圖3 AMPK信號通路中基因表達量與甘油三酯含量相關性
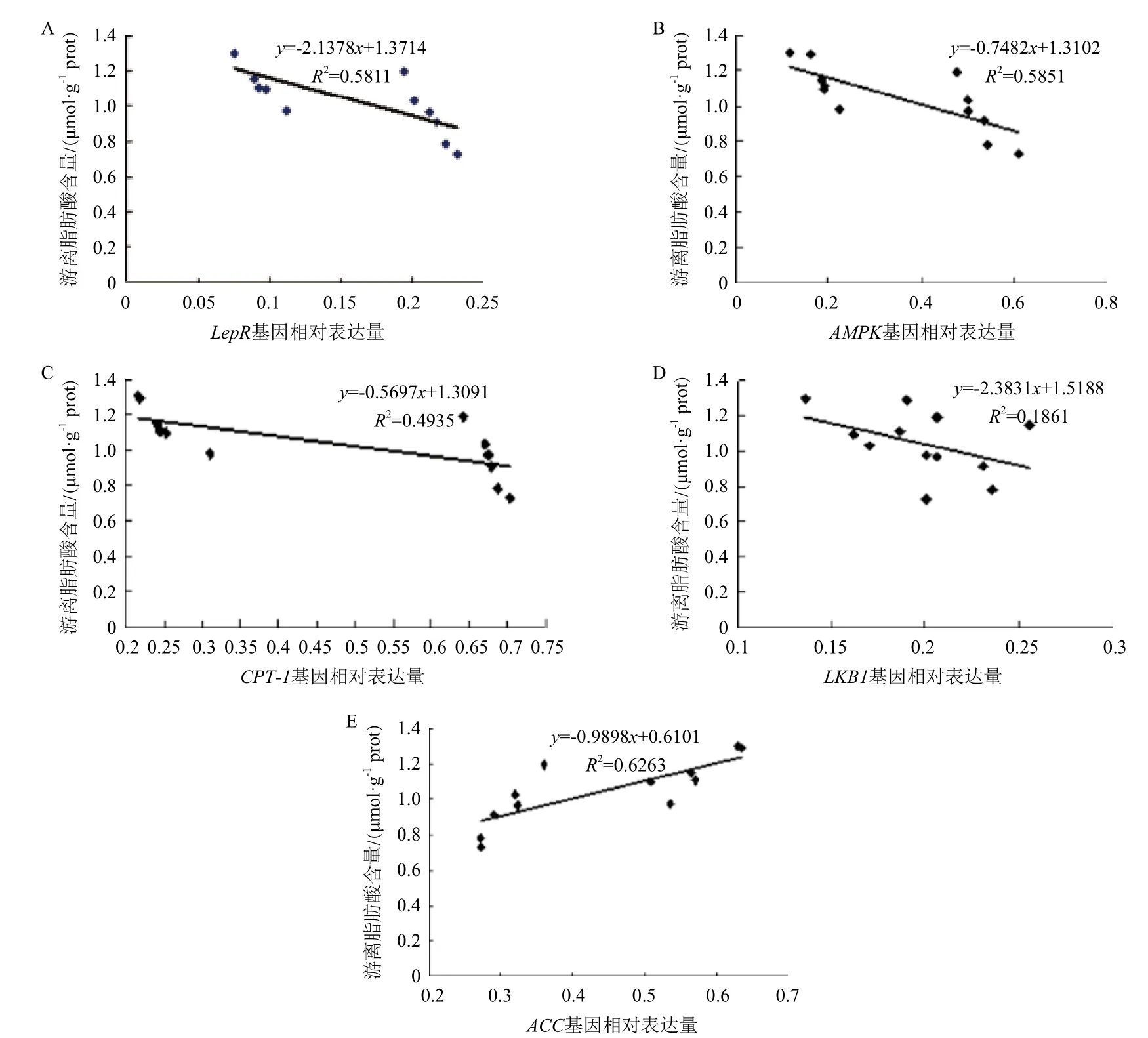
圖4 AMPK信號通路中基因表達量與游離脂肪酸含量相關性
lepR是一種跨膜受體,主要的生理功能是與Leptin結合,lepR基因表達量與Leptin濃度有關[7,8]。Leptin與lepR結合后可激活LKB1,使LKB1與STE20相關接合蛋白(STE20 related adaptor protein,STRAD)和鼠蛋白25(mouse protein 25,MO25)結合形成三元復合物,使LKB1從細胞核轉到細胞質中。此三元復合物可使LKB1活性增強從而激活下游的AMPK[9,10]。本研究表明,Leptin組與對照組相比,LKB1的表達量沒有顯著差異,說明LKB1從細胞核轉到細胞質過程中其表達量沒有改變。活化的LKB1使AMPKα亞基中的Thr172磷酸化,并使AMPK活化[11,12]。活化的AMPK可以磷酸化ACC的Ser79,從而使ACC失去活性。有研究表明,瘦素缺陷小鼠ACC mRNA的表達增強,可導致脂肪酸合成增加,而給予瘦素干預后,ACC mRNA的表達下調[13]。在離體的脂肪細胞中,Leptin可以降低涉及合成脂肪酸的ACC的酶活性,同時上調了CPT-1基因的表達量,從而促進了脂肪酸的氧化以及降低甘油三酯的合成[14]。本研究中Leptin組CPT-1基因相對表達量顯著高于對照組(P<0.05),ACC基因相對表達量顯著低于對照組(P<0.05),本研究結果與前人研究一致。
ACC是脂肪酸從頭合成過程中的限速酶,它調節脂肪酸的合成,可以催化乙酰CoA形成丙二酸單酰CoA,所以ACC直接影響丙二酸單酰CoA在細胞內的濃度,而丙二酸單酰CoA是脂肪酸合成的底物,也是抑制脂肪酸β氧化的一種抑制劑,它可以抑制CPT-1活性從而阻礙脂肪酸轉運進入線粒體來降低脂肪酸的氧化[15,16]。當ACC失去活性后會減少丙二酸單酰CoA的生成,一方面減少了脂肪酸的合成,另一方面解除了丙二酸單酰CoA對CPT-1的抑制,使CPT-1活性增強,促進了脂肪酸進入到線粒體內進行β氧化[17]。故ACC基因的表達量與甘油三酯和游離脂肪酸呈正相關,CPT-1基因表達量與游離脂肪酸和甘油三酯含量呈顯著負相關。ACC是脂肪酸合成的關鍵酶,為AMPK重要底物。激活AMPK使ACC磷酸化失活,抑制了脂肪的合成。此外AMPK磷酸化甘油磷酸酰基轉移酶,抑制甘油三酯合成,以及磷酸化激素敏感酯酶,控制脂解作用,使其不超過脂肪酸的氧化速率,以防過量堆積的脂肪酸重新合成脂肪[18]。有研究表明,AMPK可以抑制甘油二酯和甘油三酯的合成,在大鼠肝細胞培養液中加入AICAR培養3 h,14C-油酸和3H-進入甘油三酯的量分別降低50%和38%,14C-油酸進入甘油二酯的量降低60%。肌細胞與AICAR儀器培養90 min,14C-油酸進入甘油三酯量降低37%,而14CO2的產量增加48%[19]。Leptin具有促磷酸化作用,可活化骨骼肌中AMPKα2催化亞基。AMPK具有檢測細胞內能量狀態的作用,可通過抑制ACC的活性,有效地促進肌肉中脂肪酸的氧化,降低脂肪酸的酯化。與AMPK活化相平衡,Leptin抑制ACC的活性,刺激脂肪酸在肌肉中的氧化。通過AMPK-ACC的調節作用實現Leptin的信號轉導,故AMPK基因表達量與甘油三酯和游離脂肪酸成負相關。Leptin通過與lepR結合后使LKB1從細胞核轉到細胞質與STARD和MO25兩種蛋白結合,形成的三元復合物可激活LKB1,但LKB1基因表達量沒有明顯改變。活化的LKB1可以磷酸化AMPK并激活AMPK,故LKB1基因表達量與甘油三酯和游離脂肪酸含量呈負相關但沒達到顯著水平。Leptin通過lepR來調節下游基因,lepR基因表達量與Leptin濃度有關,故lepR基因表達量與甘油三酯和游離脂肪酸含量成顯著負相關。
4 結論
Leptin通過激活AMPK信號途徑,降低ACC基因的表達量,提高CPT-1基因表達水平,促進甘油三酯分解及脂肪酸的氧化,降低細胞中甘油三酯和游離脂肪酸的含量。
[1] Luo Z, Zang M, Guo W. AMPK as a metabolic rumor suppressor:control of metabolism and cell growth[J]. Future Oncol, 2010, 6(3):457-470.
[2]Tauchi K, Ozek S, Houjou T, et al. The surface of lipid droplets is a phospholipid monolayer with a unique fatty acid composition[J]. Biological Chemistry, 2002, 277:44507-44512.
[3] 趙素梅. 兩種肉雞胚胎期脂肪代謝及DHEA調控研究[D].南京:南京農業大學, 2007.
[4]Eikelis N, Lambert G, Wiesner G, et al. Extra-adipocyte Leptin release in human obesity and its relation to sympathoadrenal function[J]. Am J Physiol, 2004, 286(5):E744-E752.
[5] Nogalska A, Swierczynski J. Potential role of high serum Leptin concentration in age-related decrease of fatty acid synthase gene expression in rat white adipose tissue[J]. Experimental Gerontology,2004, 39:147-150.
[6] Gregory R, Arend B, David J, et al. Fatty acid oxidation and triacylglycerol hydrolysis are enhanced after chronic Leptin treatment in Rats[J]. American Journal of Physiology Endocrinology and Metablism,2002, 282:593-600.
[7]Ramsay TG, Richards MP. Leptin and Leptin receptor expression in skeletal muscle and adipose tissue in response to in vivo porcine somatotropin treated[J]. Animal Science, 2005, 83:2501-2508.
[8]Borja G, Alfredo S, Teresa F, et al. Leptin receptors in human skeletal muscle[J]. Applied Physiology, 2007, 102:1786-1792.
[9]龍璐, 王平芳. LKB1-AMPK信號通路與胰島素抵抗[J]. 中國糖尿病雜志, 2007, 15:382-384.
[10]Song P, Xie ZL, Wu Y, et al. Protein kinase Cζ-dependent LKB1 serine 428 phosphorylation increases LKB1 nucleus export and apoptosis in endothelial cells[J]. Biological Chemistry, 2008,283:12446-12455.
[11]Eijiro Y, Jeffrey E, Irwin J, et al. Fyn-dependent regulation of energy expenditure and body weight is mediated by tyrosine phosphorylation of LKB1[J]. Cellular Metabolism, 2010, 11:113-124.
[12]Chung T, Blerina K, Marta K. AMPK as a mediator of hormonal signalling[J]. Molecular Endocinology, 2010, 44:87-97.
[13]Li J, Grigoryev DN, Ye SQ, et al. Chronic interm ittent hypoxia upregulates genes of lipid biosynthesis in obesemice[J]. Applied Physiology, 2005, 99:1643-1648.
[14]Niang F, Benelli C, Ribiere C, et al. Leptin induces nitric oxidemediated inhibition of lipolysis and glyceroneogenesis in rat white adipose tissue[J]. Nutrition, 2011, 141:4-9.
[15]Jeukendrup AE. Regulation of fat metabolism in skeletal muscle[J]. Annals of the New York Academy of Sciences, 2002,967:217-235.
[16]Knafo L, Chessex P, Rouleau T. Association between hydrogen peroxide-dependent byproducts of ascorbic acid and increased hepatic acetyl-CoA carboxylase activity[J]. Clinical Chemistry,2005, 51:1462-1471.
[17]張芳林. 肉堿棕櫚酰轉移酶-Ⅰ的研究進展[J]. 國外醫學內分泌學分冊, 2002, 22:166-169.
[18] 符慶瑛, 高鈺琪. 蛋白激酶AMPK的研究進展[J]. 生命科學,2005, 17:147-152.
[19]Muoio D, Seefeld K, Witters L, et al. AMP-activated kinase reciprocally regulates triacylglycerol synthesis and fatty acid oxidation in liver and muscle:evidence that sn-glycerol-3-phosphate acyltransferase is a novel target[J]. Biochemistry,1999, 338:783-791.
(責任編輯 馬鑫)
The Regulation of Leptin-mediated AMPK Signal Pathway on Lipid Metabolism in Porcine Subcutaneous Preadipocyte
HUANG Ying1YANG Ming-hua1KONG Ling-fu2HAO Mei-lin1GAO Shi-zheng1LI Yong-neng3ZHAO Su-mei1
(1. Yunnan Key Laboratory of Animal Nutrition and Feed,Yunnan Agricultural University,Kunming 650201;2. Faculty of Animal Science and Technology,Yunnan Agricultural University,Kunming 650201;3. Admission and Employment Office,Yunnan Agricultural University,Kunming 650201)
Using in vitro cultured porcine subcutaneous preadipocytes as the study material, the expression levels of related genes were measured for investigating the molecular regulation mechanism of leptin-mediated AMPK signal pathway on lipid metabolism. The subcutaneous adipocytes were treated with 0 and 100 ng/mL leptin for 48 h, and the adipocytes were identified by oil red O dyeing, and the contents of triglyceride and free fatty acids in the cells were measured by kit, and the mRNA expression levels of related genes in the AMPK signal pathway of subcutaneous preadipocytes were detected using Real-time PCR technology. The results showed that in leptin group, the content of the triglyceride of the subcutaneous preadipocytes was significantly lower(P<0.05)compared with the control group, indicating that the leptin reduced the contents of triglyceride and free fatty acids in the cells. The expression levels of gene lepR, AMPK, CPT-1 in AMPK signal pathway were significantly higher in leptin group than control group(P<0.05), while the expression level of gene ACC in leptin group was significantlylower than control group(P<0.05), implying that leptin initiated the signal transmission in the AMPK signal pathway by regulating the mRNA expression of related genes. The expression levels of gene lepR, AMPK, and CPT-1 were significantly negatively correlated with the content of triglyceride and free fatty acid(P<0.05);however, the expression level of gene ACC was significantly positively correlated with the content of triglyceride and free fatty acid(P<0.05). In conclusion, the results suggested that leptin activated AMPK signal pathway, reduced the expression of ACC, and increased the expression of CPT-1, which therefore promoted the decomposition of triglyceride and oxidation of fatty acid,and finally decreased the contents of the triglycerides and free fatty acid in the cells.
subcutaneous preadipocyte;leptin;AMPK;signal pathway
10.13560/j.cnki.biotech.bull.1985.2016.02.029
2015-05-05
云南省教育廳科學研究基金項目(A3007017),云南農業大學動物科學技術學院科學研究基金項目(DKY3P201105)
黃英,女,碩士,副教授,研究方向:動物分子營養與代謝調控;E-mail:hying5@sina.com
李永能,男,碩士,副教授,研究方向:動物分子營養與代謝調控;E-mail:lyn77@vip.sina.com趙素梅,女,博士,教授,研究方向:動物分子營養與代謝調控;E-mail:zhaosm2009@126.com

