大豆14-3-3蛋白與轉錄因子蛋白GmMYB173的互作
董 萌高友菲韓天富東方陽蔣炳軍,*
1河北科技師范學院生命科技學院, 河北秦皇島 066000;2中國農業科學院作物科學研究所 / 農業部北京大豆生物學重點實驗室, 北京 100081
大豆14-3-3蛋白與轉錄因子蛋白GmMYB173的互作
董 萌1,2高友菲2韓天富2東方陽1,*蔣炳軍2,*
1河北科技師范學院生命科技學院, 河北秦皇島 066000;2中國農業科學院作物科學研究所 / 農業部北京大豆生物學重點實驗室, 北京 100081
14-3-3蛋白家族在真核生物中普遍存在, 可與其他蛋白相互作用, 調控多種生理生化過程。MYB基因家族作為植物中最大的一類轉錄因子, 廣泛參與了植物的生長發育和代謝調控。本研究通過分析 1個從自貢冬豆中克隆的 MYB轉錄因子 GmMYB173的亞細胞定位情況, 發現 GmMYB173在細胞核中特異表達; 序列分析發現GmMYB173與GmMYB176相似, 具有1個14-3-3蛋白的潛在結合結構域, 即pST結合結構域。通過重疊延伸PCR (SOE-PCR)刪除了GmMYB173序列中pST結合結構域編碼序列, 發現GmMYB173細胞核表達特異性消失。酵母雙雜交互作分析表明, 大豆基因組中所有具有表達的16個14-3-3蛋白GmSGF14a~GmSGF14p均能與GmMYB173互作。β-半乳糖苷酶活性分析發現, 與 GmMYB173互作最強的是 GmSGF14n, 其次是 GmSGF14k、GmSGF14e和GmSGF14o。這些結果說明14-3-3蛋白不僅與GmMYB173互作, 且可能調控其在細胞內的定位, 有助于研究14-3-3蛋白與GmMYB173的互作關系及其在大豆生長發育中的作用。
14-3-3蛋白; GmMYB173; 亞細胞定位; 酵母雙雜交
14-3-3蛋白是一類在真核生物中廣泛存在的蛋白。關于植物中14-3-3蛋白的報道最先見于大麥[1]、擬南芥[2]和菠菜[3]。目前組學研究發現, 14-3-3蛋白在植物基因組中存在多個編碼基因, 呈現差異表達。在擬南芥基因組中已經鑒定出15個14-3-3蛋白基因, 其中13個有轉錄表達[4-5]。在水稻中鑒定出8個, 其中6個有轉錄表達[6]。Li等[7]在大豆基因組中發現了18個14-3-3蛋白基因, 其中16個即GmSGF14a~GmSGF14p可通過 RT-PCR檢測到其表達。14-3-3蛋白在植物體內主要以同源或異源二聚體的形式存在。14-3-3蛋白與其他蛋白的結合主要通過磷酸化的多肽域來實現, 包括 2種序列模式, 一種是RSXpSXP, 另一種是RXY/FXpSXP, 其中X為任意氨基酸, pS是磷酸化的絲氨酸[8]。但是, 一些14-3-3蛋白也能通過識別非磷酸化的序列來實現與互作蛋白的結合[9-10]。由此可見, 不同14-3-3蛋白可能由于表達差異化、結合蛋白多樣化, 而呈現豐富的生理生化功能。
植物14-3-3蛋白家族基因調控著植物中多種生理生化過程。14-3-3蛋白在細胞核中能夠調節轉錄激活子的亞細胞定位和基因的表達。Carrasco等[11]研究發現 14-3-3蛋白能與 DNA結合蛋白磷酸酶(DBP1)結合而調控轉錄激活因子的亞細胞定位, 并能將DBP1轉運出細胞核, 且能與DBP1結合從而調控目的基因CEVI1的表達以應對病毒入侵帶來的危害。14-3-3蛋白還參與了植物的光信號通路。Folta等[12]利用酵母雙雜交和免疫共沉淀證明14-3-3蛋白能夠與重要的光周期蛋白 Constans相互作用, 暗示14-3-3蛋白參與了植物的光信號途徑。此外, 14-3-3蛋白還參與了蛋白合成、蛋白折疊、質膜質子泵的初級代謝、激素代謝和染色質重組等生理生化過程[13-14]。Hajduch等[15]對大豆種子的蛋白質組學分析發現14-3-3蛋白對于大豆種子發育有重要的作用。
MYB超級家族是序列特異性轉錄因子家族之一,具有種類多和功能多樣化的特點[16], 參與細胞分化、細胞周期的調節, 激素和環境因子應答, 并對植物的次生代謝以及葉片等器官形態的建成具有重要的調節作用[17]。Liao等[18]在大豆中獲得了48個具有基因全長開放閱讀框的MYB類似基因, 其中43個基因對鹽、干旱、低溫和ABA處理產生了相應的應答反應。李曉薇[19]從大豆中克隆了兩個 R2R3-MYB轉錄因子基因GmMYB12a和GmMYB12B2, 對轉基因擬南芥的研究發現, 植物類黃酮合成途徑中的多個關鍵酶基因均受這 2個基因的正向調控。Liu等[20]研究發現,GmMYB73可能通過減少GL2, 進而釋放GL-2Y抑制性的PLDa1表達來積累油脂, GmMYB73的調控潛在提高豆類作物的油產量。Chen等[21]發現MYB56為CULLIN3 (CUL3)-based E3連接酶的一個新的靶位點, 遺傳學研究表明 MYB56是開花的負調控因子。Liu等[22]研究發現韌皮部中MYB30表達水平的提高通過直接調控FT而促進擬南芥的開花。
14-3-3蛋白和 MYB類轉錄因子分別在植物的生理生化代謝中發揮重要的作用, 但是對于二者相互作用共同發揮作用的研究較少。Yi等[23]和Li等[24]發現了 1個單重復結構域的 MYB轉錄因子基因GmMYB176。在大豆中, GmMYB176能夠調節CHS8的表達, 但是在發根中過表達此基因不足以增加CHS8的表達量和異黃酮的含量, 而與其互作的14-3-3蛋白編碼基因GmSGF14i的過表達引起了異黃酮表達模式的改變。高友菲等[25]利用酵母單雜交技術篩選到自貢冬豆中與T1元件結合的MYB轉錄因子GmMYB173, 對GmMYB173功能及其調節機制的研究將對后續研究具有重要意義。
本研究利用 SOE-PCR及亞細胞定位間接證明了14-3-3蛋白對于 GmMYB173亞細胞定位的影響,利用酵母雙雜交證明了大豆中已知的16種在轉錄水平上表達的14-3-3蛋白能夠與 GmMYB173互作, 其中GmSGF14n編碼的14-3-3蛋白與GmMYB173互作的活性最強, 為后續深入研究14-3-3蛋白及GmMYB173的功能提供了一定的分子基礎。
1 材料與方法
1.1 材料與試劑
大豆品種自貢冬豆由中國農業科學院作物科學研究所農業部北京大豆生物學重點實驗室保存。將大豆種子播于混有營養基質和蛭石(體積比 1∶1)的花盆中, 置人工氣候箱培養至第 1片三出復葉完全展開, 取3株不同植株葉片于液氮中速凍后放入-80℃冰箱保存備用。洋蔥購自超市。用于遺傳轉化的大腸桿菌(Eschrichia coli)菌株 DH5α購自北京天根生化科技有限公司。用于酵母雙雜交的酵母菌(Saccharomyces cerevisiae)菌株 AH109及表達載體p16318-GFP、pGADT7和pGBKT7由中國農業科學院作物科學研究所農業部北京大豆生物學重點實驗室保存
1.2 GmMYB173亞細胞定位載體的構建
根據GmMYB173的基因序列, 利用Primer Blast (http://www.ncbi.nlm.nih.gov/)設計克隆引物, 以實驗室保存的pLB-GmMYB173為模板, F-1和R-1為引物(表1)進行PCR擴增, 條件為94℃ 2 min; 98℃10 s, 55℃ 30 s, 68℃ 25 s; 30個循環; 68℃ 10 min;Sal I和BamH I雙酶切PCR產物和p16318-GFP連接構建表達載體p16318-GmMYB173。
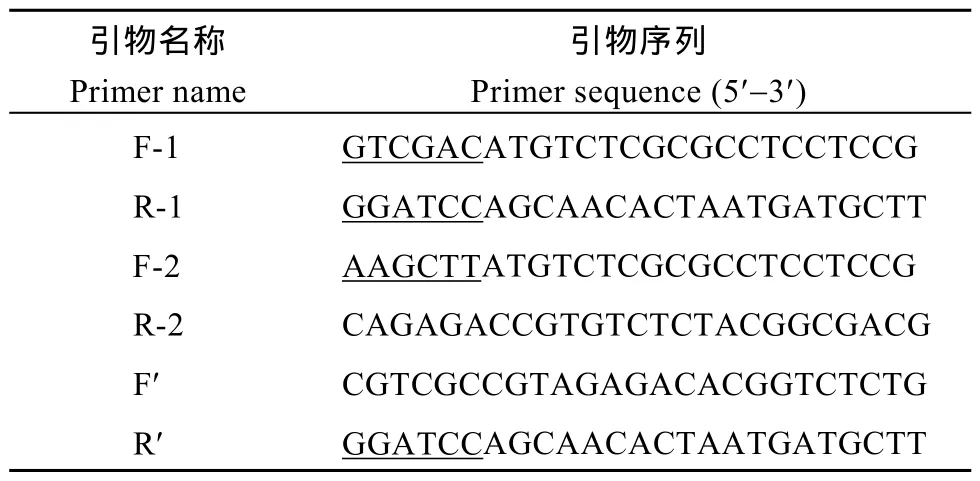
表1 亞細胞定位載體基因克隆引物Table1 Primers of cloning gene in subcellular vector construction
1.3 缺失 14-3-3 蛋白結合多肽域序列的GmMYB173 deletion亞細胞定位載體的構建
以p16318-GmMYB173為模板, 以F-2、R-2、F′和R′為引物, 利用SOE-PCR方法, 先后進行兩輪PCR擴增, 獲取缺失編碼14-3-3蛋白結合多肽域的GmMYB173 deletion, 其中第1輪擴增條件為94℃ 2 min; 98℃ 10 s, 55℃ 30 s, 68℃ 15 s, 30個循環; 68 ℃ 10 min。第2輪擴增條件為94℃ 2 min; 98℃ 10 s, 52℃ 30 s, 68℃ 25 s, 30個循環; 68℃ 10 min。Hind III和BamH I雙酶切PCR產物和p16318-GFP連接構建表達載體p16318-GmMYB173 deletion。
1.4 目標基因的亞細胞定位
參照曲夢楠[26]《大豆GmFT2b基因的功能分析》中“洋蔥表皮亞細胞定位觀察方法”。
1.5 14-3-3蛋白編碼基因GmSGF14家族基因表達載體的構建
根據 NCBI數據庫提供的基因信息設計克隆引物如表2所示, 并以自貢冬豆 cDNA為模板, 對GmSGF14家族基因進行 PCR克隆; 然后用相應限制性內切酶將 GmSGF14家族基因連接到表達載體pGADT7。
1.6 以酵母雙雜交驗證 14-3-3蛋白與轉錄因子GmMYB173互作
參照Clontech的Yeast Protocols Handbook中提供的方法。挑取營養缺陷平板上單菌落到YPDA液體培養基中培養10~12 h, 提取質粒后進行菌落PCR驗證。

表2 14-3-3蛋白編碼基因GmSGF14家族基因信息Table2 Information of GmSGF14 genes conforming 14-3-3 proteins
2 結果與分析
2.1 GmMYB173的序列分析
目的基因GmMYB173的開放閱讀框為852 bp,編碼 284個氨基酸。利用 BaCelLo (http://gpcr.biocomp.unibo.it/bacello/)對GmMYB173進行亞細胞預測, 結果顯示其定位于細胞核中(圖1)。其蛋白序列與 NCBI中公布的部分 MYB類蛋白序列比對發現, GmMYB173具有一個14-3-3蛋白的潛在結合位點(圖2)。

圖1 GmMYB173的亞細胞定預測結果Fig.1 Results of prediction of subcellular location of GmMYB173

圖2 GmMYB173與其他MYB類轉錄因子氨基酸序列比對Fig.2 Sequence multi-alignment of GmMYB173 with other MYB transcription factors
2.2 GmMYB173和GmMYB173 deletion表達載體的構建及亞細胞定位
以保存的 pLB-GmMYB173載體為模板, 加有相應酶切位點的克隆引物進行PCR擴增, 得到與目標大小相符的特異性條帶(圖3-A)。對測序正確的單克隆擴大培養后提取質粒進行雙酶切驗證, 酶切得到與目標基因大小相符的條帶(圖4), 證明GmMYB173已經正確連接入表達載體中。
在表達載體 p16318-GmMYB173 deletion構建中, 亞克隆得到與 GmMYB173 deletion大小相符的條帶(圖3-B)。測序后得到克隆無誤的 GmMYB173 deletion, 對提取的質粒進行了雙酶切驗證, 得到了大小略小于GmMYB173條帶的840 bp左右的目標條帶 GmMYB173 deletion (圖4), 表明 GmMYB173 deletion已經正確連接入表達載體中。
利用激光共聚焦顯微鏡對瞬時轉化 GFP、 GmMYB173-GFP和GmMYB173 deletion-GFP載體的洋蔥表皮細胞觀察表明, 對照GFP可在洋蔥表皮細胞中大量表達, 綠色熒光信號在細胞核, 細胞質均有分布; 與對照相比, GmMYB173-GFP綠色熒光信號主要分布在細胞核中, 在細胞質中未檢測到明顯的熒光信號; 而GmMYB173 deletion-GFP綠色熒光信號在細胞核和細胞質中均有分布, 失去了GmMYB173核表達的特異性(圖5)。
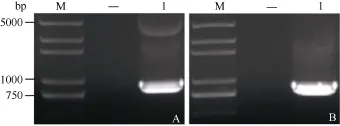
圖3 GmMYB173 PCR和GmMYB173 deletion擴增產物Fig.3 PCR products of GmMYB173 and GmMYB173 deletion
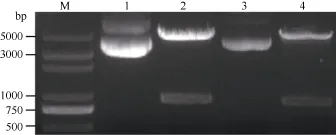
圖4 p16318-GmMYB173和p16318-GmMYB173 deletion雙酶切驗證Fig.4 Identification of p16318-GmMYB173 and p16318-GmMYB173 deletion double enzyme digestion
2.3 14-3-3蛋白編碼基因GmSGF14家族基因的克隆及酵母雙雜交載體的構建
以自貢冬豆葉片cDNA為模板, 表2中克隆引物對GmSGF14家族基因進行克隆, 1%瓊脂糖凝膠電泳分離, 得到與目標基因大小相符的特異性條帶(圖6), 膠經回收并連接pLB載體后測序。將序列與NCBI中的參考序列比對發現, GmSGF14a、GmSGF14b、GmSGF14c、GmSGF14d、GmSGF14e、GmSGF14g和GmSGF14m與參考序列之間存在多處的SNP, 其余GmSGF14家族基因與參考序列相同。將連接入表達載體的陽性克隆提取質粒后進行酶切驗證, 所有載體均得到與目標基因大小相符的酶切片段, 表明目標基因已正確連入載體中(圖7)。
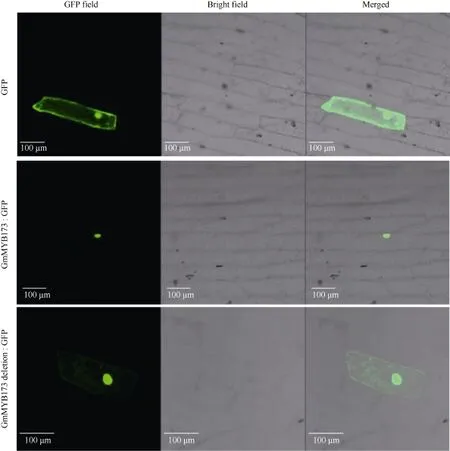
圖5 GmMYB173-GFP和GmMYB173 deletion-GFP融合蛋白的亞細胞定位Fig.5 Subcellular location of GmMYB173-GFP and GmMYB173 deletion-GFP fusion proteins
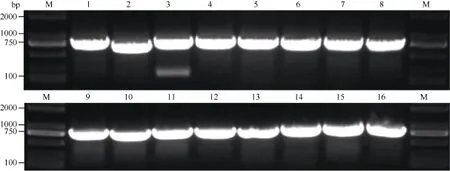
圖6 14-3-3蛋白編碼基因GmSGF14a-p PCR擴增產物Fig.6 PCR products of 14-3-3 proteins coding genes GmSGF14a-p
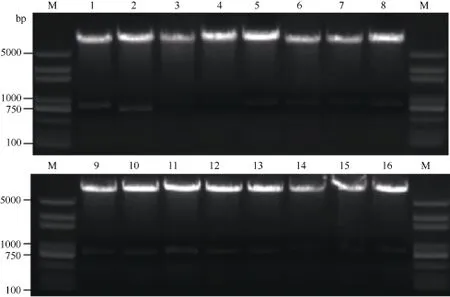
圖7 pGADT7-GmSGF14a-p和pGBKT7-GmMYB173載體雙酶切驗證Fig.7 Identification of pGADT7-GmSGF14a-p and pGBKT7-GmMYB173 double enzyme digestion
2.4 以酵母雙雜交實驗驗證 GmMYB173與14-3-3蛋白互作
采用上述實驗方法制備酵母感受態并轉化, 轉化后將感受態細胞分別涂布于營養缺陷平板 SD/-Trp-Leu和SD/-Trp-Leu-Ade-His上。在SD/-Trp-Leu平板上均有酵母單菌落生長, 表明AD和BK載體已成功轉入酵母中。在SD/-Trp-Leu-Ade-His平板上, 只轉入AD和BK空載體的酵母不能在平板上生長。同時,轉入pGBKT7-GmMYB173和pGADT7載體的酵母也不能在平板上生長, 表明pGBKT7-GmMYB173不具有自激活活性。轉入pGBKT7和pGADT7-GmSGF14 family載體的酵母也不能生長(在此以 pGADT7-GmSGF14d的結果省略表示), 表明 pGADT7-GmSGF14 family也不具有自激活活性。而同時轉入pGBKT7-GmMYB173和pGADT7-GmSGF14 family的酵母菌能夠生長出正常的菌斑(圖8), 表明GmMYB173與GmSGF14 family存在互作。挑取SD/-Trp-Leu-Ade-His單菌落搖菌后提取質粒, 菌落 PCR驗證表明, pGBKT7-GmMYB173和pGADT7-GmSGF14 family均已轉入酵母中(圖9)。
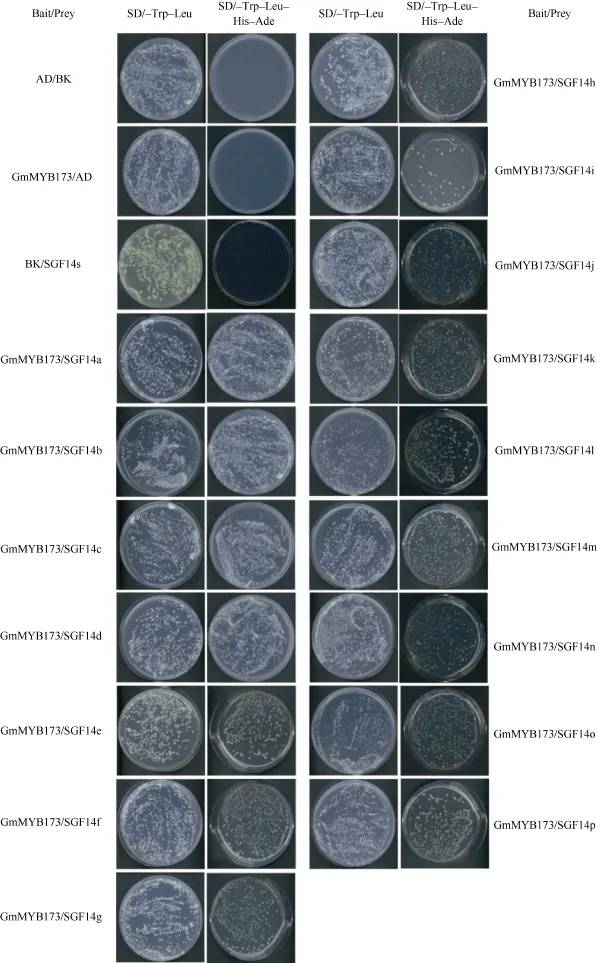
圖8 GmMYB173與14-3-3蛋白的酵母雙雜交結果Fig.8 Results of yeast two-hybrid assay of GmMYB173 and 14-3-3 proteins
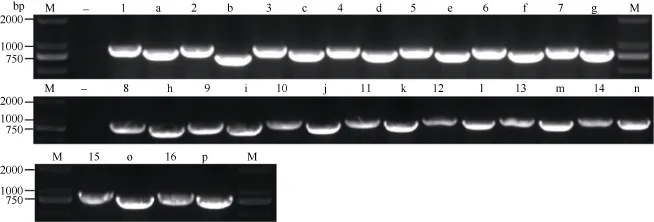
圖9 酵母雙雜實驗中酵母單菌落的菌落PCR驗證Fig.9 PCR Identification of yeast individual colony
2.5 GmMYB173與14-3-3蛋白互作強度測定
參照上述實驗方法測定 β-半乳糖苷酶活性, 確定GmMYB173與14-3-3蛋白互作強度表明, 不同的14-3-3蛋白與 GmMYB173互作之后激活的 β-半乳糖苷酶活性存在一定的差異。其中, 對照AD/BK、GmMYB173/AD、SGF14d/BK在本底水平上存在一定的β-半乳糖苷酶活性, 與對照相比, GmSGF14n與GmMYB173互作后激活的 β-半乳糖苷酶活性最強,GmSGF14k、GmSGF14e和GmSGF14o稍次之(圖10),暗示GmSGF14n與GmMYB173在植物體中相互作用來發揮一定的生物學功能。
3 討論
蛋白質的亞細胞定位是功能基因組學研究的重要內容, 對其研究有助于更加系統全面地理解植物的生長發育, 形態建成等。融合報告基因定位法是研究蛋白亞細胞定位最廣泛使用的方法之一[27]。洋蔥鱗莖內表皮細胞因其具有不含葉綠體、結果容易觀察等諸多優點而被廣泛用作亞細胞定位的受體細胞[28]。本研究通過在線的BaCelLo對GmMYB173的亞細胞定位預測, 顯示其定位于細胞核中(圖1)。進一步利用基因槍介導洋蔥表皮細胞瞬時轉化實驗驗證預測結果, 實驗結果與預測結果一致(圖5)。通過氨基酸序列比對分析, 發現GmMYB173與GmMYB176相似,都存在一個潛在的14-3-3蛋白結合位點, 即pST結合位點, 氨基酸序列為 SSLFDITT[23]。進一步利用SOE-PCR技術刪除相關編碼序列發現 GmMYB173失去了細胞核表達特異性(圖5), 這一結果與GmMYB176的亞細胞定位結果[23]類似。轉錄因子需要在細胞核中實現對靶基因的精準調控[29], 由此該結合位點不僅影響了GmMYB173的亞細胞表達特性,而且可能影響到 GmMYB173功能的發揮, 暗示14-3-3蛋白可能通過pST結合位點影響GmMYB173亞細胞定位進而調控GmMYB173的功能。
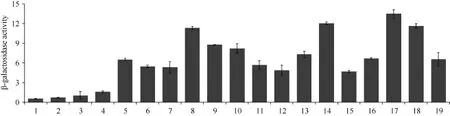
圖10 β-半乳糖苷酶活性測定Fig.10 Identification of β-galactosidase activity
為進一步明確 14-3-3蛋白是否能夠與GmMYB173互作, 本研究采用酵母雙雜交方法對此分析, 該方法是研究蛋白之間相互作用的經典方法。利用此方法發現16個14-3-3蛋白與GmMYB173均能互作, 通過測定蛋白互作后激活的 β-半乳糖苷酶活性發現它們與GmMYB173互作能力各有不同,其中 GmSGF14n與 GmMYB173的結合活性最強,GmSGF14k、GmSGF14e和GmSGF14o稍次之, 這一方面表明在植物體中可能是 GmSGF14n與GmMYB173結合進而調控靶基因的功能, 另一方面也說明植物有可能通過不同 14-3-3蛋白實現對GmMYB173的精準調控。在對GmMYB176的研究中也發現16個14-3-3蛋白與GmMYB176均能產生互作, 其中GmSGF14i與GmMYB176互作激活的β-半乳糖苷酶活性最高[24], 進一步表明14-3-3蛋白有可能廣泛參與 MYB轉錄因子功能活性的調控, 但對于不同的MYB轉錄因子又呈現一定的結合特異性。
轉錄因子GmMYB173是通過酵母單雜交技術,以自貢冬豆中開花基因GmFT2a的啟動子的T1元件為誘餌篩選出來的[25]。GmFT2a在大豆葉片中表達進而促進莖尖端花分生組織決定基因的表達, 最終促進大豆開花[30]。Li等[7]研究發現大豆中14-3-3蛋白表現不同的亞細胞分布和組織表達特異性, 其中GmSGF14n被定位于細胞核中, 并且在大豆葉片中的表達量最高。本研究也發現GmMYB173定位于細胞核中, 并且GmSGF14n與GmMYB173互作強度最高。由此推斷二者的互作可能會對GmFT2a的表達產生一定的影響, 但是仍需進一步實驗驗證。
由此可見, 14-3-3蛋白不僅與GmMYB173互作,而且可能對其在亞細胞中的定位產生影響, 也就會對其功能的發揮產生一定的影響, 這一研究結果有助于今后更好地研究14-3-3蛋白與GmMYB173的互作關系及其在大豆生長發育中的作用, 促進大豆育種應用研究。
4 結論
GmMYB173在細胞核中特異性表達, 這種特異性與14-3-3蛋白結合位點即 pST結合位點有關。GmMYB173可與大豆中所有檢測到表達的16個14-3-3蛋白 GmSGF14a-GmSGF14p互作, 其中與GmSGF14n互作最強。由此可見, 14-3-3蛋白不僅與GmMYB173互作, 而且可能通過pST結合位點對其在亞細胞中的定位產生影響。
References
[1] Brandt J, Thordal-Christensen H, Vad K, Gregersen P L,Collunge D B.A pathogen-induced gene of barley encodes a protein showing high similarity to a protein kinase regulator.Plant J,1992, 2: 815-820
[2] Lu G, DeLisle A J, de Vetten N C, Ferl R J.Brain proteins in plants: an Arabidopsis homolog to neurotransmitter pathway activators is part of a DNA binding complex.Proc Natl Acad Sci USA, 1992, 89: 11490-11494
[3] Hirsch S, Aitken A, Bertsch U, Soll J.A plant homologue to mammalian brain 14-3-3 protein and protein kinase C inhibitor.FEBS Lett, 1992, 296: 222-224
[4] DeLille J M, Sehnke P C, Ferl R J.The Arabidopsis 14-3-3 family of signaling regulators.Plant Physiol, 2001, 126: 35-38
[5] Rosenquist M, Alsterfjord M, Larsson C, Sommarin M.Data mining the Arabidopsis genome reveals fifteen 14-3-3 genes.Expression is demonstrated for two out of five novel genes.Plant Physiol, 2001, 127: 142-149
[6] Yao Y, Du Y, Jiang L, Liu J Y.Molecular analysis and expression patterns of the 14-3-3 gene family from Oryza sativa.J Biochem Mol Biol, 2007, 40: 349-357
[7] Li X, Dhaubhadel S.Soybean 14-3-3 gene family: identification and molecular characterization.Planta, 2011, 233: 569-582
[8] Yaffe M B, Rittinger K, Volinia S, Caron P R, Aitken A, Leffers H, Gamblin S J, Smerdon S J, Cantley L C.The structural basis for 14-3-3: phosphopeptide binding specificity.Cell, 1997, 91:961-971
[9] Fu H, Subramanian R R, Masters S C.14-3-3 proteins: structure,function, and regulation.Annu Rev Pharmacol Toxicol, 2000, 40:617-647
[10] Sumioka A, Nagaishi S, Yoshida T, Lin A, Miura M, Suzuki T.Role of 14-3-3γ in FE65-dependent gene transactivation mediated by the amyloid β-protein precursor.J Biol Chem, 2005, 280:42364-42374
[11] Casaretto J, Ho T H.The transcription factors HvABI5 and HvVP1 are required for the abscisic acid induction of gene expression in barley aleurone cells.Plant Cell, 2003, 15: 271-284
[12] Folta K M, Paul A L, Mayfield J D, Ferl R J.14-3-3 isoforms participate in red light signaling and photoperiodic flowering.Plant Signal Behav, 2008, 3: 304-306
[13] Huber S C, MacKintosh C, Kaiser W M.Metabolic enzymes as targets for 14-3-3 proteins.Plant Mol Bio, 2002, 50: 1053-1063
[14] Paul A L, Folta K M, Ferl R J.14-3-3 proteins, red light and photoperiodic flowering: a point of connection.Plant Signal Behav, 2008, 3: 511-515
[15] Hajduch M, Ganapathy A, Stein J W, Thelen J J.A systematic proteomic study of seed filling in soybean.Establishment of high-resolution two-dimensional reference maps, expression profiles, and an interactive proteome database.Plant Physiol, 2005,137: 1397-1419
[16] Prouse M B, Campbell M M.The interaction between MYB proteins and their target DNA binding sites.Biochim Biophys Acta,2012, 1819: 67-77
[17] 陳清, 湯浩茹, 董曉莉, 侯艷霞, 羅婭, 蔣艷, 黃瓊瑤.植物Myb 轉錄因子的研究進展.基因組學與應用生物學, 2009, 28:365-372 Chen Q, Tang H R, Dong X L, Hou Y X, Luo Y, Jiang Y, Huang Q Y.Progress in the Study of Plant Myb Transcription Factors.Geno Appl Biol, 2009, 28: 365-372 (in Chinese with English abstract)
[18] Liao Y, Zou H F, Wang H W, Zhang W K, Ma B, Zhang J S, Chen S Y.Soybean GmMYB76, GmMYB92, and GmMYB177 genes confer stress tolerance in transgenic Arabidopsis plants.Cell Res,2008, 18: 1047-1060
[19] 李曉薇.大豆兩個 MYB轉錄因子基因的克隆及其功能分析.吉林大學博士學位論文, 吉林長春, 2011 Li X W.Cloning and Characterization of Two MYB Transcription Factor Genes from Soybean.PhD Dissertation of Jilin University,Changchun, China, 2011 (in Chinese with English abstract)
[20] Liu Y F, Li Q T, Lu X, Song Q X, Lam S M, Zhang W K, Ma B,Lin Q, Man W Q, Du W G, Shui G H, Chen S Y, Zhang J S.Soybean GmMYB73 promotes lipid accumulation in transgenic plants.BMC Plant Biol, 2014, 14: 1
[21] Chen L, Bernhardt A, Lee J, Hellmann H.Identification of Arabidopsis MYB56 as a Novel Substrate for CRL3 (BPM) E3 Ligases.Mol Plant, 2015, 8: 242-250
[22] Liu L, Zhang J, Adrian J, Gissot L, Coupland G, Yu D, Turck F.Elevated levels of MYB30 in the phloem accelerate flowering in Arabidopsis through the regulation of FLOWERING LOCUS T.PLoS One, 2014, 9(2): e89799
[23] Yi J, Derynck M R, Li X, Telmer P, Marsolais F, Dhaubhadel S.A single-repeat MYB transcription factor, GmMYB176, regulates CHS8 gene expression and affects isoflavonoid biosynthesis in soybean.Plant J, 2010, 62: 1019-1034
[24] Li X, Chen L, Dhaubhadel S.14-3-3 proteins regulate the intracellular localization of the transcriptional activator GmMYB176 and affect isoflavonoid synthesis in soybean.Plant J, 2012, 71: 239-250
[25] 高友菲, 岳巖磊, 蔣炳軍, 韓天富.大豆GmFT2a啟動子InDel區結合蛋白的篩選.中國油料作物學報, 2015, 37: 27-34 Gao Y F, Yue Y L, Jiang B J, Han T F.Screening of protein binding to GmFT2a promoter indel region in soybean.Chin J Oil Crop Sci, 2015, 37: 27-34 (in Chinese with English abstract)
[26] 曲夢楠.大豆GmFT2b基因的功能分析.中國農業科學院碩士學位論文, 北京, 2014 Qu M N.Function Analysis of GmFT2b Gene in Glymine max.MS Thesis of Chinese Academy of Agricultural Sciences, Beijing,China, 2014 (in Chinese with English abstract)
[27] 邢浩然, 劉麗娟, 劉國振.植物蛋白質的亞細胞定位研究進展.華北農學報, 2006, 21(增刊2): 1-6 Xing H R, Liu L J, Liu G Z.Advancement of Protein Subcellular Localization in Plant.Acta Agric Boreali-Sin, 2006,21(S2): 1-6 (in Chinese with English abstract)
[28] 劉海燕, 馮冬茹, 劉兵, 何炎明, 王宏斌, 王金發.農桿菌介導的MpASR蛋白在洋蔥表皮細胞的定位研究.熱帶亞熱帶植物學報, 2009, 17: 218-222 Liu H Y, Feng D R, Liu B, He Y M, Wang H B, Wang J F.Studies on subcellular localization of MpASR in onion epidermal cells mediated by Agrobacterium.J Trop & Subtrop Bot, 2009, 17:218-222 (in Chinese with English abstract)
[29] Jin H, Xu G, Meng Q, Huang F, Yu D.GmNAC5, a NAC transcription factor, is a transient response regulator induced by abiotic stress in soybean.Sci World J, 2013, 2013: 768972
[30] Nan H, Cao D, Zhang D, Li Y, Lu S, Tang L, Yuan X, Liu B,Kong F.GmFT2a and GmFT5a redundantly and differentially regulate flowering through interaction with and upregulation of the bZIP transcription factor GmFDL19 in soybean.PLoS One, 2014, 9(5): e97669
Interaction of Soybean 14-3-3 Proteins with Transcription Factor GmMYB173
DONG Meng1,2, GAO You-Fie2, HAN Tian-Fu2, DONG-FANG Yang1,*, and JIANG Bing-Jun2,*
1Life Science and Technology College, Hebei Normal University of Science & Technology, Qinhuangdao 066000, China;2Key Laboratory of Soybean Biology (Beijing), Ministry of Agriculture / Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China
14-3-3 proteins, nearly existing in all eukaryotic cells, may regulate many physiological and biochemical processes through interacting with other proteins.As the largest class of transcription factors in plants, MYB gene family is widely involved in plant growth and metabolism regulation.A gene cloned from soybean cultivar Zigongdongdou, and specifically expressed in the nuclear in the subcellular location assay.Sequence analysis showed that there was a binding site of 14-4-4 proteins, namely the pST binding site, in GmMYB173 similar to that in GmMYB176.The nuclear-specific expression of GmMYB173 disappeared when the sequence of the pST binding site was deleted through the splicing by overlap extension PCR.All 14-3-3 proteins from GmSGF14a to GmSGF14p could interact with GmMYB173.Among them, GmSGF14n interacted with GmMYB173 strongest,GmSGF14e and GmSGF14k took second place, which was proved by the β-galactosidase activity analysis.These results suggest that 14-3-3 proteins not only interact with GmMYB173, but also probably regulate its subcellular location.The information provided by this study will facilitate the study of interaction relationship between 14-3-3 proteins and GmMYB173 and its function on the soybean development.
14-3-3 proteins; GmMYB173; Subcellular location; Yeast two-hybrid
10.3724/SP.J.1006.2016.01419
本研究由國家現代農業產業技術體系建設專項(CARS-04)和中國農業科學院科技創新工程項目資助。
This study was supported by the Special Program of Modern Agro-industry Technology System (CARS-04) and the Agricultural Science and Technology Innovation Program of Chinese Academy of Agricultural Sciences.
(Corresponding authors): 東方陽, E-mail: yang_dongfang@hotmail.com, Tel: 13780335864; 蔣炳軍, E-mail: jiangbingjun @caas.cn, Tel: 13910305439
聯系方式: E-mail: dongmeng902@163.com, Tel: 13164257831
Received(): 2016-03-15; Accepted(接受日期): 2016-06-20; Published online(網絡出版日期): 2016-07-04.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160704.0826.010.html

