鹽脅迫對貫葉連翹種子萌發及幼苗POD的影響
胡真明,張雅君,沈天文,徐根娣,江麗,呂洪飛
(1.浙江省永康市舟山鎮林業站,浙江金華321308;2.常熟理工學院生物與食品工程學院,江蘇常熟215500;3.浙江師范大學化學與生命科學學院,浙江金華321004)
鹽脅迫對貫葉連翹種子萌發及幼苗POD的影響
胡真明1,3,張雅君2,沈天文3,徐根娣3,江麗3,呂洪飛3
(1.浙江省永康市舟山鎮林業站,浙江金華321308;2.常熟理工學院生物與食品工程學院,江蘇常熟215500;3.浙江師范大學化學與生命科學學院,浙江金華321004)
為研究貫葉連翹的抗鹽生理,本研究利用不同濃度的NaCl溶液及相同濃度不同比例、不同鹽分的混合溶液處理貫葉連翹種子進行種子萌發試驗.結果表明:鹽脅迫對貫葉連翹種子萌發具有抑制作用,其中Na2CO3的抑制作用最顯著.采用垂直平板聚丙烯酰胺凝膠電泳,研究了貫葉連翹幼苗在不同濃度NaCl溶液處理下不同時期過氧化物同工酶(POD)的變化情況.結果表明:不同時期的貫葉連翹在鹽脅迫下,同工酶酶帶有一定的差異.不同鹽濃度下,同一時期貫葉連翹的同工酶酶帶也有所差異.結論:鹽脅迫對貫葉連翹種子萌發具有抑制作用,并對過氧化物同工酶(POD)有一定的影響.
貫葉連翹;鹽脅迫;種子萌發率;幼苗;過氧化物酶同工酶
貫葉連翹(Hypericum perforatum L.)為藤黃科(Guttiferae)金絲桃屬(Hypericum L.)多年生草本植物,種子黑褐色,花期7—8月,果期9—10月[1].貫葉連翹除作為傳統的中藥材外,其活性成分在治療抑郁癥、肝炎和艾滋病及抗癌等方面的重要利用前景使其成為近年來世界最暢銷植物藥之一[2].研究表明,貫葉連翹含有雙蒽酮衍生物、黃烷酮醇類、黃酮及黃醇酮類、香豆素類、酚酸類、間苯三酚衍生物、揮發油類等物質.雙蒽酮衍生物中的金絲桃素具有抑制中樞神經、抗病毒、增強免疫的功能[3-4].貫葉連翹在自然條件下主要分布于西北、中南、西南、華東,生長于海拔800~1200 m,喜向陽、濕潤土壤,耐寒[5-6],除營養繁殖外,它主要靠種子繁殖,而自然條件下其種子萌發率較底,研究還表明,貫葉連翹是需光性種子,在萌發初期進行光預處理能有效提高萌發率[2].
鹽脅迫是植物種子萌發和生長發育過程中經常遇到的一種脅迫,特別是在鹽堿化較為嚴重的區域.鹽脅迫對植物造成的主要影響表現在以下兩方面:一是細胞質中金屬離子(主要是Na+)的大量積累,它會破壞細胞內離子平衡并抑制細胞內生理生化代謝過程,使植物光合作用能力下降,最終因碳饑餓而死亡;二是鹽堿土壤是一個高滲環境,它能阻止植物根系吸收水分,從而使植物因“干旱”而死亡.同時鹽堿土壤pH值較高,這使得植物體與外界環境酸堿失衡,進而破壞細胞膜結構,造成細胞內溶物外滲而使植物死亡[7].
土壤鹽堿化主要是土壤中的Na+、Ca2+、Mg2+3種陽離子和CO32-、HCO3-、Cl-、SO42-4種陰離子組成的鹽分過多所造成的[8].國內外對星星草、棉花、甜菜等植物的抗鹽性都有所研究,這些研究都促進了上述植物在鹽堿地的適應性栽培[7].但至今尚未有研究報道貫葉連翹種子在鹽脅迫下的萌發狀況及生理生化變化過程.本文擬通過對不同濃度和組分的鹽處理下貫葉連翹種子萌發和生理變化的研究,以期了解貫葉連翹的抗鹽性,為人工栽培貫葉連翹提供科學依據.
1 材料與方法
1.1材料
本次實驗所用的貫葉連翹種子采自浙江師范大學實驗苗圃.
1.2方法
1.2.1種子發芽試驗
選取顆粒飽滿、顏色深(黑色)、有光澤的貫葉連翹種子,用0.1%HgCl2消毒1 min,蒸餾水清洗4~5次.以不同濃度及不同組合的鹽溶液浸種處理36 h.單鹽處理NaCl溶液濃度分別為50,100,150,200,250,300,350 mmol/L,設蒸餾水為對照(CK).混合鹽處理中用以混合的各鹽濃度均為為5 mg/ml,混合鹽的配方分別為:NaCl(1),Na2SO4(1),Na2CO3(1),NaCl-Na2SO4(3:1)…….
在洗凈、烘干的玻璃培養皿(d=120 mm)中放入濾紙,分別加入上述濃度溶液至濾紙飽和為止.然后擺入相應溶液浸種處理過的種子100顆,各3次重復.移入25℃±1℃的人工氣候箱中進行萌發.開始10 d 24 h光照,隨后進行24 h更替.以胚芽長度達到種子一半為種子發芽的判斷標準[9].萌發過程中每24 h檢測1次,記錄發芽種子數,并補充蒸發的水分,使各種處理鹽溶液濃度相對維持不變.

1.2.2幼苗生長過氧化物同工酶試驗
讓貫葉連翹種子先在培養皿(d=120 mm)中發芽,等發芽后(約7 d),將種子移入沙子(沙子洗凈后用蒸餾水浸泡24 h,然后烘干)中,每天澆蒸餾水,使沙子濕度保持在80%左右,移栽一周后,每周定時澆1次營養液.當幼苗長至10對葉片時,開始用鹽溶液處理幼苗,處理NaCl溶液濃度分別為50,100,150,200,250,300,350 mmol/L;設蒸餾水為對照(CK).采用將鹽溶液噴到葉片上的方法,每天定時定量(每次15 ml)噴1次,處理7 d后,用于POD同工酶測定.
將實驗苗圃中自然條件下生長的貫葉連翹幼苗(幼苗均具有20對葉片)移栽至實驗室的潔凈沙子中,每天澆蒸餾水,7 d后同樣采用噴鹽溶液的方法,每天定時定量(每次15 ml)噴1次,處理7 d后,用于POD同工酶測定.處理NaCl溶液濃度同樣分別為50,100,150,200,250,300,350 mmol/L;設蒸餾水為對照(CK).
用聚丙烯酰胺凝膠垂直板電泳法[11-12]分離貫葉連翹POD同工酶.分離膠濃度7.5%,濃縮膠濃度3.3%,凝膠厚1.5 mm,濃縮膠電流強度1 mA/cm膠寬,分離膠電流強度2 mA/cm膠寬.Tris-甘氨酸緩沖液為電極緩沖液,pH值8.3.點樣液(樣品上清夜與400 mg/g蔗糖2∶1混合)每槽點樣30 μl,以0.3 mg/g溴酚藍水溶液作前沿指示劑.電泳約3~4 h,當指示劑達到凝膠底部0.5 cm時停止.Rf=酶帶遷移距離/溴酚藍遷移距離.
用抗壞血酸-聯苯胺染色法.抗壞血酸0.0704 g,聯苯胺溶液20 ml(2 g聯苯胺溶于18 ml溫熱冰醋酸,再加蒸餾水72 ml),0.6%過氧化氫20 ml,蒸餾水60 ml.染色10 min,即可得酶譜,用去離子水沖洗,保存于7%冰醋酸中.凝膠采用THETMAL IMAGING FTI-500掃描記錄,根據掃描記錄再繪制模式圖.
2 結果與分析
2.1鹽脅迫對貫葉連翹種子發芽率的影響
貫葉連翹種子的發芽率在不同的鹽濃度和不同的萌發時間下,有較大差異(圖1).從圖1中可以看出,隨著鹽濃度的增加,種子的萌發曲線越低,表明隨著鹽濃度的增加,發芽率呈降低趨勢.貫葉連翹種子在CK、50 mmol/L和100 mmol/L鹽濃度下最終萌發率變化不大,但起始萌發時間和萌發整齊度依次下降,從150 mmol/L鹽濃度開始萌發率明顯下降,150 mmol/L的最終萌發率為45%.當NaCl溶液的濃度為350 mmol/L時,發芽率接近0.貫葉連翹種子在相同濃度的單鹽及相同濃度不同比例、不同鹽分混合液中的發芽率見表1.其中以Na2CO3的抑制作用最顯著,NaCl-Na2CO3次之,NaCl的抑制作用最小.各種鹽溶液處理下種子的最終萌發率顯著低于蒸餾水(CK)中的萌發率(見圖1、表1).
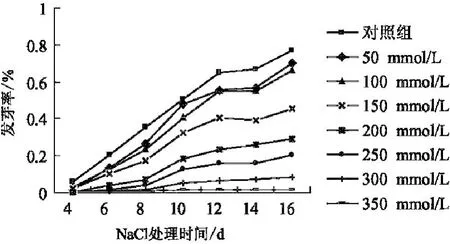
圖1 單鹽脅迫下貫葉連翹種子的萌發曲線
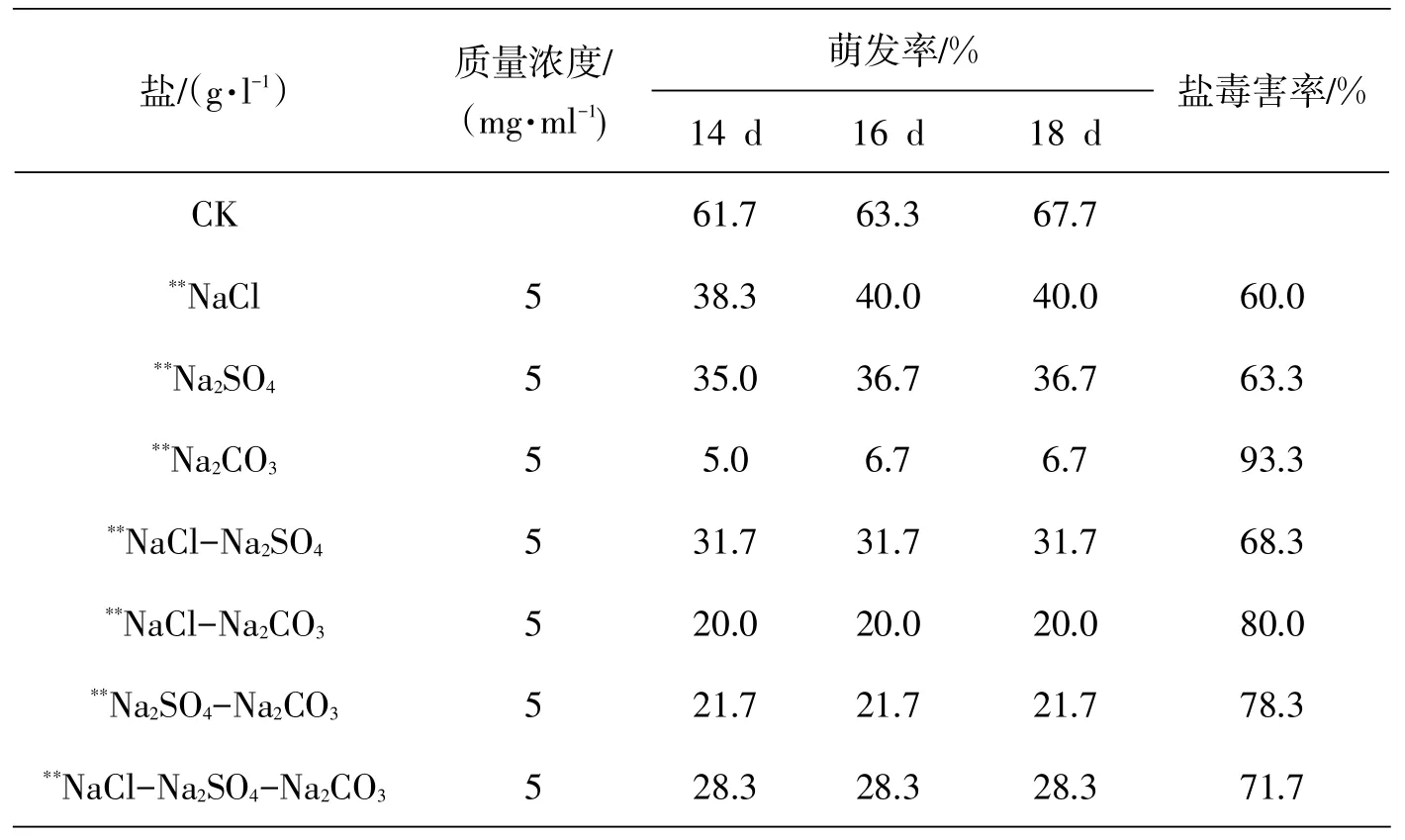
表1 混合鹽脅迫對貫葉連翹種子發芽率的影響
2.2鹽脅迫對貫葉連翹幼苗生長過氧化物同工酶的影響
圖2和圖3為鹽脅迫對貫葉連翹10葉期和20葉期幼苗過氧化物同工酶的凝膠圖.
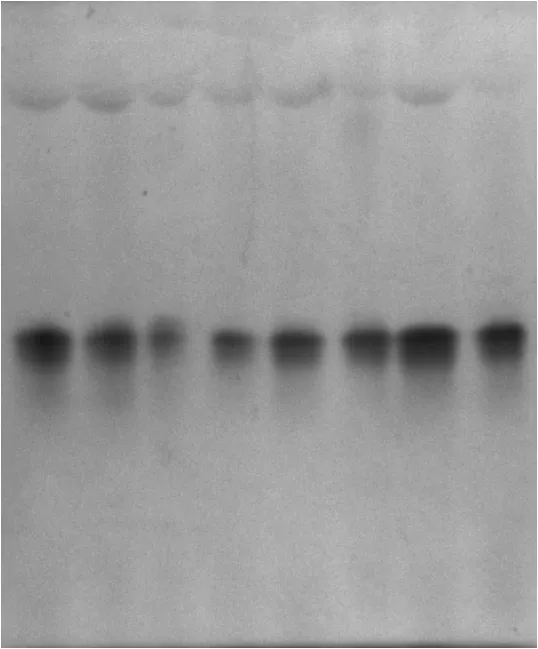
圖2 鹽脅迫對貫葉連翹10葉期幼苗過氧化物同工酶的影響
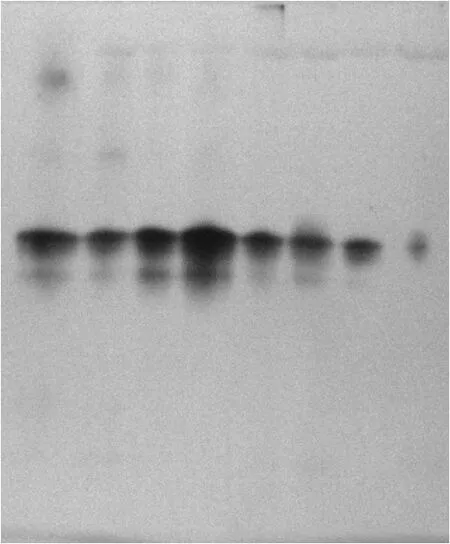
圖3 鹽脅迫對貫葉連翹20葉期幼苗過氧化物同工酶的影響
使用Image Master TotFelb軟件分析,可獲得鹽脅迫處理的幼苗過氧化物同工酶的模式圖(圖4、圖5).
從圖2和圖3可看出,20葉期的貫葉連翹植株的過氧化物同工酶的酶帶數要明顯多于10葉期時的,而且鹽脅迫對20葉期植株的影響要大于10葉期的.雖然10葉期貫葉連翹的幼苗都只出現了一條酶帶(見圖4),但是酶的活性卻不同,濃度為100 mmol/L的NaCl溶液對貫葉連翹幼苗過氧化物同工酶的影響最大,酶活性最低,濃度為300,350 mmol/L時的貫葉連翹植株POD同工酶卻保持著較高的活性.從圖5可看出,各濃度鹽處理對貫葉連翹幼苗的影響變化較為明顯.第3位的酶帶每個處理都有;高鹽濃度對貫葉連翹幼苗的抑制作用更為明顯,用濃度為350 mmol/L的NaCl溶液處理的貫葉連翹幼苗過氧化物同工酶的酶帶數和酶的活性明顯低于對照組;而用150 mmol/L濃度處理的貫葉連翹幼苗過氧化物同工酶的3、4位酶帶的活性要高于對照組,且為最高.
3 結果和討論
3.1鹽脅迫對貫葉連翹種子萌發率的影響
鹽脅迫對植物整個生長發育時期都有很大的影響,鹽分進入細胞中對參與代謝的酶活性產生影響,導致膜透性、光合作用、呼吸作用等生化過程混亂,從而使植物的生長受到抑制,尤其受到抑制的是細胞的分裂和分化[13].一般認為,中性鹽(NaCl)脅迫的傷害作用主要是通過離子本身的毒性效應、高濃度鹽的滲透效應和營養效應來完成的[14].
鹽能抑制植物種子萌發,其抑制程度隨鹽濃度的增大而增大[15].在NaCl脅迫下,種子萌發過程中吸水受阻,將會進一步抑制細胞內正常的代謝活動,而且細胞內Na+的濃度要高于Cl-的濃度,從而引起種子萌發受阻[16-17].閆先喜[18]認為大麥在種子吸脹過程中鹽脅迫會破壞細胞膜,膜透性增大導致溶液外滲,導致種子萌發受阻.本研究結果表明,鹽脅迫處理對貫葉連翹種子發芽有很強的抑制作用,隨著鹽濃度的升高,種子的發芽率減小.混合鹽處理,在一定程度上具有減輕Na2CO3的抑制作用.表現在混合鹽處理的貫葉連翹種子發芽率均低于同濃度Na2CO3處理結果.
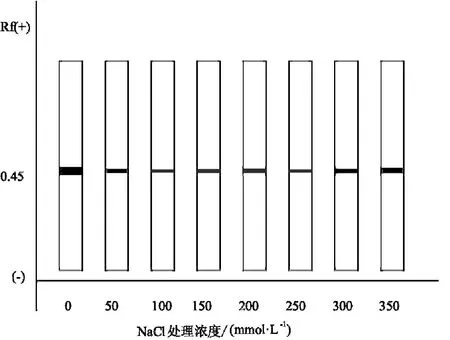
圖4 鹽脅迫對貫葉連翹10葉期幼苗過氧化物同工酶的影響的模式圖
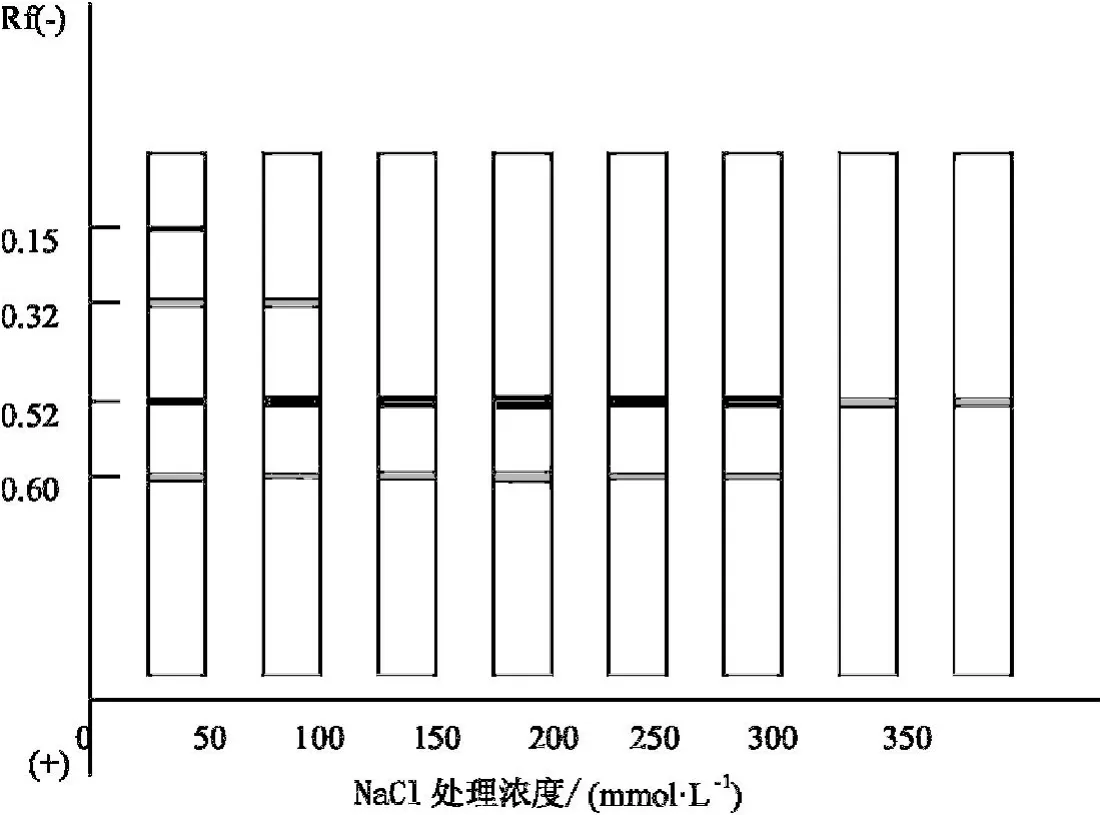
圖5 鹽脅迫對貫葉連翹20葉期幼苗過氧化物同工酶的影響的模式圖
3.2鹽脅迫對貫葉連翹幼苗過氧化物同工酶的影響
清除過氧化物的POD包括許多種類,其中AsAPOD是植物抗氧化脅迫中起重要作用的酶,類黃酮POD可利用植物體內普遍存在的類黃酮物質清除H2O2[19].一般認為,在鹽脅迫條件下,植物通過吸收、積累無機鹽和合成有機物質作用滲透劑進行滲透調節,以適應鹽漬環境[20].SOD、POD、CAT等是酶促防御系統保護酶,它們協同作用,防御活性氧或其他過氧化自由基對細胞膜系統的傷害.鹽脅迫下植物細胞內Na+、Cl-和其他離子如K+、Ca2+運輸的動態平衡被破壞[21].細胞內過量的Na+還可以破壞體內活性氧產生和清除系統之間的動態平衡,啟動膜脂過氧化或膜脂脫酯化作用,破壞膜脂和膜蛋白[22].
POD同工酶是一種對外界不良環境條件反應十分敏感的酶.Dash[23]在研究鷹嘴豆時發現隨著NaCl濃度的增加POD的活性會降低,環境中高濃度的鹽可以誘導或抑制某些同工酶的產生[24],一些學者把植物的這種特性稱作“適應性”反應.植物在處于諸如高鹽等不良生活環境時,通過誘導或抑制某些同工酶的產生來適應環境而使其得以生存.大量的脅迫處理試驗和在分子水平上的基因調控研究證據已經證實大部分的POD合成屬于誘導表達型[25].本研究中也觀察到這一現象,從兩張酶譜圖中,當貫葉連翹植株為10葉期時,低濃度鹽可以抑制POD的活性,而高濃度鹽卻增強POD的活性.可以推測:在高鹽濃度下,貫葉連翹體內的一些調控基因啟動,進行了表達,使得保護系統抗逆能力有所增強,表現在300 mol/L濃度處理時,POD的活性比對照組還要高.反之,當貫葉連翹植株為20葉期時,低濃度鹽增強POD的活性,高濃度鹽卻抑制了POD的活性,據此推測,20葉期幼苗要比10葉期幼苗對鹽更敏感.
[1]中國科學院中國植物志編委會.中國植物志:第50卷,第2分冊[M].北京:科學出版社,1990:1.
[2]賀軍民,李發榮,余小平,等.光、赤霉素和乙烯利對貫葉連翹種子萌發的影響[J].中草藥,2002,33(9):840-843.
[3]呂洪飛,初慶剛,胡正海.金絲桃屬植物的化學成分研究進展[J].中草藥,2001,21(2):1135-1138.
[4]呂洪飛,胡正海.貫葉連翹分泌結構的發育及其內含物積累的研究[J].西北植物學報,2001,21(2):287-292.
[5]張林靜,胡正海,趙桂仿.金絲桃屬藥用植物的研究開發現狀及一些看法[J].中成藥,1999,21(12):647-650.
[6]鄭清明.金絲桃屬藥用植物的生藥學研究[D].上海:第二軍醫大學,2002.
[7]屈芳芳.植物耐鹽相關的生理生化機制[J].河南科技,2015,12:141-143.
[8]斯琴巴特爾,吳紅英.鹽脅迫對玉米種子萌發及幼苗生長的影響[J].干旱區資源與環境,2000,14(4):76-80.
[9]莫測輝,吳啟堂,周友平,等.城市污染對作物種子發芽及幼苗生長影響的初步研究[J].應用生態學報,1997,8(6):645-649.
[10]邵秋玲,謝小丁,張方申,等.鹽地堿蓬人工栽培與品系選育初報[J].中國生態農業學報,2004,12(1):47-49.
[11]孟學平,楊恒山,郭宏,等.鹽脅迫對冬小麥過氧化物同工酶的影響[J].華北農學報,2000,15(4):62-67.
[12]SHAO Y,GAO J,WU X,et al.Effect ofsalt treatment on growth,isoenzymes and metabolites of Andrographis paniculata(Burm.f.)Nees[J].Acta Physiol Plant,2015,37:35.
[13]任昱坤,吳雪峰,謝亞軍.植物抗鹽性研究進展的綜述[J].寧夏農學院學報,1995,16(4):60-66.
[14]RUIZ D,MARTINEZ V,CERDA A.Demarcatingspecific ion(NaCl,Cl-,Na+)and osmotic effects in the response of two citrus root-stocks tosalinity[J].Sci Hortic-Amsterdam,1999,80:213-224.
[15]王志才,牙庫甫江·阿西木,王艷,等.水鹽脅迫對花花柴種子萌發的影響[J].中國沙漠,2012,32(3):750-755.
[16]金蘭,丁莉.鹽脅迫下星星草種子萌發過程中淀粉酶活性及可溶性糖含量變化[J].青海師范大學學報(自然科學版),2003(1):86-97,90.
[17]JBIR N,AYADI A,AMARs,et al.Seed germination of two wheatspecies differing in theirsensitivity to NaCl,in response tosaltstress[J].J Trace Microprobe Techn,2002,20(4):625-637.
[18]閆先喜,馬小杰,刑樹平,等.鹽脅迫對大麥種子細胞膜透性的影響[J].植物學報,1995,12(增刊):53-54.
[19]盧靜君,多立安,劉祥君.鹽脅迫下兩草種SOD和POD及脯氨酸動態研究[J].植物研究,2004,24(1):115-119.
[20]周希琴,吉前華.鹽脅迫下木麻黃幼苗抗氧化酶活性的變化及Ca2+對它的調控[J].植物生理學通訊,2004,40(2):184-186.
[21]NIU X,BRESSAN R A,HASEGAWA P M,et al.Ion homeostasis in NaClstress environment[J].Plant Physiol,1995,109:735-742.
[22]劉欣.植物的耐鹽生物學機制研究進展[J].哈爾濱師范大學自然科學學報,2015,31(2):140-145.
[23]DASH M,PANDAs K.Saltstress induced changes in growth and enzyme activities in germinating Phaseolus mungoseeds[J]. Biol Plantarum,2001,44(4):587-589.
[24]王振英,鄭堅瑜,陳瑞陽.鹽脅迫、輻射條件下耐鹽與不耐鹽水稻POD同工酶、全蛋白變化的研究[J].南開大學學報(自然科學版),1999,32(1):23-27.
[25]田國忠,李懷方,裘維蕃.植物過氧化物酶研究進展[J].武漢植物學研究,2001,19(4):332-344.
The Effect ofsaltstress onseed Germination andseedling Growth of Hypericum perforatum L.
HU Zhenming1,3,ZHANG Yajun2,SHEN Tianwen3,XU Gendi3,JIANG Li3,Lü Hongfei3
(1.Zhoushan Town Forestrystation of Yongkang City,Zhejiang Province,Jinhua 321308;2.School of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500;3.College of Chemistry and Lifesciences,Zhejiang Normal University,Jinhua 321004,China)
In order to understand thesalt resistance of Hypericum perforatum L.,and to prove whether it issuitable forsaline alkalisoil cultivation,theseed was treated by different concentration NaClsolution or mixedsolution ofsame concentration with differentsalts.The resultshowed thatsaltstress inhibited H.perforatumseed germination.The effect of Na2CO3 inhibition was the mostsignificant in allsalt treatments.The effect ofsaltstress on isoenzymes of POD inseeding growth of H.perforatum was analyzed through polyacrylamide gel electrophoresis.The resultsshowed that there existsome differences in the isoenzymatic patterns of POD in differentstage.Andsome differences in the isoenzymatic patterns of POD also occurred in differentsalt concentrations on thesamestage.Therefore,a conclusion was reached thatsaltstress inhibited H.perforatumseed germination and effect on Peroxidase isoenzyme(POD)activities of theseedling.
Hypericum perforatum L.;salt-stress;seed germination;seedling;POD
Q945.78
A
1008-2794(2015)04-0120-05
2016-04-12
江蘇省科技支撐計劃項目“規模化生態雞在循環經濟體系中的應用及推廣示范”(BE2012416)
呂洪飛,教授,博士,研究方向:植物學,E-mail:luhongfei0164@163.com.

