養豬發酵床墊料微生物類群結構特性分析
藍江林,栗 豐,2,劉 波*,史 懷,黃素芳
(1.福建省農業科學院農業生物資源研究所,福建 福州 350003;2.福建農林大學,福建 福州 350108)
?
養豬發酵床墊料微生物類群結構特性分析
藍江林1,栗豐1,2,劉波1*,史懷1,黃素芳1
(1.福建省農業科學院農業生物資源研究所,福建福州350003;2.福建農林大學,福建福州350108)
采用定點取樣、平板分離的方法,分析養豬發酵床墊料微生物的結構特性。結果表明,在30個樣點5次取樣過程中,微生物含量總體為細菌>放線菌>真菌。細菌含量變化幅度最大[(33.72~197.23)×105cfu·g-1],真菌含量變化相對較小[(7.87~48.64)×103cfu·g-1],而放線菌含量變化穩定[(20.14~33.18)×104cfu·g-1]。細菌含量類群Ⅰ(大于70.00×105cfu·g-1)平均9.2個樣點、占總樣點的28.67%;類群Ⅲ(小于30.00×105cfu·g-1)平均為8.6個樣點,占總樣點的30.67%;類群Ⅱ[(30.00~70.00)×105cfu·g-1]平均為12.2個樣點,所占比例最大,為40.67%。真菌類群Ⅰ(大于70.00×103cfu·g-1)平均僅3.8個樣點,所占比例最低,為12.67%;類群Ⅱ[(30.00~70.00)×103cfu·g-1]平均為6.4個樣點,所占比例為21.33%;類群Ⅲ(小于30.00×103cfu·g-1)平均19.8個樣點,所占比例高達66.00%。放線菌3種類群所占比例與真菌類似,類群Ⅰ(大于70.00×104cfu·g-1)平均僅1.4個樣點,所占比例最低,僅為4.67%;類群Ⅱ[(30.00~70.00)×104cfu·g-1]平均8.4個樣點,所占比例為28.00%;類群Ⅲ(小于30.00×104cfu·g-1)平均20.2個樣點,所占比例高達67.33%。
發酵床墊料;微生物類群;空間結構
發酵床養豬是將微生物發酵技術和養殖技術相結合,利用墊料吸收養殖過程中排泄的豬糞尿,通過微生物進行原位發酵,分解消納,去污除臭,實現了畜禽養殖的清潔環保[1]。生豬排泄的糞尿和發酵床墊料充分混合,發酵分解過程實質上是微生物的物質代謝和能量轉化過程,因此微生物群落組成與空間分布的研究是揭示發酵床墊料中微生物多樣性產生和維持機制的必要前提,對及時了解發酵進程、有效控制發酵過程、優化發酵條件、提高糞污降解效率都具有很重要的作用。在糞便腐熟發酵過程中,無論是常溫型還是高溫型,細菌的數量占了絕對的優勢,升溫期各種微生物數量均有增加。進入高溫期只有高溫細菌和高溫放線菌的數量繼續上升,在腐熟期細菌數量下降,但放線菌和霉菌數量明顯上升[2]。劉波等[3-4]運用脂肪酸生物標記法研究了零排放豬舍基質墊層微生物群落的多樣性,并提出了微生物群落分布的特征指標,構建發酵指數指示基質墊層的發酵特性。畢泗偉等[5]采用16S rDNA 基因文庫技術分析發酵床細菌群落,結果表明,各層墊料細菌均分布在數十個已知細菌種屬里,中層和深層墊料中具有明顯的與分解氮等有機物相關的優勢菌株。養豬發酵床墊料的微生物組成種類較多, 呈現出很高的微生物多樣性。在同一個豬舍內,其管理方式較為一致,養殖環境基本相同,但各飼養欄內豬只的生長狀況、生活習慣等均存在差異,會造成墊料中微生物優勢種類,種群結構等也存在差異。本研究采集相同豬舍內不同飼養欄內的發酵床墊料,采用平板分離方法,分析研究墊料中細菌、真菌和放線菌的多態性,不同類群微生物的分布狀態,從微生態角度進一步闡明發酵床墊料中微生物的變化動態。研究結果將進一步豐富微生物發酵床養殖技術理論體系,也為該項技術的實際應用奠定基礎。
1 材料與方法
1.1采樣環境
采樣地點為福州新店養豬場,飼養“杜×長×大”商品豬,采用接觸式微生物發酵床飼養模式[1]。本研究樣品采集自飼養第2批生豬起取樣,取樣期間室外氣溫為26~38℃,豬舍采用風機配合水簾降溫,舍內溫度27~32℃。
1.2樣品采集
樣點位置分布見圖1。每個豬欄發酵床面積為6 m×8 m=48 m2,基質墊層厚度80 cm,主要配料為谷殼和鋸末,基本配比為體積比1∶1,飼養25 kg左右的生豬40頭。在豬欄縱向中軸線上距欄邊沿1、3、5 m處設3個樣點,每個采樣點直徑約40 cm,將墊料上下縱深翻勻,取樣500 g待用,采樣10個豬欄共30個樣品,按照欄位樣點順序編號為1、2、3、…、30。從第2批生豬進欄舍起,每間隔15 d取樣一次,共取樣5個批次。
1.3發酵床墊料可培養微生物分離檢測[6]
采用牛肉膏蛋白胨培養基(NA)培養細菌,馬鈴薯培養基(PDA)培養真菌,高氏培養基(改良)培養放線菌。稱取10 g樣品加入100 mL無菌水中,搖床振蕩15 min,使之充分混勻,梯度稀釋至10-2、10-3、10-4、10-5。每個濃度每種培養基平板涂布3塊,每塊平板涂布菌懸液200 μL。靜置20 min,倒置于恒溫箱中培養。細菌30℃,1~2 d;真菌25℃,2~6 d;放線菌28℃,5~7 d。統計菌落種類和數量,計算對應樣品微生物的含量。
1.4發酵床墊料微生物生態分布多態性分析
以樣點為樣本,以墊料中微生物含量為指標,進行聚類分析,將30個樣點根據微生物含量(細菌、真菌、放線菌)分為高含量、中含量和低含量3個類群。繪制細菌/真菌/放線菌樣點生態分布格局平面圖,類群Ⅰ(高含量),圖中以黑色標示;類群Ⅱ(中含量),圖中以灰色標示;類群Ⅲ(低含量),圖中以白色標示。
2 結果與分析
2.1微生物發酵床養豬墊料微生物的數量分布多態性
發酵床墊料微生物的數量分布多態性結果見表1。由于各欄圈生豬的生長狀況、行為習慣均以及人為操作管理均存在差異,采樣期間各墊料樣品的微生物的含量及結構也存在顯著差異。整體取樣30個樣點中5次取樣過程中,微生物含量總體為細菌>放線菌>真菌。細菌含量最低為5.23×105cfu·g-1,最高達1 930.00×105cfu·g-1;放線菌含量最低為3.50×104cfu·g-1,最高達122.00×104cfu·g-1;真菌含量最低為0.75×103cfu·g-1,最高達277.5×103cfu·g-1。從各次取樣總體平均值來看,細菌含量變化幅度最大[(33.72~197.23)×105cfu·g-1],真菌含量變化相對較小[(7.87~48.64)×103cfu·g-1],而放線菌含量變化相對穩定[(20.14~33.18)×104cfu·g-1]。
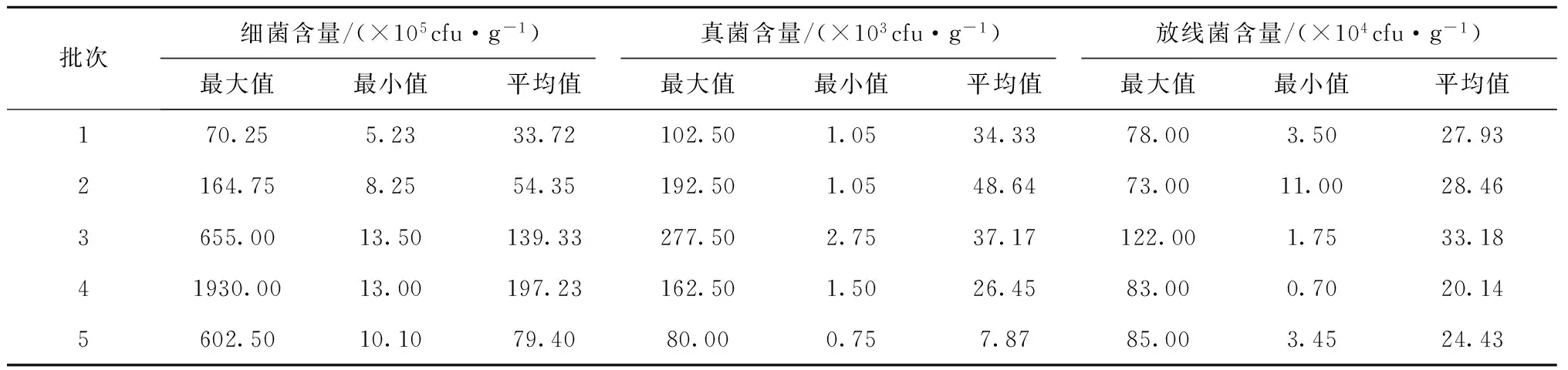
表1 微生物含量統計
2.2微生物發酵床養豬墊料微生物空間分布多態性
2.2.1微生物發酵床養豬墊料細菌空間分布多態性根據細菌含量為指標,將30個樣點分為3類:類群Ⅰ為高含量,大于70.00×105cfu·g-1,類群Ⅱ為中含量,為(30.00~70.00)×105cfu·g-1,類群Ⅲ為低含量,小于30.00×105cfu·g-1。根據各樣點細菌的含量類別,繪制樣點分布格局平面圖2。第1批取樣(圖2-A)細菌類群Ⅰ僅包括1個樣點10,細菌含量為70.25×105cfu·g-1;類群Ⅱ包括16個樣點,分別為樣點1、2、3、4、13、15、17、18、21、22、24、26、28、29和30,含量為(30.00~60.00)×105cfu·g-1;余下的13個樣點均屬于類群Ⅲ,含量低于30.00×105cfu·g-1,其中樣點16含量最低為5.53×105cfu·g-1。第2批取樣(圖2-B)類群Ⅰ包括10個樣點,分別為樣點1、2、4、5、19、、22、23、24、25和29,其中樣點5含量最高為164.75×105cfu·g-1;類群Ⅱ包括13個樣點,分別為樣點3、7、9、10、11、14、16、18、20、21、26、27和28,含量為(30.50~69.50)×105cfu·g-1;類群Ⅲ包括余下的7個樣點,其中樣點15含量最低為8.25×105cfu·g-1。第3批取樣(圖2-C)類群Ⅰ包括11個樣點,分別為樣點1、2、7、10、13、14、22、24、25、28和30,其中樣點10細菌數量最高為865.00×105cfu·g-1;類群Ⅱ包括13個樣點,分別為樣點3、4、5、8、9、12、15、17、20、21、23、26和27,含量為(34.50~66.50)×105cfu·g-1;類群Ⅲ包括其余6個樣點,其中樣點18含量最低為8.25×105cfu·g-1。第4批取樣(圖2-D)類群Ⅰ包括15個樣點,分別是樣點1、13、16、18、19、20、21、22、23、24、26、27、28、29和30,其中樣點1細菌含量最高為1930.00×105cfu·g-1;類群Ⅱ中包括7個樣點,分別是樣點2、4、5、7、9、12和25,含量為(32.00~64.75)×105cfu·g-1;類群Ⅲ包括其余8個樣點,其中樣點1含量最低為13.00×105cfu·g-1。第5批取樣(圖2-E)類群Ⅰ包括9個樣點,分別是樣點2、3、4、6、23、27、28、29和30,其中樣點3細菌含量最高為602.50×105cfu·g-1;類群Ⅱ包括13個樣點,分別是1、5、7、8、9、12、13、14、15、19、22、24和26,細菌含量為(38.25~68.00)×105cfu·g-1;類群Ⅲ包括8個樣點,分別為樣點10、11、16、17、18、20、21和25,其中樣點11細菌含量最低為10.10×105cfu·g-1。
2.2.2微生物發酵床養豬墊料真菌空間分布多態性根據真菌含量將30個樣點分類分為3類:類群Ⅰ為高含量,大于70.00×103cfu·g-1;類群Ⅱ為中含量,為(30.00~70.00)×103cfu·g-1;類群Ⅲ為低含量,小于30.00×103cfu·g-1。根據各樣點真菌含量的類別,繪制樣點分布格局平面圖3。第1批取樣(圖3-A)類群Ⅰ包括樣點2、5和9,真菌含量高于80.00×103cfu·g-1,其中樣點9最高為102.50×103cfu·g-1;類群Ⅱ包括11個樣點,分別為樣點1、3、6、7、8、14、15、17、25、26、27,含量為(31.50~60.00)×103cfu·g-1;類群Ⅲ包括其余16個樣點,含量為(1.05~26.50)×103cfu·g-1,其中樣點12真菌含量最低為1.05×103cfu·g-1。第2批取樣(圖3-B)類群Ⅰ包括8個樣點,分別是樣點4、5、9、14、25、26、27、28,其中樣點26真菌含量最高為192.50×103cfu·g-1;類群Ⅱ中包括6個樣點,分別是樣點1、6、7、8、13和15,含量為(32.50~67.55)×103cfu·g-1;類群Ⅲ包括其余16個樣點,含量為(1.05~27.75)×103cfu·g-1,其中樣點12含量最低為1.05×103cfu·g-1。第3批取樣(圖3-C)類群Ⅰ包括樣點19、20、21和25,其中樣點19真菌含量最高為277.50×103cfu·g-1;類群Ⅱ中包括10個樣點,分別是樣點1、2、7、9、13、14、15、17、26、27和28,真菌含量為(30.00~62.50)×103cfu·g-1;其余16個樣點屬于類群Ⅲ,真菌含量變化范圍為(2.75~25.00)×103cfu·g-1,其中樣點12最低為2.75×103cfu·g-1。第4批取樣(圖3-D)類群Ⅰ包括樣點16、18和19,其中樣點19真菌含量最高為162.50×103cfu·g-1;類群Ⅱ中樣點13、15、20和21,含量范圍為(32.50~57.50)×103cfu·g-1;其余23個樣點屬于類群Ⅲ,含量變化范圍為(1.50~25.00)×103cfu·g-1,其中樣點24含量最低為1.50×103cfu·g-1。第5批取樣(圖3-E)。類群Ⅰ僅包括1個樣點18,真菌含量為80.00×103cfu·g-1;類群Ⅱ僅包括1個樣點17,含量為35.00×103cfu·g-1;其余28個樣點均屬于類群Ⅲ,真菌含量為(0.75~10.00)×103cfu·g-1,其中樣點10含量最低為0.75×103cfu·g-1。在5批采樣過程中,樣點10、11、12、22、23、24、29和30真菌含量穩定,屬于類群Ⅲ。
2.2.3微生物發酵床養豬墊料放線菌空間分布多態性根據放線菌含量將30個樣點分類分為3類:類群Ⅰ為高含量,大于70.00×104cfu·g-1,類群Ⅱ為中含量,為(30.00~70.00)×104cfu·g-1,類群Ⅲ為低含量,小于30.00×104cfu·g-1。根據各樣點放線菌含量的類別,繪制樣點分布格局平面圖4。第1批取樣(4-A)類群Ⅰ包括僅1個樣點2,放線菌含量為78.00×104cfu·g-1;類群Ⅱ中包括9個樣點,分別是樣點7、8、9、12、13、15、17、18和24,含量為(32.00~66.50)×104cfu·g-1;類群Ⅲ包括其余20個樣點,含量為(3.50~28.00)×104cfu·g-1,其中樣點5和30含量最低為3.50×104cfu·g-1。第2批取樣(圖4-B)類群Ⅰ僅包括1個樣點26,放線菌含量為73.00×104cfu·g-1;類群Ⅱ中包括8個樣點,分別是樣點7、8、 9、14、15、25、27和30,含量為(35.00~59.75)×104cfu·g-1;類群Ⅲ包括其余21個樣點,放線菌含量變化范圍為(11.00~29.75)×104cfu·g-1,其中樣點4含量最低為11×104cfu·g-1。第3批取樣(圖4-C)類群Ⅰ包括樣點9、19和21,其中樣點19放線菌含量最高為122.00×104cfu·g-1;類群Ⅱ中包括9個樣點,分別是樣點7、13、14、15、17、20、25、26和30,含量為(35.50~54.50)×104cfu·g-1;類群Ⅲ包括其余18個樣點,含量變化范圍為(1.75~28.50)×104cfu·g-1,其中樣點1含量最低為1.75×104cfu·g-1。第4批取樣(圖4-D)類群Ⅰ僅包括1個樣點3,放線菌含量為83.00×104cfu·g-1;類群Ⅱ中包括7個樣點,分別是樣點2、4、5、6、7、8和9,含量范圍為(30.50~49.75)×104cfu·g-1;類群Ⅲ包括其余22個樣點,放線菌含量范圍為(0.70~28.50)×104cfu·g-1,其中樣點30含量最低為0.70×104cfu·g-1。第5批取樣(圖4-E)類群Ⅰ僅包括1個樣點28,放線菌含量為85.00×104cfu·g-1;類群Ⅱ中包括9個樣點,分別是樣點2、8、14、15、16、18、23、29和30,含量為(30.00~61.00)×104cfu·g-1;類群Ⅲ包括其余20個樣點,含量變化范圍為(3.45~28.50)×104cfu·g-1,其中樣點1含量最低為3.45×104cfu·g-1。
在整個取樣過程中,放線菌含量類群Ⅰ樣點分布很少,第30 d類群Ⅰ有3個樣點,其余時間均為1個樣點,類群Ⅲ比較多,多于18個樣點;樣點10和11放線菌分布比較穩定,屬于類群Ⅲ。
2.3微生物發酵床養豬墊料微生物時間分布多態性
2.3.1微生物發酵床養豬墊料細菌類群時間分布多態性微生物發酵床養豬墊料細菌類群分布比例見圖5。高含量類群Ⅰ在5個批次中樣點數量分別為1、10、11、15、9個,平均為9.2個。在總體30個樣點比例趨勢為先升后降,為3.33% → 33.33% → 36.67% → 50% → 30.00%,變化趨勢符合函數:y=-0.1667x3-0.4286x2+ 9.7381x-7.8,R2=0.9215。細菌含量類群變化趨勢函數生物學意義為:y為各批次本特征樣點的數量,x代表采樣的批次(每15 d 1次),通過函數計算出下批次樣點中細菌高含量樣點的數量,進而評估墊料發酵狀況。
類群Ⅱ在5個批次中樣點數量分別為16、13、13、6、13個,平均為12.2個。在總體樣點數量所占比例變化與類群Ⅰ相反,為先降后升,為53.33% → 43.33% → 43.33%→ 20.00% → 43.33%,變化趨勢符合函數:y=0.75x3-5.8929x2+ 11.357x+ 9.4,R2=0.7589。
類群Ⅲ在5個批次中樣點數量分別為13、7、6、9、8個,平均為8.6個。所占樣點比例總體變化與與類群Ⅱ相似,為先降后升,為43.33% → 23.33% → 20.00% → 30.00% → 26.67%,變化趨勢符合函數:y=-0.5833x3+ 6.3214x2-21.095x+ 28.4,R2=0.9956。
2.3.2微生物發酵床養豬墊料真菌類群時間分布多態性微生物發酵床養豬墊料真菌類群分布見6。類群Ⅰ在5個批次中樣點數量分別為3、6、4、3、1個,平均為3.8個。所占樣點比例總體為先升后降,10.00%→26.67%→13.33%→ 10.00%→3.33%,變化趨勢符合函數:y=0.6667x3-6.7857x2+ 19.548x-10.2,R2=0.8635。
類群Ⅱ在5個批次中樣點數量分別為11、6、10、4、1個,平均為6.4個。所占樣點比例總體為先降后升,為36.67%→20.00%→ 33.33%→13.33%→3.33%,變化趨勢符合函數:y=-0.5x3+ 4.0714x2-11.429x+ 18.4,R2=0.7886。
類群Ⅲ在5個批次中樣點數量分別為16、16、16、23、28個,平均為19.8個。所占樣點比例總體為平穩上升,為53.33%→53.33%→53.33%→76.67%→93.33%),變化趨勢符合函數:y=-0.1667x3+ 2.7143x2-8.119x+ 21.8,R2=0.9697。
2.3.3微生物發酵床養豬墊料放線菌類群時間分布多態性微生物發酵床養豬墊料放線菌類群分布見圖7。類群Ⅰ在5個批次中樣點數量分別為1、1、3、1、1個,平均為1.4個。所占樣點比例總體為先升后降,3.33%→3.33%→10%→ 3.33%→3.33%,變化趨勢符合函數:y=0.5x4-6x3+ 24.5x2-39x+ 21,R2=1。
類群Ⅱ在5個批次中樣點數量分別為9、8、9、7、9個,平均為8.4個。所占樣點比例相當較為平穩,為30.00%→26.67%→ 30.00%→23.33%→30.00%,變化趨勢符合函數:y=0.5x4-5.8333x3+ 23.5x2-38.167x+ 29,R2=1。
類群Ⅲ在5個批次中樣點數量分別為20、21、18、22、20個,平均為20.2個。所占樣點比例較高,但數量比例相當平穩,為66.67%→70.00%→60.00%→73.33%→66.67%,變化趨勢符合函數:y=-1x4+ 11.833x3-48x2+ 77.167x-20,R2=1。
2.4微生物發酵床養豬墊料微生物類群分布多態性
5個批次樣品中,細菌高含量類群Ⅰ和低含量類群Ⅲ所占樣點比例相近,類群Ⅰ平均9.2個樣點、占比28.67%;類群Ⅲ平均為8.6個樣點,占比30.67%;類群Ⅱ平均為12.2個樣點,所占比例最大為40.67%。
真菌則類群Ⅰ平均僅3.8個樣點,所占比例最低,為12.67%;類群Ⅱ平均為6.4個樣點,所占比例為21.33%;類群Ⅲ平均19.8個樣點,所占比例高達66.00%。
放線菌3種類群所占比例與真菌類似,類群Ⅰ平均僅1.4個樣點,所占比例最低,僅為4.67%;類群Ⅱ平均8.4個樣點,所占比例為28.00%;類群Ⅲ平均20.2個樣點,所占比例高達67.33%。
3 討論與結論
糞污的降解是通過微生物完成的,微生物良好的發酵狀態是發酵床養殖技術的核心,了解墊料各種狀態下微生物的空間分布狀況是評價養殖墊料發酵程度的重要研究手段。劉云浩等[7]通過對比6種關于養豬發酵床墊料微生物總DNA的提取方法,表明SDS-CTAB結合法是一種高效、可靠的墊料微生物總DNA提取方法,有利于進行下游的分子生態學研究。郭艷等[8]研究了豬糞堆肥升溫期細菌的分子生態學,表明堆肥樣品都具有較豐富的微生物種群多樣性,同時存在著明顯的優勢種群結構變化,中層多樣性最為豐富。王瀟娣等[9]采集不同年齡階段豬只腸道內容物及不同飼養階段發酵床墊料進行細菌分離,研究表明不同年齡豬腸道以及發酵床分離細菌種類相同,但是細菌含量存在差異。主要分離菌有大腸桿菌、葡萄球菌、沙門氏菌、鏈球菌、黏液性枯草芽孢桿菌、普通枯草芽孢桿菌。李婧[10]通過Real-Time PCR技術對不同深度中發酵床墊料中大腸桿菌、乳酸桿菌、產甲烷菌進行定量分析。發酵床墊料中表層大腸桿菌數量最多,達到9.68×105CFU·g-1,隨著深度遞增,大腸桿菌數量減少,40 cm深度處數量最少。乳酸桿菌存在于表層數量少,僅為3.69×103CFU·g-1。隨著深度的增加,乳酸桿菌數量呈上升趨勢,15 cm處達到最高值6.08×103CFU·g-1。40 cm處乳酸桿菌數量最低,為1.16×102CFU·g-1。本研究采集10個豬欄30個樣點5個批次的樣品,采用平板分離法研究其中細菌、真菌、放線菌的數量動態,期間30個墊料樣品的微生物的含量及結構也存在顯著差異,微生物含量總體為細菌>放線菌>真菌。其中細菌含量變化幅度最大[(33.72~197.23)×105cfu·g-1],真菌含量變化相對較小[(7.87~48.64)×103cfu·g-1],而放線菌含量變化相對穩定[(20.14~33.18)×104cfu·g-1]。
空間分布是同類空間事物的群體定位信息的反應,特定分布區域中的分布對象是單一性質的。空間對象按空間實體的幾何形態劃分為點、線、面,不同的空間分布對象具有不同的空間分布特征,并且具有各自相應的空間分布參數。Hao X等[11]研究了弱酸性電解質水對豬舍內環境空間的影響,結果表明,空氣中的細菌和真菌的數量顯著下降(P<0.05)。劉波等運用脂肪酸生物標記法研究了零排放豬舍基質墊層微生物群落的多樣性,結果表明不同生物標記多樣性指數在基質墊層不同層次分布不同,提出了微生物群落分布的特征指標,構建發酵指數指示基質墊層的發酵特性[4-5]。本研究的30個樣點5批次取樣分析中,細菌高含量(大于70.00×105cfu·g-1)、中含量[(30.00~70.00)×105cfu·g-1]、低含量(小于30.00×105cfu·g-1)的樣點數量平均分別為9.2、12.2、8.6個,占總樣點比例分別為30.67%、40.67%和28.67%。真菌高含量(大于70.00×103cfu·g-1)平均樣點為3.8個,占總樣點數的12.67%;中含量[(30.00~70.00)×103cfu·g-1]樣點數平均為6.4個,占總樣點數的21.33%;低含量(小于30.00×103cfu·g-1)的樣點數量則為19.8個,占總樣點數的66%;即整個研究階段,真菌數量相對較低。而放線菌高含量(大于70.00×104cfu·g-1)平均樣點為1.4個,占總樣點數的4.67%;中含量[(30.00~70.00)×104cfu·g-1]樣點數平均為8.4個,占總樣點數的28%;低含量(小于30.00×104cfu·g-1)的樣點數量則為20.2個,占總樣點數的67.33%。
研究表明很多放線菌可產生多種抗生素和酶,在微生物產生的新生物活性物質中,放線菌產生的就占到了74%[12]。植物土傳病害逐漸嚴重伴隨著根系微生物區系的失調,表現在真菌的增長幅度大,而細菌和放線菌的比例呈下降或小幅增長趨勢,細菌性土壤變為真菌性土壤,結果造成土壤理化性質改變,增加了植物病蟲害的侵染程度[12-15]。在微生物發酵床養豬過程中,墊料中的微生物(細菌、真菌、放線菌)在生豬的活動和管理操作的影響下隨時變化。從本研究的30個樣點微生物的分布狀況來看,細菌各類群的分布呈現隨機的特性,沒有明顯的規律,但總體上含量是遠高于真菌和放線菌。放線菌在各樣點的分布也是以低含量為主,其中樣點10、11、22在整個采樣分析期間均處于低含量分布。真菌的含量最少,各樣點以低含量分布為主,其中樣點10、11、12、22、23、24、29和30這8個樣點在5次采樣分析中均處于低含量分布。在土壤真菌中,植物的病原真菌的比例顯著高于細菌和放線菌,有機無機肥配施相對增加了土壤細菌和放線菌的數量,可能減少土壤中的病原真菌數量[16-19]。發酵床墊料類似于土壤的體系,因此,從研究結果判斷,發酵床墊料處于一個較好的發酵狀態,能夠及時分解消納生豬排泄的糞污。
微生物發酵床養豬是一項應用不久的技術,對于墊料發酵狀況、評價標準等尚缺乏系統的研究。本研究對墊料中可培養的微生物(細菌、真菌、放線菌)數量分布動態進行了研究,研究結果僅揭示了墊料中微生物群落動態的部分信息。對于全面了解墊料中微生物的動態信息,尚需要輔助更先進的、多樣化的研究手段。
[1]劉波,朱昌雄.微生物發酵床零污染養豬技術研究與應用[M].北京:中國農業科學技術出版社,2009.
[2]凌云,路葵,徐亞同.禽畜糞便堆肥中優勢菌株的分離及對有機物質降解能力的比較[J].華南農業大學學報,2007,28(1):36-39.
[3]劉波,鄭雪芳,朱昌雄,等.脂肪酸生物標記法研究零排放豬舍基質墊層微生物群落多樣性[J].生態學報,2008,28(12):1-11.
[4]鄭雪芳,劉波,林營志,等.利用磷脂脂肪酸生物標記分析豬舍基質墊層微生物亞群落的分化[J].環境科學學報,2009,29(11):2306-2317.
[5]畢泗偉,吳祖芳,虞耀土.16S rDNA 基因文庫技術分析發酵床細菌群落的多樣性[J].寧波大學學報:理工版,2013,26(1):18-22.
[6]許光輝.鄭洪元.土壤微生物分析方法手冊[M].北京:農業出版社,1986.
[7]劉云浩,藍江林,劉波,等.微生物發酵床墊料微生物DNA提取方法的研究[J].福建農業學報,2011,26(2):153-158.
[8]郭艷,張進良,鄧昌彥,等.豬糞堆肥升溫期細菌分子生態學研究[J].河南農業科學,2010,(9):74-82.
[9]王瀟娣,廖春燕,朱玲.發酵床養豬模式中墊料的主要菌群分析[J].養豬,2012,(3):69-72.
[10]李婧.發酵床不同深度墊料中微生物與溫室氣體的分布特征[D].南京:南京農業大學,2012.
[11]HAO X,CAO W,LI B,et al.Slightly acidic electrolyzed water for reducing airborne microorganisms in a layer breeding house[J].J Air Waste Manag Assoc, 2014, 64(4):494-500.
[12]文孟良,李銘剛,李一青.從放線菌次生代謝產物創制生物農藥[C]//第五屆新農藥創制交流會論文集. 北京:中國化工學會,2003:146-147.
[13]李瓊芳.不同連作年限麥冬根系微生物區系動態研究[J].土壤通報, 2006,37(3) :563-565.
[14]田苗,房敏鋒,黃建新,等.根系土壤微生物變化對西洋參種植的影響[J].生物學雜志,2011,28(5) :38 -42.
[15]邸寧,劉志民,馬煥普.拮抗放線菌G19 對monica 再植毛桃根際微生物多樣性的影響[J].中國農學通報, 2011, 27(28) :225-230.
[16]陳堯,鄭華,石俊雄,等.施用化肥和菜籽粕對烤煙根際微生物的影響[J].土壤學報,2012,49(1) : 208-213.
[17]劉恩科,趙秉強,李秀英,等.不同施肥制度土壤微生物量碳氮變化及細菌群落16S rDNA V3 片段PCR 產物的DGGE 分析[J].生態學報,2007,27(3) :1079-1085.
[18]FROSTEGARD A,BAATH E,TUNLIID A.Shift in the structure of soilmicrobial communities in limed forests as revealed by phospholipids fatty acid analysis[J].Soil Biol Biochem,1993,25(6) :723-730.
[19]ZELLES L.Fatty acid patterns of phospholipids and lipopolysaccharides in the characterization of micro-bialcommunities in soil:a review[J].Biol Fert Soils,1999,29:111-129.
(責任編輯:林海清)
Analysis on Spatial Distribution of Microbes Population in the Fermentation Bed
LAN Jiang-lin1,LI Feng1,2, LIU Bo1*,SHI Huai1,HUANG Su-fang1
(1.AgriculturalBioresourceResearchInstitute,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian350003,China;2.FujianAgricultureandForestryUniversity,Fuzhou,Fujian350108,China)
Spatial distribution of microbes in the fermentation bed was analyzed by sampling and culturing, the results indicated that the amount of bacterium was highest, the second was actinomycete, the amount of fungi was lowest. In all of the samples,amplitude of variation of bacterial content was the biggest with(33.72~197.23)×105cfu·g-1, fungal content changes are relatively small with(7.87~48.64)×103cfu·g-1, and Actinomyces content was stability with(20.14~33.18)×104cfu·g-1. GroupⅠ(more than 70.00×105cfu·g-1)of bacteria content was averaged 9.2 sample points, accounting for 28.67% of the total sample; group III(less than 30.00×105cfu·g-1)was averaged 8.6 points, accounting for 30.67% of the total sample. Group II (30.00~70.00)×105cfu·g-1was averaged 12.2 points, accounted for the largest proportion of 40.67%. Fungal group I(more than 70.00×103cfu·g-1)was averaged only 3.8 points, the lowest proportion for 12.67%, Group II(30.00~70.00)×103cfu·g-1was averaged 6.4 points, the proportion was 21.33%, group III (less than 30.00×103cfu·g-1) was averaged 19.8 points, a whopping 66.00%.The proportion of actinomyces was similar to type of fungi, group I (more than 70.00×104cfu·g-1)was averaged just1.4 sample points, the lowest proportion, only 4.67%.Group II(30.00~70.00)×104cfu·g-1was averaged 8.4 points and percentage 28%, Group III(less than 30.00×104cfu·g-1)was averaged 20.2 sample points, a whopping 67.33%.
litter in fermentation bed;microbes populationg;spatial distribution
藍江林,栗豐,劉波,等.養豬發酵床墊料微生物類群結構特性分析[J].福建農業學報,2016,31(6):649-656.
LAN J-L,SU F,LIU B,et al.Analysis on Spatial Distribution of Microbes Population in the Fermentation Bed[J].FujianJournalofAgriculturalSciences,2016,31(6):649-656.
2016-01-29初稿;2016-04-11修改稿
藍江林(1972-),女,博士,研究員,主要從事應用微生物研究(E-mail:lanfz2008@163.com)
劉波(1957-),男,博士,研究員,主要從事農業微生物研究(E-mail:liubofaas@163.com)
國家科技支撐計劃(2012BAD14B15);福建省科技重大專項(2012NZ0002);公益性行業(農業)科研專項(201303094)
S 828
A
1008-0384(2016)06-649-08

