適應(yīng)海南熱帶海洋環(huán)境產(chǎn)脂肪酶菌株的篩選及產(chǎn)酶條件研究
郭聰,吳海武,2,郭偉良,朱彥博,黃捷暢,周永燦,王世鋒,謝珍玉
(1.海南大學(xué) 海洋學(xué)院 海南省熱帶生物資源可持續(xù)利用重點(diǎn)實(shí)驗(yàn)室 海南省水生生物技術(shù)重點(diǎn)實(shí)驗(yàn)室,海南 海口570228;2.海南省農(nóng)業(yè)科學(xué)院,海南 海口 571100)
適應(yīng)海南熱帶海洋環(huán)境產(chǎn)脂肪酶菌株的篩選及產(chǎn)酶條件研究
郭聰1,吳海武1,2,郭偉良1,朱彥博1,黃捷暢1,周永燦1,王世鋒1,謝珍玉1
(1.海南大學(xué)海洋學(xué)院海南省熱帶生物資源可持續(xù)利用重點(diǎn)實(shí)驗(yàn)室海南省水生生物技術(shù)重點(diǎn)實(shí)驗(yàn)室,海南海口570228;2.海南省農(nóng)業(yè)科學(xué)院,海南海口571100)
從海南熱帶海水中分離篩選得到10株產(chǎn)脂肪酶菌,其中菌株LD-1302產(chǎn)脂肪酶活性最高。根據(jù)16S rDNA序列分析和生理生化試驗(yàn)結(jié)果,鑒定該菌為地衣芽孢桿菌Bacillus licheniformis。對(duì)該菌株的產(chǎn)酶條件進(jìn)行優(yōu)化,在pH 8、溫度37℃、鹽度32的條件下,經(jīng)橄欖油誘導(dǎo),起始濃度為3.75×105CFU/mL的LD-1302搖瓶發(fā)酵48 h時(shí)產(chǎn)脂肪酶活最高,脂肪酶活可達(dá)(34.97±1.45) U/mL。
脂肪酶;地衣芽孢桿菌;篩選;產(chǎn)酶條件
海南管轄海洋面積200多萬(wàn)km2,海洋資源豐富;不過(guò),當(dāng)前海水養(yǎng)殖產(chǎn)生的含大量殘餌、動(dòng)物殘?bào)w的養(yǎng)殖廢水及其它來(lái)源油脂性污水的任意排放,造成了該海區(qū)海洋環(huán)境的存在脂肪污染,嚴(yán)重影響當(dāng)?shù)睾Q笊鷳B(tài)環(huán)境的健康(周永燦等,2013;Nejidat,2005)。因此,安全有效清除海南熱帶水產(chǎn)養(yǎng)殖和海洋環(huán)境中的脂肪是熱帶海洋生態(tài)環(huán)境修復(fù)和可持續(xù)利用的重要前提。脂肪酶是催化長(zhǎng)鏈脂肪酸甘油酯水解和合成的羧酸酯酶,廣泛存在于動(dòng)植物和微生物,其中以微生物脂肪酶資源最為豐富;因其廣泛的底物特異性、在有機(jī)溶劑中穩(wěn)定性好、易于大規(guī)模生產(chǎn)及純化等優(yōu)點(diǎn)而成為當(dāng)代酶工業(yè)最受矚目的酶種之一(李鑫玲等,2011;彭立鳳等,2006;閆云君等,2006),也是環(huán)境中脂肪降解的主要原動(dòng)力。
海南為我國(guó)唯一的熱帶沿海地區(qū),在長(zhǎng)期自然進(jìn)化過(guò)程中,海南地區(qū)形成了獨(dú)特的微生物群落結(jié)構(gòu),存在豐富的產(chǎn)脂肪酶芽孢桿菌資源,為安全解決海南熱帶水產(chǎn)養(yǎng)殖和海洋環(huán)境中脂肪污染問(wèn)題奠定了重要基礎(chǔ)(朱彥博,2013;吳海武,2014)。不過(guò),有關(guān)產(chǎn)脂肪酶芽孢桿菌的海南土著菌種的相關(guān)研究迄今尚未見(jiàn)報(bào)道。為此,本文試圖從海南熱帶海洋環(huán)境中篩選產(chǎn)脂肪酶芽孢桿菌并闡述其產(chǎn)酶條件,這對(duì)于應(yīng)用脂肪酶生物技術(shù)處理被油脂污染的熱帶海洋水體特別是熱帶養(yǎng)殖水體以及可持續(xù)發(fā)展熱帶海洋經(jīng)濟(jì)具有重大意義。
1 材料與方法
1.1材料
樣品:從海南省樂(lè)東縣球港、陵水縣新村港、東方市板橋和三亞市南山等地的熱帶海水養(yǎng)殖環(huán)境中采集10份水樣。
主要試劑:蛋白胨、橄欖油(主要脂肪酸鏈長(zhǎng)為C16-C18)、椰子油(主要脂肪酸鏈長(zhǎng)為C8-C20)、葵花籽油(主要脂肪酸鏈長(zhǎng)為C16-C22)、聚乙烯醇、蔗糖、4%聚乙烯醇(PVA)溶液、1 mg/mL羅丹明B溶液和橄欖油乳化液(4%PVA溶液:橄欖油=3:1,v/v)。
主要儀器:PCR儀 (型號(hào):5331,德國(guó)Eppendorf股份公司);冷凍離心機(jī)(型號(hào):5180,德國(guó)Eppendorf股份公司);食品勻漿機(jī)(型號(hào):HFJ-10,上海楚定分析儀器有限公司);倒置熒光相差微分?jǐn)?shù)碼顯微鏡(型號(hào):DM2500,德國(guó)Leica儀器有限公司)。
1.2培養(yǎng)基
改良富集液體培養(yǎng)基:(NH4)2SO42 g/L,MgSO4·7H2O 0.5 g/L,K2HPO41 g/L,蛋白胨5 g/L,橄欖油乳化液100 mL/L,滅菌海水定容至1 L,pH 7.0,121℃滅菌20 min。
改良羅丹明B顯色初篩培養(yǎng)基:(NH4)2SO42g/L,MgSO4·7H2O 1 g/L,K2HPO41 g/L,蛋白胨5 g/L,瓊脂15 g/L,橄欖油乳化液100 mL/L,滅菌海水定容至1 L,pH 7.0,121℃滅菌20 min;滅菌后冷卻至60℃加入6 mL羅丹明B溶液。
改良復(fù)篩固體培養(yǎng)基:蛋白胨10 g/L,MgSO4· 7H2O 1 g/L,K2HPO41 g/L,橄欖油乳化液100 mL/L,瓊脂15 g/L,滅菌海水定容至1 L,pH 7.0,121℃滅菌20 min。
生長(zhǎng)培養(yǎng)基:(NH4)2SO42 g/L,MgSO4·7H2O 1 g/L,K2HPO41 g/L,蛋白胨5 g/L,橄欖油乳化液100 mL/L,滅菌海水定容至1 L,pH 7.0,121℃滅菌20 min。
計(jì)數(shù)固體培養(yǎng)基:蛋白胨10 g/L,酵母膏5g/L,瓊脂15g/L,滅菌海水1L,pH7.0,121℃滅菌20min。
改良產(chǎn)酶發(fā)酵培養(yǎng)基:蛋白胨10g/L,(NH4)2SO41 g/L,K2HPO41.5 g/L,MgSO4·7H2O 2 g/L,橄欖油10g/L,pH7.0,滅菌海水定容至1L,pH7.0,121℃滅菌20 min。
1.3產(chǎn)脂肪酶菌株的篩選
吸取10mL水樣至100mL滅菌海水中,180r/min、30℃振蕩10 min;并在80℃下水浴15 min,取出、靜置。吸取10 mL上清菌液至100 mL富集液體培養(yǎng)基中,在180 r/min、30℃下培養(yǎng)。2 d后,吸取5 mL富集培養(yǎng)菌液至100 mL新鮮的富集液體培養(yǎng)基中,進(jìn)行二次富集,如此連續(xù)富集培養(yǎng)3次。吸取1 mL第3次富集培養(yǎng)菌液至9 mL滅菌海水中,依次倍比稀釋至10-4;吸取100 μL稀釋度為10-4的菌液在羅丹明B顯色初篩培養(yǎng)基上涂布,挑選在羅丹明B顯色初篩培養(yǎng)基上水解圈較大且在350 nm紫外燈下橙黃色熒光亮斑較大的菌落為篩選分離菌株。挑取菌落繼續(xù)于羅丹明B顯色初篩培養(yǎng)基上重復(fù)3次劃線分離培養(yǎng),直到菌落形態(tài)一致。挑取羅丹明B顯色初篩培養(yǎng)基上的單菌落至復(fù)篩固體培養(yǎng)基上重復(fù)劃線培養(yǎng),直至單菌落不再染上羅丹明B顯色劑。挑選在復(fù)篩固體培養(yǎng)基上的單菌落至改良產(chǎn)酶發(fā)酵培養(yǎng)基中,于200 r/min、30℃下振蕩培養(yǎng)48 h,測(cè)定篩選得到菌株的產(chǎn)脂肪酶活性,以最優(yōu)產(chǎn)脂肪酶活性的菌株為目的菌株。
1.4菌株鑒定
1.4.1菌落形態(tài)及鏡檢
挑取純化單菌落于計(jì)數(shù)固體培養(yǎng)基上劃線,參照沈萍等的方法進(jìn)行革蘭氏染色、芽孢染色(沈萍等,2005)。
1.4.216S rDNA序列測(cè)定和分析
單菌落振蕩培養(yǎng)18 h后,按照北京艾德萊生物科技有限公司的細(xì)菌基因組DNA快速提取試劑盒的說(shuō)明提取目的菌株DNA,對(duì)菌株進(jìn)行16S rDNA序列的 PCR擴(kuò)增與測(cè)序 (徐先棟 等,2012)。
1.4.3生理生化鑒定
挑取純化單菌落,參照東秀珠的方法進(jìn)行VP測(cè)定、丙酸鹽、淀粉水解、明膠水解、V-P培養(yǎng)物終pH>7、檸檬酸鹽、55℃、pH 5.7、pH 6.8、NaCl 5%、NaCl 7%等理化指標(biāo)試驗(yàn)(東秀珠等,2001)。
1.5活菌總數(shù)計(jì)數(shù)
吸取6 mL目的菌株過(guò)夜培養(yǎng)液(于生長(zhǎng)培養(yǎng)基中培養(yǎng)10-12 h)轉(zhuǎn)入盛有60 mL生長(zhǎng)培養(yǎng)基的三角瓶中,混勻后分別吸取5 mL混合液至標(biāo)記0、1.5、3、4、6、8、10、12、14、16、18、20的12支無(wú)菌大試管中。于30℃、250 r/min條件下培養(yǎng),并于相應(yīng)時(shí)間點(diǎn)將標(biāo)有對(duì)應(yīng)時(shí)間的大試管取出,分別吸取1 mL各個(gè)時(shí)間點(diǎn)的生長(zhǎng)培養(yǎng)菌液至9 mL滅菌海水中,依次倍比稀釋至10-5。吸取100 μL稀釋度為10-5的菌液于計(jì)數(shù)固體培養(yǎng)基上涂布、計(jì)數(shù)。
1.6脂肪酶活力的測(cè)定
在40℃、pH 7.5條件下,以1 min催化水解反應(yīng)底物(橄欖油)釋放1 μmol脂肪酸的酶量定義為1個(gè)脂肪酶活力單位(U) (施巧琴,1998)。搖瓶發(fā)酵48 h后,吸取發(fā)酵上清液于8 000 r/min、4℃下離心5 min,吸取上清酶液備用,參照李建武等的方法測(cè)定所篩菌株的產(chǎn)脂肪酶活(李建武等,1994)
1.7產(chǎn)酶條件的優(yōu)化
改良產(chǎn)酶發(fā)酵培養(yǎng)基瓶裝量為50 mL/250 mL時(shí),根據(jù)接種量、碳源、pH、溫度、鹽度等影響產(chǎn)脂肪酶的因素,依次進(jìn)行LD-1302產(chǎn)脂肪酶活條件的優(yōu)化。
1.7.1接種量對(duì)產(chǎn)酶的影響
研究菌起始濃度為5×105CFU/mL的LD-1302的接種量分別為0.50%、1.00%、1.50%、2.00%、2.50%時(shí),對(duì)LD-1302產(chǎn)脂肪酶的影響,每隔24 h測(cè)定酶活一次,連續(xù)測(cè)定3次,篩選最適溫度接種量。
1.7.2碳源對(duì)產(chǎn)酶的影響
研究以1%的橄欖油、椰子油、葵花籽油為碳源時(shí),對(duì)LD-1302產(chǎn)脂肪酶活性的影響,每隔24 h測(cè)定酶活一次,連續(xù)測(cè)定3次,篩選最適碳源。
1.7.3pH對(duì)產(chǎn)酶的影響
研究改良產(chǎn)酶發(fā)酵培養(yǎng)基起始pH分別為5、6、7、8、9時(shí),對(duì)LD-1302產(chǎn)脂肪酶的影響,每隔24 h測(cè)定酶活一次,連續(xù)測(cè)定3次,篩選最適pH。
1.7.4溫度對(duì)產(chǎn)酶的影響
研究改良產(chǎn)酶發(fā)酵培養(yǎng)基搖瓶發(fā)酵溫度分別為27℃、37℃、47℃時(shí),對(duì)LD-1302產(chǎn)脂肪酶的影響,每隔24 h測(cè)定酶活一次,連續(xù)測(cè)定3次,篩選最適溫度。
1.7.5鹽度對(duì)產(chǎn)酶的影響
研究海水鹽度分別為28、30、32、34、36時(shí),對(duì)LD-1302產(chǎn)脂肪酶的影響,每隔24 h測(cè)定酶活一次,連續(xù)測(cè)定3次,篩選最適鹽度。
1.8采用SPSS
18.0統(tǒng)計(jì)軟件分析數(shù)據(jù),并采Tukey法對(duì)影響酶活的因素進(jìn)行分析比較。
2 結(jié)果
2.1產(chǎn)脂肪酶菌株的篩選
從羅丹明B初篩固體培養(yǎng)基上篩選得到10株水解圈較大的菌株,這些菌株在350 nm紫外燈下觀察,在菌落周圍均有明顯的橙黃色熒光圈(圖1)。重復(fù)3次搖瓶發(fā)酵后,10株菌的產(chǎn)脂肪酶活性存在一定的差異(表1),其中菌株LD-1302的產(chǎn)脂肪酶活性最高,酶活達(dá)(22.58±0.09) U/mL。發(fā)酵24 h后,LD-1302培養(yǎng)基表面存在不溶于水且浮在水面的絮凝狀乳白色蠟樣物質(zhì),48 h后該絮凝狀乳白色蠟樣物質(zhì)消失。

圖1 350 nm紫外燈下產(chǎn)脂肪酶菌落周圍的橙黃色熒光圈
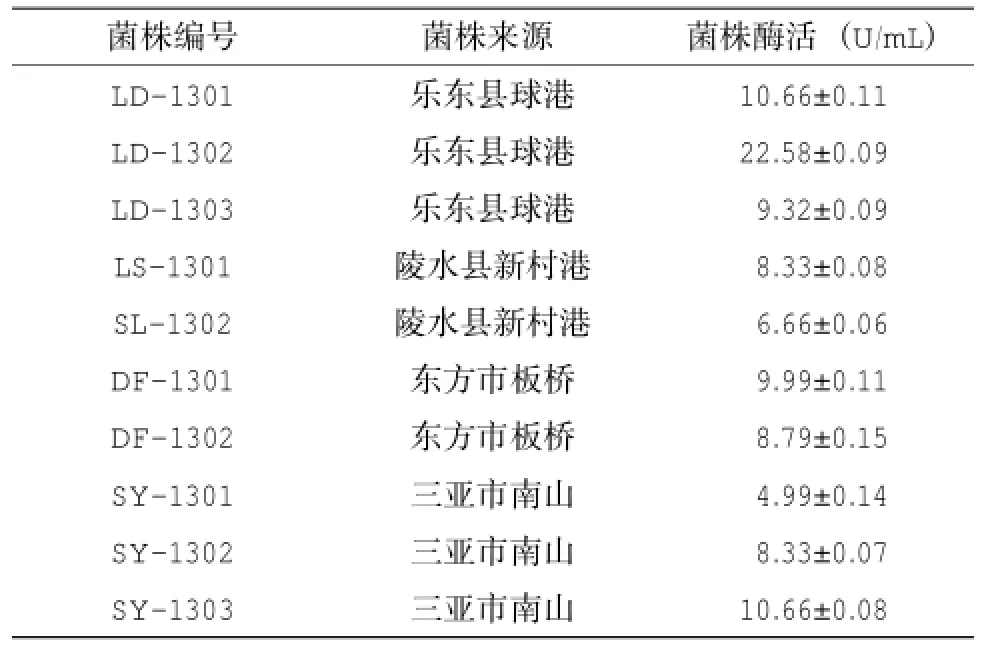
表1 10株產(chǎn)脂肪酶菌株的酶活
2.2菌株鑒定結(jié)果
2.2.1菌落形態(tài)及鏡檢
LD-1302菌落形狀不規(guī)則、凸面、白色不透明、邊緣為毛發(fā)狀;革蘭氏染色鏡檢呈紫色,為G+菌;芽孢染色鏡檢可觀察到綠色的芽孢、顯紅色的營(yíng)養(yǎng)體。
2.2.216S rDNA序列測(cè)定與分析
以菌株LD-1302的DNA為模版,經(jīng)細(xì)菌16SrDNA通用引物擴(kuò)增獲得序列長(zhǎng)度為1 512 bp的基因片段,對(duì)其測(cè)序并提交Genbank核酸序列數(shù)據(jù)庫(kù)。同源性分析結(jié)果表明,菌株LD-1302的16S rDNA基因序列與Genbank中的BCRC 15413等15株芽孢桿菌屬細(xì)菌的同源性達(dá)99.9%以上,利用MEGA 6.1構(gòu)建系統(tǒng)進(jìn)化樹(shù),結(jié)果表明該菌株與地衣芽孢桿菌B.licheniformis聚為一支(圖2)。初步鑒定菌株LD-1302為地衣芽孢桿菌。
2.2.3生理生化鑒定
菌株LD-1302可于55℃下生長(zhǎng)、淀粉水解試驗(yàn)菌落四周出現(xiàn)無(wú)色透明圈、明膠水解培養(yǎng)基出現(xiàn)液化現(xiàn)象、V-P試驗(yàn)培養(yǎng)基顯紅色、V-P試驗(yàn)培養(yǎng)基的終pH顯酸性、檸檬酸鹽及丙酸鹽培養(yǎng)基顯藍(lán)色、均可在NaCl 5%、NaCl 7%的肉湯培養(yǎng)基中生長(zhǎng)、在pH5.7、pH6.8的肉湯培養(yǎng)基中生長(zhǎng)良好,符合對(duì)地衣芽孢桿菌的描述(東秀珠等,2001)。結(jié)合革蘭氏染色、芽孢染色及16S rDNA序列測(cè)定與分析結(jié)果,鑒定菌株LD-1302為地衣芽孢桿菌。
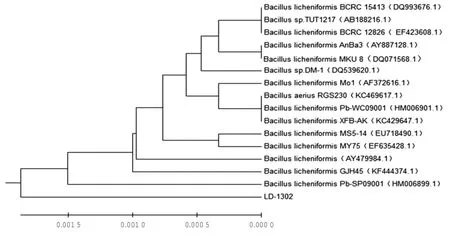
圖2 菌株LD-1302的16S rDNA序列系統(tǒng)發(fā)育樹(shù)
2.3活菌總數(shù)計(jì)數(shù)
地衣芽孢桿菌LD-1302在以橄欖油為唯一碳源的生長(zhǎng)培養(yǎng)基中延滯期較短,培養(yǎng)6 h活菌總數(shù)達(dá)到最高,為(94.67±3.21)×106CFU/mL,LD-1302在6~20 h內(nèi)生長(zhǎng)較為穩(wěn)定,表明該菌株可利用有機(jī)碳源橄欖油,并在6 h時(shí)將培養(yǎng)基營(yíng)養(yǎng)物質(zhì)基本消耗殆盡(圖3)。
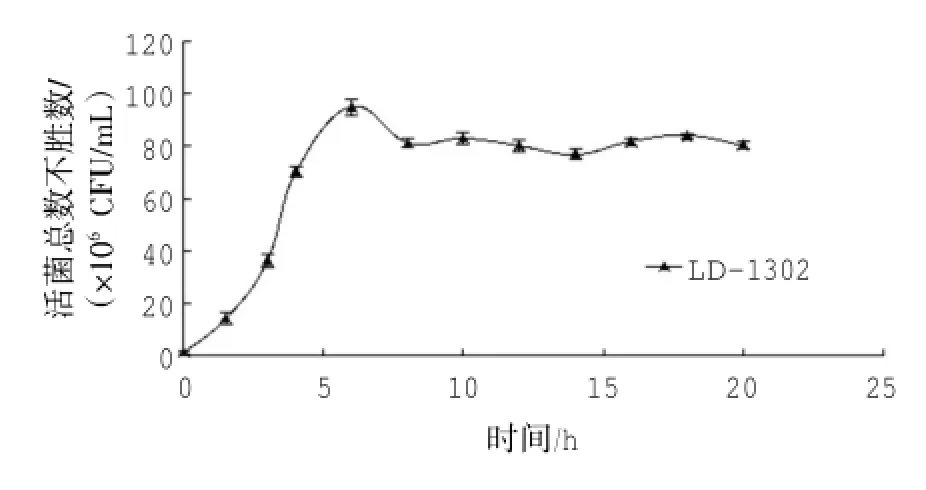
圖3 菌株LD-1302的生長(zhǎng)曲線
2.4接種量對(duì)LD-1302產(chǎn)酶活性的優(yōu)化
由圖4可知:以橄欖油為碳源時(shí),菌株LD-1302的最適接種量為1.50%,即菌株起始接種濃度為3.75×105CFU/mL時(shí),產(chǎn)脂肪酶活性最高,酶活可達(dá)到(31.64±0.34) U/mL,且在最少接種濃度為1.25×105CFU/mL時(shí),也存在較高的產(chǎn)脂肪酶活性。采用SPSS 18.0統(tǒng)計(jì)軟件分析數(shù)據(jù)可知:接種量P=0.00<0.01、時(shí)間P=0.001<0.01,表明接種量、時(shí)間均對(duì)酶活影響極顯著;由接種量-酶活的同類子集結(jié)果可知:接種量為0.50%、2.50%時(shí),酶活均值分別為15.35 U/mL、17.87 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異;接種量為1.00%、2.00%時(shí),酶活均值分別為20.68 U/mL、19.02 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)酶效果優(yōu)于前兩者;接種量為1.50%時(shí),酶活均值為26.53 U/mL,與前四者分屬不同子集,表明為接種量為1.50%時(shí),產(chǎn)脂肪酶效果最好;由時(shí)間-酶活的同類子集結(jié)果可知:72 h時(shí),酶活均值為17.72 U/mL,24 h、48 h時(shí),酶活均值分別為21.35 U/mL、20.60 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)脂肪酶活優(yōu)于前者。
2.5碳源對(duì)LD-1302產(chǎn)酶活性的影響
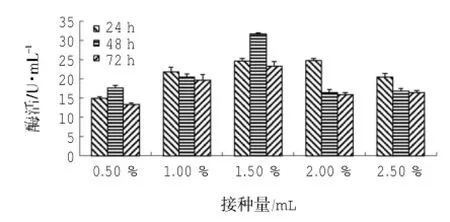
圖4 接種量對(duì)LD-1302利用橄欖油產(chǎn)脂肪酶的影
由圖5可知:最適接種量的LD-1302經(jīng)橄欖油、椰子油、葵花籽油誘導(dǎo),最高產(chǎn)脂肪酶活分別為(23.42±0.84)U/mL、(10.76±0.51)U/mL、(9.77± 0.51)U/mL。采用SPSS 18.0統(tǒng)計(jì)軟件分析數(shù)據(jù)可知:碳源、時(shí)間的P=0.00<0.01,表明碳源、時(shí)間均對(duì)酶活影響極顯著;由碳源-酶活的同類子集結(jié)果可知:以椰子油、葵花籽油為碳源時(shí),酶活均值均為8.51 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,而以橄欖油為碳源時(shí),酶活均值為17.54 U/mL,與椰子油、葵花籽油分屬不同子集,表明以橄欖油為碳源時(shí),產(chǎn)脂肪酶效果最好;由時(shí)間-酶活的同類子集結(jié)果可知:24 h、72 h時(shí),酶活均值分別為10.84 U/mL、9.06 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,48 h時(shí),酶活均值為14.66 U/mL,與前兩者分屬不同子集,表明48 h時(shí),產(chǎn)脂肪酶活效果最好;同時(shí)椰子油、葵花籽油也可誘導(dǎo)該菌株產(chǎn)生較高的酶活。
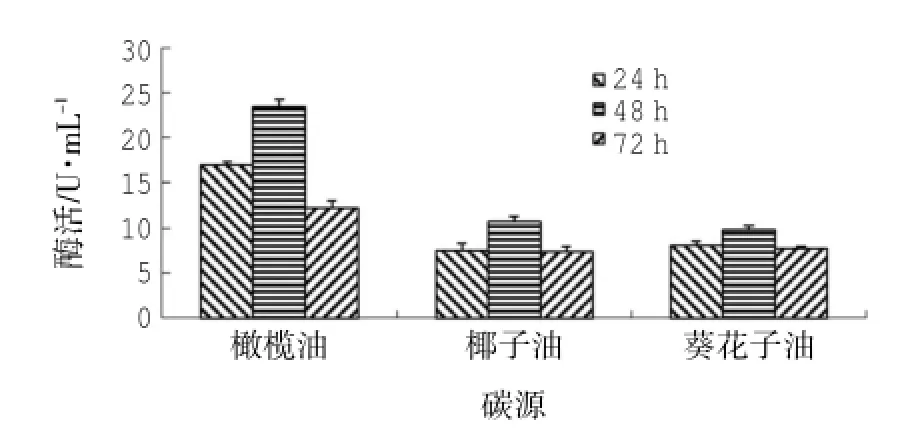
圖5 碳源對(duì)產(chǎn)酶的影響
2.6pH對(duì)LD-1302產(chǎn)酶活性的影響
接種量為3.75×105CFU/mL、橄欖油、椰子油、葵花籽油為有機(jī)碳源時(shí),菌株LD-1302在pH 8下有最大脂肪酶活,分別為(29.97±0.33)U/mL、(19.98±0.23)U/mL、(19.98±0.67)U/mL。(圖6(a)、圖6(b)、圖6(c))。
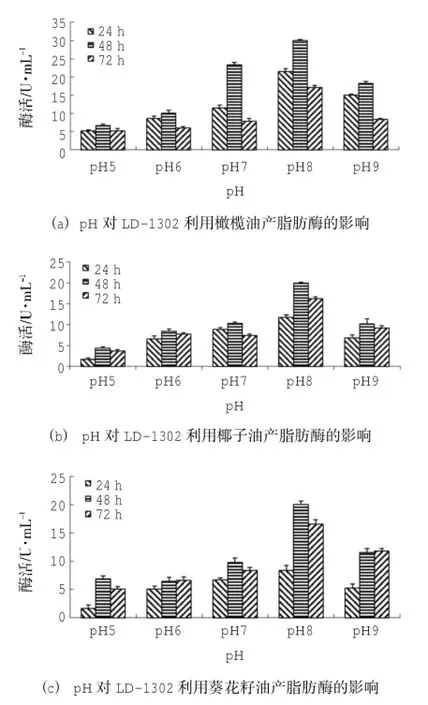
圖6 pH對(duì)LD-1302產(chǎn)脂肪酶的影響
采用SPSS 18.0統(tǒng)計(jì)軟件分析數(shù)據(jù)可知:pH、時(shí)間的P=0.00<0.01,表明pH、時(shí)間均對(duì)酶活影響極顯著。由圖6-1 pH-酶活的同類子集結(jié)果可知:pH 5、pH 6時(shí),酶活均值分別為5.69 U/mL、8.21 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異;pH 7、pH 9時(shí),酶活均值分別為14.21 U/mL、13.84 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)脂肪酶活效果優(yōu)于前兩者;pH 8時(shí),酶活均值為22.87 U/mL,與pH 5、pH 6、pH 7、pH 9分屬不同子集,表明pH 8時(shí),產(chǎn)脂肪酶活效果最好;由圖6(a) 時(shí)間-酶活的同類子集結(jié)果可知:24 h、48 h、72 h時(shí),酶活均值分別為12.36 U/mL、17.65 U/mL、8.88 U/mL,分屬不同子集,表明三者對(duì)酶活的影響有明顯差異,且48 h時(shí),產(chǎn)脂肪酶活效果最好。由圖6(b)pH-酶活的同類子集結(jié)果可知:pH 5時(shí),酶活均值為3.18 U/mL;pH 6、pH 7、pH 9時(shí),酶活均值分別為7.52 U/mL、8.80 U/mL、7.66 U/mL,在同一子集中,表明三者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)脂肪酶活效果優(yōu)于前者;pH 8時(shí),酶活均值為15.98 U/mL,與pH 5、pH 6、pH 7、pH 9分屬不同子集,表明pH 8時(shí),產(chǎn)脂肪酶活效果最好;由圖6(b) 時(shí)間-酶活的同類子集結(jié)果可知:24 h時(shí),酶活均值為7.10 U/mL;48 h、72 h時(shí),酶活均值分別為9.99 U/mL、8.79 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)脂肪酶活優(yōu)于前者,且在48 h時(shí)酶活均值最大。由圖6(c)pH-酶活的同類子集結(jié)果可知:pH 5、pH 6時(shí)酶活均值分別為4.55 U/mL、6.03 U/mL,且在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異;pH 7、pH 9時(shí)酶活均值分別為8.25 U/mL、9.51 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)脂肪酶活效果優(yōu)于前者;而pH 8時(shí)酶活均值為14.95 U/mL,且與pH 5、pH 6、pH 7、pH 9分屬不同子集,表明pH 8時(shí),產(chǎn)脂肪酶活效果最好;由圖6(c) 時(shí)間-酶活的同類子集結(jié)果可知:24 h時(shí)酶活均值為5.39 U/mL,48 h、72 h時(shí)酶活均值分別為10.92 U/mL、9.66 U/mL,在同一子集中,兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)脂肪酶活優(yōu)于前者,且在48 h時(shí)酶活均值最大。因此,菌株LD-1302的最適pH為8,且在pH 5~pH 9的培養(yǎng)條件下也存在一定的產(chǎn)脂肪酶活性。
2.7溫度對(duì)LD-1302產(chǎn)酶活性的影響
接種量為3.75×105CFU/mL、pH為8、以橄欖油、椰子油、葵花籽油為碳源時(shí),菌株LD-1302在37℃條件下?lián)u瓶發(fā)酵48h后產(chǎn)脂肪酶活最高,依次為(30.97±0.58)U/mL、(20.98±1.2)U/mL、(20.31±0.58)U/mL;產(chǎn)脂肪酶活性跟溫度的關(guān)系均為37℃>27℃>47℃(圖7)。
采用SPSS 18.0統(tǒng)計(jì)軟件分析數(shù)據(jù)可知:溫度、時(shí)間的P=0.00<0.01,表明溫度、時(shí)間均對(duì)酶活影響極顯著。由7(a)溫度-酶活的同類子集結(jié)果可知:27℃、47℃時(shí)酶活均值分別為16.17 U/ mL、16.35 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異;37℃時(shí)酶活均值為25.97 U/ mL,且與前兩者分屬不同子集,表明37℃時(shí),產(chǎn)脂肪酶活效果優(yōu)于前兩者;由7(a)時(shí)間-酶活的同類子集結(jié)果可知:24 h、72 h時(shí)酶活均值分別為18.54 U/mL、17.16 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,而48 h時(shí)酶活均值為22.79 U/mL,且與前兩者分屬不同子集,表明培養(yǎng)時(shí)間為48 h時(shí),產(chǎn)脂肪酶活效果最好。由7(b)溫度-酶活的同類子集結(jié)果可知:27℃、47℃時(shí)酶活均值分別為10.02 U/mL、9.06 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異;37℃時(shí)酶活均值為14.95 U/mL,且與前兩者分屬不同子集,表明37℃時(shí),產(chǎn)脂肪酶活效果優(yōu)于前兩者;由7(b)時(shí)間-酶活的同類子集結(jié)果可知:24 h、72 h時(shí)酶活均值分別為9.95 U/mL、9.73 U/mL,在同一子集中,表明兩者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,而48 h時(shí)酶活均值為14.35 U/mL,且與前兩者分屬不同子集,表明培養(yǎng)時(shí)間為48 h時(shí),產(chǎn)脂肪酶活效果最好。由7(c)溫度-酶活的同類子集結(jié)果可知:27℃、37℃、47℃時(shí)酶活均值分別為7.69 U/mL、14.91 U/mL、10.84 U/mL,分屬不同子集,表明三者對(duì)產(chǎn)脂肪酶活有明顯差異,且37℃時(shí)產(chǎn)脂肪酶活效果最好;由7(c)時(shí)間-酶活的同類子集結(jié)果可知:24h、48h、72 h時(shí)酶活均值分別為7.47 U/ml、15.39 U/ml、10.58 U/ml,分屬不同子集,表明三者對(duì)產(chǎn)脂肪酶活有明顯差異,且培養(yǎng)時(shí)間為48 h時(shí),產(chǎn)脂肪酶活效果最好。因此,菌株LD-1302的最適產(chǎn)酶溫度為37℃,且在27℃、47℃的培養(yǎng)條件下也存在一定的產(chǎn)脂肪酶活性。
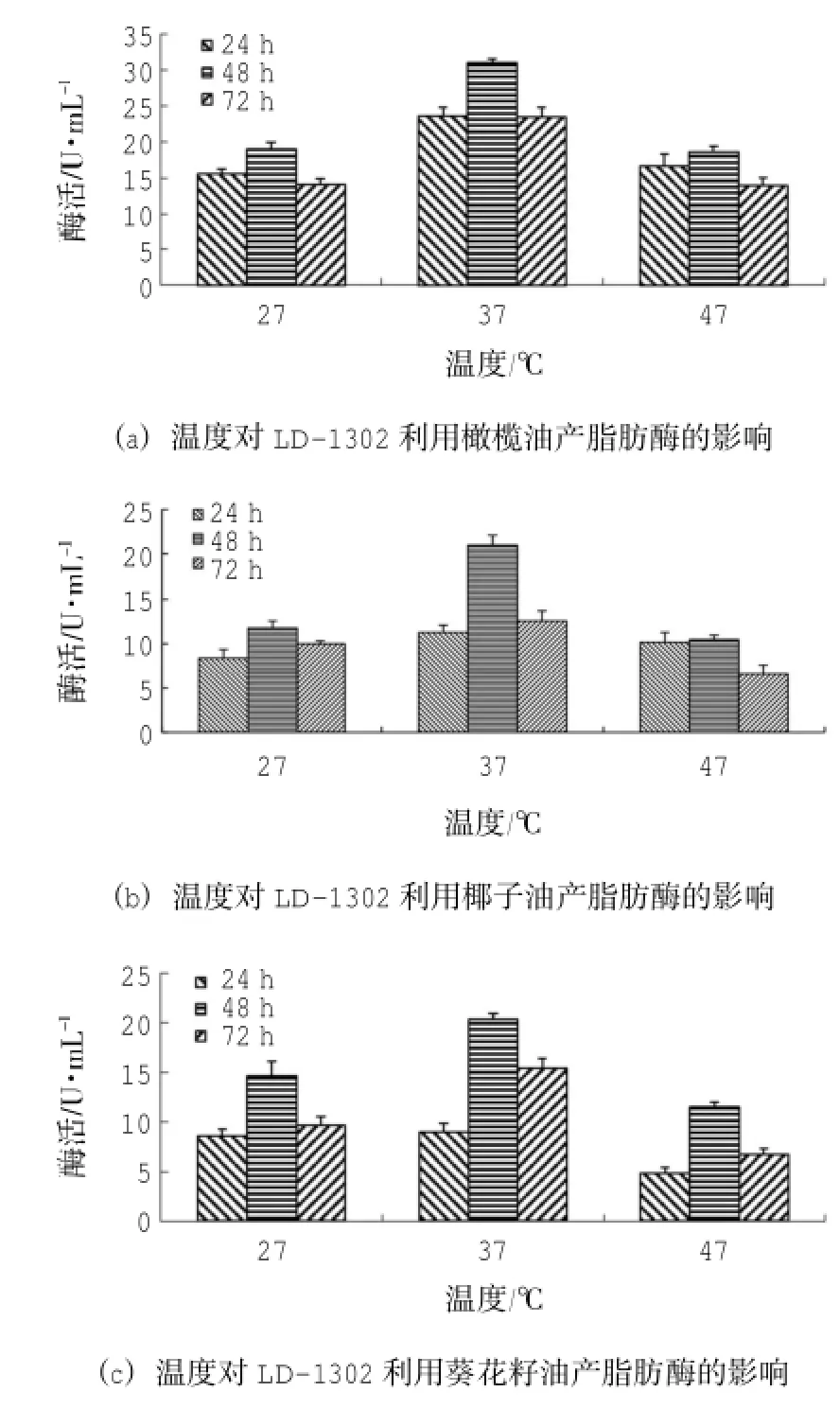
圖7 溫度對(duì)LD-1302產(chǎn)脂肪酶的影響
2.8鹽度對(duì)LD-1302產(chǎn)酶的優(yōu)化
由圖8可知:以橄欖油為有機(jī)碳源、接種量為3.75×105CFU/mL、pH 8、37℃時(shí),菌株LD-1302在鹽度32時(shí)有最大脂肪酶活,為(34.97±1.45)U/mL。采用SPSS 18.0統(tǒng)計(jì)軟件分析數(shù)據(jù)可知:鹽度、時(shí)間的P=0.00<0.01,表明鹽度、時(shí)間均對(duì)酶活影響極顯著;由鹽度-酶活的同類子集結(jié)果可知:鹽度36時(shí)酶活均值為22.88 U/mL;鹽度28、30、34時(shí)酶活均值分別為25.71U/mL、28.60U/mL、27.29U/mL,在同一子集中,表明三者對(duì)產(chǎn)脂肪酶活無(wú)明顯差異,但產(chǎn)脂肪酶活效果略優(yōu)于前者;鹽度32時(shí)酶活均值為30.59 U/mL,且與前四者分屬不同子集,表明鹽度32時(shí),產(chǎn)脂肪酶活效果最好;由時(shí)間-酶活的同類子集結(jié)果可知:24 h、48 h、72 h時(shí)酶活均值分別為27.72U/mL、30.65U/mL、22.68U/mL,分屬不同子集,表明三者對(duì)酶活的影響有明顯差異,且培養(yǎng)時(shí)間為48 h時(shí),產(chǎn)脂肪酶活效果最好。隨著鹽度的增加或減少,菌株LD-1302的產(chǎn)脂肪酶活性都有一定程度的降低,尤其是隨鹽度的增加,脂肪酶活下降較為顯著。
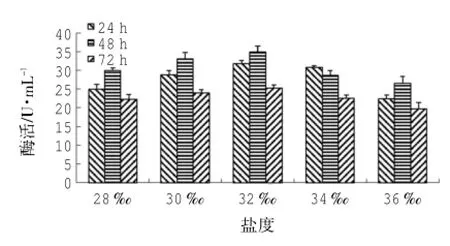
圖8 鹽度對(duì)LD-1302利用橄欖油產(chǎn)脂肪酶的影響
3 討論
本研究采用高溫水浴法從海南熱帶海水中篩選得到產(chǎn)脂肪酶活性較高的地衣芽孢桿菌LD-1302。當(dāng)前,已報(bào)道的產(chǎn)脂肪酶芽孢桿菌主要有枯草芽孢桿菌、芽孢桿菌B5-12、芽孢桿菌WF63、蠟樣芽孢桿菌B.cereus等(胡德朋 等,2008;劉秀花等,2006;黃鷺強(qiáng)等,2010;Akanbi et al.2010),其脂肪酶活依次為2.8 U/mL、24.8U/mL、6.33U/mL、2.51 U/mL,均低于菌株LD-1302的酶活。菌株LD-1302最適應(yīng)用于鹽度32、pH 8、溫度37℃的海水環(huán)境,在鹽度28~36、pH 5~9、27℃~47℃的海水條件下也存在較穩(wěn)定產(chǎn)脂肪酶活性,并可在蔗糖等速效碳源及橄欖油、椰子油和葵花籽油等有機(jī)碳源的誘導(dǎo)下產(chǎn)較高脂肪酶活,這與本研究基于海水環(huán)境下篩選產(chǎn)脂肪酶活性菌株并在該環(huán)境條件下闡述影響其產(chǎn)酶活性的主要環(huán)境因素直接相關(guān)。
有關(guān)學(xué)者篩選的產(chǎn)脂肪酶活性的菌株均是在淡水或者添加NaCl不超過(guò)10‰的環(huán)境下篩選的(李鑫玲等,2011;胡德朋等,2008;劉秀花等,2006;黃鷺強(qiáng)等,2010;Akanbi et al,2010;魏濤 等,2011;陳林林等,2010;劉秀花 等,2006;Eltayib et al,2010),盡管這些菌株也存在一定的產(chǎn)脂肪酶活性,但其對(duì)海水環(huán)境的適應(yīng)性尚未見(jiàn)報(bào)道。海水中含有Li+、K+、Ca2+、Mg2+、Zn2+、Sr2+、Ba2+等多種離子,存在較高滲透壓,對(duì)芽孢桿菌等細(xì)菌產(chǎn)脂肪酶、蛋白酶、淀粉酶等活性存在抑制作用(曹煜成等,2005;朱彥博等,2013),導(dǎo)致眾多在鹽度很低及不含上述離子條件下存在產(chǎn)脂肪酶活較高的菌株的產(chǎn)酶活性大大降低甚至消失。從菌株LD-1302的16S rDNA序列系統(tǒng)發(fā)育樹(shù)可知,雖然菌株LD-1302與Genbank中其他菌株的同源性均為99.9%,卻沒(méi)有明顯地高度聚為一支,由此我們推斷菌株LD-1302很可能為海南熱帶海洋環(huán)境中的地衣芽孢桿菌菌株,比目前常用的芽孢桿菌對(duì)熱帶海水環(huán)境具有更強(qiáng)的適應(yīng)能力。這可能是在長(zhǎng)期的歷史進(jìn)化過(guò)程中,海南獨(dú)特的熱帶沿海地理環(huán)境形成了獨(dú)特的微生物細(xì)菌地理種群。
橄欖油的主要成分為棕櫚酸C16H32O2、亞油酸C18H32O2、油酸 C18H34O2、硬脂酸C18H36O2等的甘油三酯(湯富彬等,2013),菌株LD-1302產(chǎn)生的脂肪酶可將這些甘油三酯分解為C16-C18的游離高級(jí)脂肪酸,這些游離高級(jí)脂肪酸不溶于水浮于水的表面形成絮凝狀乳白色蠟樣物質(zhì),這是菌株LD-1302發(fā)酵24 h后在三角瓶中產(chǎn)生的浮于培養(yǎng)基表面的絮凝狀乳白色蠟樣物質(zhì)的原因,隨著發(fā)酵時(shí)間的延長(zhǎng),這些絮凝狀乳白色蠟樣高級(jí)脂肪酸的混合物逐漸消失,推測(cè)菌株LD-1302除了產(chǎn)脂肪酶外,還可能產(chǎn)生烴類水解酶等其它酶類,將絮凝狀乳白色蠟樣物質(zhì)分解為水溶性物質(zhì)或小分子氣體。石油是一類以C6-C20的烷烴、環(huán)烷烴、芳香烴類為主的油質(zhì),近年來(lái),我國(guó)海面溢油與深海溢油事件時(shí)有發(fā)生,這嚴(yán)重破壞了海洋生態(tài)環(huán)境,一定程度上制約了海洋經(jīng)濟(jì)的可持續(xù)健康發(fā)展(馬麗等,2013;廖國(guó)祥等,2011;楊建強(qiáng)等,2011),而微生物修復(fù)技術(shù)因高效安全、環(huán)境友好、無(wú)二次污染等優(yōu)勢(shì),被逐漸應(yīng)用于修復(fù)溢油、深海水產(chǎn)養(yǎng)殖等造成的海洋環(huán)境污染(王麗娜等,2013;鄭天凌等,2001),所以菌株LD-1302很可能對(duì)被石油污染的熱帶海洋環(huán)境存在較好的修復(fù)作用,當(dāng)然,這還有待進(jìn)一步的深入研究。
Akanbi T O,Kamaruzaman A L,Abu Bakar F,et al,2010.Highly thermostable extracellular lipase-producing Bacillus strain isolated from a Malaysian hotspring and identified using 16S rRNA gene sequencing.International Food Research Journal,(17):45-53.
Eltayib H A,Tripti R,Datta M A,2010.Thermostable Alkaline Lipase from a Local Isolate Bacillus subtilis EH 37:Characterization, Partial Purification,and Application in Organic Synthesis.Applied Biochemistry and Biotechnology,(160):2102-2113.
Nejidat A,2005.Nitrification and occurrence of salt-tolerant nitrifying bacteria in the Negev desert soils.FEMS microbiology ecology,52 (1):21-29.
曹煜成,李卓佳,馮娟,等,2005.地衣芽孢桿菌胞外產(chǎn)物消化活性的研究.熱帶海洋學(xué)報(bào),24(6):6-12.
陳林林,辛嘉英,張穎鑫,等,2010.粗狀假絲酵母產(chǎn)脂肪酶發(fā)酵條件的優(yōu)化.食品工業(yè)科技,31(1):183-185.
東秀珠,蔡妙英,等,2001.常見(jiàn)細(xì)菌系統(tǒng)鑒定手冊(cè).北京:科學(xué)出版社,353-354.
胡德朋,唐家毅,曹昱,等,2008.枯草芽孢桿菌的分離鑒定及酶系分布的研究.水產(chǎn)科學(xué),27(2):86-88.
黃鷺強(qiáng),謝必峰,黃建忠,等,2010.芽孢桿菌WF63脂肪酶分離純化及酶學(xué)性質(zhì).云南民族大學(xué)學(xué)報(bào)(自然科學(xué)版),19(4):290-293.
李建武,簫能,余瑞元,等,1994.生物化學(xué)實(shí)驗(yàn)原理與方法.北京:北京大學(xué)出版社,3-11.
李鑫玲,孫曉菲,孟楠,等,2011.產(chǎn)脂肪酶菌株的篩選及產(chǎn)酶條件優(yōu)化.食品研究與開(kāi)發(fā),32(6):119-120.
廖國(guó)祥,楊建強(qiáng),高振會(huì),等,2011.深海環(huán)境中溢油輸移擴(kuò)散的初步數(shù)值模擬.海洋通報(bào),30(6):707-712.
劉秀花,劉茵,梁峰,2006.一株產(chǎn)脂肪酶芽孢桿菌的發(fā)酵條件及酶學(xué)特性.湖北農(nóng)業(yè)科學(xué),45(4):509-511.
馬麗,李吉鵬,陸志強(qiáng),等,2013.海洋溢油生態(tài)損害簡(jiǎn)易評(píng)估方法研究.海洋通報(bào),32(1):113-120.
彭立鳳,趙汝淇,譚天偉,2006.微生物脂肪酶的應(yīng)用.食品與發(fā)酵工業(yè),26(3):68-73.
沈萍,范秀容,李廣武,2005.微生物實(shí)驗(yàn).北京:高等教育出版社,31-32.
施巧琴,1998.堿性脂肪酶的研究.微生物學(xué)通報(bào),8(3):108-110.
湯富彬,沈丹玉,劉毅華,等,2013.油茶籽油和橄欖油中主要化學(xué)成分分析.中國(guó)糧油學(xué)報(bào),28(7):108-113.
王麗娜,2013.海洋近岸溢油污染微生物修復(fù)技術(shù)的應(yīng)用基礎(chǔ)研究.中國(guó)海洋大學(xué).
魏濤,封盛學(xué),毛多斌,等,2011.根霉ZZ-3脂肪酶發(fā)酵條件的優(yōu)化及酶學(xué)性質(zhì)研究.食品工程,(2):20-23.
吳海武,2014.凈化水質(zhì)熱帶芽孢桿菌的篩選、復(fù)方研制及效果研究.海南大學(xué).
徐先棟,謝珍玉,歐陽(yáng)吉隆,等,2012.褐點(diǎn)石斑魚脫鱗病病原菌的分離與鑒定.海洋科學(xué),36(2):67-74.
閆云君,舒正玉,楊江科,2006.細(xì)菌脂肪酶的結(jié)構(gòu)和功能研究進(jìn)展.食品與生物技術(shù)學(xué)報(bào),(4):121-126.
楊建強(qiáng),張秋艷,羅先香,等,2011.深海溢油生態(tài)損害快速評(píng)估模擬研究.海洋通報(bào),30(6):702-706.
鄭天凌,莊鐵城,蔡立哲,等,2001.微生物在海洋污染環(huán)境中的生物修復(fù)作用.廈門大學(xué)學(xué)報(bào)(自然科學(xué)版),40(2):524-534.
周永燦,張本,謝珍玉,等,2013.海南省潛在海水增養(yǎng)殖區(qū)研究.海洋出版社,289-290.
朱彥博,2013.海南土著芽孢桿菌篩選、復(fù)合及其水質(zhì)凈化效果研究.海南大學(xué).
朱彥博,唐葉玲,陳圣豐,等,2013.鹽度、溫度和pH對(duì)2株海南地衣芽孢桿菌相對(duì)蛋白酶活性的影響.海南大學(xué)學(xué)報(bào)(自然科學(xué)版,31(2):133-138.
(本文編輯:袁澤軼)
Screening of lipase producing strains adapting to the Hainan tropical marine environment and study on the lipase producing conditions
GUO Cong1,WU Hai-wu1,2,GUO Wei-liang1,ZHU Yan-bo1,HUANG Jie-chang1, ZHOU Yong-can1,WANG Shi-feng1,XIE Zhen-yu1
(1.Key Laboratory of Hainan University for Sustainable Exploitation of Tropical Biotic Resources,Key Laboratory of AquaticBiological Technology of Hainan,College of Marine Science,Hainan University,Haikou 570228;2.Hainan Academy of Agricultural Sciences,Haikou 571100,China)
10 lipase-producing bacterial strains were isolated from Hainan tropical seawater,and the lipase-producing activity of strain LD-1302 was the highest.The strain LD-1302 was identified as Bacillus licheniformis based on 16S rDNA sequence analysis and physiological and biochemical tests.The lipase fermentation condition for the strain LD-1302 was studied on the effect of carbon sources,pH,temperature,inoculation volume,lasting time and salinity,in the seawater environment with pH 8,the salinity of 32,the initial concentration of 3.75×105CFU/mL of LD-1302,which was fermentation of lipase-producing induced by the optimum carbon source of olive oil,and the highest lipase activity was produced in the fermentation of 48 h,and the lipase activity reached the maximal level of(34.97±1.45)U/mL.
lipase;bacillus licheniformis;screening;lipase-producing condition
S913
A
1001-6932(2016)04-0427-09
10.11840/j.issn.1001-6392.2016.04.010
2015-05-07;
2015-07-26
海南省產(chǎn)學(xué)研一體化專項(xiàng)資金項(xiàng)目(CXY20130028);海南省重大科技項(xiàng)目(ZDZX2013014);農(nóng)業(yè)科技成果轉(zhuǎn)化資金項(xiàng)目(2011GB2F200009);國(guó)家自然科學(xué)基金(41466002)。
郭聰(1989-),女,碩士研究生,主要從事水產(chǎn)動(dòng)物健康養(yǎng)殖與病害控制技術(shù)研究。電子郵箱:1257303447@qq.com。
謝珍玉,博士,教授。電子郵箱:xiezyscuta@163.com。
- 海洋通報(bào)的其它文章
- 基于隨機(jī)情景模擬統(tǒng)計(jì)的海洋溢油污染風(fēng)險(xiǎn)分析
——以濱州貝殼堤島與濕地國(guó)家級(jí)自然保護(hù)區(qū)為例 - 珠江口赤潮爆發(fā)過(guò)程中水體及表層沉積物間隙水中營(yíng)養(yǎng)鹽與葉綠素的變化特征
- 東海區(qū)海洋觀測(cè)預(yù)報(bào)減災(zāi)信息共享技術(shù)研究及框架設(shè)計(jì)
- 我國(guó)海洋二號(hào)衛(wèi)星微波散射計(jì)數(shù)據(jù)處理軟件設(shè)計(jì)
- 水下生產(chǎn)系統(tǒng)防沉板結(jié)構(gòu)形式改進(jìn)研究
- 6種海洋雙殼類貝殼中碳酸鈣、碳酸鎂含量的測(cè)定

