三氧化二砷對人骨肉瘤細胞系MG-63遷移、黏附能力的影響
岳龍,賀濤,張玲,韓樹峰
(1山西醫科大學第一臨床醫學院,太原 030000;2鄭州大學附屬腫瘤醫院)
?
三氧化二砷對人骨肉瘤細胞系MG-63遷移、黏附能力的影響
岳龍1,賀濤2,張玲2,韓樹峰1
(1山西醫科大學第一臨床醫學院,太原 030000;2鄭州大學附屬腫瘤醫院)
目的觀察三氧化二砷對人骨肉瘤細胞系MG-63遷移、黏附能力的影響。方法 常規培養人骨肉瘤細胞系MG-63,將其分為實驗組(加入濃度為1.0 μmol/L的三氧化二砷)、陽性對照組(加入15 mg/L的5-FU)、陰性對照組(加入同體積的的培養液)。細胞聚集實驗方法檢測細胞同質黏附能力,用層黏蛋白實驗來觀察細胞的異質黏附能力,用劃痕實驗及Transwell小室法檢測細胞趨化遷移能力。結果實驗組在振搖時間20、40、60 min時的細胞聚集指數分別為0.24±0.030、0.46±0.060、0.59±0.070,陽性對照組分別為0.16±0.012、0.20±0.024、0.33±0.022,陰性對照組分別為0.14±0.011、0.18±0.015、0.22±0.023,實驗組與陽性對照組、陰性對照組相比,P均<0.05。實驗組在培養60、90 min時的OD值分別為0.144±0.007、0.141±0.013,陽性對照組分別為0.363±0.035、0.513±0.034,陰性對照組分別為0.387±0.026、0.461±0.024,實驗組與陽性對照組、陰性對照組相比,P均<0.05。實驗組遷移距離、遷移面積及遷移速率分別為(192.3±16.7)μm、(91.9±9.1)×103μm2、(4.00±0.35)μm/h,陽性對照組分別為(301.6±23.8)μm、(161.9±12.9)×103μm2、(6.9±0.9)μm/h,陰性對照組分別為(362.0±27.8)μm、(242.5±21.2)×103μm2、(8.2±1.1)μm/h,實驗組與陽性對照組、陰性對照組相比,P均<0.05。實驗組、陽性對照組、陰性對照組遷移跨膜細胞數分別為(112±11)、(172±15)、(276±37)個,兩兩組間比較,P均<0.05。結論三氧化二砷在體外能顯著增加人骨肉瘤細胞系MG-63同質之間的黏附能力而抑制骨肉瘤細胞與基質的黏附能力,并且抑制骨肉瘤細胞的趨化遷移。
三氧化二砷;骨肉瘤;細胞遷移;細胞黏附
骨肉瘤是一種起源于間葉組織的惡性腫瘤,又稱成骨肉瘤,其以能產生骨樣組織的梭形基質細胞為特征,占原發惡性骨腫瘤的20%,是骨骼系統最常見的原發惡性骨腫瘤,70%~80%的患者發病于青少年,年發病率為(1~3)/100萬。骨肉瘤常無典型臨床癥狀,容易與外傷或生長痛混淆,惡性程度高,早期極有可能發生肺轉移。目前常采用綜合治療的方式,外科手術治療輔以術前后化療,但術后易復發,而化療總體有效率僅為60%左右。因此,改善預后的關鍵除要早期診斷早期治療外,更重要的是尋找有效的治療措施。三氧化二砷已被研究證實具有誘導細胞分化、凋亡及細胞毒作用,最早運用于治療急性早幼粒細胞性白血病。近來許多實驗和臨床研究也證實,三氧化二砷對抑制骨肉瘤增殖及促進骨肉瘤凋亡有一定的抑制作用。本研究觀察了三氧化二砷對人骨肉瘤細胞系MG-63遷移、黏附的影響。
1 材料與方法
1.1材料人骨肉瘤細胞系MG-63購自上海中科院細胞庫;RPIM1640培養液干粉及小牛血清由河南省腫瘤醫院張玲教授饋贈(購自美國英駿生物技術有限公司);Transwell小室購自corning公司(美國);三氧化二砷購自鄭州安賽生物科技有限公司。
1.2細胞培養人骨肉瘤細胞系MG-63,用含10%的小牛血清RPIM1640培養基(含100 mg/L青霉素及鏈霉素)置于37 ℃、5% CO2飽和濕度的培養箱內培養備用。
1.3三氧化二砷對人骨肉瘤細胞系MG-63黏附的影響觀察①細胞同質黏附能力檢測:采用細胞聚集實驗。將24孔板用1%BSA 4 ℃包被過夜。取對數期生長的人骨肉瘤細胞系MG-63,用HCMF(10 mmol/L HEPES、0.137 mol/L NaCl、5.4 mmol/L KCl、0.34 mmol/L Na2HPO4·12H2O、0.1% glucose)洗滌細胞兩次,0.05%胰蛋白酶消化。HCMF再次洗滌一次,使細胞懸浮在HCMF溶液中,計數細胞,調節細胞濃度為2×105。按500 μL細胞懸液/孔加入到1% BSA包被好的24孔培養板,加入Ca2+使之終濃度為1 mmol/L,實驗組加入1 mL濃度為1.0 μmol/L的三氧化二砷,陽性對照組加入1 mL濃度為15 mg/L的5-FU,陰性對照組加入1 mL的培養液。將培養板放置在空氣振蕩器上,80 r/min分別振搖20、40、60 min后顯微鏡下統計聚集細胞數及單個細胞數。通過計算細胞聚集指數(AI)來衡量細胞黏附能力,AI=(N0-Nt)/N0,其中N0為聚集實驗開始前統計細胞數(包括單個細胞與聚集細胞),Nt為特定時間后總細胞數(包括單個細胞與聚集細胞),三組均獨立實驗重復3次。②細胞異質黏附能力檢測:采用層黏蛋白實驗。選用96孔培養板,三組細胞分別選用5個復孔,均用層黏連蛋白Ln進行包被,胰酶消化骨肉瘤細胞,然后將骨肉瘤細胞等量加入每個孔,每個孔的細胞數為1×106個。在室溫、5%CO2條件下,實驗組加入1 mL濃度為1.0 μmol/L的三氧化二砷,陽性對照組加入1 mL濃度為15 mg/L的5-FU,陰性對照組不做處理。靜置培養,30 min后各取出一孔,將未黏附的骨肉瘤細胞快速去除,用Cell Counting Kit-8試劑盒避光染色三組細胞,2 h后,分別計算在490 nm處三組各孔骨肉瘤細胞的OD值,然后在培養60 min和培養90 min時重復上述步驟。獨立實驗重復3次取平均值。
1.4三氧化二砷對人骨肉瘤細胞系MG-63遷移的影響觀察 ①劃痕實驗檢測細胞遷移:取對數生長期的骨肉瘤細胞,胰酶消化,以細胞1×106每孔接種6孔板。在不含血清的DMEM中培養24 h,實驗組加入1 mL濃度為1.0 μmol/L的三氧化二砷,陽性對照組加入1 mL濃度為15 mg/L的5-FU,陰性對照組加入1 mL的培養液。用細胞刮刀于培養板底部劃出4條長500 μm、寬650 μm平行垂直的劃痕,48 h后拍照,Adobe Photoshop CS3分析其遷移距離、遷移面積及遷移速率。②Transwell小室檢測細胞趨化遷移:Transwell小室放入24孔培養板,形成上下兩個小室。胰酶消化細胞,重懸于無血清0.5% BSA-DMEM培養基。調節細胞為1×106/mL,取100 μL細胞懸液加入Transwell上層小室,下層小室加胎牛血清培基作趨化因子。實驗組在上層小室內加入1 mL濃度為1.0 μmol/L的三氧化二砷,陽性對照組在上層小室內加入1 mL濃度為15 mg/L的5-FU,陰性對照組不做處理。繼續培養24 h后,將各組Transwell膜以甲醇固定,結晶紫染色。洗脫膜表面的細胞并用中性樹膠封閉于玻片中。鏡下觀察穿膜細胞并拍照,隨機選取5~8個視野計數并統計。
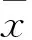
2 結果
三組細胞振蕩不同時間后AI比較見表1。三組細胞孵育不同時間后OD值比較見表2。實驗組細胞于鏡下可見大量的細胞團塊狀組織,陽性對照組可見少量的細胞團塊組織,而陰性對照組可見大量散在的細胞及極少的小細胞團塊。三組細胞劃痕實驗遷移面積、遷移距離、遷移速率比較見表3。實驗組、陽性對照組、陰性對照組遷移跨膜細胞數分別為(112±11)、(172±15)、(276±37)個,兩兩組間比較,P均<0.05。

表1 振蕩不同時間后三組細胞AI比較( ±s)
注:與陽性對照組、陰性對照組相比,*P<0.05。

表2 孵育不同時間后三組細胞OD值比較±s)
注:與陽性對照組、陰性對照組相比,*P<0.05。

表3 三組細胞劃痕實驗遷移面積、遷移距離、遷移速率比較
注:與陽性對照組、陰性對照組相比,*P<0.05。
3 討論
骨肉瘤是兒童及青少年常發的惡性腫瘤,臨床常用抗癌藥物有阿霉素、順鉑和環磷酰胺等,常單用或合用。近年來新輔助化療的出現顯著提高了患者的生存率,但腫瘤發生轉移和復發率仍較高,并很容易形成耐藥。因此,需要尋求新的單純應用或聯合應用的化療藥物。三氧化二砷是無機劇毒品,既往研究[1]發現其治療急性早幼粒細胞白血病臨床效果顯著。體外實驗發現,三氧化二砷對惡性淋巴瘤、胃癌[2]、肝癌[3]、膽囊癌、肺癌[4]、宮頸癌[5]等多種惡性腫瘤細胞的增殖均有抑制作用。對尤文肉瘤[6]及轉移性骨腫瘤[7]也有明顯抑制作用。三氧化二砷抗腫瘤作用的機制可能主要有:①可能存在誘導或促進腫瘤細胞的凋亡作用[8]。三氧化二砷可能因自身的毒性作用作用于癌細胞自身的凋亡基因干擾或阻止了癌細胞的無限增殖途徑。目前研究發現,三氧化二砷對腫瘤細胞增殖的抑制強度主要可能和其濃度有關。②抑制腫瘤細胞端粒酶的活性[9]。三氧化二砷作用于裸鼠移植性肝癌以及急性早幼粒細胞株后,腫瘤細胞的端粒酶活性有不同程度的下降,且下降的程度和三氧化二砷的作用時間和濃度呈正相關。③抑制腫瘤血管生成[10]。④阻滯細胞周期[11]。三氧化二砷能將多種腫瘤細胞株阻滯在G1/S和G2/M期。⑤細胞毒作用[12]。三價砷具有很強的毒性,三價砷可能與細胞的某些抗氧化酶結合使其失去活性,影響細胞的DNA合成和修復,進而導致細胞凋亡。骨肉瘤早期極易發生遠處轉移,轉移途徑主要有以下幾個步驟:①骨肉瘤細胞間黏附能力降低而骨肉瘤細胞與異質間的黏附能力增強,瘤細胞與細胞外的某些基質結合脫離原發部位。②脫離原發部位后,癌細胞分泌水解酶水解細胞外基質,形成游離狀態。③游離的癌細胞黏附于組織細胞、淋巴液、血液進入血管或淋巴管,進而向全身遠處轉移。本研究采用細胞聚集實驗及Ln黏附實驗分別檢測了經三氧化二砷作用后骨肉瘤同質及異質黏附能力的變化,結果發現經三氧化二砷作用后細胞同質黏附能力顯著增加,而同Ln的黏附顯著降低,這說明了三氧化二砷抑制骨肉瘤侵襲的機制可能包括增加細胞同質黏附而抑制其異質黏附。細胞遷移能力與癌細胞的侵襲能力呈正相關。本研究采用細胞劃痕法證明,細胞經三氧化二砷作用后骨肉瘤細胞的遷移面積、遷移距離、遷移速率低于對照組。Transwell小室結果表明,細胞經三氧化二砷作用后骨肉瘤穿膜細胞數顯著低于對照組。這說明三氧化二砷抑制骨肉瘤細胞侵襲的機制還可能包括抑制細胞的趨化遷移。
可見,三氧化二砷在體外能顯著增加人骨肉瘤細胞系MG-63同質之間的黏附能力而抑制骨肉瘤細胞與基質的黏附能力,并且抑制骨肉瘤細胞的趨化遷移。三氧化二砷在骨腫瘤的應用越來越多,目前對四肢骨骼惡性腫瘤的治療方法主要是以新輔助化療為基礎的保肢手術,三氧化二砷應用的各種劑型不斷涌現,作為一種化療藥的同時又是化療增敏劑,局部應用于病灶清除后,配合全身化療,不僅能提高局部有效藥物濃度,還能減少化療藥物總劑量,降低毒副作用。
[1] Emi N. Arsenic trioxide as a therapeutic agent in APL[J]. Nihon Rinsho, 2007,65 Suppl 1:724-728.
[2] Liang XQ, Cao EH, Zhang Y, et al. P53-induced gene 11 (PIG11) involved in arsenic trioxide-induced apoptosis in human gastric cancer MGC-803 cells[J]. Oncol Rep, 2003,10(5):1265-1269.
[3] Lin CC, Hsu C, Hsu CH, et al. Arsenic trioxide in patients with hepatocellular carcinoma: a phase Ⅱ trial[J]. Invest New Drugs, 2007,25(1):77-84.
[4] Park JH, Kim EJ, Jang HY, et al. Combination treatment with arsenic trioxide and sulindac enhances apoptotic cell death in lung cancer cells via activation of oxidative stress and mitogen-activated protein kinases[J]. Oncol Rep, 2008,20(2):379-384.
[5] Kang YH, Lee SJ. Role of p38 MAPK and JNK in enhanced cervical cancer cell killing by the combination of arsenic trioxide and ionizing radiation[J]. Oncol Rep, 2008,20(3):637-643.
[6] Wang X, Wang G, Dong D, et al. Inhibition on LS-174T cell growth and activity of telomerase in vitro and in vivo by arsenic trioxide[J]. Exp Toxicol Pathol, 2008,60(6):481-488.
[7] Scholz C, Richter A, Lehmann M, et al. Arsenic trioxide induces regulated, death receptor-independent cell death through a Bcl-2-controlled pathway[J]. Oncogene, 2005,24(47):7031-7042.
[8] 杜彩文,林英城.三氧化二砷誘導人鼻咽低分化鱗癌裸鼠移植瘤細胞分化的研究[J].癌癥,2003,22(1):21-25.
[9] 袁坦,姜國忠,李宏云.三氧化二砷對肺癌細胞NCI-H520的影響[J].中華實驗外科雜志,2014,31(6):1292-1293.
[10] 華海清,秦叔逵,王錦鴻,等.三氧化二砷抗腫瘤血管形成研究[J].世界華人消化雜志,2004,12(1):27-31.
[11] Kim JH, Kim JH, Yu YS, et al. Antitumor activity of arsenic trioxide on retinoblastoma: cell differentiation and apoptosis depending on arsenic trioxide concentration[J]. Invest Ophthalmol Vis Sci, 2009,50(4):1819-1823.
[12] Pettersson HM, Pietras A, Munksgaard PM, et al. Arsenic trioxide is highly cytotoxic to small cell lung carcinoma cells[J]. Mol Cancer Ther, 2009,8(1):160-170.
10.3969/j.issn.1002-266X.2016.23.015
R738.0
A
1002-266X(2016)23-0047-03
2015-12-25)

