人參皂甙Rbl對大鼠局灶性腦缺血細胞凋亡的抑制作用※
袁秀梅 李思甌 尹昌浩*
(1牡丹江醫學院紅旗醫院神經科,牡丹江157003;2牡丹江醫學院紅旗醫院內分泌科,牡丹江157003)
人參皂甙Rbl對大鼠局灶性腦缺血細胞凋亡的抑制作用※
袁秀梅1李思甌2尹昌浩1*
(1牡丹江醫學院紅旗醫院神經科,牡丹江157003;2牡丹江醫學院紅旗醫院內分泌科,牡丹江157003)
目的探究人參皂甙Rbl對大鼠局灶性腦缺血細胞凋亡的抑制作用。方法首先建立一個阻塞大鼠大腦局灶性暫時腦缺血的模型,將神經功能出現缺失癥的大鼠按照隨機的原則分別分為GRb1組與缺血組,然后對灌注后的GRb1組大鼠進行人參皂甙Rbl腹腔注射,以45 mg/kg為宜,對這些大鼠進行不同時間階段的再灌注,按照時間點的不同,將GRb1組大鼠分為7個組別,然后用免疫組織化學法以及原位末端標記法對大鼠的細胞凋亡情況進行觀察分析。結果經過參皂甙Rbl干預的GRb1組大鼠與缺血組相比,其各分組內的大鼠凋亡細胞數量降低,且僅在灌注的12 h~3 d時間階段內的降低數量差異比較明顯,NAIP陽性細胞數在進行再灌注12 h~10 d與缺血組有著明顯的差別,Bcl-2陽性細胞數在灌注12 h~10 d期間出現了明顯的上升趨勢,且與缺血組大鼠相比,Bax陽性細胞數在相同的時間點出現下降。結論采用人參皂甙Rbl能夠通過對NAIP與Bcl-2的促進起到對大鼠的局灶性腦缺血細胞凋亡的保護作用,可以在臨床醫學中得以廣泛地推廣、應用。
人參皂甙Rbl;大鼠;局灶性腦缺血;細胞凋亡;抑制;動物實驗;中風
隨著我國社會主義現代化建設的不斷發展,我國的醫療衛生水平得到了空前的提升。目前,臨床醫學中對人參單體的作用進行了深入研究,并取得了卓有成效的研究成果。人參皂甙Rbl能夠在一定程度上減少局灶性腦缺血的細胞凋亡,促進脊髓神經元的恢復生長,進而對局灶性腦缺血起到保護作用。為了探究人參皂甙Rbl對大鼠局灶性腦缺血細胞凋亡的抑制作用,特建立阻塞大鼠大腦局灶性暫時腦缺血的模型,并進行深入研究,現對此做一個匯報:
1 資料與方法
1.1 一般資料首先隨機選取雌雄不均的成年Wistar大鼠,體質量在240 g~300 g之間,實驗中所用到的人參皂甙Rbl經醫學奠定純度在98%以上,單克隆小鼠抗Bax、Bcl-2,生物素化羊抗小鼠抗體及辣根酶標記鏈霉卵白素由北京生物試劑公司提供,單克隆小鼠抗神經元凋亡抑制蛋白由Santa Cruz公司提供,對細胞凋亡檢測的試劑盒則是從武漢博士德公司購進[1]。
1.2 研究方法首先要建立一個局灶性腦缺血模型,可以按照線栓法對其進行詳細制作,采用1%的戊巴比妥鈉腹腔對大鼠進行注射麻醉,然后在無菌的環境下,對大鼠的頸部腹側行一切口,使這個切口充分暴露,對大鼠的右側頸總動脈、頸內外動脈進行分離,對直徑0.2 mm左右的尼龍線進行尖端燒圓并沿著頸外動脈分叉處插入距離在1.8 cm左右,大致到大鼠的頸內動脈出現大腦中動脈的地方,阻塞持續2 h左右,然后用乙醚將大鼠麻醉,再將尼龍線推出至頸內動脈頸部,進而實現再次灌注[2]。然后將具有神經功能缺失癥的大鼠按照隨機的原則分為人參皂甙Rbl組與缺血組,在對Rbl組進行再灌注時需向其注射40 mg/kg的人參皂甙,而對于假手術組的大鼠,由于尼龍線長度不夠,難以達到頸內動脈的大腦動脈處,這4只大鼠未出現神經缺失癥狀,可將其作為正常對照組,對實驗組大鼠在進行再灌注后3 h、12 h、1 d、2 d、3 d、5 d、10 d這些時間點,以每個時間點4只對其進行麻醉處死,而對照組大鼠則在手術后的2 d進行處死,大鼠的腦組織采用4%多聚甲醛以及生理鹽水進行心臟灌注固定,用石蠟包埋,切片呈現5 um厚度的冠狀[3]。
1.3 免疫組織化學首先對切片進行脫蠟處理,抗原經復合消化液(Bax)、0.1%胰酶(NAIP)和0.01 mol/L檸檬酸緩沖液熱修復(Bcl-2)處理;將10%山羊血清在室環境下溫孵育20 min左右,單克隆抗體Bcl-2、bax和NAIP(1∶100),在37℃溫度下孵育60 min,生物素化羊抗小鼠二抗,37℃,30 min;HRP-Streptavidin,37℃室溫下孵育30 min。上述各項步驟結束后,采用0.01 mol/L的磷酸緩沖液反復沖洗,以3~5次為宜,孵育在濕盒內進行。DAB顯色3~5 min,蘇木素輕度復染。陰性對照除不加一抗外,其余處理相同。
1.4 細胞凋亡分析對大鼠腦缺血細胞凋亡的檢測試劑盒來確定DNA鏈斷裂的的細胞數量。首先,采用蛋白酶K消化以及2%的過氧化氫溶液對脫蠟切片的內源性過氧化物酶活性進行抑制[4],然后通過末端脫氧核糖核酸轉移酶以及生物素化抗地高新抗體對切片進行處理,采用陰性對照則用水代替TdT,然后用蘇木素對細胞核進行輕度復染。
1.4 圖片分析與統計學處理選取每只大鼠4張左右的前囪后1.9~2.9 mm冠狀切面切片進行觀察分析,主要對大鼠的缺血側皮質、紋狀體以及視前區進行觀察,并準確記錄大鼠免疫反應陽性細胞數以及凋亡的細胞數量[5],Rbl組與缺血組的同時間點采用t進行檢驗,Rbl組內部的不同時間點的比較用方差進行分析,所采用的計量數據用X列卡方來進行檢驗,當P<0.05時,有統計學意義。
2 結果
經過實驗分析,假手術組與正常組大鼠腦實質內可以看出0~3個的細胞凋亡(如圖1),對大鼠進行腦缺血再灌注,3 h后凋亡的細胞數量開始出現上升,到了24 h后,達到了一個巔峰,然后逐漸出現下降趨勢,到了10 d時,其細胞凋亡指標與對照組相比仍有明顯的差異(P<0.05),大鼠的凋亡細胞主要集中分布在視前區、額頂皮質以及紋狀體(如圖2),并且細胞凋亡大部分都出現在梗死灶邊緣位置。另外,細胞凋亡主要是以神經元為主,除此之外還包含了血管內皮細胞、脈絡叢上皮細胞等。通過對GRb1組的分析,可以發現其與缺血組相比,在再灌注的12 h時,細胞凋亡開始出現了明顯的下降趨勢,該現象持續到3 d(P<0.05)(如圖3),在再灌注5 d~10 d期間,GRb1組與缺血組沒有明顯的差異,無統計學意義(如圖4)。
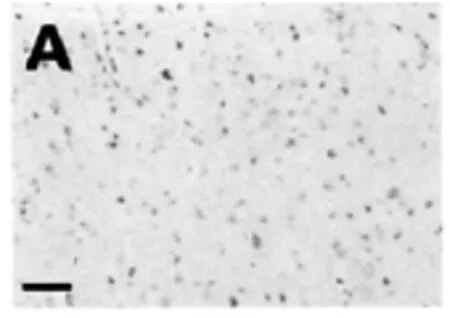
圖1 假手術組與正常組大鼠細胞凋亡情況
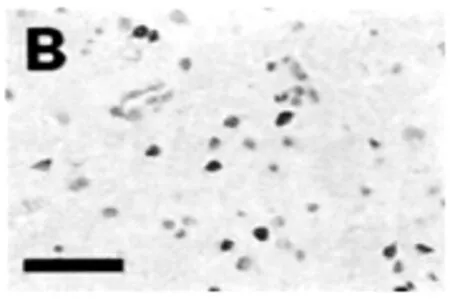
圖2 大鼠凋亡細胞分布圖
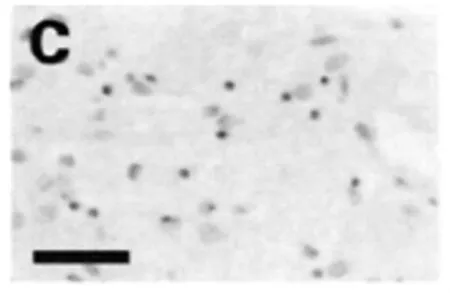
圖3 再灌注12h細胞凋亡情況
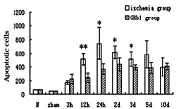
圖4 再灌注5~10 d細胞凋亡情況
3 討論
目前,臨床醫學中對缺血性神經元損傷進行深入的研究,并取得了一定的研究成果。細胞的凋亡與壞死是并存的,通過本次研究,可以發現局灶性腦缺血會引起大量細胞凋亡現象,研究結果與以往相比,有著一致性,該實驗結果顯示,GRb1組通過大腦中動脈阻塞后施以GRb1能夠有效抑制由于腦缺血導致的神經元凋亡,盡管對GRb1抑制細胞凋亡的機制仍是模糊的,但可以得知缺血性神經元損傷主要包括的病理有谷氨酸興奮性毒性、自由基以及基因表達的改變[6]。而GRb1具有清除自由基的功效,并能夠有效抑制鈣物質的過量流入,對神經元起到一定的保護作用。對大鼠進行GRb1注射,然后實行再灌注,在12 h后就能夠使bcl-2的陽性細胞數明顯升高,而bax陽性細胞卻開始出現下降,這在一定程度上是抗凋亡機制的表現。該研究結果與國內學者報道缺血預處理促進bcl-2表達和抑制bax表達的研究結果相似,說明Bcl-2蛋白表達能夠增加而Bax蛋白則呈現下降,是抗凋亡的一種機制。此外,聶榮慶等學者在研究報道中將原代培養的大鼠皮質神經元中加入Rb1,可以發現其能夠降低由于低氧所致的神經元的凋亡率,增加bcl-2蛋白、降低bax蛋白的表達。因此,在體和離體實驗均證實Rb1通過上調bcl-2蛋白和下調bax蛋白表達,提高bcl-2與bax的比率抑制細胞凋亡,從而在大鼠的實驗性卒中中發揮神經保護作用。目前有研究表明人參皂苷Rb1能促進周圍神經軸突生長,但其在中樞神經系統中軸突的作用尚未有研究。本實驗在MCAO/R 3 d后,模型組胼胝體APP蛋白表達增多并出現聚集,在內囊也有聚集。而經GSRb1干預的大鼠APP蛋白表達降低,表明人參皂苷Rb1可能促進中樞神經軸突重塑。本次研究中建立了大鼠腦缺血模型,在灌注3 h后,NAIP陽性細胞呈現出上升趨勢,2 d后達到頂峰,后逐漸下降,其作為一種內源性凋亡抑制物,能夠使caspase-3以及caspase-7失活,同時對細胞凋亡起到阻礙作用,進而使GRb1出現上調,阻止神經元凋亡。通過本次研究,可以發現GRb1對神經元具有一定的保護作用,能夠抑制大鼠腦缺血凋亡細胞的降低,可能在中樞神經系統損傷后康復中起促進作用。具有一定的應用價值,符合膠質細胞比神經元更能經受缺血性損傷的理論,其作用機制與上調NAIP和Bcl-2蛋白和降低Bax蛋白表達有關。臨床醫學可以對此進行深入研究,在醫學事業中得以應用發展。
[1]胡光強,張慧,蕭洪文,等.人參皂苷Rbl對大鼠局灶性腦缺血白質重塑的影響[J].中國臨床解剖學雜志,2015(4):451-454.
[2]李亮,何軍鋒,蔡雄,等.人參皂苷Rg1對局灶性腦缺血再灌注大鼠神經保護作用的實驗研究[C]//第十二次全國中西醫結合實驗醫學專業委員會暨第七次湖南省中西醫結合神經科專業委員會學術年會論文集. 2015.
[3]王巧云,劉鳳,吳峰階,等.人參皂苷Rg1對局灶性腦缺血再灌注損傷大鼠海馬p-ERK1/2與p-JNK表達的影響[J].中國中西醫結合雜志,2013,33(2):229-234.
[4]游詠梅,薛偕華.電針足三里穴、曲池穴對腦缺血再灌注大鼠Bad及其磷酸化的影響[J].亞太傳統醫藥,2014,10(4):21-23.
[5]江欣,陳立典.電針曲池、足三里對腦缺血大鼠NICD表達影響觀察[J].亞太傳統醫藥,2014,10(4):25-26.
[6]Young L Y,Jin-Sun P,Eun-Jung L,et al.Anti-inflammatory Mechanism of GinsengSaponin Metabolite Rh3 in Lipopolysaccharide-Stimulated Microglia:Critical Role of 5'-Adenosine Monophosphate-Activated Protein Kinase SignalingPathway.[J].Journal ofAgricultural&Food Chemistry,2015,63(13).
Inhibition of Ginsenosides Rbl on Focal Cerebral Ischemia and Apoptosis
YUAN Xiumei1,Li Siou2,YIN Changhao1*
(1.Department of Neurology,Hongqi Hospital of Mudanjiang Medical University,Helongjiang Province,Mudanjiang 157003,China;2.Department of Endocrinology,Hongqi Hospital of Mudanjiang Medical University,Helongjiang Province,Mudanjiang 157003,China)
Objective To explore the inhibition of ginsenosides Rbl on focal cerebral ischemia and apoptosis.Methods Firstly,a cerebral occlusion model of focal cerebral ischemia in temporarily was established.The neurological deficit disorder occurs in rats in accordance with the principle of random were divided into GRb1 group and ischemia group.After perfusion,the GRb1 group with large ginsenosides Rbl mice was injected intraperitoneally with 45mg/kg.These rats were given reperfusion in different period of time,according to different points in time,and the rats were divided into seven groups GRb1 groups.The immunohistochemistry TUNEL method was used to observe and analyze cell apoptosis of rats.Results After the intervention of ginsenoside Rbl GRb1 rats with ischemia group compared to the number of apoptotic cells in rats which each packet was lowered,and only reduce the number of differences in perfusion 12h~3d period of time within the more obvious,NAIP positive cells during reperfusion 12h~10d and ischemic group has a significant difference,Bcl-2 positive cells in perfusion has a clear upward trend during the 12h~10d,and compared with ischemic rats,Bax positive cells decline at the same point in time.Conclusion Ginsenoside Rbl through NAIP and promoting Bcl-2 plays a protective effect on focal cerebral ischemia in rat's apoptosis,and can be widely promotion and application in clinical medicine.
ginsenoside Rbl;rats;focal cerebral ischemia;apoptosis;inhibition;animal experiment;stroke
10.3969/j.issn.1672-2779.2016.20.063
1672-2779(2016)-20-0138-03
楊杰 本文校對:尹昌浩
2016-06-21)
牡丹江醫學院科研項目資助(No:2010-06)
*通訊作者:yinchanghao7916@sina.com

