超高效液相色譜-串聯四極桿質譜聯用法同時測定蒙藥全石榴、中藥石榴皮及新鮮石榴中7 種成分
王常喜,岳麗麗,許海燕,烏妮爾,黃 燕,張海鵬,高 杰,馬超美(內蒙古大學生命科學學院,內蒙古 呼和浩特 010021)
超高效液相色譜-串聯四極桿質譜聯用法同時測定蒙藥全石榴、中藥石榴皮及新鮮石榴中7 種成分
王常喜,岳麗麗,許海燕,烏妮爾,黃 燕,張海鵬,高 杰,馬超美*
(內蒙古大學生命科學學院,內蒙古 呼和浩特 010021)
采用超高效液相色譜-串聯四極桿質譜聯用法,同時檢測蒙藥全石榴皮及籽、中藥石榴皮、鮮石榴皮及籽中訶子鞣質A、訶子鞣質B、訶子裂酸、五沒食子酰葡萄糖、鞣料云實素、訶黎勒酸和沒食子酸7 種成分。選用表兒茶素-4-乙酰半胱氨酸作為內標。石榴樣品經粉碎用甲醇(含內標液)溶液超聲提取,采用ZORBAX Eclipse XDB-C18柱(2.1 mm×50 mm,1.8 μm),以甲醇-0.1%甲酸溶液為流動相,梯度洗脫,以電噴霧離子源,采用超高效液相色譜-串聯四極桿質譜聯用動態多反應監測模式測定。結果表明,7 種成分檢出限均小于0.013 5 μg/mL,定量限均小于0.054 2 μg/mL,在0.003 4~13.875 0、0.013 5~13.875 0、0.003 4~13.875 0、0.216 8~55.500 0、0.867 2~55.500 0、0.216 8~55.500 0、0.003 4~13.875 0 μg/mL范圍內,峰面積與質量濃度呈良好線性關系,相關系數均大于0.99;方法回收率為99.44%~105.54%;其日內及日間精密度實驗的相對標準偏差分別為0.11%~0.95%和0.14%~1.21%。該方法靈敏度高、穩定性強、操作簡便、快捷、準確,可用于蒙藥全石榴、中藥石榴皮、鮮石榴及其相關食品藥品的質量控制。
石榴;全石榴;石榴皮;超高效液相色譜-串聯四極桿質譜聯用;同時測定
石榴(Punica granatum L.)為石榴科石榴屬植物,原產于中亞地區,唐朝時傳入我國,并得以廣泛栽培。石榴果實色澤艷麗,籽粒晶瑩、清香可口,享有“霧殼作房珠作骨,水晶為粒玉為漿”的美譽,是一種老少咸宜的果品[1]。據報道[2],石榴營養豐富,其中含有大量的有機酸、糖類、蛋白質、脂肪、維生素以及鈣、磷、鉀等礦物質。不僅可生食,還可以加工成石榴果汁、果醬、果凍、濃縮石榴汁、糖漿、石榴酒和馬丁尼酒;石榴葉片還可以加工成石榴茶。
石榴皮中主要含有鞣質、多酚及黃酮類化合物。它們具有抗癌[3]、抗炎、抗氧化[4]和抑菌[5-6]的作用。石榴籽中含有黃酮類化合物、原花色素及脂肪酸等成分,具有抗氧化、降血糖等作用。傳統中醫認為,石榴味甘、酸、澀、性溫、歸肺、腎和大腸經,具有生津止渴、收斂止瀉、止血、殺蟲和解酒等功效[7],多以石榴皮入藥。而在蒙醫藥臨床應用中多以全石榴入藥,用于澀腸、止血、驅蟲,治療久瀉、久痢等[8]。
目前,用于石榴有效成分定量分析的方法有高效液相色譜-二極管陣列檢測器法、高效液相色譜-蒸發光散射檢測器法、氣相色譜-質譜法、分光光度法、Folin-Ciocalteu比色法及高效毛細管電泳法[9-15]等。這些方法對石榴及其衍生產品的質量控制有著重要的作用。然而到目前為止,鮮見可以同時快速分析石榴中包括訶子鞣質A、訶子鞣質B等多種多酚類成分的理想方法。
現代新型分析儀器如超高效液相色譜能顯著提高分辨率并縮短測定時間,質譜檢測器特別是其多反應監測模式能夠大幅提高檢測靈敏度和特異性,優化的內標測定法還能補償回收率不佳等問題,液相色譜-質譜聯用技術在食品功能成分及有害物質殘留的檢測方面發揮了越來越重要的作用[16-18]。本實驗采用超高效液相色譜-串聯四極桿質譜(ultra-high-performance liquid chromatography-triple quadrupole mass spectrometry,UPLC-QQQMS)聯用法,對蒙藥全石榴的皮與籽、中藥石榴皮及新鮮石榴的皮與籽中7 種鞣質類化合物:訶子鞣質A、訶子鞣質B、訶子裂酸、五沒食子酰葡萄糖、鞣料云實素、訶黎勒酸和沒食子酸進行同時測定,并對各化合物的分布情況進行了比較分析,以期為石榴藥材、成藥及相關食品質量控制提供新的方法,并為石榴皮與籽的開發利用提供科學依據。
1 材料與方法
1.1 材料與試劑
鮮石榴 市購;所有石榴樣品經內蒙古大學生命科學學院馬超美教授鑒定為石榴科石榴屬石榴(Punica granatum L.);蒙藥全石榴 安國市祁澳中藥飲片有限公司;中藥石榴皮 呼和浩特市萬福大藥房;所有鞣質標準品均由內蒙古大學天然藥物與功能食品研究室分離制備,并用多種光譜法確定其結構[19](高效液相色譜法檢測純度大于98%)。
甲醇(色譜純) 美國Fisher Scientific公司;甲酸(色譜純) 天津阿法埃莎化學有限公司;屈臣氏蒸餾水 廣州屈臣氏食品飲料有限公司;二甲基亞砜(分析純) 日本和光公司。
1.2 儀器與設備
1290 UPLC-高分辨串聯6430四極桿-MS聯用儀(配有電噴霧電離源) 美國安捷倫科技公司;PS-20超聲波清洗儀 潔康超聲波設備有限公司;CF-10高速離心機 大韓科學有限公司;FDU-1200冷凍干燥機 東京理化器械株式會社;TB-25電子天平 丹佛儀器有限公司;移液槍 大龍興創實驗儀器有限公司;有機相微孔濾膜 天津富集科技有限公司;Sep-Pak?Plus tC18固相萃取柱 美國沃特世公司。
1.3 方法
1.3.1 LC條件
ZORBAX Eclipse XDB-C18柱(2.1 mm×50 mm,1.8 μm);柱溫30 ℃;流速0.4 mL/min;進樣量1 μL;流動相:A相為0.1%甲酸溶液,B相為甲醇。流動相A、B的梯度洗脫程序如表1所示。
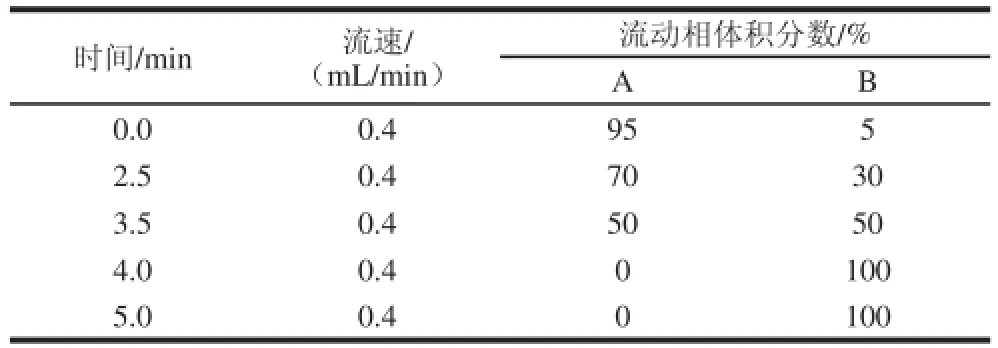
表1 梯度洗脫條件Table 1 Gradient elution program
1.3.2 MS條件
UPLC-QQQMS接有電噴霧離子源,采用負離子化模式;噴霧電壓4 500 V;干燥氣體氮氣;干燥氣流量12 L/min;干燥氣體溫度350 ℃;毛細管電壓:負離子3 500 V;采用選擇離子監控模式優化待測化合物電壓,子離子掃描模式:優化子離子、定性離子及二者碰撞能量,多反應監測模式優化各組分分離洗脫條件,最后采用動態多反應監測模式高選擇性地分析測定各組分。8 種分析物MS條件見表2。
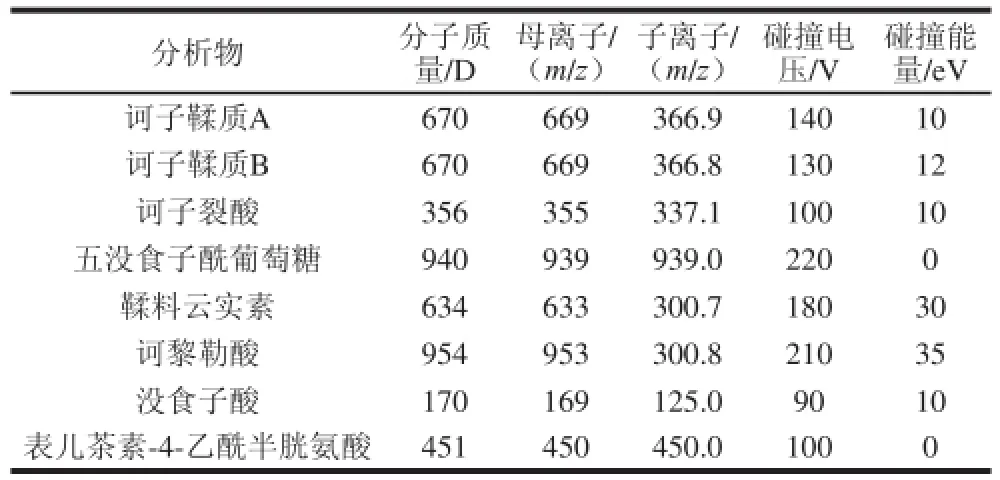
表2 MS優化條件Table 2 Optimized mass spectrometry conditions
1.3.3 溶液配制
7 種標準品各稱取適量于1.5 mL離心管中,二甲基亞砜溶解過濾,配制成10 mg/mL標準品儲液;表兒茶素-4-乙酰半胱氨酸稱取適量于1.5 mL離心管中,甲醇溶解過濾配制成1 μg/mL的內標溶液儲液。
1.3.4 樣品前處理
將鮮石榴冷凍干燥處理,之后將全石榴皮、全石榴籽、中藥石榴皮、鮮石榴皮、鮮石榴籽樣品敲碎成小米粒大小,各樣品稱取約50 mg,分別置于2 mL離心管中,用1 mL甲醇(含內標液)溶液超聲提取10 min,離心(轉速6 000 r/min)取上清液,重復3 次,制得提取液。提取液用Sep-Pak?Plus tC18固相萃取柱萃取,再用0.22 μm有機相微孔濾膜過濾后進樣供LC-MS儀檢測。
2 結果與分析
2.1 UPLC-QQQMS條件優化
通過改變流動相A、B兩相比例尋找到最佳分離條件,7 種標準品及內標用表1中梯度洗脫條件在5 min內得到分離。為了得到最靈敏的檢測條件,對MS碰撞電壓和碰撞能量進行了優化,優化后的參數列于表2。在此條件下用MS動態多反應監測模式檢測到8 種化合物的色譜疊加效果見圖1。鞣料云實素與表兒茶素-4-乙酰半胱氨酸難以得到色譜完全分離,一般的紫外檢測將難以得到準確的定量結果,動態多反應監測模式檢測在這種情況下發揮了其優勢,對這2 個母離子和子離子不同的化合物可分別給出準確峰面積,進而準確定量。

圖1 標準品混和物的動態多反應監測模式掃描圖Fig.1 UPLC-QQQMS profile of a mixture of standard compounds in MRM mode
2.2 線性范圍及檢出限
用含有1 μg/mL表兒茶素-4-乙酰半胱氨酸的內標液配制標準品溶液。7 種標準品儲備液先分別用內標溶液稀釋為1 mg/mL,然后分別吸取稀釋后的標準品儲備液各50 μL,混合均勻,用內標溶液將混合液按體積比1∶4∶4∶4∶4∶4∶4∶4∶4的比例梯度稀釋,制得9 份混合標準品使用液。采用所優化的MS條件與LC條件檢測標準混合溶液(質量濃度范圍為0.000 9~55.500 0 μg/mL)。用Agilent Mass Hunter定量分析軟件對UPLC-QQQMS檢測結果進行分析,以待測物的質量濃度為橫坐標,待測物與內標的峰面積比為縱坐標,進行線性回歸。各對照品的線性關系如表3所示。取3 倍信噪比的待測物質量濃度為方法檢出限,取10 倍信噪比的待測物質量濃度為方法定量限。由表3可知,7 種標準品在各自的線性范圍內具有良好的線性相關性,定量限均小于0.054 2 μg/mL,檢出限均小于0.013 5 μg/mL,可滿足實際檢測的需要。
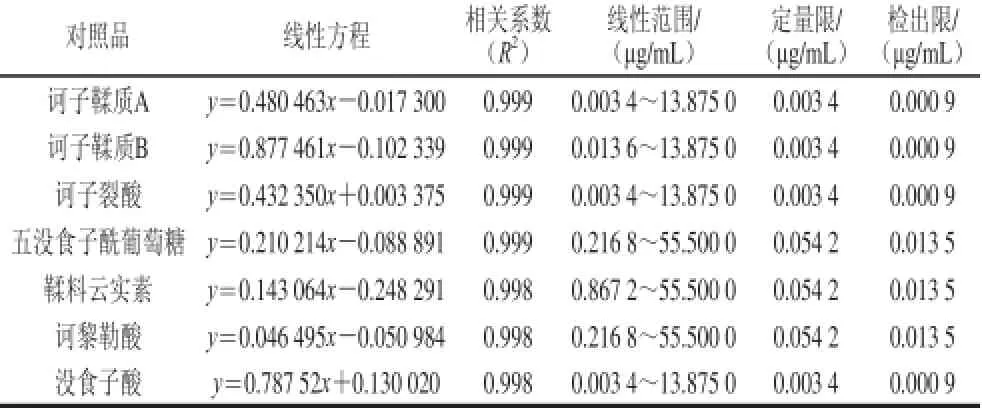
表3 各對照品的線性關系Table 3 Linear relationships of reference substances
2.3 樣品分析
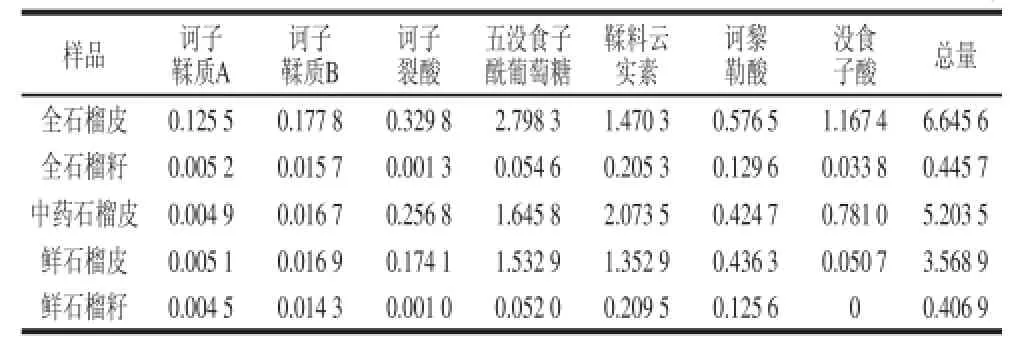
表4 全石榴皮、全石榴籽、中藥石榴皮、鮮石榴皮、鮮石榴籽成分含量分析結果Table 4 Contents of 7 components in different parts of pomegranateTable 4 Contents μg/mg
采用Agilent Mass Hunter定量分析軟件對樣品UPLCQQQMS檢測結果進行分析,經標準曲線回歸方程,計算得到待測物的質量濃度,從而換算出待測物在樣品中的含量,結果見表4。
其中訶子裂酸、五沒食子酰葡萄糖、鞣料云實素、訶黎勒酸和沒食子酸在石榴皮部分的含量明顯高于石榴籽中的含量,訶子鞣質A和訶子鞣質B這2 種化合物在全石榴皮中的含量明顯高于其他部位。訶子裂酸具有細胞保護活性和抗氧化活性[20],五沒食子酰葡萄糖具有抗細菌活性[21],鞣料云實素具有抗病毒[22]、抗氧化[23]、抗細菌與抗真菌活性[24-25],訶黎勒酸具有抗病毒[22]、抗細菌[24]、抗真菌[26]活性,沒食子酸具有抗細菌、抗真菌[27]、抗氧化[28]、抗病毒[29]、抗寄生蟲[30-32]等活性。這些具有保護性作用的化合物可能對石榴皮在抵抗害蟲、微生物,保護果實方面有一定的作用。
沒食子酸在鮮石榴皮中的含量明顯低于其在全石榴皮和中藥石榴皮的含量,而且在鮮石榴籽中并未檢測到沒食子酸,這可能意味著石榴藥材在干制的過程中有部分鞣質化合物分解為沒食子酸單體,從而提高了石榴藥材中沒食子酸的含量。而沒食子酸具有抗氧化、抗微生物、抗病毒、抗癌[33]等多種生物活性,這說明石榴在干制的過程中,其藥用價值可能會有所提高。
2.4 回收率和精密度
取3 份已知質量濃度的溶液,分別向其加入等體積高、中、低3 種已知質量濃度的混合標準品溶液,充分混勻后進樣測定計算加樣回收率。結果顯示,訶子鞣質A、訶子鞣質B、訶子裂酸、五沒食子酰葡萄糖、鞣料云實素、訶黎勒酸和沒食子酸回收率分為100.62%、99.44%、103.02%、100.78%、104.04%、105.54%、102.07%。配制質量濃度為13.875 μg/mL的標準品混合液室溫放置,24 h內連續進樣6 次測定日內精密度,日間精密度則連續3 d每天進樣測定1 次。結果表明,在混合標準品儲備液中訶子鞣質A、訶子鞣質B、訶子裂酸、五沒食子酰葡萄糖、鞣料云實素、訶黎勒酸和沒食子酸具有良好的精密度,其日內及日間精密度相對標準偏差范圍分別為0.11%~0.95%和0.14%~1.21%。
3 結 論
本實驗建立的UPLC-QQQMS內標法,不僅可以同時定量測定石榴中訶子鞣質A、訶子鞣質B、訶子裂酸、五沒食子酰葡萄糖、鞣料云實素、訶黎勒酸和沒食子酸7 種鞣質成分,還可以快速比較蒙藥全石榴、中藥石榴皮及新鮮石榴在成分含量上的差異。目前在石榴質量控制及有效成分測定研究中[7-14],鮮見類似報道。本實驗所建立的方法穩定性強,靈敏度和分辨率高,快速、簡便、準確,為石榴藥材、成藥及相關食品的質量控制提供了新的定量方法。
[1] 李海霞, 王釗. 石榴科植物化學成分及藥理活性研究進展[J]. 中草藥, 2002, 33(8): 765-766. DOI:10.3321/j.issn:0253-2670.2002.08.045.
[2] 苑兆和, 尹燕雷, 李自峰, 等. 石榴果實香氣物質的研究[J]. 林業科學, 2008, 44(1): 65-69. DOI:10.3321/j.issn:1001-7488.2008.01.011.
[3] YOSHIMURA M, WATANABE Y, KASAI K, et al. Inhibitory effect of an ellagic acid-rich pomegranate extract on tyrosinase activity and ultraviolet-induced pigmentation[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(12): 2368-2373. DOI:10.1271/bbb.69.2368.
[4] SEERAM N P, AVIRAM M, ZHANG Y J, et al. Comparison of antioxidant potency of commonly consumed polyphenol-rich beverages in the united states[J]. Journal of Agricultural and Food Chemistry, 2008, 56(4): 1415-1422. DOI:10.1021/jf073035s.
[5] 吳水華, 劉艷紅, 李俊清. 三種不同植物多酚提取物的抗真菌活性研究[J]. 科學技術與工程, 2005, 5(15): 1073-1077. DOI:10.3969/ j.issn.1671-1815.2005.15.011.
[6] ZHU X F, ZHANG H X, LO R. Phenolic compounds from the leaf extract of artichoke (Cynara scolymus L.) and their antimicrobial activities[J]. Journal of Agricultural and Food Chemistry, 2004, 52(24): 7272-7278. DOI:10.1021/jf0490192.
[7] 賈冬英, 姚開. 飲食營養與食療[M]. 成都: 四川大學出版社, 2004: 1161.
[8] 楊巧荷, 賈海鷹. 全石榴和石榴皮中沒食子酸含量測定的比較[J]. 中國民族醫藥雜志, 2003, 9(1): 34-35. DOI:10.3969/ j.issn.1006-6810.2003.01.027.
[9] NUNCIO-J?UREGUI N, NOWICKA P, MUNERA-PICAZO S, et al. Identification and quantification of major derivatives of ellagic acid and antioxidant properties of thinning and ripe Spanish pomegranates[J]. Journal of Functional Foods, 2015, 12: 354-364. DOI:10.1016/j.jff.2014.11.007.
[10] FISCHER U A, CARLE R, KAMMERER D R. Identification and quantification of phenolic compounds from pomegranate (Punica granatum L.) peel, mesocarp, aril and differently produced juices by HPLC-DAD-ESI/MSn[J]. Food Chemistry, 2011, 127(2): 807-821. DOI:10.1016/j.foodchem.2010.12.156.
[11] 鄭敏燕, 耿薇, 劉鵬, 等. HPLC-ELSD法檢測石榴中的游離糖含量[J]. 安徽農業科學, 2010, 38(14): 7692-7693. DOI:10.3969/ j.issn.0517-6611.2010.14.154.
[12] 趙云榮, 王文領, 王勇, 等. 石榴籽中脂肪酸成分分析[J]. 化學研究, 2005, 16(2): 72-74. DOI:10.3969/j.issn.1008-1011.2005.02.022.
[13] 許宗運, 蔣慧, 吳靜, 等. 石榴皮和石榴渣總黃酮含量的測定[J]. 中國農學通報, 2003, 19(3): 72-74. DOI:10.3969/ j.issn.1000-6850.2003.03.022.
[14] 田樹革, 魏玉龍, 劉宏炳. Folin-Ciocalteu比色法測定石榴不同部位總多酚的含量[J]. 光譜實驗室, 2009, 26(2): 341-344. DOI:10.3969/ j.issn.1004-8138.2009.02.045.
[15] 周本宏, 吳振華, 李小軍, 等. 高效毛細管電泳法測定石榴皮中鞣花酸的含量[J]. 中國藥房, 2005, 16(24): 1893-1894. DOI:10.3969/ j.issn.1001-0408.2005.24.023.
[16] 吳俊輝, 羅輝泰, 沈小玲, 等. HPLC-MS/MS檢測中藥保健品中非法添加成分的研究[J]. 中藥新藥與臨床藥理, 2014, 25(5): 606-610.
[17] 楊長志, 王傳松, 程陽, 等. HPLC-MS/MS測定玉米中異惡唑草酮及代謝物殘留量[J]. 食品科學, 2011, 32(22): 280-284.
[18] 葉日貴, 高杰, 王冰, 等. 超高效液相-串聯四極桿質譜聯用法同時測定并比較甘草各部位中8 種成分含量[J]. 食品科學, 2014, 35(20): 242-247. DOI:10.7506/spkx1002-6630-201420001.
[19] AJALA O S, JUKOV A, MA C M. Hepatitis C virus inhibitory hydrolysable tannins from the fruits of Terminalia chebula[J]. Fitoterapia, 2014, 99: 117-123. DOI:10.1016/j.fitote.2014.09.014.
[20] LEE H S, JUNG S H, YUN B S, et al. Isolation of chebulic acid from Terminalia chebula Retz. and its antioxidant effect in isolated rat hepatocytes[J]. Archives of Toxicology, 2007, 81(3): 211-218. DOI:10.1007/s00204-006-0139-4.
[21] JIAMBOONSRI P, PITHAYANUKUL P, BAVOVADA R, et al. The inhibitory potential of Thai mango seed kernel extract against methicillin-resistant staphylococcus aureus[J]. Molecules, 2011, 16(8): 6255-6270. DOI:10.3390/molecules16086255.
[22] LI Y X, YU S J, LIU D, et al. Inhibitory effects of polyphenols toward HCV from the mangrove plant Excoecaria agallocha L.[J]. Bioorganic and Medicinal Chemistry Letters, 2012, 22(2): 1099-1102. DOI:10.1016/j.bmcl.2011.11.109.
[23] THITILERTDECHA N, TEERAWUTGULRAG A, KILBURN J D, et al. Identification of major phenolic compounds from Nephelium lappaceum L. and their antioxidant activities[J]. Molecules, 2010, 15(3): 1453-1465. DOI:10.3390/molecules15031453.
[24] FOGLIANI B, RAHARIVELOMANANA P, BIANCHINI J P, et al. Bioactive ellagitannins from Cunonia macrophylla, an endemic Cunoniaceae from New Caledonia[J]. Phytochemistry, 2005, 66(2): 241-247. DOI:10.1016/j.phytochem.2004.11.016.
[25] KOLODZIEJ H, KAYSER O, LATTé K P, et al. Enhancement of antimicrobial activity of tannins and related compounds by immune modulatory effects[M]//Plant polyphenols 2. US: Springer, 1999: 444-446. DOI:10.1007/978-1-4615-4139-4_32.
[26] LI X C, JOSHI A S, ELSOHLY H N, et al. Fatty acid synthase inhibitors from plants: isolation, structure elucidation, and SAR studies[J]. Journal of Natural Products, 2002, 65(12): 1909-1914. DOI:10.1021/np020289t.
[27] LIN J B, ZHAO H Q, HANG B, et al. Antimicrobial and antitumor activities of crude extracts and isolated compounds from Euphorbia humifusa[J]. Asian Journal of Chemistry, 2013, 25(7): 3957-3960.
[28] MAHDAVI B, YAACOB W A, DIN L B, et al. Antioxidant activity of consecutive extracts of the base, stem and leaves of Etlingera brevilabrum[J]. Asian Journal of Chemistry, 2013, 25(7): 3937-3941. DOI:10.14233/ajchem.2013.13851.
[29] KRATZ J M, ANDRIGHETTI-FR?HNER C R, LEAL P C, et al. Evaluation of anti-HSV-2 activity of gallic acid and pentyl gallate[J]. Biological and Pharmaceutical Bulletin, 2008, 31(5): 903-907. DOI:10.1248/bpb.31.903.
[30] TASDEMIR D, KAISER M, BRUN R, et al. Antitrypanosomal and antileishmanial activities of flavonoids and their analogues: in vitro, in vivo, structure-activity relationship, and quantitative structure-activity relationship studies[J]. Antimicrobial Agents and Chemotherapy, 2006, 50(4): 1352-1364. DOI:10.1128/AAC.50.4.1352-1364.2006.
[31] CAO S G, RANARIVELO L, RATSIMBASON M, et al. Antiplasmodial activity of compounds from Sloanea rhodantha (Baker) Capuron var. rhodantha from the Madagascar rain forest[J]. Planta Medica, 2006, 72(15): 1438-1440. DOI:10.1055/s-2006-951729.
[32] SUBEKI S, MATSUURA H, TAKAHASHI K, et al. Anti-babesial and anti-plasmodial compounds from Phyllanthus niruri[J]. Journal of Natural Products, 2005, 68(4): 537-539. DOI:10.1021/np0497245.
[33] MITTAL A K, KUMAR S, BANERJEE U C. Quercetin and gallic acid mediated synthesis of bimetallic (silver and selenium) nanoparticles and their antitumor and antimicrobial potential[J]. Journal of Colloid and Interface Science, 2014, 431: 194-199. DOI:10.1016/j.jcis.2014.06.030.
Simultaneous Quantification of 7 Components in Different Parts of Punica granatum Fruits Using Ultra-High Performance Liquid Chromatography-Triple Quadrupole Mass Spectrometry (UPLC-QQQMS)
WANG Changxi, YUE Lili, XU Haiyan, Uneer, HUANG Yan, ZHANG Haipeng, GAO Jie, MA Chaomei*
(School of Life Sciences, Inner Mongolia University, Hohhot 010021, China)
An ultra-high performance liquid chromatography-triple quadrupole mass spectrometry (UPLC-QQQMS) method was developed and validated to simultaneously determine seven constituents including chebumeinin A, chebumeinin B, chebulic acid, pentagalloyl glucose, corilagin, chebulagic acid and gallic acid in dried whole pomegranate (containing peels and seeds, a traditional Mongolian medicinal material), dried pomegranate peels (a traditional Chinese medicinal material), and fresh pomegranate peels and seeds (Punica granatum L.). 4β-(L-acetylcysteinyl)-epicatechin was used as an internal standard for the quantification. The internal standard was added to methanol before being used to extract samples. The separation was performed on an Agilent ZORBAX Eclipse XDB-C18column (2.1 mm × 50 mm, 1.8 μm) with methanol-0.1% formic acid as the mobile phase at a flow rate of 0.4 mL/min. As a result, the linear ranges of chebumeinin A, chebumeinin B, chebulic acid, pentagalloyl glucose, corilagin, chebulagic acid and gallic acid were 0.003 4–13.875 0, 0.013 5–13.875 0, 0.003 4–13.875 0, 0.216 8–55.500 0, 0.867 2–55.500 0, 0.216 8–55.500 0, and 0.003 4–13.875 0 μg/mL, respectively, with correlation coefficients higher than 0.99. The average recovery rate of the developed method ranged from 99.44% to 105.54% and the intra-day and inter-day relative standard deviations (RSDs) were 0.11%–0.95% and 0.14%–1.21%, respectively. This method is sensitive, simple, fast, and accurate, and can be used for the quality control of pomegranate for medicinal use and related food products or pharmaceuticals.
Punica granatum; whole pomegranate; pomegranate peel; ultra-high-performance liquid chromatography triple quadrupole mass spectrometry (UPLC-QQQMS); simultaneous determination
10.7506/spkx1002-6630-201604025
R284.1
A
1002-6630(2016)04-0139-05
王常喜, 岳麗麗, 許海燕, 等. 超高效液相色譜-串聯四極桿質譜聯用法同時測定蒙藥全石榴、中藥石榴皮及新鮮石榴中7 種成分[J]. 食品科學, 2016, 37(4): 139-143. DOI:10.7506/spkx1002-6630-201604025. http://www.spkx.net.cn
WANG Changxi, YUE Lili, XU Haiyan, et al. Simultaneous quantification of 7 components in different parts of Punica granatum fruits using ultra-high performance liquid chromatography-triple quadrupole mass spectrometry (UPLC-QQQMS)[J]. Food Science, 2016, 37(4): 139-143. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604025. http://www.spkx.net.cn
2015-06-05
內蒙古大學校級大學生創新創業訓練計劃資助項目(201414199);高等學校博士學科點專項(#20131501110008)
王常喜(1994—),男,本科生,研究方向為天然藥物與功能食品。E-mail:mowoilo@hotmail.com
*通信作者:馬超美(1962—),女,教授,博士,研究方向為天然藥物與功能食品。E-mail:cmma@imu.edu.cn

