以“氯氣的性質”例說元素化學的“實驗化教學”
摘要:如何在“非金屬元素及其化合物”的教學中由傳統講授型向“實驗化教學”轉移,文章以“氯氣的性質”淺述例說,并期待拋磚引玉。
關鍵詞:實驗教學法;形象記憶;實驗設計;驗證性;探究性;微型化
文章編號:1008-0546(2016)10-0081-02 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2016.10.028
高中化學“元素及其化合物”部分的核心思想,就是通過元素單質及其化合物性質的學習,提高學生對“化學是一門以實驗為基礎的科學”的認識,培養學生的實驗意識、操作技能,觀察能力和分析問題的能力[1]。通過結合實驗的教學并側重于實驗為主線進行的課堂設計,進而讓學生系統掌握“元素及其化合物”的學習方法,實現學生實驗能力的提升與發展。
一、從事實現象提出問題
筆者曾聽過多所學校的青年教師的“氯氣的性質”公開課。多數老師采用的是:“物理性質(展示氯氣以供觀色)→化學性質(演示氯氣與氫氣混合光照、氯水的漂白等系列實驗)→由性質推及制法與用途”的經典但很傳統的授課模式。盡管老師們都試圖突破傳統,如采用先實物展示,再根據其所觀察到的理化性質加以總結歸納……但仍給人以脫不開“以講為主的灌輸式教學”烙印之感,沒有充分利用化學以實驗為基礎的學科教學優勢。作為“旁觀者”,我想,如果根據所學元素的性質精心設計實驗,甚至將實驗貫穿于整個“元素及其化合物”的教學始終,再結合實驗思考題,那學生獲得的學習體驗將會是更好的,他(她)的觀察、思維、探究等綜合學習的能力也定會得以提升。怎樣設計這樣的實驗呢?
二、基于問題的解決方法
非金屬元素氯、氮、硫等的單質、氧化物、氫化物、含氧酸及其鹽的許許多多的物理化學性質,都可以設計成系列實驗進而將整個知識體系貫穿起來,從而實現元素化合物的“實驗化”教學。下文以“氯氣的性質”為例,示設如下:
1. “實驗化教學”思路
氯氣是活潑的非金屬氣體,有強烈的刺激性氣味,有毒,易液化,在水中的溶解度為1∶2.0,溶于水形成黃綠色的氯水,并與水反應生成HClO(極不穩定、極強氧化性、漂白性且有弱酸性);氯氣氧化性極強,能與幾乎所有的金屬反應,能與堿、還原性酸、還原性鹽等物質反應。Cl2與水的反應內容豐富,知識點眾多,且與水生成的HClO因具有強氧化性,而使有機色素發生漂白褪色,但干燥的氯氣則不能,這一現象會給學生留下先疑后釋的思維沖擊,從而加深對氯水成分的深刻認識,而氯水中各成分的分析正是本課需要重點討論的內容之一。所以優化編制好實驗的先后順序并設計好實驗流程,會讓學生在鮮明的實驗現象的“耳濡目染”下取得良好的學習效果。
2. “實驗化教學”設計
[實驗Ⅰ]①出示一瓶氯氣,觀色、聞味,后放入一片紅色布條,置于桌面2到3分鐘;②在靜候現象時完成如下實驗:將收集有30mL氯氣的針筒吸進10mL的水,觀察現象;③用酒精噴燈加熱密封有氯氣的“香蕉管”的一端,觀察現象。
[問題Ⅰ]①集氣瓶中觀察到的現象說明什么問題?②據針筒中的現象你能得到什么結論?③怎么解釋加熱時“香蕉管”的一端卻出現了黃綠色的液體?
依據學生的反應或引導或追問,最終通過實驗現象的分析,讓學生得到氯氣的諸多物理性質(色、態、味、溶解性和常溫下的溶解度以及易液化等性質)包括干燥氯氣無漂白性的結論。
這一階段,教師實際上無須講述太多,因為現象“鮮活”,學生大多會輕松有效地完成氯氣物理性質及部分化學性質的學習。
[實驗Ⅱ]①打開放有色布條的氯氣瓶塞,滴水將布條潤濕,注意觀察現象;②將“實驗Ⅰ”針筒里的溶液分別滴加到盛有AgNO3、NaHCO3、淀粉-KI溶液、品紅溶液的四支試管中,觀察現象。
[問題Ⅱ]①的現象說明什么問題?你是怎樣推理到這一結論的?
②中分別觀察到什么現象?其對應的離子方程式如何書寫?通過分析說明氯水中含有哪些分子,哪些離子?
[說明]由于此處設計的驗證性實驗較多,所以應該分門別類地對每一組實驗取得的現象進行討論、分析、研判,由此推理得出氯水中所含的各種成分,特別是與淀粉-KI溶液形成藍色時,I2到底是被何物質氧化而來?而品紅褪色又是誰的功勞?這些都是本課的關鍵之處。
通過上述的實驗設計,基本上完成了氯氣物理性質的觀察與總結,氯水成分的分析與推理,而所有這些都是以眼見為實的實驗現象展現在學生面前的,對照實驗現象的分析以及由此得到的結論也是學生親自體驗并自行完成的。
[實驗Ⅲ]①展示一倒置燒瓶(告知學生:這是課前制得的一滿瓶飽和氯水,倒立水槽中并在陽光直射下二小時以上)。②將燒瓶中溶液取出,分別滴加到硝酸銀溶液、藍色石蕊試紙、CaCO3粉末中,觀察發生的現象。
[問題Ⅲ]①倒置的燒瓶底部有一較大的無色氣泡,通過觀色確定不是氯氣,則可能是什么氣體?如何驗證你的推測?②中的現象表明溶液中含有Cl-、H+,還有其他物質存在,它能使藍色石蕊試紙褪色,可與CaCO3反應,這些物質可能是什么?如何證明你的猜測?
事實上問題②的提出是在原有問題基礎上的再深化,是為深入探究HClO的強氧化性、漂白性和酸性弱于H2CO3而設計的。那么怎樣檢出氯水中加入CaCO3后HClO的濃度提高了呢?這是整個實驗設計中比較困難的部分。可以啟發學生設計對比實驗加以驗證:理論上可以將新制氯水和加入了CaCO3粉末后的新制氯水,同時在陽光下照射,觀察其冒氣泡的快慢程度,進而推斷出HCl、H2CO3、HClO三者的相對強弱。但現象的對比會因光照強度、觀察環境、等待時間等因素的不同而存在一定的不確定性。討論以上問題時學生或熱烈或冷場,作為老師要時刻關注并積極調控學生的情緒。
另一思路是,借助傳感器(這要視學校條件而定),引出如下“可視化”的實驗:
[實驗Ⅳ]用兩只小燒杯,取新制飽和氯水25mL,一支加入2g左右的CaCO3粉末后,攪拌靜置,一支不作變化。連接好電腦與H+濃度傳感器,分別測定溶液中c(H+),投影測定曲線。結果表明與CaCO3反應消耗了溶液中大量的H+;再換成檢測HClO含量的余氯傳感器(煙臺東潤儀表有限公司DRCL-99 極譜型余氯檢測儀),結果表明加CaCO3的試管中HClO的濃度增大了。
[問題Ⅳ]上述實驗的結論說明什么?為何消耗了酸反而換來了HClO濃度的增大?
實驗設計和問題討論目標明確,指向的都是氯氣性質的核心知識點,作為“氯氣的性質”的教學,其主要的核心內容在本設計中幾乎都得以體現,而且現象與結果直觀可靠。
3. “實驗化教學“效果
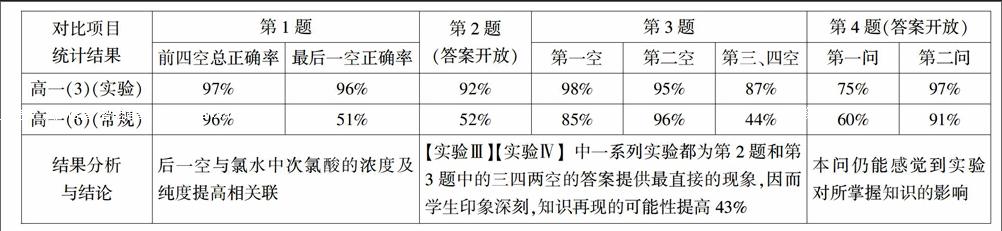
課后一周,筆者在所教的兩個平行班(“實驗化教學”班與“常規教學”班)做過一次比較性小測試(4大題共50分限于篇幅,此處不再列出題目)結果如下:
對比實驗與采集的數據(數據4舍5入全部取整)如下:
數據表明,將元素單質或化合物呈現的某些性質巧妙地設計成表征性、驗證性或探究性實驗,對元素化學的學習來說,其作用和效果都是不錯的。
三、實驗設計的原則
上述實驗設計對于“氮的氧化物、氫化物(氨氣)及其鹽、氮的含氧酸及其鹽”;“硫的氧化物、氫化物、含氧酸(硫酸、亞硫酸等)”的教學也有一定借鑒作用,關于元素化學“實驗化教學”中的實驗設計須注意如下幾點:
(1)要根據所學元素的知識,認真思考實驗設計的內容,實驗現象呈現的先后和所要達成的實驗教學目標,切忌僅僅為了熱鬧好玩吸引學生眼球而進行實驗和問題設計。
(2)由于實驗過程的現象綜合而復雜,除在實驗及課程的設計上要認真謀劃外,對可能會耗時較多的實驗,可做前期的準備工作,例如先配好溶液,搭好裝置等;實驗現象展示時應該盡可能將現象完整明顯地呈現給每位同學,以便學生通過現象,依據創設的問題去尋找結論或結果。
(3)根據不同元素的特點,還可以進行分組實驗,采用“微型化”實驗等,讓學生參與其中,既給了學生更清晰的實驗現象,又在大大滿足學生的參與欲望的同時,提升其動手能力。
(4)課堂上能通過實驗解決說明的問題,那就少講或不講,能做的實驗就不要以實驗視頻代替,能親自體驗實驗就不必以課本結論為據……總之要將“實驗化”充分發揮、充分挖掘!
四、課堂實踐的點滴反思
“實驗化教學”在學生掌握與記憶“元素化學”知識時是有優勢的,常言道“百聞不如一見”也說明了這一點。同時“實驗化教學”對于提升學生觀察能力、思維能力、思維的品質皆有其優勢,如此,就值得去推行去嘗試,因為“教育就是生長,其本質是人的發展,也就是說,教育的過程就是發掘人的天性、潛能以及潛在價值的過程[4]。”
“實驗化教學”的優點是在提高學生的學習興趣的同時,可以將整個元素及化合物的知識巧妙地穿插在所設計的實驗中,讓學習者去觀察、發現、分析、討論、概括直至進行探究性嘗試,培養學生多渠道獲取知識及信息加工的能力,讓學生逐步掌握學習元素化合物知識的一般方法,這正是“實驗化教學”的優勢所在[5]。
參考文獻
[1] 人民教育出版社課程教材研究所化學課程教材開發中心.普通高中課程標準教科書·化學1(必修) 教師教學用書[M].北京:人民教育出版社,2007:38-43
[2] 江蘇省教育考試院. 2013江蘇省普通高中學業水平測試(選修科目)說明[M].南京:江蘇教育出版社,2013:32
[3] 北京師范大學,華中師范大學,南京師范大學無機化學教研室.無機化學下冊[M].北京:高等教育出版社,2003:456
[4] 林格. 教育是一種大智慧 [M].北京:清華大學出版社,2007
[5] 李虎山.“金屬元素及其化合物”的“實驗化教學”方法初探[J]. 化學教與學,2014(12):33~34,46

