GPC結合超高效液相色譜-串聯質譜法測定韭菜中50種農藥殘留
徐 晶張海霞蒲國鋒楊 靜
(1.哈爾濱市農產品質量安全檢驗檢測中心 黑龍江·哈爾濱 150070)(2.黑龍江省農業科學院大豆所 黑龍江·哈爾濱 150000)
■試驗報告■
GPC結合超高效液相色譜-串聯質譜法測定韭菜中50種農藥殘留
徐 晶1張海霞1蒲國鋒2楊 靜1
(1.哈爾濱市農產品質量安全檢驗檢測中心 黑龍江·哈爾濱 150070)(2.黑龍江省農業科學院大豆所 黑龍江·哈爾濱 150000)
利用GPC結合超高效液相色譜-串聯質譜(UPLC-MS/MS)檢測韭菜中50種農藥殘留。樣品用1%乙酸乙腈震蕩提取,經凝膠色譜凈化,收集9~21min的流出液,在線濃縮近干并用乙腈∶水(1∶3)溶解定容至2m1,收集于2m1樣品瓶中,過0.22μm濾膜,以Waters BEH C18色譜柱分離,采用多反應檢測模式進行檢測,外標法定量。加標水平為0.05mg/kg和0.1mg/kg時,回收率在65.2%~102.1%之間,相對標準偏差小于20%。農藥在線性范圍內相關系數均大于0.99。方法具有提取效率高,凈化效果好,準確度高、靈敏等優點,適用于韭菜中多農藥殘留檢測。
韭菜;凝膠滲透色譜;超高效液相色譜-串聯質譜;農藥殘留檢測
韭菜是最常見的綠葉蔬菜之一,其高水分,低熱量,富含維生素、粗纖維及硫化物,不但具有很好的營養價值,還具有一定的藥用價值,在我國的栽培區域極廣。但由于韭菜在種植過程中違規使用高毒農藥、不遵守農藥安全間隔期等原因,使韭菜中農藥殘留問題較大,消費者因為食用殘留農藥的韭菜引發食物中毒的事件頻頻發生[1]。
韭菜的基質十分復雜,在其農藥殘留檢測過程中,傳統的樣品前處理技術不易實現基質成分的有效凈化,導致在目標殘留化合物的檢測分析時產生嚴重的基質干擾現象,影響測定結果的準確性。陳建航等[2]采用微波加熱處理,使酶鈍化減少打擾,檢測姜、韭菜中的農藥殘留,但在加熱過程中會使熱不穩定的農藥降解。應興華[3]等用乙腈提取后,直接用氣相色譜檢測韭菜中的有機磷農藥,提取后不凈化,會污染色譜柱及檢測器,并且雜質干擾較多,易產生假陽性。徐宜宏[4]等采用QuEchERS方檢測了韭菜中的34中農藥殘留,C18、PSA能去除糖等雜質,但去除色素的效果不好,石墨化碳黑能去除色素,但對具有平面結構的化合物如等農藥有吸附。
凝膠滲透色譜能很好的去除基質中潛在的干擾目標化合物分析的油脂、色素、生物堿等大分子化合物,并已經在農藥殘留中得到了廣泛的應用[5]。歐盟標委會技術委員會的農藥殘留測定標準(TC275)和日本厚生勞動省的農藥殘留分析都采用了GPC法[6-7]。本方法通過在線凝膠滲透色譜對樣品凈化,液相色譜-串
徐晶,女,職稱:高級農藝師。 Emai1:xj_hrb@126.com聯質譜進行分析,檢測韭菜中的農藥殘留。
1 試驗部分
1.1 儀器、試劑與樣品
供試樣品韭菜,購自當地超市。
超高效液相色譜-串聯四級桿質譜聯用儀Waters Acquity UPLC–TQD(美國Waters公司),配有電噴霧離子源;凝膠滲透色譜儀FREE STYLE GPC+EVA(德國Lctech);Milli-Q高純水發生器(美國Millipore公司);往復式震蕩器(IKA);高速離心機(Sigma);渦旋振蕩器(IKA);氮吹儀(美國Organomation);電子天平(感量0.01g);乙腈、乙酸、氯化鈉、醋酸鈉、無水硫酸鎂優級純(科密歐);乙腈、甲醇色譜純(美國Fisher公司);環己烷、乙酸乙酯色譜純(科密歐);供試農藥標準品濃度為100ug/mL,購自農業部環境保護科研檢測所。
1.2 試驗方法
1.2.1 樣品的提取
稱取粉碎的樣品15g(精確到0.01g)置于50mL離心管中,依次加入15mL1%的乙酸乙睛,1.5g醋酸鈉,6g無水硫酸鎂,2顆玻璃珠,渦混1~2min,往復式振蕩器上震蕩30min后,5000r/min離心10min,取2.4mL乙腈層,氮吹至小于1.0mL后用環己烷:乙酸乙酯(1∶1)定容至6mL,供凝膠色譜凈化。
1.2.2 凝膠色譜凈化
凝膠色譜柱填料為Bio-Beads S-X,玻璃柱(300mm×20mm),體積比為1∶1的乙酸乙酯-環己烷溶液作為流動相,流速為4.5mL/ min,進樣量5mL,前棄9min,收集9~21min樣品,后棄5min,收集液在線旋蒸近干并用乙腈∶水(1∶3)溶解定容至2mL,收集于2mL樣品瓶,過0.22μm濾膜,供液用質聯儀分析檢測。
1.3 儀器條件
1.3.1 超高效液相色譜條件
色譜柱:WatersACQUITY UPLC BEH C18柱(1.7μm,2.1x100 mm );柱溫:35℃;進樣體積:5μL;流速:0.3mL/min;流動相1∶A為乙腈,流動相B為0.1%甲酸溶液,流動相2∶A為甲醇,B為5mmol乙酸銨,洗脫程序(見表1)。

表1 兩種不同流動相洗脫程序
1.3.2 質譜條件
離子源:電噴霧電離源(ESI);源溫度:110℃;毛細管電壓:0.5kV;脫溶劑溫度:400℃;脫溶劑氣流速(N2):800L/h;錐孔氣速:50L/h。采用MRM多反應檢測模式。
2 結果與討論
2.1 提取方法
王連珠等[8]在蔬菜QuEChERS提取方法中對比了了加緩沖鹽和不加緩沖鹽兩種提取方法對66種有機磷農藥的提取效果,結果表明加緩沖鹽的提取效果好,尤其是對pH敏感的有機磷類農藥的提取效率高。本試驗提取過程中在提取液1%的乙酸乙睛中加醋酸鈉緩沖鹽以保證對pH敏感的農藥提取率。試驗過程中發現,先加入無水硫酸鎂會產生結塊,把農藥包裹在結塊里,不利于農藥的提取,應在提取液中先加乙酸鈉搖勻后再加無水硫酸鎂,防止產生結塊。
2.2 GPC方法的優化
韭菜中的硫化物和葉綠素含量高,本試驗采用GPC凈化的方式去除這些雜質。這50種農藥的分子量在141~434之間,差距較大,需要通過試驗來優化GPC的收集時間。用環己烷∶乙酸乙酯(1∶1)配濃度為1.5μg/mL標準品,進樣體積為5mL,從第6min開始,每兩分鐘接收一瓶,共接收10瓶,氮吹至干,流動相溶解,超高效液相色譜-串聯質譜儀檢測。檢測結果表明,這50種農藥的流出時間主要集中在9~21min,但在9min時收集流出液還有少量色素的殘留,收集液呈透明淺黃色,若收集時間在10~21min時,葉綠素能去除干凈,但這樣小分子量的農藥如甲胺磷的回收率會降低。所以本試驗選擇收集9~21min的流出液,收集液在線旋蒸并用乙腈∶水(1∶3)溶解定容至2mL,收集于進樣瓶中。
2.3 液相方法的優化
試驗進樣0.1μg/mL的混合標準品,對甲醇-5mmol/L乙酸銨、乙腈-0.1%甲酸體系的流動相和不同梯度洗脫程序進行優化。結果表明,不同的農藥在這兩種流動相體系中的電離情況不同,儀器響應值不同,選出6種在兩個體系中電離差異大的農藥進行對比,見圖1。根據不同農藥的具體電離情況及出峰時間把這50種標品分為兩組,具體見表2;圖2,圖3為這兩組標品的總離子流圖。

圖1 6種不同種類相同濃度的標準品在兩種流動相體系中的響應值

圖2 第一組混合標準品總離子流圖

圖3 第二組混合標準品總離子流圖
2.4 質譜方法的優化
以流動注射方式,對50種農藥的單一標準溶液進行母離子全掃描,再對其子離子全掃描,每個化合物選擇2對響應值高的特征離子對作為定量及定性離子對進行MRM參數優化,優化的質譜參數(見表2)。

表250 種農藥標品多反應監測掃描模式(MRM)的質譜參數
2.5 方法的線性、回收率和精密度
為了消除基質效應對定量結果造成的影響,以不含待測物的空白樣品為基質液,配制成基質標準溶液,濃度分別為10、20、50、100、150、200、300、400、500μg/kg,進行方法線性的測定。以待檢參數的的面積為(y)為縱坐標,質量濃度(x,mg/L)為橫坐標,建立標準曲線,得到線性回歸方程。線性范圍及相關系數見表3。
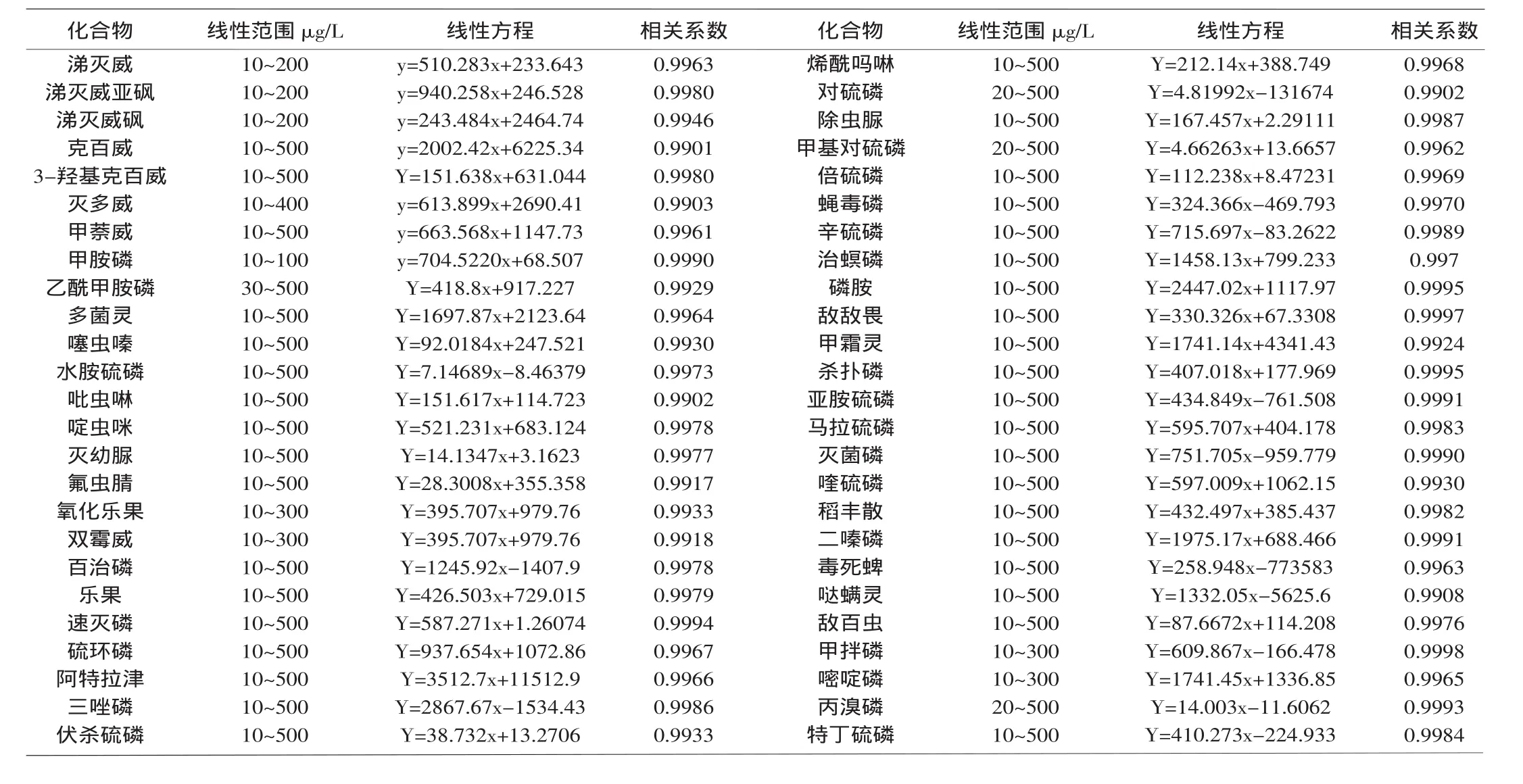
表3 50種農藥的線性范圍、線性方程及相關系數
2.6 方法的回收率、精密度及定量限
在樣品中添加50、100μg/kg=2個水平的標品,每個水平重復6次,按照1.2的試驗方法進行處理,計算法的回收率和精密度。該法在這兩個添加水平上的回收率范圍在65.2%~102.1%,方法精密度的范圍在0.9%~8.7%之間,具體數值見表4。以S/N=10為定量限,不同農藥的定量限范圍為0.8~15μg/kg,完全可以滿足韭菜中農藥殘留檢測的需要。

表4 方法的添加回收率和精密度(n=6)
3 結論
液質質的MRM多反應監測對于分析復雜基質的抗干擾能力強,但樣品前處理不干凈,會嚴重的污染液相色譜柱和質譜檢測器,并會增大基質效應,影響檢測結果。凝膠滲透系統根據化合物的流出時間不同,能夠很好的祛除韭菜中的葉綠素等大分子雜質,降低基質干擾,提高檢測的準確度。并且GPC系統能自動的完成凈化、濃縮、復溶等過程,減少人力,提高了工作效率。每個化合物性質不同,在不同溶液中的帶電能力不同,把待測農藥分成兩組,用不同的流動相進行分析,提高了方法的檢出限。該方法能滿足韭菜中農藥殘留的檢測。
[1]王文嬌,張濤,等.韭菜農藥殘留現狀及防控技術.山東農藥科學,2011,10:82-84.
[2]陳建航,葉瑜霏,等.分散固相萃取-氣相色譜-質譜聯用法檢測蔥、韭菜和姜中多種農藥殘留.質譜學報,2011,6:341-348.
[3]應興華,徐霞,等.毛細管氣相色譜法測定韭菜中13種有機磷農藥殘留的研究.分析測試學報,2009,10:1185-1188.
[4]徐宜宏,蔣施,等.韭菜中34種農藥殘留同時檢測的氣相色譜-串聯質譜確證方法.農藥,2012,11:825-828.
[5]LIUL B,HASHI Y,QIN Y P.Development of automated online gel permeation chromatographygas chromatograph mass spectrometry for measuring multiresidual pesticides in agricultural products[J].Journal of Chromatography B,2007,845(1):61-68.
[6]SCHENZLER C,THEIR H P.European standardization of methods for pesticide residue analysis in foods-current status[J].Food Additives and Contaminants,2001,1(10):875-879.
[7]Director Notice of Ministry of Health,Labour and Welfare,Japan. Analytical methods for residual compositional substances of agricultural chemicals,feed additives.andveterinarydrugsinfood[S].Syoku-AnNo.0124001,2005,FinalamendmentsweremadeonMay26,2006.
[8]王連珠,周昱,陳泳.QuEChERS樣品前處理-液相色譜-串聯質譜法測定蔬菜中66種有機磷農藥殘留量方法評估[J].色譜2012,30(2):146-153.
Determination of 50 Pesticide Residues in Leafy Greens by QuEChERS-GPC-UPLC-MS/MS
Xujing Zhanghaixia Puguofeng Yangjing
(Harbin Examing and Inspection Center for Agricultural Products Safety and Quality,Harbin 150070,China)(Heilongjiang Academy of Agricultural Sciences,Harbin,150000,China)
This paper describes using the method of GPC combined with ultra performance liquid chromatography tandem mass spectrometry(UPLC-MS/MS)to detect 50 kinds of pesticide residues in Chinese chives.The samples were extracted with 1%acid acetonitrile,and purified by gel.And then collect 9~21min the outflow;concentrate the outflow to dry and keep the residue;use acetonitrile∶water(1∶3)to dissolve the residue in a constant volume to 2ml;filter the liquid by 0.22μm membrane into a sample bottle.Separate the sample with the Waters BEH C18 chromatographic column.Then the multiple reaction detection mode was used for the detection,and the external standard method was used for quantification.The recovery rate was between 65.2%~102.1,when the spiked levels are 0.05mg/kg and 0.1mg/kg,with RSD less than 20%.The correlation coefficient of pesticide in the linear range was more than 0.99.The method has the advantages of high extraction efficiency,good purification effect,high accuracy,and high sensitive and so on.It is suitable for the detection of pesticide residues in Chinese chives.
Chinese chives;gel permeation chromatography;ultra performance liquid chromatography tandem mass spectrometry;pesticide residue detection
10.16627 /j.cnki.cn22-1215/s.2016.10.018

