微流控技術應用于細胞分析的研究進展
莊琪琛 寧芮之 麻遠 林金明 ??

摘 要 微流控技術由于其固有的優勢已發展成為細胞分析中一個強有力的工具。本文從微流控芯片上的細胞培養、細胞微環境的模擬和控制、單細胞分析、芯片器官以及微流控芯片與質譜聯用技術等方面對微流控技術在細胞分析研究中的應用進展進行了介紹,并對這一技術的發展前景進行了總結和展望,希望能為相關研究的開展提供啟發。
關鍵詞 微流控芯片;細胞培養;微環境;單細胞;芯片器官;微流控芯片質譜聯用技術;細胞分析; 綜述
1 引 言
微流控是一門研究如何在微米和亞微米尺度下控制微小流體和顆粒的科學,同時也是為實現上述目標而誕生的多種技術的總稱。微流控最早起源于20世紀90年代,當時人們認識到微電子加工技術可以應用于加工制作微型色譜和毛細管電泳裝置,并且具有顛覆傳統實驗室分析方法的應用前景[1]。與傳統實驗室分析方法相比,微流控技術具有樣品消耗量小、分析速度快、自動化程度高、微型化、易于集成等優勢[2]。尤其是其強大的集成能力,使得包括反應、前處理、檢測等實驗流程都能夠集成到一個微流控系統中完成。
在微流控技術的眾多應用中,人們更加關注其在生命科學領域尤其是細胞分析領域所能發揮的作用,例如細胞細胞共培養和相互作用、體外細胞微環境的構建和模擬、單細胞操控和分析以及芯片器官等。除上述優勢滿足了生命科學對細胞等生物樣品進行更高效、更靈敏、更快速分離分析的需求外,微流控系統特征長度的尺度與細胞和其他微生物實體的大小相稱,更有利于對少量細胞甚至是單個細胞的操控和分析。而且,大多數生物體系中都會涉及到微米甚至納米尺度下的物質或信號傳遞,特別是在細胞細胞間相互作用及通訊中,這使得能夠應用微流控技術在體外有效模擬細胞微環境尤其是模擬可溶性因子所構成的微環境[3]。系統比表面積與其特征長度成反比意味著在微流控系統中,傳熱和傳質等過程被大大加強,一些在宏觀維度下通常不會遇到的物理化學界面現象也能夠利用微流控平臺進行研究。而且,在微小尺度下物質的分離也能夠更快速更有效的進行。
本文將從微流控芯片上的細胞培養、細胞微環境的模擬和控制、單細胞分析、芯片器官以及微流控芯片質譜聯用技術等方面對微流控技術在細胞分析研究中的應用進展進行介紹。
2 微流控芯片上的細胞培養
對細胞進行培養是在體外開展細胞研究的基礎。目前,微流控芯片上的細胞培養方式有二維(2D)和三維(3D)兩種培養方式。
微流控芯片上2D培養與將細胞培養于培養皿或培養瓶中相似,一般都是細胞貼壁于剛性的2D基底(例如玻璃的表面)上,從細胞上方流過培養基等液體來為細胞提供營養物質、沖走代謝廢物或者提供藥物刺激等[4,5]。而在將細胞2D培養前,一般會對芯片通道進行表面處理,改善其親水性以利于細胞貼壁生長,常用的修飾試劑有多聚賴氨酸(PolyLlysine,PLL)[6]、膠原蛋白[7]等。PLL為多聚陽離子化合物,而細胞表面帶負電荷,使用PLL修飾微通道表面后通過正負電荷的吸引作用促進細胞的貼壁和生長。Gao等[8]利用0.1% PLL溶液對細胞培養室的玻璃表面進行修飾后進行細胞的接種、培養和藥物刺激(圖1),A549細胞在該細胞培養室中能保持至少5天的活性。在該工作中,Gao等利用聚乙烯管將細胞培養室與填充有固相萃取材料的功能單元連接起來,并與電噴霧四極桿飛行時間質譜(ESIQTOFMS)直接聯用實現了對A549細胞對維生素E代謝的研究。Liu等[9]構建了一種微透析紙噴霧離子化質譜的一體化平臺用于細胞培養的在線化學監控。在該工作中,頻率和大小可控的液滴在微透析后產生并通過質譜進行檢測和分析。但是,這種直接在細胞培養上方流過培養基的培養方式所產生的流體剪切力會對細胞的正常生長產生影響[10~12]。Lecault等[13]開發了一種等滲灌注微流控細胞培養陣列實現了低剪切力條件下的細胞連續培養。
(A)芯片上2D細胞培養和固相微萃取單元的示意圖。(B)2D細胞培養單元的尺寸,接種細胞前使用0.1% PLL修飾玻璃基底。(C)固相微萃取單元的尺寸。(D)微流控芯片裝置的實物圖。
(A) Schematics of one unit for cell culture and sample pretreatment prior to ESIQTOFMS detection. (B) Dimensions of cell culture channel, precoated by 0.1% PolyLlysine (PLL) before cells seeded on the glass substrate. (C) Dimensions of microSPE column. (D) An image of microfluidic device.
芯片上2D培養的優勢在于操作簡單并易于實現,但2D培養的細胞環境與體內細胞所處的3D環境相差較大,因而細胞對藥物刺激等的反應有可能不能反映體內的真實情況。針對2D培養的上述缺陷,微流控芯片上細胞的3D培養得到了越來越多的關注。微芯片中細胞的3D培養最常用的策略是將細胞培養在自然或合成的各種模擬細胞外基質(Extra cellular matrix,ECM)的材料中,例如基質膠(Matrigel)[14]、膠原蛋白(Collagen)[15]和水凝膠(Hydrogel)[16~18]等。Wu等[19]利用瓊脂糖凝膠成功開發出一個基于模擬血管和組織間擴散過程的三維培養微流控芯片用于量子點的細胞毒性分析(圖2A)。Wu等在此3D微流控平臺上模擬了血管與組織間的擴散作用,證明了細胞自吞噬是導致量子點細胞毒性的原因之一,為在更精確的微環境下研究量子點細胞毒性開拓了新的思路。除此之外,水凝膠以外的材料用于細胞3D培養的方法也有報道[20~22]。Toh等[23]通過在微流控芯片上集成微柱結構實現了芯片上的3D細胞培養,并成功保持了肝細胞正常的解毒功能(圖2B)。
圖2 微流控芯片上的3D細胞培養。(A)3D培養微流控芯片模擬血管和組織間擴散過程來分析量子點的細胞毒性[19]。(B)用于藥物毒性測試的3D微流控肝細胞芯片[23]
Fig.2 3D cell culture on microfluidic chips. (A) Cytotoxicity of quantum dots assay on a microfluidic 3Dculture device based on modeling diffusion process between blood vessels and tissues[19]. (B) A microfluidic 3D hepatocyte chip for drug toxicity testing[23]
細胞細胞間相互作用的研究在組織工程、腫瘤生長和轉移以及揭示癌癥等疾病的機理等方面都有著重要作用。在體內,細胞細胞間的相互作用通過細胞細胞間的直接接觸或者可溶性因子的交換而頻繁發生。微流控技術為研究細胞細胞共培養提供了更為靈活可靠的方式,能夠在體外模擬細胞細胞間通過可溶性信號或者直接接觸的相互作用。目前常采用膠原蛋白軌道[24,25]、半透膜[26]、聚二甲基硅氧烷(PDMS)多孔薄膜[27,28]、聚碳酸酯(PC)多孔薄膜[29]以及表面張力栓等[30,31]將微流控芯片在空間上分為幾個區域來分別培養不同類型的細胞以開展芯片上細胞細胞間相互作用的研究。Wong等[25]將包含細胞的基質膠流過一個多入口的微通道,借助層流作用利用一個或多個水凝膠微板將微通道分隔為幾個子通道從而構造了一個可調的3D共培養系統。Wei等[32]使用具有高度差的微通道實現了PC12細胞和GH3細胞的共培養,并與質譜聯用對神經元調節垂體細胞分泌生長激素的行為進行了定性和定量的研究。Chen等[28]將小鼠胚胎干(mES)細胞和飼養層細胞技術性地分別培養于PDMS多孔膜的兩側,并保持了飼養層細胞較好的增殖狀態和細胞活性,同時維持了mES細胞的自我更新和未分化潛能。該工作與常規干細胞培養方法相比,不需要對飼養層細胞進行滅活以及無需進一步地純化就能夠直接獲取高純度的胚胎干細胞。Zhuang等[29]通過集成聚碳酸酯多孔膜的雙層通道微芯片裝置模擬了神經細胞腎細胞的相互作用(圖3A)。Mao等[30]則首次在微流控芯片上集成了“表面張力栓”控制和模擬了肝臟在腎上腺素的作用下將肝糖原分解為葡萄糖并釋放到血液中的過程。將該集成表面張力栓的微芯片與ESIQTOFMS聯用成功檢測到了信號分子腎上腺素和細胞通訊的最終代謝物葡萄糖(圖3B)。
圖3 用于細胞細胞間相互作用研究的微流控芯片平臺。(A)集成聚碳酸酯多孔膜的微流控芯片研究神經細胞腎細胞相互作用[29]。(B)集成表面張力栓的微流控芯片研究腎細胞肝細胞的相互作用[30]
Fig.3 Microfluidic platform for cellcell interaction study. (A)Nephrocyteneurocyte interaction on polycarbonatemembrane integrated microfluidic device[29]. (B)Nephrocytehepatocyte interaction on surface tension plug integrated microfluidic device[30]
3 微流控芯片上細胞微環境的模擬和控制
在體內,細胞的微環境由復雜的化學和機械力因素組成,包括特定的物理化學性質(氧含量、溫度、pH和滲透壓等)、可溶性因子、細胞間接觸和細胞基質間相互作用等[33]。在體內,細胞所處的微環境是動態變化的。微流控芯片上細胞培養的一大優勢就在于能夠在微尺度上控制細胞所處的微環境。
在藥物篩選的研究中,微流控技術能夠通過結構設計產生濃度梯度來滿足進行系列濃度的平行實驗的需求。微芯片上產生濃度梯度最經典的設計是“圣誕樹形”結構,該設計利用兩種液體的層流作用進行混合進而產生濃度梯度[34,35]。Gao等[36]通過集成“圣誕樹形”濃度梯度發生裝置的微流控芯片平臺實現了高通量的細胞毒性測試、藥物吸收和代謝物的同時表征。近年來,陸續開發了一些產生濃度梯度的方法。Chen等[37]開發出一種用于細胞培養和藥物篩選中濃度梯度生成的微流網絡混合通道。該微流網絡混合通道的混合過程是上下混合流所產生的,這比直通道對于藥物的混合效果要更好。針對質譜只能半定量的缺點,Chen等在該工作中使用了同位素內標法,不僅擴大了芯片上質譜檢測的線性范圍而且提高了線性指數,真正實現了芯片質譜(ChipMS)聯用對細胞代謝物的定性和定量檢測。Scherber等[38]則在芯片上觀察了內皮細胞根據內皮生長因子(EGF)的梯度在微流控芯片迷宮中“感知”路徑。
缺氧環境能夠促進腫瘤的生長、侵襲和轉移,因此,模擬和研究體內缺氧微環境對腫瘤發展的影響是腫瘤研究的一大熱點[39]。Wang等[40]在微流控芯片上設計產生了O2分子的濃度梯度,并研究了動態缺氧環境下細胞對藥物刺激的反應。而Lin等[41]則利用一個集成化的雙層微流控芯片模擬了腫瘤細胞體內氧濃度梯度的微環境,并通過在芯片通道的兩層固定核酸適配體,實現了血管內皮生長因子165(VEGF165)的在線檢測(圖4)。此外,他們在該工作中還研究了不同距離對內皮細胞腫瘤細胞間相互作用的影響,以及不同的氧濃度梯度微環境對細胞遷移的影響,深入探索了腫瘤血管新生的信號通路以及細胞遷移行為,為宮頸癌的發生發展研究提供了重要實驗數據支持。
圖4 在氧梯度下進行細胞共培養的集成化微芯片裝置[41]。(A)氧氣能夠影響細胞細胞間通訊并促進細胞遷移。(B)該集成化微芯片裝置的示意圖。(C)芯片上集成的微閥。(D)在低氧條件下共培養細胞的雙層微通道截面圖。(E)利用核酸適配體檢測VEGF165的示意圖。(F)微芯片的實物圖
Fig.4 Integrated microfluidic device for cell coculture under oxygen gradient system[41]. (A) Oxygen effects cellcell communication and promotes cell migration. (B) Schematic diagrams of integrated microfluidic device. (C) Micro valve integrated on the microchip. (D) Twolayer microfluidic channel for cells coculture under low oxygen conditions. (E) Schematic illustration for determination VEGF165 based on nucleic acid aptamer. (F) Actual microfluidic device
細胞密度的差異會引起細胞間基質、自分泌或旁分泌的細胞因子局部濃度的不同,從而會導致不同的細胞反應。因此,細胞密度在一定程度上影響著細胞細胞間相互作用,進而影響生物體內相關組織的功能[42]。Wu等[43]設計了一種精確性好、重復性高的微流控方法用于細胞密度梯度的產生。在該工作中,通過控制通道中微坑的個數就能夠調控細胞密度,細胞密度隨著微坑個數的增加而增加,而且所產生的細胞密度梯度與理論計算值一致。他們利用此微芯片裝置考察了不同細胞密度下量子點的細胞毒性,發現量子點在高細胞密度條件下比低細胞密度條件下表現出較低的細胞毒性。
此外,微流控技術對細胞微環境的控制已被用來闡明一些關鍵蛋白在諸如成纖維細胞的趨化性[44]和趨電性[45]等細胞行為中的作用。微流控芯片還被用來闡釋一些蛋白的功能,如在炎癥反應里中性粒細胞粘附過程中選擇素的作用[46]。微流控芯片平臺也被報道通過調節細胞微環境來研究旁分泌和自分泌信號。例如,使用微流控流體減少小鼠胚胎干(mES)細胞分泌因子的濃度為深入研究信號分子的動態變化和干細胞分化提供了有價值的手段[47,48]。
4 微流控芯片上的單細胞分析
目前的研究表明,單個細胞之間存在著顯著的差異性。開發單細胞的操縱、篩選以及分析方法,研究細胞的異質性,對于疾病診斷、藥物篩選等方面都具有十分重要的意義。微流控技術具有能夠精確操控小體積樣品的優勢,因此在操縱單個細胞融合、轉染、染色、分選、測序等研究中有著廣泛的應用前景[49]。
細胞分選和捕獲技術已被應用來研究完整的單細胞或分析裂解的單細胞中的內容物。微流控技術起源于集成電路芯片的制作,由此通過設計各種微結構實現了細胞分選和捕獲 [52,53]。Chen等[50]則開發了一種新型的基于核酸適配體的微坑陣列來實現單細胞的特異性捕獲(圖5A)。該工作中具有三維形貌的微坑結構加強了細胞與微坑表面的核酸適配體之間的相互作用,使得單細胞占有率高達88.2%。利用這種對單細胞具有特異性的捕獲技術實現了從復雜細胞樣品中獲得靶向單細胞陣列,并進一步進行了單細胞水平上的酶反應動力學分析,揭示了單細胞水平上細胞代謝的差異性。Chen等所使用的微坑陣列是由濕法刻蝕法獲得的,而Liu等[51]則在玻璃基底表面利用聚苯乙烯微球的自組裝制作出了PDMS微坑陣列(圖5B)。這種制作微坑的方法與濕法刻蝕法相比,操作更加簡捷,而且所使用的試劑對環境的危害也更小,更符合綠色化學的原則。Mach等[54]開發了一種芯片離心機(Centrifugeonachip),利用流體的渦流進行細胞分選,并與后續的樣品濃縮、染色和清洗等處理操作集成在一起。而Wang等[55]將微流控技術與化學發光技術相結合,建立了一種將單細胞分散在油相包圍的水相液滴中并進行培養和分析的高通量方法。利用該方法可以實現從104個細胞中篩選出唯一一個過量消耗木糖的釀酒酵母細胞,并分析確定導致木糖高消耗的基因組變化。
圖5 微流控芯片上的單細胞分析:(A)微流控芯片上核酸適配體修飾的微坑陣列用于單細胞特異性捕獲及酶動力學分析[50];(B)利用聚苯乙烯微球自組裝制作微坑陣列進行高通量的單細胞分析[51]
Fig.5 Single cell analysis on microfluidic chips: (A) Target isolation and analysis of single tumor cells with aptamerencoded microwell array on microfluidic device[50];(B) Fabrication of microwell arrays based on twodimensional ordered polystyrene microspheres for highthroughput single cell analysis[51]
隨著微流控技術的不斷發展,單細胞分析也將得到更好的發展和應用,也將更清晰的揭示被細胞群體性研究所掩蓋的細胞異質性。
5 芯片器官
近年來,細胞生物學、精密加工和微流控技術的發展使得模擬和開發芯片器官的研究得到迅速的發展,芯片器官能夠為臨床化驗提供更強大的預測能力。Huh等[56]實現了在芯片上模擬器官水平的肺功能(圖6A)。該仿生微系統的核心部分是一個PDMS多孔薄膜,人肺泡上皮細胞和人肺微血管內皮細胞被分別培養在PDMS多孔薄膜的兩側成功構建了功能化的人肺肺泡毛細血管界面。由于PDMS多孔薄膜具有彈性,將該微芯片裝置與編程控制的真空聯用能夠成功模擬肺的呼吸運動,并研究了該條件下兩種細胞對納米顆粒的吸入量。近年來,在微流控芯片上模擬血管生成和心血管系統得到了極大地關注。Yeon等[57]通過在纖維蛋白凝膠的任意一側培養人臍帶靜脈內皮細胞(HUVECs)實現了芯片上誘導毛細血管的生成。而Miller等[58]則報道在內皮細胞培養中加入可降解的玻璃纖維能夠更好地模擬血管網絡。Song等[59]研究了間隙滲流、血管內皮生長因子梯度和剪切力對內皮細胞在膠原蛋白基質中出芽生長的影響。其它一些心血管芯片器官系統則研究了心肌細胞對電的和機械力刺激的反應。例如,Ma等[60]在一個多電極陣列生物芯片平臺上構造了心肌并成功監測了干細胞橋接心肌細胞過程中的導電性,該因素是成功移植干細胞治療局部缺血或梗塞的關鍵因素(圖6B)。而Grosberg等[61]則將心肌細胞培養在彈性膜上,成功監測了心肌細胞收縮過程中的應力變化。
圖6 芯片器官。(A)在芯片上重構器官水平的肺功能[56]。(B)在多電極陣列生物芯片平臺上構造了心肌并成功監測了干細胞橋接心肌細胞過程中的導電性[60]
Fig.6 Organonachip. (A) Reconstituting organlevel lung functions on a chip[56]. (B) Constructing cardiac muscle on a multielectrode arraybased biochip and successfully measuring the electrical conductivity of stem cells bridging cardiomyocytes[60]
6 微流控芯片質譜聯用技術
在眾多分離檢測方法中,微流控芯片、電泳化學發光、激光誘導熒光和電化學檢測等作為最早被使用的技術得到了廣泛的應用和發展,但主要被用于分離或者檢測已知或者種類較少的目標分子[62,63]。Lin等[64]通過將聚合酶鏈式反應(PCR)和微芯片毛細管電泳技術(MCE)結合,實現了多元迷你短串聯重復序列(miniSTR)位點的快速靈敏檢測。在最優條件下,僅0.001 ng DNA模板便足夠產生miniSTR,且15種miniSTR尺寸的相對標準偏差為0.49 %~4.41%,濃溶液為0.94%~4.95%。同時,由于這種miniSTR檢測技術在對實際樣品的檢測下證實具有可靠性,在刑事鑒定和親子鑒定方面具有巨大潛力。Yi等[65]也使用類似的技術實現了對11種人乳頭瘤病毒(HPV)的高靈敏和精確的分型檢測,檢出限為200 copies,且對臨床樣品也具有檢出可靠性,可用于宮頸癌的篩選和預后。
由于質譜檢測能夠一次性快速、高靈敏度地檢測多組分化合物,檢測范圍覆蓋了小分子、多肽、氨基酸、蛋白質等多尺寸生物產物,且根據質荷比的不同能夠分析和判斷未知產物,在細胞分析中具有日趨重要的地位。雖然質譜檢測具有以上優勢,但由于細胞產物復雜,干擾基質強,難以直接用于細胞產物分析檢測。因此,將質譜與有效的分離模塊聯用是細胞分析中的常用手段。從20世紀50年代至今,開發出的與質譜檢測器聯用的分離模塊依次經歷了氣相色譜、液相色譜、毛細管電泳以及近些年的微流控芯片。但與其它基于柱分離的分離技術不同的是,微流控芯片平臺不僅能夠實現有效分離,同時還具有高度集成性、在線處理且試劑消耗量更低等,在細胞研究方面具有無可比量的優勢[66]。
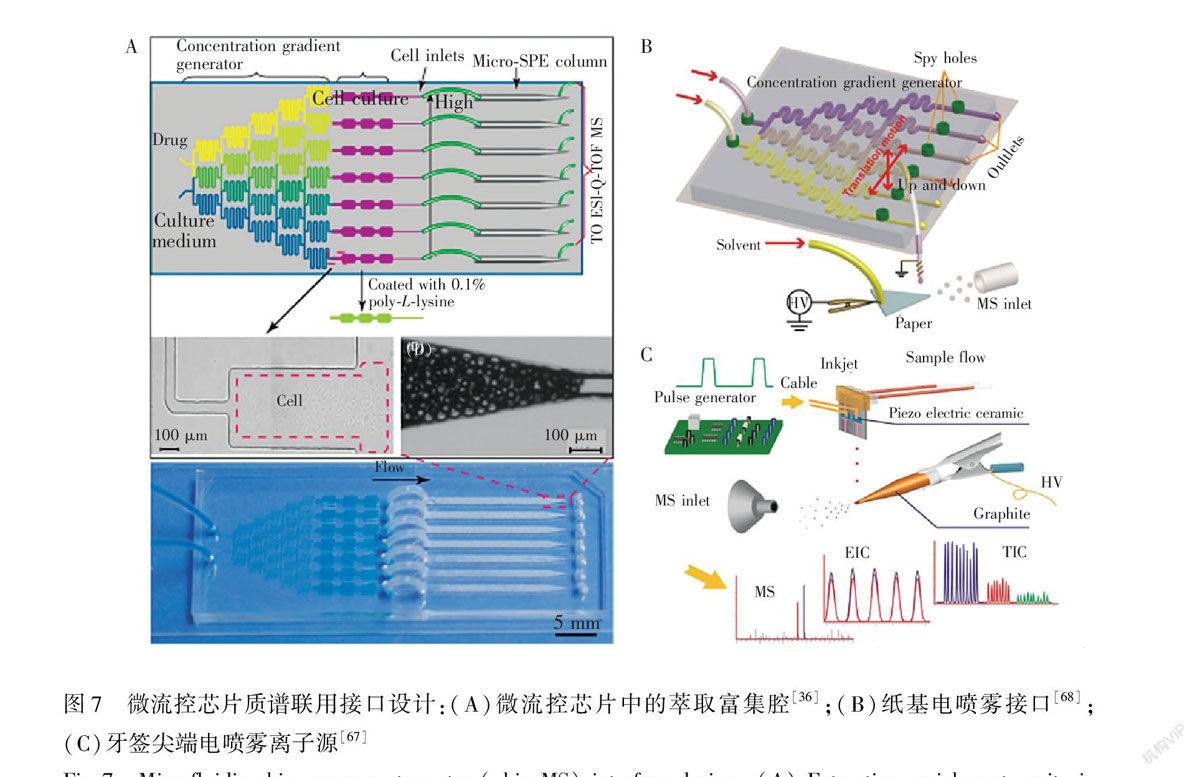
在微流控芯片質譜聯用中,目前主要使用的是電噴霧質譜(ESIMS)。微流控芯片平臺上的樣品前處理和與質譜連接的接口設計是實現細胞分析的關鍵。微流控芯片上的樣品前處理通常是通過在芯片中集成整體柱或者萃取材料[8,36,37],對含有血清等復雜成分的溶液進行脫鹽富集處理,提高目標檢測物的質譜信號強度。Gao等[36]在微流控平臺上結合了固相萃取微柱,在質譜檢測前對流體進行了洗凈和濃縮處理,選用甲氨蝶呤(葉酸代謝酶體系的一種抑制劑)為藥物模型,HepG2和Caco2為目標細胞,證實了其微流控芯片平臺對藥物吸收的有效性,有望用于對活細胞的實時藥物動力學研究(圖7A)。此外,為了簡化芯片上樣品前處理單元的復雜設計和操作,本研究組還提出了液滴紙噴霧離子源接口和inkjet牙簽噴霧針離子源技術[67]。通過液滴紙噴霧,實現在紙纖維上對復雜成分溶液的同步分離和純化過程,將不易離子化的物質保留在紙纖維上。Liu等[68]建立了一種多通道可移動微流控芯片檢測平臺,使用紙基電噴霧質譜,對非共價鍵結合的蛋白蛋白復合物的締合常數進行了測定(圖7B)。結果證明了該平臺對蛋白分析的有效性。同樣,Inkjet牙簽噴霧針離子源技術對樣品的直接分析也是利用了牙簽的木質纖維對復雜基質的分離純化作用,且inkjet芯片能可控產生皮升級微液滴,精確定位滴于牙簽尖端處形成噴霧用于質譜分析。Luo等[67]建立了這種裝置(圖7C),并用可可堿作為內標,對咖啡因進行了定量檢測。結果證明在1~200 mg/L范圍內都具有良好的線性,且由于電噴霧持續時間短,峰強比近似為峰面積比,可用于定量研究。
圖7 微流控芯片質譜聯用接口設計:(A)微流控芯片中的萃取富集腔[36];(B)紙基電噴霧接口[68];(C)牙簽尖端電噴霧離子源[67]
Fig.7 Microfluidic chipmass spectrometry (chipMS) interface design: (A) Extraction enrichment cavity in microfluidic chips[36], (B) Paperbased electrospray interface[68] and (C) Toothpick electrospray ion source[67]
基質輔助激光解吸電離質譜(MALDIMS)由于對鹽度具有較好的耐受度,常用于對生物大分子,如蛋白質、多肽等進行檢測,但由于MALDI需要將激光直接照射于樣品和基質的共晶層以實現樣品的離子化,因此需要檢測樣品區域為開放式,從而導致其與微流控芯片的聯用受到了限制。盡管如此,由于MALDI的點陣化檢測特點,其在單細胞和點陣化分析方面具有獨特的優勢。Zhang等[69]將哺乳動物細胞直接培養在氧化銦錫導電玻璃表面,然后通過電噴霧的方式將基質噴涂在其表面形成一個均勻的結晶層,利用MALDI質譜對細胞膜脂質進行了原位表征,獲得了豐富的膜脂信息,這種較為粗略的分子圖譜可以對細胞類型的識別提供佐證。
7 總結與展望
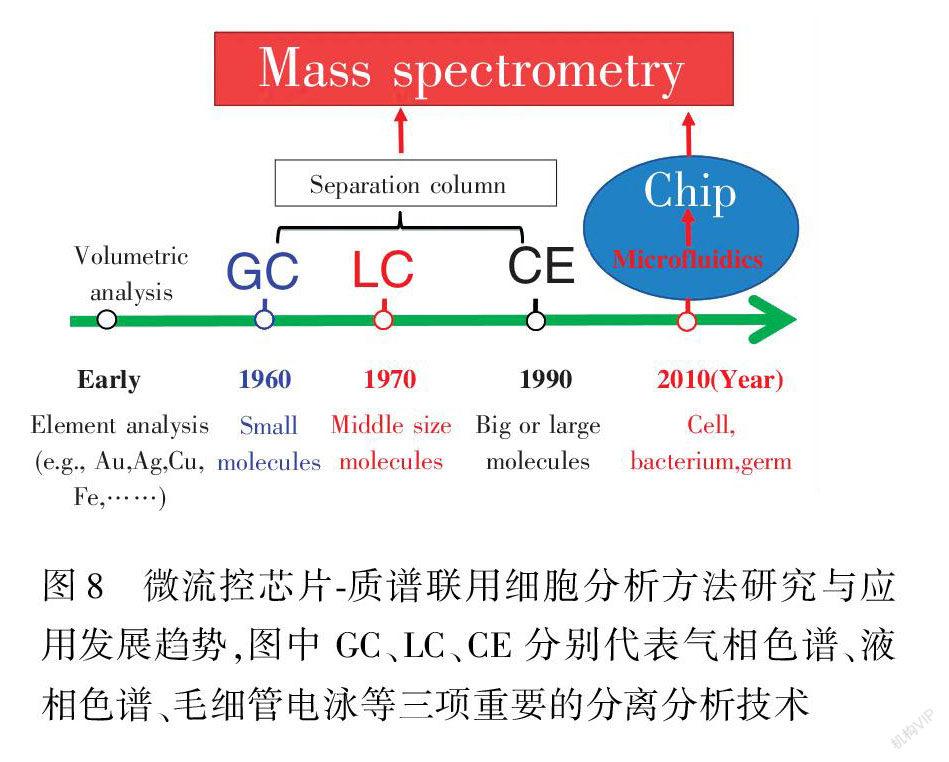
經過二十多年的發展,微流控技術在細胞生物學及細胞分析的研究中發揮出了不可替代的作用。與傳統的細胞培養方法相比,微流控芯片上的細胞培養有許多優勢,比如能夠在時間和空間上使細胞所處的微環境與體內相似,從而使得基于細胞的分析能夠獲得更為真實可靠的結果。研究者們已經開發出許多種方法來提高微流控系統的能力,例如在同一芯片平臺上集成不同的功能單元或者設計更為有效的結構來對流體或者細胞進行操控等。我們有理由相信,用于細胞分析的芯片設計將會更加靈活有效,更重要的是用于細胞分析的標準化微流控系統的設計和制備,尤其是微流控芯片質譜聯用分析技術(ChipMS),也將逐步成熟,發展成繼氣相色譜質譜(GCMS)、液相色譜質譜(LCMS)、毛細管電泳質譜(CEMS)聯用3個不同階段的一項新技術,分別應用于小分子、中等大小的分子、大分子等無生命的化合物的分離分析,
圖8 微流控芯片質譜聯用細胞分析方法研究與應用發展趨勢,圖中GC、LC、CE分別代表氣相色譜、液相色譜、毛細管電泳等三項重要的分離分析技術
Fig.8 Development of chipmass spectrometry following with gas chromatography (GC), liquid chromatography (LC) and capillary electrophoresis (CE)到目前能夠初步應用于具有生命最小單元的細胞的微流控芯片質譜聯用分析,其發展趨勢將有可能如圖8所示。所以,我們有理由推測并且相信,微流控芯片的出現,不單單是為了實現分析儀器的小型化,其主要是為了適應具有微小尺寸的細胞、細菌等的研究與分析[66,70,71]。雖然微流控技術在細胞分析領域仍然面臨許多挑戰,但由于其所具備的低試劑消耗、高通量、易于集成、設計靈活、能夠模擬復雜微環境等明顯優于傳統細胞生物學方法的優勢使得微芯片技術依然在生物醫學、藥物篩選和現場即時診斷等許多基于細胞的分析研究中不可替代。隨著微流控芯片制作材料和微加工技術的進一步發展,我們有望在未來實現將便宜且便攜的手持設備用于大規模集成化的高通量藥物研發或者現場即時診斷的個性化醫療。而更重要的是,我們希望通過完善各種技術、加大技術推廣和宣傳,使多通道微流控芯片質譜聯用技術能夠在細胞的研究領域得到廣泛的使用,為生命科學研究提供一種新的工具。
References
1 Yeo L, Chang H, Chan P, Friend J. Small, 2011, 7(1): 12-48
2 CHEN Li, ZHENG XiaoLin, HU Ning, YANG Jun, LUO HongYan, JIANG Fan, LIAO YanJian. Chinese J. Anal.Chem., 2015, 43(2): 300-309
陳 禮, 鄭小林, 胡 寧, 楊 軍, 羅洪艷, 姜 帆, 廖彥劍. 分析化學, 2015, 43(2): 300-309
3 Meyvantsson I, Beebe D. Annu. Rev. Anal. Chem. (Palo.Alto. Calif.), 2008, 1: 423-449
4 Mao S, Gao D, Liu W, Wei H, Lin J M. Lab Chip, 2012, 12(1): 219-226
5 Gao D, Liu H, Lin J M, Wang Y, Jiang Y. Lab Chip, 2013, 13(5): 978-985
6 Wei H, Li H, Gao D, Lin J M. Analyst, 2010, 135(8): 2043-2050
7 Camelliti P, Mcculloch A D, Kohl P. Microsc. Microanal., 2005, 11(3): 249-259
8 Gao D, Wei H, Guo G S, Lin J M. Anal. Chem., 2010, 82(13): 5679-5685
9 Liu W, Wang N, Lin X, Ma Y, Lin J M. Anal. Chem., 2014, 86(14): 7128-7134
10 Vedel S, Tay S, Johnston D M, Bruus H, Quake S R. Proc. Natl. Acad. Sci. U. S. A., 2013, 110(1): 129-134
11 Huh D, Hamilton G A, Ingber D E. Trends. Cell Biol., 2011, 21(12): 745-754
12 Zheng C, Zhao L, Chen G, Zhou Y, Pang Y, Huang Y. Anal. Chem., 2012, 84(4): 2088-2093
13 Lecault V, Vaninsberghe M, Sekulovic S, Knapp D J, Wohrer S, Bowden W, Viel F, Mclaughlin T, Jarandehei A, Miller M, Falconnet D, White A K, Kent D G, Copley M R, Taghipour F, Eaves C J, Humphries R K, Piret J M, Hansen C L. Nat. Methods., 2011, 8(7): 581-586
14 Lii J, Hsu W J, Parsa H, Das A, Rouse R, Sia S K. Anal. Chem., 2008, 80(10): 3640-3647
15 Chung S, Sudo R, Mack P J, Wan C R, Vickerman V, Kamm R D. Lab Chip, 2009, 9(2): 269-275
16 Tumarkin E, Tzadu L, Csaszar E, Seo M, Zhang H, Lee A, Peerani R, Purpura K, Zandstra P W, Kumacheva E. Integr. Biol. (Camb.), 2011, 3(6): 653-662
17 Tsuda Y, Morimoto Y, Takeuchi S. Langmuir, 2010, 26(4): 2645-2649
18 Liu J, Gao D, Li H, Lin J M. Lab Chip, 2009, 9(9): 1301-1305
19 Wu J, Chen Q, Liu W, Zhang Y, Lin J M. Lab Chip, 2012, 12(18): 3474-3480
20 Ong S M, Zhang C, Toh Y C, Kim S H, Foo H L, Tan C H, van Noort D, Park S, Yu H. Biomaterials, 2008, 29(22): 3237-3244
21 Toh Y C, Zhang C, Zhang J, Khong Y M, Chang S, Samper V D, van Noort D, Hutmacher D W, Yu H. Lab Chip, 2007, 7(3): 302-309
22 Choi J, Kim S, Jung J, Lim Y, Kang K, Park S, Kang S. Biomaterials, 2011, 32(29): 7013-7022
23 Toh Y C, Lim T C, Tai D, Xiao G, van Noort D, Yu H. Lab Chip, 2009, 9(14): 2026-2035
24 Ravula S K, Wang M S, Asress S A, Glass J D, Bruno F A. J. Neurosci. Methods, 2007, 159(1): 78-85
25 Wong A P, PerezCastillejos R, Christopher L J, Whitesides G M. Biomaterials, 2008, 29(12): 1853-1861
26 Kimura H, Yamamoto T, Sakai H, Sakai Y, Fujii T. Lab Chip, 2008, 8(5): 741-746
27 Yuan B, Li Y, Wang D, Xie Y, Liu Y, Cui L, Tu F, Li H, Ji H, Zhang W, Jiang X. Adv. Funct. Mater., 2010, 20(21): 3715-3720
28 Chen Q, Wu J, Zhuang Q, Lin X, Zhang J, Lin J M. Sci. Rep., 2013, 3: 2433
29 Zhuang Q, Wang S, Zhang J, He Z, Li H, Ma Y, Lin J M. Sci. China Chem., 2015, 58(8): 1-8
30 Mao S, Zhang J, Li H, Lin J M. Anal. Chem., 2013, 85(2): 868-876
31 Zhang J, Wu J, Li H, Chen Q, Lin J M. Biosens.Bioelectron., 2015, 68: 322-328
32 Wei H, Li H, Mao S, Lin J M. Anal. Chem., 2011, 83(24): 9306-9313
33 Gao D, Liu H, Jiang Y, Lin J M. TRACTrend Anal. Chem., 2012, 35: 150-164
34 Toh A G G, Wang Z P, Yang C, NamTrung N. Microfluid. Nanofluid., 2014, 16(12): 1-18
35 Jeon N L, Dertinger S, Chiu D T, Choi I S, Stroock A D, Whitesides G M. Langmuir, 2000, 16(22): 8311-8316
36 Gao D, Li H, Wang N, Lin J M. Anal. Chem., 2012, 84(21): 9230-9237
37 Chen Q, Wu J, Zhang Y, Lin J M. Anal. Chem., 2012, 84(3): 1695-1701
38 Scherber C, Aranyosi A J, Kulemann B, Thayer S P, Toner M, Iliopoulos O, Irimia D. Integr. Biol.Uk., 2012, 4(3): 259-269
39 Byrne M B, Leslie M T, Gaskins H R, Kenis P J. Trends Biotechnol., 2014, 32(11): 556-563
40 Wang L, Liu W, Wang Y, Wang J C, Tu Q, Liu R, Wang J. Lab Chip, 2013, 13(4): 695-705
41 Lin X, Chen Q, Liu W, Zhang J, Wang S, Lin Z, Lin J M. Sci. Rep., 2015, 5: 9643
42 Rosso F, Giordano A, Barbarisi M, Barbarisi A. J. Cell Physiol., 2004, 199(2): 174-180
43 Wu J, Chen Q, Liu W, Lin J M. Lab Chip, 2013, 13(10): 1948-1954
44 Wu C, Asokan S B, Berginski M E, Haynes E M, Sharpless N E, Griffith J D, Gomez S M, Bear J E. Cell, 2012, 148(5): 973-987
45 Sun Y S, Peng S W, Cheng J Y. Biomicrofluidics, 2012, 6(3): 34117
46 Tong Z, Cheung L S, Stebe K J, Konstantopoulos K. Integr. Biol. (Camb.), 2012, 4(8): 847-856
47 Przybyla L M, Voldman J. Proc. Natl. Acad. Sci. U. S. A., 2012, 109(3): 835-840
48 Moledina F, Clarke G, Oskooei A, Onishi K, Gunther A, Zandstra P W. Proc. Natl. Acad. Sci. USA, 2012, 109(9): 3264-3269
49 YU ZhiLong, HUANG YanYi. Sci. China Chem., 2015, 45(11): 1090-1101
虞之龍, 黃巖誼. 中國科學: 化學, 2015, 45(11): 1090-1101
50 Chen Q, Wu J, Zhang Y, Lin Z, Lin J M. Lab Chip, 2012, 12(24): 5180-5185
51 Liu C, Liu J, Gao D, Ding M, Lin J M. Anal. Chem., 2010, 82(22): 9418-9424
52 Wei H, Chueh B H, Wu H, Hall E W, Li C W, Schirhagl R, Lin J M, Zare R N. Lab Chip, 2011, 11(2): 238-245
53 Wu J, Li H, Chen Q, Lin X, Liu W, Lin J M. RSC. Adv., 2014, 4(47): 24929-24934
54 Mach A J, Kim J H, Arshi A, Hur S C, Di Carlo D. Lab Chip, 2011, 11(17): 2827-2834
55 Wang B L, Ghaderi A, Zhou H, Agresti J, Weitz D A, Fink G R, Stephanopoulos G. Nat. Biotechnol., 2014, 32(5): 473-478
56 Huh D, Matthews B D, Mammoto A, MontoyaZavala M, Hsin H Y, Ingber D E. Science, 2010, 328(5986): 1662-1668
57 Yeon J H, Ryu H R, Chung M, Hu Q P, Jeon N L. Lab Chip, 2012, 12(16): 2815-2822
58 Miller J S, Stevens K R, Yang M T, Baker B M, Nguyen D H, Cohen D M, Toro E, Chen A A, Galie P A, Yu X, Chaturvedi R, Bhatia S N, Chen C S. Nat. Mater., 2012, 11(9): 768-774
59 Song J W, Munn L L. Proc. Natl. Acad. Sci. USA, 2011, 108(37): 15342-15347
60 Ma Z, Liu Q, Liu H, Yang H, Yun J X, Eisenberg C, Borg T K, Xu M, Gao B Z. Lab Chip, 2012, 12(3): 566-573
61 Grosberg A, Alford P W, Mccain M L, Parker K K. Lab Chip, 2011, 11(24): 4165-4173
62 Lin X, Leung K H, Lin L, Lin L, Lin S, Leung C H, Ma D L, Lin J M. Biosens. Bioelectron., 2016, 79: 41-47
63 SU WenTao, FENG Ke, QIN JianHua. Chinese J. Anal. Chem., 2015, 43(10): 1490-1498
蘇文濤, 馮 可, 秦建華. 分析化學, 2015, 43(10): 1490-1498
64 Lin X, Wu J, Li H, Wang Z, Lin J M. Talanta, 2013, 114: 131-137
65 Yi L, Xu X, Lin X, Li H, Ma Y, Lin J M. Analyst, 2014, 139: 3330-3335
66 LI HaiFang, ZHANG Ying, LIN JinMing. Scientia Simia Chimica, 2014, 44(5): 777-783
李海芳, 張 英, 林金明. 中國科學: 化學, 2014, 44(5): 777-783
67 Luo C, Ma Y, Li H, Chen F, Uchiyama K, Lin J M. J. Mass Spectrom., 2013, 48: 321-328
68 Liu W, Chen Q, Lin X, Lin J M. Analyst, 2015, 140: 1551-1554
69 Zhang Y, Li H, Ma Y, Lin J M. Sci. China Chem., 2014, 57(3): 442-446
70 He X, Chen Q, Zhang Y, Lin J M. TRACTrends Anal. Chem., 2014, 53: 84-97
71 Lin L, Lin J M. Journal of Pharmaceutical Analysis, 2015, 5(6): 337-347
Recent Development in Microfluidic Chips for
in vitro Cellbased Research
ZHUANG QiChen1, NING RuiZhi1,2, MA Yuan1, LIN JinMing*1
1(Department of Chemistry, Beijing Key Laboratory of Microanalytical Methods and Instrumentation,
The Key Laboratory of Bioorganic Phosphorus Chemistry and Chemical Biology, Tsinghua University, Beijing 100084, China)
2(Department of Biomaterial Sciences, The University of Tokyo, Tokyo 1138657, Japan)
Abstract Microfluidic technology has become a powerful tool in cellbased research due to its inherent advantages. The research progress of cell culture on chips, simulation and manipulation of cell microenvironment on chips, single cell analysis on chips, organonachip, and chipmass spectrometry technology was introduced in this review. Morover, the summary and prospect on the microfluidic technology were introduced to give some insights for researchers who were interested in developing microfluidic platforms for cellbased research.
Keywords Microfluidic chip; Cell culture; Microenvironment; Single cell; Organonachip; Chipmass spectrometry; Cell analysis; Review
(Received 3 January 2016; accepted 16 January 2016)
This work was supported by the National Natural Science Foundation of China (Nos.81373373, 21227006, 21435002) and the China Equipment and Education Resources System (No. CERS175)

