微流控PCR芯片的研究進展
何啟迪 黃丹萍 黃冠 陳纘光

摘 要 基因是人類的遺傳密碼,人類個體之間只有萬分之一的基因不相同,卻導致了人與人之間豐富的差異。了解這種差異對于科學研究具有巨大的應用價值。PCR是基因研究中常用的手段之一,但傳統PCR儀存在反應時間長、能量消耗大、不便于集成與攜帶等缺陷,微流控技術與PCR結合可以有效縮小反應體系,提高反應效率,且易于集成化與微型化。本文按照微流控PCR芯片的結構分類, 詳細介紹了微池型、連續流動型PCR芯片,以及電泳、熒光、電化學和DNA雜交陣列等檢測方法,并在最后進行了總結與展望。
關鍵詞 微流控; 聚合酶鏈式反應; 芯片; 綜述
1 引 言
2001年2月12日,中、美、日、德、法、英等國科學家和美國賽萊拉公司公布了人類基因組圖譜和初步分析結果[1]。這是人類對自身奧秘的探索史上一個重要的里程碑。研究結果顯示,人類99.99%的基因是相同的,僅萬分之一的不同基因造就了個體間豐富的差異。了解這種差異對于基礎生物學和醫學等方面研究都具有巨大的應用價值。
在基因研究中,聚合酶鏈式反應(Polymerase chain reaction,PCR)是一種常用手段。PCR技術最先由Mullis等在1985年發明[2],并獲得了1993年的諾貝爾化學獎[3]。PCR的過程包括3個步驟:變性、退火、延伸,需要在高低中3個不同的溫度(高溫變性:90℃~95℃,低溫退火:55℃~60℃;中溫延伸:70℃~72℃)下進行。除了反應區域溫度的調節,實驗中還涉及到反應物、酶、DNA模板溶液體積的精準測量,反應體系的混合,溶液的驅動和控制等。傳統的PCR儀器中的反應是通過樣品槽反應管樣品之間的熱傳遞實現的,存在反應時間長、反應體積大、能量消耗多、易產生副產物、不便于集成與攜帶等缺陷。
微流控(Microfluidics)是一門在μm~mm尺度下研究流體的處理與操控的技術[4],集成化的微流控芯片還可以將采樣、稀釋、反應、分離、檢測、分析等多個步驟融為一體,已廣泛用于化學、生物等各領域。本實驗室對于微流控芯片在化合物分離檢測[5]、藥物篩選[6]等方面的應用均有研究。利用微流控芯片,傳統PCR儀存在的各種問題都有了解決的可能。例如:微小的反應體系可以使熱傳遞更迅速,顯著提高擴增速度,同時避免非特異性擴增,提高反應效率;全封閉的體系可以減少頻繁的手工操作引入的樣本污染和溶液損失;系統微型便攜,利于現場實時檢測等。
2 微流控PCR芯片
用于制作微流控芯片的材料有硅、玻璃、石英、金屬和有機聚合物如環氧樹脂、聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯(PC)和聚二甲基硅氧烷(PDMS)等[7]。其中,硅和玻璃具有良好的化學惰性和熱穩定性,與硅相比,玻璃的機械強度更高,是制作PCR芯片的主要材料。PDMS生物相容性好,可塑性強,并且PDMS表面與很多材料表面都有很好的親和力,易于實現可逆封裝,可以用于制作生化分析器件[8]。但是PDMS的導熱系數小,散熱性差等特性在某些情況下不利于PCR反應的進行,可以與熱傳導性能好的玻璃形成混合芯片結構,同時改善PCR芯片的散熱和光學性能。
除了利用軟光刻技術對微流體通道進行微細精密的加工[9], 還可使用熱壓法、注塑法和激光燒灼法等傳統方法以及3D打印等新興手段制作芯片。微通道封裝時,采用等離子表面處理或深紫外照射[10]后,迅速貼合,可以得到牢固和永久的封裝。
根據芯片的結構差異可將PCR芯片分為靜止PCR與動態PCR,或微池型PCR(Microchamber PCR, MCPCR)與連續流動PCR(ContinuousFlow PCR, CFPCR)。微池型PCR的特點在于,反應體系不流動,通過芯片整體升溫降溫的循環來實現反應;連續流動PCR則由反應液體循環流過不同溫區進行擴增。在連續流動型PCR芯片中,反應溶液沿著微通道在3個固定的溫度區連續流動,3個溫度分別對應高溫變性區、低溫退火區和中溫延伸區,在每個溫區的流動時間和速度決定了反應時間。每流過3個溫區為一次循環,PCR溶液按照所需的循環數依次流動,最后完成整個擴增反應。
2.1 微池型PCR芯片
微池型PCR芯片是傳統PCR的微型化,有單反應池[11~15],液滴虛擬微池[16,17]及微池陣列[18~22]3種設計。 單反應池結構簡單,1993年由Northrup等[11]首次報道,他們在硅基質上刻蝕出空腔,加入50 μL反應液進行PCR擴增。Giordano等[12]在2001年采用聚酰亞胺材料制作單池PCR芯片(如圖1A所示),利用紅外加熱,在4 min內完成了對長度為500 bp的DNA片段的擴增。Neuzil等[16]采取以礦物油包裹PCR溶液的方式,形成了液滴虛擬微池來實現擴增(如圖1B所示),可以有效減少反應溶液的揮發,他們設計的芯片能夠快速地升溫降溫,最后通過融解曲線分析和毛細管電泳兩種方法檢驗純度。微池陣列是在單反應池的基礎上增加反應通量得到。Matsubara等[18]在一塊長3英寸、寬1英寸的硅片上刻蝕了1248個微孔,每個微孔容積為50 nL(如圖1C所示)。PCR反應液用點樣儀加入每個微池,再用石蠟油密封。Cai等[22]則是將PCR反應液通入芯片中,進行預載入,之后通過芯片多層之間的滑動使溶液進入微室陣列中,最后分別進行擴增與成像,免去了頻繁加樣的繁瑣操作。微池型PCR的關鍵在于體系溫度的快速切換,需要優化儀器的溫度控制來縮短循環時間,其次因為反應體積微小,需要精密的加樣儀器或是利用微流控芯片結構的特殊設計實現高通量。
2.2 蛇形通道PCR芯片
蛇形通道PCR芯片由Kopp等[23]在1998年首次提出,蛇形通道PCR芯片的經典形狀是平行式(如圖2A所示),隨后Schaerli等[24]在2009年開發出了輻射式排布的蛇形通道芯片,同時結合了液滴技術,將納升級的PCR反應液包裹在油相之中,沿著通道在溫區間循環。Jiang等[25]在2014年同樣設計了一款輻射式通道的芯片(圖2B),利用太陽能加熱,并通過智能手機裝載的熒光檢測器檢測反應的進行。這種芯片的溫區一般以高溫中溫低溫的形式排布,加熱元件有Cu[24]、Pt[26]、Al[27]等金屬或是ITO[28, 29] (indium tin oxide,銦錫氧化物)電極等,為了提高芯片的溫度控制效率和3個溫區的精確控制,芯片還與溫度傳感器集成,并且通過熱隔離槽來降低溫區間的熱交換。雖然在一些特別的模板和引物條件下,PCR反應中的退火和延伸溫度可以一致,只需兩個溫區就可以進行PCR擴增,但是3個溫區PCR芯片適用性更廣。然而3個溫區芯片存在的一個問題是,高溫區解鏈產物在經過中溫延伸區時可能會與DNA模板或互補鏈配對重新回到雙鏈狀態導致退火失敗,降低擴增效率。而更改溫區的排布會使得芯片的設計更為復雜。
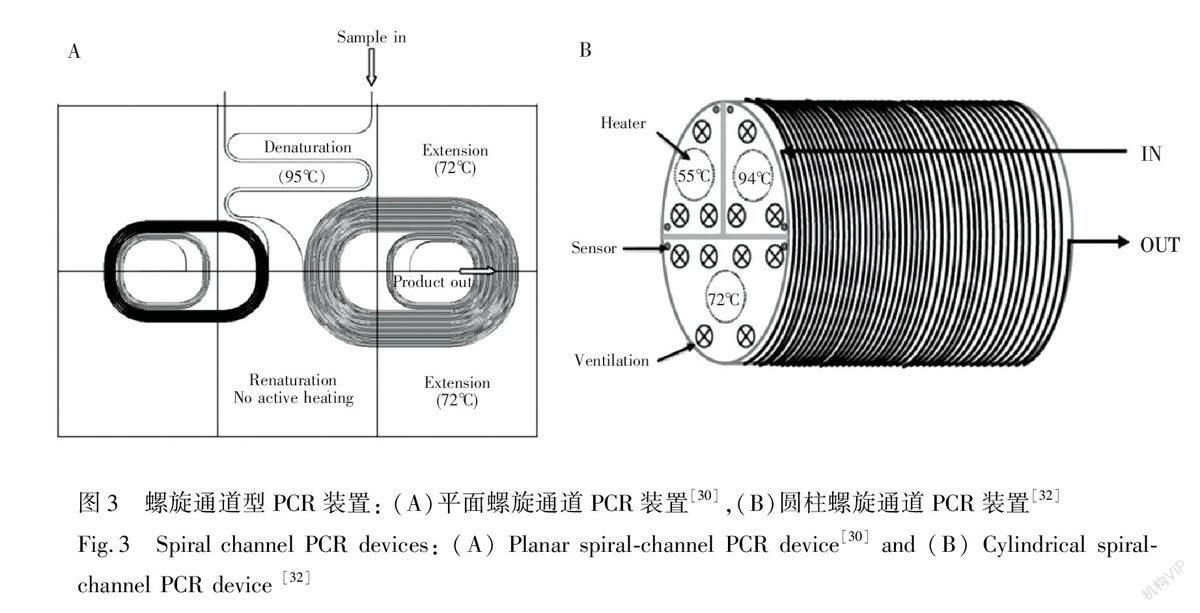
2.3 螺旋通道PCR芯片
螺旋通道PCR芯片可以有效解決溫區布局的問題。在這類芯片中,3個溫區以扇形排布,反應溶液沿著通道盤旋流動,依次經過高低中3個溫區。DNA的高溫變性產物直接進入低溫退火區,避免了在延伸區雙鏈復性的可能,提高擴增效率。螺旋通道PCR芯片有平面式與圓柱式兩種, Hashimoto等[30]研制的PCR芯片就是平面結構(如圖3A所示),他們設計的芯片分左右兩個區域,通道寬度為50 μm,右側通道之間的距離為250 μm,左側為50 μm。他們利用這款芯片對反應液流速進行了探索,最終可以分別在1.7和3.2別min內完成500 bp及997 bp的DNA片段的20次循環擴增與檢測。Park等[31]將一條長3.5 m的彈性石英管在有3個溫區的圓柱加熱器上螺旋式纏繞33周,實現了PCR擴增。隨后Dorfman等[32]也研制了類似的PCR設備(如圖3B所示),他們利用不混溶的氟化溶劑將反應液分隔成液滴的形式,借助對界面性質的優化控制使得相鄰液滴不會相互污染,以達到高通量的目的。Shu等[33]采用空氣對液體片段進行隔離,發展了一種在螺旋通道微流控裝置上進行的高通量快速核酸擴增方法,可以在一個液滴里同時擴增4種病原菌的靶基因,對實驗中涉及的4種病原菌的基因組同時檢測的靈敏度可以達到100 copies/μL。相比而言,平面式結構緊湊但每個循環的長度不一致,圓柱式體積比較大但是每個循環長度一致,流體控制較為簡便。蛇形通道與螺旋通道PCR芯片的共同特點是,PCR的循環次數和時間受到整個通道的長度和流體速度的限制,一旦芯片結構固定,循環次數也相對固定。
2.4 振蕩式PCR芯片
振蕩式PCR是近年來隨著微流控技術不斷發展衍生的新方法。在振蕩式裝置中,循環次數不會受微通道長短限制。振蕩式PCR裝置由反應微通道、流體驅動器及加熱器組成。PCR溶液在驅動器的控制下在溫區間往復運動,循環次數可以隨意調節,在各個溫區的反應時間也可以通過改變各溫區的長度和流動速度來優化(見圖4)。Wang等[34]將1 μL PCR反應液以液滴的形式注入微通道中,反應液液滴兩端以石蠟油封裝,通過雙向蠕動泵的控制使液滴在3個溫區中循環,可以在15 min內完成對人乳頭瘤細菌DNA的擴增。隨后, 其他研究者們也設計了類似的芯片對黑色素瘤相關的酪氨酸酶基因[35],沙門氏菌、大腸桿菌、李斯特菌等[36]以及食物來源的病原體[37]的DNA進行了檢測。振蕩式PCR芯片與蛇形通道式PCR芯片有個共同點是,PCR反應溶液在循環過程中不得不在高溫變性后穿過延伸區, 才能來到退火區,但是通過流體驅動器的調節,可以盡量縮短這段過程的時間,避免DNA雙鏈復性。
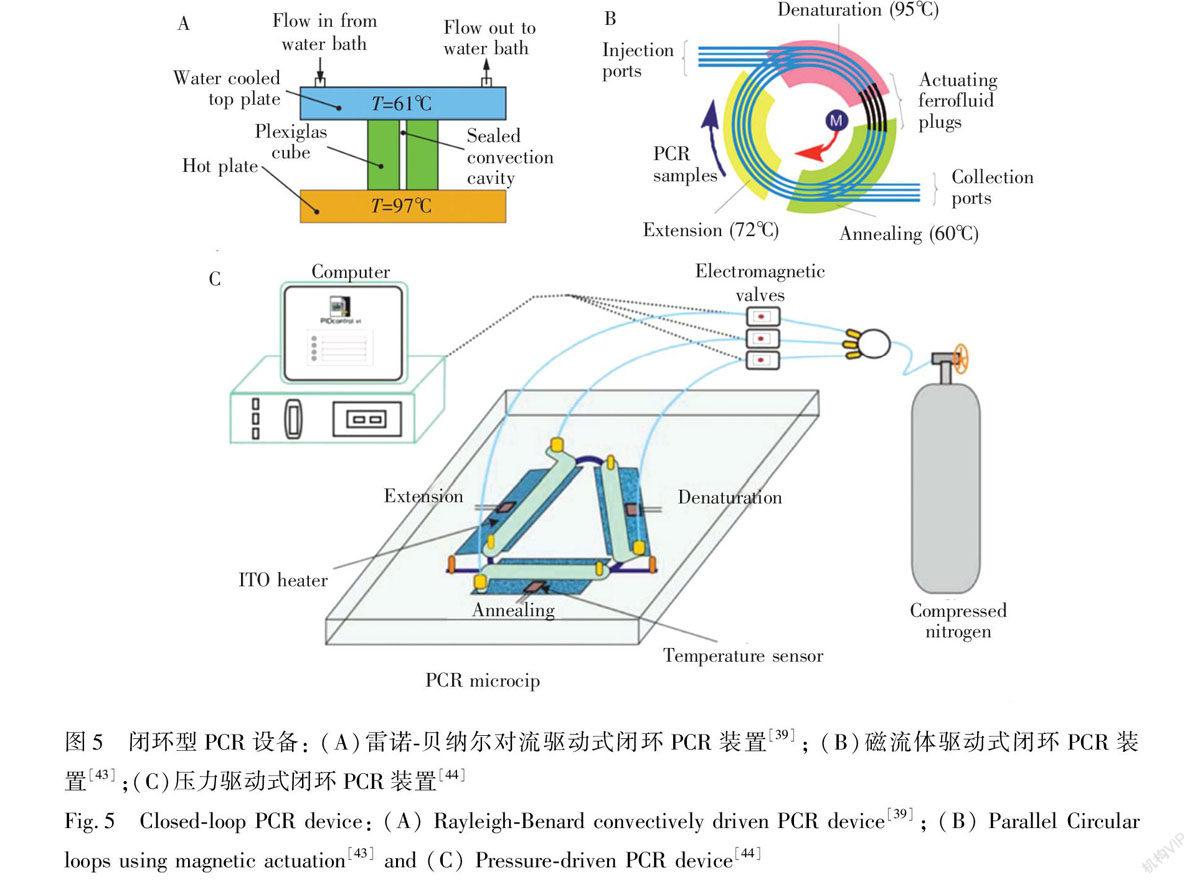
2.5 閉環式PCR芯片
閉環式PCR芯片的原理與平面螺旋式PCR芯片類似,同樣是通過驅動PCR溶液在平面內的環形通道內循環流過3個溫區實現擴增反應。反應溶液依次經過高低中3個溫區,避免了DNA復性影響擴增效率。根據驅動液體流動的原理可以分為溫差環流[38]、對流驅動[39]和外力(如浮力[40,41]、磁力[42,43]、壓力[44]等)驅動的閉環PCR。與螺旋式PCR不同的是,閉環式PCR每個循環都是在同一個環形通道中進行,因此每次循環的長度是一致的,芯片體積小,
圖4 振蕩型PCR裝置[36]
Fig.4 Oscillatoryflow PCR device[36]利于集成化和平行化高通量擴增。Krishnan等[39]首次開發了一種利用雷諾貝納爾(RayleighBenard)自然對流驅動方式進行的PCR設備(如圖5A所示),PCR反應液在61℃和97℃的密閉空間內往復流動,DNA的擴增效率會受到雷諾數(Ra)和密閉腔體的高度與直徑的比值(h/d)的影響。Sun等[43]將多個閉環通道合并在一塊芯片內(如圖5B所示),利用中心的磁鐵同時對四重閉環內的磁性流體進行操縱,磁性流體繼而推動反應液在環內流動,循環通過3個溫區。Xu等[44]通過ITO電極加熱控制3個溫區的溫度,采用壓縮氮氣作為驅動力,氣體的釋放由開關控制,反應液在通道內的移動同時需要微閥的配合(如圖5C所示)。在這種設計的PCR芯片中,反應時間、循環次數、反應溫度都是可以根據實際要求設置的,大大提高了芯片的適用性。
3 芯片PCR產物的檢測與分析
在只具有擴增功能的PCR芯片中,反應完成后, 擴增產物一般采用離線的凝膠電泳[23,43,45~47]、毛細管電泳[12]等分離檢測方法進行驗證,這與傳統PCR儀相比并沒有優勢,在線的檢測方法在提高檢測通量、減少交叉污染的風險等方面更具有前景,因此發展功能集成化的芯片也是研究者追求的方向。
3.1 毛細管電泳法
毛細管電泳(Capillary electrophoresis, CE)的原理是擴增產物在進入檢測通道前, 先通過嵌入型染料進行標記,隨后在電場的驅動下遷移運動,因不同片段長度的DNA分子遷移速度不同而被分離。檢測器有紫外、熒光等。將PCR與毛細管電泳結合最早是由Mathies課題組[48]在1996年提出,他們將硅片PCR芯片與玻璃毛細管電泳芯片通過環氧樹脂連接在起一次,PCR擴增后的產物經芯片的十字交叉口注入分離通道進行電泳。他們隨后又利用類似的方法對人類基因組DNA進行擴增并且可以對性別進行鑒定[49];之后還對病原微生物的DNA進行了檢測,檢出限可以低至2~3個細菌[50]。近年來, PCR與CE的結合也逐漸朝著集成化的方向發展[51~53]。毛細管電泳因為結構簡單、分析迅速,是最常用的分離檢測方法,然而它的缺陷在于只能分辨DNA序列的大小而無法區分DNA序列的不同。
3.2 熒光檢測法
熒光檢測法也是目前微流控PCR芯片中常用的檢測方法之一。研究者將芯片與熒光成像系統結合,不但可以在終點進行產物檢測[22,54],還可以借助熒光探針和芯片結構實時監測反應的進行過程[27, 55~62]。熒光終點檢測一般用于判斷PCR的成功與否或進行半定量分析,但是實時熒光檢測則可以通過循環閾值的方法進行準確的定量分析[27]。然而循環閾值定量方法會受到擴增效率的影響,Vogelstein等[63]在1999年提出了數字PCR(digital PCR)的概念,通過將樣本分配到成百上千個反應單元中,每個單元只包含一個或多個拷貝的DNA分子,在每個反應單元中分別進行PCR擴增,擴增結束后對各個單元的熒光信號進行統計學分析,最終獲得定量結果。反應單元越多,數字PCR的結果越準確,且不會受到擴增效率的影響。微池型PCR芯片與熒光檢測相結合,進行數字PCR是目前的研究熱點之一[17,20,64]。
在線熒光檢測除終點檢測、實時檢測,還包括熒光融解曲線分析。這是一種可以與實時熒光PCR有機結合的檢測技術,在PCR 結束后,利用現有的溫度梯度,從退火溫度緩慢升溫至變性溫度即可完成,具有靈敏、準確,且可以防止污染的優點。Crews課題組[65]采用這種分析技術,在20 min內完成了對人類唾液中的DNA的擴增與唾液來源的性別確認。
3.3 電化學方法
電化學方法是一種通過對電極的功能化修飾(如固定探針、酶、適配體等), 特異性地捕捉目標擴增產物,產生相應的電信號(電壓、電流、電阻)的檢測手段,具有靈敏性高、成本低等優點,而且可以通過微加工技術集成在微流控芯片上,因此最近也被發展用于PCR產物檢測[13, 66~69]。Fang等[66]將蛇形通道PCR芯片與電化學檢測相結合,在退火溫區集成了三電極陣列,對每個循環進行實時的產物檢測。電化學方法中所用到的探針可以是特定序列的一段核酸多聚物,通過與目標產物的特異性結合產生電信號的改變,因此電化學方法可以在一定程度上分辨產物的核酸序列。
3.4 DNA雜交微陣列
DNA雜交微陣列[70~75]是針對特定序列產物的一種檢測手段,可以對擴增產物序列進行分析。通過精細的微加工技術,可以將PCR芯片與固定有大量寡核苷酸探針的微陣列相結合,PCR產物與探針完全互補,二者結合后則會產生熒光圖樣,通過這些熒光圖樣就可以獲得擴增產物的序列信息。研究者們通過DNA雜交微陣列的方法在低豐度的DNA突變檢測[70]、流感病毒檢測[71]、HIV病毒基因分型[73]等方面進行了探索。
4 微流控PCR芯片分析應用實例
隨著微機電加工技術的快速發展,微流控PCR芯片也在向結構簡單化、功能集成化、便攜式、一次性的方向發展,目前已有不少文獻報道了可以在線完成完整的生物樣本分離與分析的裝置,為生物學和醫藥學等學科的研究帶來了很多應用價值。
Sciancalepore等[35]在2011年構建了一款振蕩型PCR芯片,也是第一款巢式PCR芯片。芯片由PDMS與玻璃基質兩層鍵合而成,PDMS中包裹有一根玻璃毛細管,作為PCR反應的通道。毛細管中填充了硅化試劑玻璃基質表面通過電子束蒸發沉積的方式設置了3個鈦/鉛復合電極,作為微加熱器,并與溫度傳感器結合,分別控制PCR過程中需要的3個溫度,升/降溫速度可以達到16℃/s。反應液滴通過毛細管兩端的流體泵控制,在3個溫區間循環。巢式PCR的特點在于引物包括內外兩套,外引物完成第一次PCR后的產物作為內引物的模板,進行第二次PCR。這種擴增方式的特異性和靈敏性都明顯高于普通的PCR。作者利用這款巢式PCR芯片在55 min內完成對酪氨酸激酶基因的擴增,可以用于惡性黑色素瘤的診斷,比傳統PCR儀的速度提高了4倍。
Tian等[64]提出了一款利用負壓協助完成DNA純化和數字PCR檢測的微流控芯片。芯片分為DNA純化區與數字PCR區,以磁珠吸附生物樣品裂解液中的DNA,并在磁鐵的幫助下固定在純化區,經過兩步清洗后, 從磁珠上洗脫,與PCR試劑混合,再借助負壓使溶液流入PCR區的微孔陣列中后,用硅油與未凝固的PDMS混合物沖走多余的樣品,在溫度循環的過程中,未固化的PDMS混合物也會逐漸凝固,起到封鎖進樣通道的作用。氣壓控制通道則注入水,使PCR區域保持濕潤,避免試劑的蒸發。擴增完成后,通過對每個微孔中熒光強度的統計以及樣品的稀釋倍數可以對樣品濃度進行定量。數字PCR的關鍵在于需要將樣品溶液分配至成百上千個單獨的反應孔中,使每個孔里只含有1~2個DNA模板或是沒有,這款芯片利用了PDMS的透氣性,在芯片外用注射器抽吸,使空腔內形成負壓,從而完成了樣品溶液的分配,擺脫了對自動加樣器的依賴。
Chang等[76]設計了一種集樣品制備、擴增、純化、檢測于一體的微池型微流控PCR芯片對假體關節液中的細菌進行了檢測和分型,用于參考選擇合適的抗生素,治療在關節成形中的細菌感染等并發癥。該課題組隨后利用類似的芯片對幽門螺旋桿菌對喹諾酮類抗生素的耐藥性診斷進行了研究[77]。他們將幽門螺旋桿菌特異性的引物結合在磁珠上,利用磁鐵的吸附,在擴增完成后可以輕松地將擴增產物與剩余試劑分離,從而達到純化的效果。利用兩種不同的引物,芯片還可以同時進行單核酸多態性的研究,通過擴增產物可以分辨樣品中的病原體是否是幽門螺旋桿菌,并判斷是否出現了耐藥性突變,為疾病的治療提供了可靠的依據。
5 總結與展望
微流控PCR芯片的形式從最初單個微池或是簡單的蛇形通道逐漸變得越來越豐富,并且在微閥、微泵等功能元件的組合下,功能也越來越完善,研究者們的思維也在逐步地擴展,出現了許多巧妙的設計。但是芯片的結構并非越復雜越好,繁瑣的流體操作會耗費大量時間,也會對芯片制作帶來麻煩,因此在完成實驗目的的前提下, 盡量簡化芯片結構才是重點。目前,PCR芯片在流體操作方面已經基本由機械化自動化的流體泵來完成,為了擺脫對流體泵的依賴,也有研究者提出了一些利用材料的表面張力自驅動的芯片,在樣品制備方面也出現了不少可以直接利用功能結構在線提取和純化的芯片,然而在在線檢測方面仍舊有待改進。熒光檢測是最為便捷和靈敏的檢測手段,但是需要依賴于昂貴的光學儀器和攝像設備,毛細管電泳與凝膠電泳則相對廉價但是受到精度和靈敏度的限制,離線檢測耗時耗力又易引入污染。所以,發展一種能夠在線檢測, 且低成本、高速度、高通量的檢測方法, 是今后的研究重點,可以向電化學生物傳感器的方向考慮。
由于芯片加工平臺還不夠普及,微流控PCR的技術也還不夠成熟,微流控PCR芯片暫時還不能取代商品化的PCR儀,但是我們相信在更為精細的微機電加工、更為準確的溫度與流體控制、更為靈敏的數碼影像分析下,芯片的制作會越來越精巧,PCR的操作會更高效和便捷,基因分析的結果會更穩定和豐富。基于微流控芯片的突出優點和人們對新技術新方法的需求,微流控PCR芯片將在今后的基因研究中逐漸占據一席之地。
References
1 Scientists Announced the Latest Human Genome. http://www.people.com.cn/GB/guoji/25/95/20010212/393263.2001
科學家公布最新的人類基因組圖譜. http://www.people.com.cn/GB/guoji/25/95/20010212/393263.2001
2 Saiki R K, Scharf S, Faloona F, Mullis K B, Horn G T, Erlich H A, Arnheim N. Science, 1985, 230(4732): 1350-1354
3 Mullis K B. Angew. Chem. Int. Ed. Engl., 1994, 33: 1209-1213
4 Whitesides G M . Nature, 2006, 442(7101): 368-373
5 Li X C, Chen Z G, Pan J B, Yang F, Li Y B, Yao M C. J. Chromatogr. A, 2013, 1291: 174-178
6 Zhang B B, Li Y B, He Q D, Qin J , Yu Y Y, Li X C, Zhang L , Yao M C, Liu J S, Chen Z G. Biomicrofluidics, 2014, 8(5): 054110
7 CHEN WenYuan, ZHANG WeiPing. Integrated Microfluidic Polymer PCR Chip. Shanghai: Profile of Shanghai Jiao Tong University Press, 2009: 35
陳文元,張衛平. 集成微流控聚合物PCR芯片, 上海: 上海交通大學出版社, 2009: 35
8 McDonald J C, Duffy D C, Anderson J R, Chiu D T, Wu H T, Schueller O J, Whitesides G M. Electrophoresis, 2000, D21(1): 27-40F
9 Deng T, Goetting L B, Hu J M, Whitesides G M. Sensor. Actuat. APhys., 1999, 75(1): 60-64
10 Dittrich P S, Tachikawa K, Manz A. Anal. Chem., 2006, 78(12): 3887-3907
11 Northrup M A, Ching M T, White R M. In: Proceeding of the 7th International Conference on Solid State Sensors and Actuators, Yokohama, Japan, 1993: 924-926
12 Giordano B C, Ferrance J, Swedberg S, Huhmer A F , Landers J P. Anal. Biochem., 2001, 291(1): 124-132
13 Lee T M, Carles M C, Hsing I M. Lab Chip, 2003, 3(2): 100-105
14 Shen K Y, Chen X F, Guo M, Cheng J. Sensor. Actuat. BChem., 2005, 105(2): 251-258
15 Wang S, Sun Y, Gan W, Liu Y, Xiang G, Wang D, Wang L, Cheng J, Liu P. Biomicrofluidics, 2015, 9(2): 024102
16 Neuzil P, Pipper J, Hsieh T M. Mol. Biosyst., 2006, 2(67): 292-298
17 Tanaka H, Yamamoto S, Nakamura A, Nakashoji Y, Okura N, Nakamoto N, Tsukagoshi K, Hashimoto M. Anal. Chem., 2015, 87(8): 4134-4143
18 Matsubara Y, Kerman K, Kobayashi M, Yamamura S, Morita V, Takamura Y, Tamiya E. Anal. Chem., 2004, 76(21): 6434-6439
19 Matsubara Y, Kerman K, Kobayashi M, Yamamura S, Morita Y, Tamiya E. Biosens. Bioelectron., 2005, 20(8): 1482-1490
20 Ottesen E A, Hong J W, Quake S R, Leadbetter J R. Science, 2006, 314(5804): 1464-1467
21 Prakash R, Kaler K V. Microfluid. Nanofluid., 2007, 3(2): 177-187
22 Cai D, Xiao M, Xu P, Xu Y C, Du W. Lab Chip, 2014, 14(20): 3917-3924
23 Kopp M U, Mello A J, Manz A. Science, 1998, 280(5366): 1046-1048
24 Schaerli Y, Wootton R C, Robinson T, Stein V, Dunsby C, Neil M A, French P M, deMello A J, Abell C, Hollfelder F. Anal. Chem., 2009, 81(1): 302-306
25 Jiang L, Mancuso M, Lu Z, Akar G, Cesarman E, Erickson D. Sci. Rep., 2014, 4: 4137
26 Schneegass I, Brautigam R, Kohler J M. Lab Chip, 2001, 1(1): 42-49
27 Tachibana H, Saito M, Shibuya S, Tsuji K, Miyagawa N, Yamanaka K, Tamiya E. Biosens. Bioelectron., 2015, 74: 725-730
28 Sun K, Yamaguchi A, Ishida Y, Matsuo S, Misawa H. Sensor. Actuat. BChem., 2002, 84(23): 283-289
29 Fukuba T, Yamamoto T, Naganuma T, Fujii T. Chem. Eng. J., 2004, 101(13): 151-156
30 Hashimoto M, Chen P C, Mitchell M W, Nikitopoulos D E, Soper S A, Murphy M C. Lab Chip, 2004, 4(6): 638-645
31 Park N, Kim S, Hahn J H. Anal. Chem., 2003, 75(21): 6029-6033
32 Dorfman K D, Chabert M, Codarbox J H, Rousseau G, de Cremoux P, Viovy J L. Anal. Chem., 2005, 77(11): 3700-3704
33 Shu B W, Zhang C S, Xing D. Anal Chim Acta, 2014, 826: 51-60
34 Wang W, Li Z X, Luo R, Lu S H, Xu A D, Yang Y J. J. Micromech. Microeng., 2005, 15(8): 1369-1377
35 Sciancalepore A G, Polini A, Mele E, Girardo S, Cingolani R, Pisignano D. Biosens. Bioelectron., 2011, 26(5): 2711-2715
36 Wang H Y, Zhang C S, Xing D. Microchim. Acta, 2011, 173(34): 503-512
37 Zhang C S, Wang H Y, Xing D. Biomed. Microdevices, 2011, 13(5): 885-897
38 Chen Z, Qian S, Abrams W R, Malamud D, Bau H H. Anal. Chem., 2004, 76(13): 3707-3715
39 Krishnan M, Ugaz V M, Burns M A. Science, 2002, 298(5594): 793-793
40 Agrawal N, Ugaz V M. Clin. Lab. Med., 2007, 27(1): 215
41 Wheeler E K, Benett W, Stratton P, Richards J, Chen A, Christian A, Ness K D, Ortega J, Li L G, Weisgraber T H, Goodson K E, Milanovich F. Anal. Chem., 2004, 76(14): 4011-4016
42 Sun Y, Kwok Y C, Nguyen N T. Lab Chip, 2007, 7(8): 1012-1017
43 Sun Y, Nguyen N T, Kwok Y C. Anal. Chem., 2008, 80(15): 6127-6130
44 Xu Z R, Wang X, Fan X F, Wang J H. Microchim. Acta, 2010, 168(12): 71-78
45 Nakano H, Matsuda K, Yohda M, Nagamune T, Endo I, Yamane T. Biosci. Biotechnol. Biochem., 1994, 58(2): 349-352
46 Agrawal N, Hassan Y A, Ugaz V M. Angew. Chem. Int. Edit., 2007, 46(23): 4316-4319
47 Guttenberg Z, Muller H, Habermuller H, Geisbauer A, Pipper J, Felbel J, Kielpinski M, Scriba J, Wixforth A. Lab Chip, 2005, 5(3): 308-317
48 Woolley A T, Hadley D, Landre P, deMello A J, Mathies R A, Northrup M A. Anal. Chem., 1996, 68(23): 4081-4086
49 Lagally E T, Emrich C A, Mathies R A. Lab Chip, 2001, 1(2): 102-107
50 Lagally E T, Scherer J R, Blazej R G, Toriello N M, Diep B A, Ramchandani M, Sensabaugh G F, Riley L W, Mathies R A. Anal. Chem., 2004, 76(11): 3162-317051 Kaigala G V, Huskins R J, Preiksaitis J, Pang X L, Pilarski L M, Backhouse C J. Electrophoresis, 2006, 27(19): 3753-3763
52 Beyor N, Yi L N, Seo T S, Mathies R A. Anal. Chem., 2009, 81(9): 3523-3528
53 Thaitrong N, Toriello N M, Del Bueno N, Mathies R A. Anal. Chem., 2009, 81(4): 1371-1377
54 Li Y Y, Zhang C S, Xing D. Microfluid. Nanofluid., 2011, 10(2): 367-380
55 Chen L, West J, Auroux P A, Manz A, Day P J. Anal. Chem., 2007, 79(23): 9185-9190
56 ZHAO ShuMi, ZHU Ling, ZHU CanCan, LI Yang, WANG HuaDong, ZHANG Long, DU DiWei,DENG GuoQing, WANG An, LIU Yong. Chinese J. Anal.Chem., 2014, 42(10): 1393-1399
趙樹彌, 朱 靈, 朱燦燦, 李 陽, 王華東, 張 龍, 堵棣威, 鄧國慶, 王 安, 劉 勇. 分析化學, 2014, 42(10): 1393-1399
57 Ramalingam N, Rui Z, Liu H B, Dai C C, Kaushik R, Ratnaharika B, Gong H Q. Sensor. Actuat. BChem., 2010, 145(1): 543-552
58 Hatch A C, Ray T, Lintecum K, Youngbull C. Lab Chip, 2014, 14(3): 562-568
59 Frey O, Bonneick S, Hierlemann A, Lichtenberg J. Biomed. Microdevices, 2007, 9(5): 711-718
60 Norian H, Field R M, Kymissis I, Shepard K L. Lab Chip, 2014, 14(20): 4076-4084
61 Sun Y, Zhou X, Yu Y. Lab Chip, 2014, 14(18): 3603-3610
62 Sun H, Olsen T, Zhu J, Tao J, Ponnaiya B, Amundson S A, Brenner D J, Lin Q. RSC Adv., 2015, 5(7): 4886-4893
63 Vogelstein B, Kinzler K W. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(16): 9236-9241
64 Tian Q C, Yu B D, Mu Y, Xu Y A, Ma C C, Zhang T, Jin W, Jin Q H. RSC Adv., 2015, 5(100): 81889-81896
65 Pjescic I, Crews N. Lab Chip, 2012, 12(14): 2514-2519
66 Fang T H, Ramalingam N, Dong X D, Ngin T S, Zeng X T, Lai Kuan A T L, Huat E Y P, Gong H Q. Biosens. Bioelectron., 2009, 24(7): 2131-2136
67 Defever T, Druet M, RocheletDequaire M, Joannes M, Grossiord C, Limoges B, Marchal D. J. Am. Chem. Soc., 2009, 131(32): 11433-11441
68 Ferguson B S, Buchsbaum S F, Wu T T, Hsieh K, Xiao Y, Sun R, Soh H T. J. Am. Chem. Soc., 2011, 133(23): 9129-9135
69 Yeung S S, Lee T M, Hsing I M. J. Am. Chem. Soc., 2006, 128(41): 13374-13375
70 Hashimoto M, Barany F, Soper S A. Biosens. Bioelectron., 2006, 21(10): 1915-1923
71 Sun Y, Dhumpa R, Bang D D, Handberg K, Wolff A. Diagn. Micr. Infec. Dis., 2011, 69(4): 432-439
72 Sun Y, Dhumpa R, Bang D D, Hogberg J, Handberg K, Wolff A. Lab Chip, 2011, 11(8): 1457-1463
73 Anderson R C, Su X, Bogdan G J, Fenton J. Nucleic Acids Res., 2000, 28(12): e60
74 Easley C J, Karlinsey J M, Bienvenue J M, Legendre L A, Roper M G, Feldman S H, Hughes M A, Hewlett E L, Merkel T J, Ferrance J P, Landers J P. P. Natl. Acad. Sci. USA, 2006, 103(51): 19272-19277
75 Jiang X, Shao N, Jing W, Tao S, Liu S, Sui G. Talanta, 2014, 122: 246-250
76 Chang W H, Wang C H, Lin C L, Wu J J, Lee M S, Lee G B. Biosens. Bioelectron., 2015, 66: 148-154
77 Chao C Y, Wang C H, Che Y J, Kao C Y, Wu J J, Lee G B. Biosens. Bioelectron., 2016, 78: 281-289
Advance in Research of Microfluidic Polymerase Chain Reaction Chip
HE QiDi, HUANG DanPing, HUANG Guan, CHEN ZuanGuang*
(School of Pharmaceutical Sciences, Sun Yatsen University, Guangzhou 510006, China)
Abstract Gene is the genetic code of human beings, and has only 0.1‰ difference among individuals but creates a weelthy divesity. Thus it has a huge application value to explore the difference. Polymerase chain reaction (PCR) is one of the technologies mostly used in genetic research. But traditional thermal cyclers are not only time and energyconsuming, but also difficult to be integrated and portable. The combination of microfluidics and PCR can decrease the reaction volume significantly and increase the reaction efficiency with easy integration and miniaturization. In this review, we briefly introduced microchamber PCR chip and continuousflow PCR chip according to their structures, and online detection methods including capillary electrophoresis, fluorescence, electrochemistry and DNA hybridization array. At last, we summarized the recent advances and pointed out the future development about microfluidic PCR chip.
Keywords Microfluidics; Polymerase chain reaction (PCR); Chip; Review
(Received 21 January 2016; accepted 25 February 2016)
This work was supported by the National Natural Science Foundation of China (No. 21375152)

