人cyclin B1對神經膠質瘤細胞增殖、侵襲和轉移的影響
高海濱,周劍云,王利清,王宇,孫煒
(中國康復研究中心北京博愛醫院 首都醫科大學康復醫學院,北京100068)
?
人cyclin B1對神經膠質瘤細胞增殖、侵襲和轉移的影響
高海濱,周劍云,王利清,王宇,孫煒
(中國康復研究中心北京博愛醫院 首都醫科大學康復醫學院,北京100068)
目的 探討人細胞周期素B1(cyclin B1)對神經膠質瘤細胞增殖、侵襲和轉移的影響。方法 將體外培養的神經膠質瘤細胞U87MG隨機分為high cyclin B1組、control cyclin B1組、cyclin B1 siRNA組、control siRNA組,high cyclin B1組、control cyclin B1組瞬時轉染pcDNA3.1 cyclin B1及空載體,cyclin B1 siRNA組、control siRNA組瞬時轉染pGCsi-U6/Neo/GFP/sh cyclin B1及空載體。轉染0、24、48、72 h時采用酶聯免疫檢測儀測定各組光密度(OD)值,轉染48 h時采用Transwell小室檢測侵襲及轉移細胞數。結果 培養24、48、72 h時high cyclin B1組OD值均高于control cyclin B1組(P均<0.05),cyclin B1 siRNA組均低于control siRNA組(P均<0.05)。培養48、72 h時high cyclin B1組OD值均高于cyclin B1 siRNA組(P均<0.05)。high cyclin B1組培養48 h時侵襲及轉移細胞數均高于control cyclin B1組及cyclin B1 siRNA組(P均<0.05),cyclin B1 siRNA組侵襲及轉移細胞數均低于control siRNA組(P均<0.05)。結論 cyclin B1可促進神經膠質瘤細胞增殖、侵襲和轉移。
神經膠質細胞瘤;細胞周期素B1;細胞增殖;侵襲;轉移
神經膠質瘤是中樞神經系統最常見的腫瘤,約占所有顱內腫瘤的45%,其發病機制尚未明確[1,2]。研究發現,細胞周期改變在腫瘤發生、發展過程中具有重要作用[3~5]。生理狀態下,細胞周期素可調節正常的細胞周期進程,但在惡性腫瘤患者或動物體內其表達異常升高[6]。人細胞周期素B1(cyclin B1)是經典的細胞分裂期周期蛋白,在細胞由G2期向M期轉換過程中發揮重要作用[4]。Song等[4]研究發現,cyclin B1高表達與食管癌的侵襲和轉移有關。但其與神經膠質瘤關系的報道較少。2014年12月~2015年6月,本研究觀察了cyclin B1對神經膠質瘤細胞增殖、侵襲和轉移的影響。現報告如下。
1 材料與方法
1.1 材料 神經膠質瘤細胞U87MG購自協和醫科大學細胞庫;cyclin B1購自美國Santa Cruz公司;LipfectimineTM2000轉染試劑盒及載體pcDNA3.1 cyclin B1、pGCsi-U6/Neo/GFP/sh cyclin B1均購自美國Invitrogen公司;Transwell小室購自北京樂博生物科技有限公司。
1.2 細胞培養及分組處理 神經膠質瘤細胞U87MG置于含10%胎牛血清的MEM培養基中,37 ℃、5% CO2培養箱中培養,至細胞融合90%~95%時,隨機分為high cyclin B1組、control cyclin B1組和cyclin B1 siRNA組、control siRNA組。high cyclin B1組、control cyclin B1組瞬時轉染pcDNA3.1 cyclin B1及空載體,cyclin B1 siRNA組、control siRNA組瞬時轉染pGCsi-U6/Neo/GFP/sh cyclin B1及空載體。
1.3 細胞增殖檢測 將轉染24 h的各組細胞均按2 000個/孔接種于96孔板,每孔體積為200 μL,將培養板置于37 ℃、5% CO2孵箱中培養。培養0、24、48、72 h時采用酶聯免疫檢測儀測定各組光密度(OD)值,以OD值反映細胞增殖情況。
1.4 細胞轉移、侵襲能力檢測 將轉染48 h的各組細胞按1×105個/孔接種至Transwell小室,上室終體積為200 μL、下室終體積為800 μL,具體步驟參照試劑盒說明書。各組侵襲5 h,轉移4 h,甲醇固定30 min,結晶紫染色5 min,正置顯微鏡下拍照,計數侵襲及轉移細胞數。
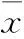
2 結果
2.1 各組細胞增殖情況比較 見表1。
2.2 各組細胞侵襲和轉移能力比較 見表2。
3 討論
神經膠質瘤惡性程度高、轉移速度快,患者預后本研究通過構建cyclin B1高、低表達細胞株和空載對照細胞株,觀察了不同cyclin B1表達對神經膠質瘤細胞增殖、侵襲和轉移的影響。結果表明,高表達cyclin B1的神經膠質瘤細胞增殖、侵襲及轉移能力均強于低表達cyclin B1細胞,表明cyclin B1具有促進神經膠質瘤發生、發展的作用。細胞遷移是腫瘤轉移的關鍵[14]。Song等[4]報道,cyclin B1可增加食管內皮細胞和肺內皮細胞的遷移能力。Kang等[11]研究發現,cyclin B1/CDC2復合物激活可導致細胞核Lamins和Vimentin磷酸化,參與重組細胞核骨架與細胞骨架之間的纖維網,促進微細絲重組。由此推測,cyclin B1高表達可能通過改變神經膠質瘤細胞骨架,進而促進腫瘤細胞外滲,增加細胞的侵襲和轉移能力。
表1 各組細胞增殖情況比較±s)
注:與control cyclin B1組同時間點比較,*P<0.05;與control siRNA組同時間點比較,△P<0.05;與cyclin B1 siRNA組比較,#P<0.05。

表2 各組培養48 h侵襲及轉移細胞數比較(個,±s)
注:與control cyclin B1組比較,*P<0.05;與control siRNA組比較,△P<0.05;與cyclin B1 siRNA組比較,#P<0.05。較差。研究發現,神經膠質瘤細胞增殖、侵襲、轉移與基因突變、細胞周期失調等密切相關。cyclin B1是細胞周期素cyclin B家族的一員,其基因由9個外顯子和8個內含子組成。在細胞周期S期、G2期cyclin B1表達逐漸升高,在G2晚期表達量達到峰值,激活CDC2激酶,形成cyclin B1/CDC2復合物,通過裂解一系列底物蛋白,使細胞進入有絲分裂期,促進細胞由G2期進入M期。cyclin B1/CDC2復合物是推動細胞從DNA合成向有絲分裂轉換的動力[7]。有絲分裂促進因子(MPF)是精確調控有絲分裂的關鍵點,cyclin B1通過調節MPF活性而調節有絲分裂的起始和終止。cyclin B1合成、降解及亞細胞定位異常等均可導致MPF活性異常,引起細胞周期紊亂,細胞增殖異常,最終導致疾病的發生[8~11]。cyclin B1高表達可激活與其相關的CDC2激酶活性,取消G2/M期阻滯[5],激活細胞有絲分裂,導致細胞過度增殖,促進腫瘤的發生、發展[8]。多種惡性腫瘤組織中可檢測到cyclin B1異常表達。Liu等[12]研究發現,非諾貝特可誘導頭頸部鱗狀細胞癌G2/M期阻滯和調亡,降低CDK1/cyclin B1激酶復合物活性可能是其作用機制。Calvisi等[13]發現,胃癌組織中cyclin B1表達增加,其表達量與淋巴結轉移有關。
總之,cyclin B1高表達可促進神經膠質瘤細胞的增殖、侵襲和轉移,但其作用機制有待進一步探討。
[1] Chambers AF, Groom AC, MacDonald IC. Dissemination and growth of cancer cells in metastatic sites[J]. Nat Rev Cancer, 2002,2(8):563-572.
[2] Fidler IJ. The pathogenesis of cancer metastasis: the ′seed and soil′ hypothesis revisited[J]. Nat Rev Cancer, 2003,3(6):453-458.
[3] Karreth F, Tuveson DA. Twist induces an epithelial-mesenchymal transition to facilitate tumor metastasis[J]. Cancer Biol Ther, 2004,3(11):1058-1059.
[4] Song Y, Zhao C, Dong L, et al. Overexpression of cyclin B1 in human esophageal squamous cell carcinoma cells induces tumor cell invasive growth and metastasis[J]. Carcinogenesis, 2008,29(2):307-315.
[5] Park M, Chae HD, Yun J, et al. Constitutive activation of cyclin B1-associated cdc2 kinase overrides p53-mediated G2-M arrest[J]. Cancer Res, 2000,60(3):542-545.
[6] Guardavaccaro D, Pagano M. Stabilizers and destabilizers controlling cell cycle oscillators[J]. Mol Cell, 2006,2(1):1-4.
[7] Taylor WR, Stark GR. Regulation of the G2/M transition by p53[J]. Oncogene, 2001,20(15):1803-1815.
[8] 秦麗莉,樊飛躍,詹啟敏.Cyclin B1在細胞周期調控及腫瘤發生發展中的作用[J].醫學研究雜志,2008,37(1):8-10.
[9] Yu M, Zhan Q, Finn OJ. Immune recognition of cyclin B1 as a tumor antigen is a result of its overexpression in human tumors that is caused by non-functional p53[J]. Mol Immunol, 2002,38(12):981-987.
[10] Pantel K, Brakenhoff RH. Dissecting the metastatic cascade[J]. Nat Rev Cancer, 2004,4(6):448-456.
[11] Kang Y, Massague J. Epithelial-mesenchymal transitions: twist in development and metastasis[J]. Cell, 2004,118(3):277-279.
[12] Liu J, Ge YY, Zhu HC, et al. Fenofibrate increases radiosensitivity in head and neck squamous cell carcinoma via inducing G2/M arrest and apoptosis[J]. Asian Pac J CancerPrev, 2014,15(16):6649-6655.
[13] Calvisi DF, Simile MM, Ladu S, et al. Activation of v-Myb avian myeloblastosis viral oncogene homolog-like2 (MYBL2)-LIN9 complex contributes to human hepatocarcinogenesis and identifies a subset of hepatocellular carcinoma with mutant p53[J]. Hepatology, 2011,53(4):1226-1236.
[14] Yamashiro S, Yamakita Y, Hosoya H, et al.Phosphorylation of non-muscle caldesmon by p34cdc2 kinase during mitosis[J]. Nature, 1991,349(6305):169-172.
孫煒(E-mail: sunwei7777@126.com)
10.3969/j.issn.1002-266X.2016.40.013
R739.4
A
1002-266X(2016)40-0043-02
2016-04-12)

