遠志皂苷類成分及其在動物體內代謝過程的研究進展
朱璋佩,王建,黃立華,高天慧
·綜述進展·
遠志皂苷類成分及其在動物體內代謝過程的研究進展
朱璋佩,王建,黃立華,高天慧
目的:綜述遠志皂苷類及其水解產物的結構類型以及體內過程研究進展,為深入研究該類成分的體內物質基礎及作用機制提供參考。方法:查閱文獻,歸納分析總結。結果:遠志皂苷結構復雜,目前文獻報道的共有百余種,大多數遠志皂苷的基本母核為細葉遠志皂苷元,其衍生物共有49種;大多數遠志皂苷性質不穩定,經堿水解后,成分穩定,生物活性顯著,其水解產物結構確切者有5個。遠志皂苷可在胃腸道菌群中發生去糖基化等復雜的生物轉化,其代謝產物主要通過被動擴散方式進行吸收;吸收入血成分中不僅有代謝產物,還有多種皂苷原型。結論:遠志皂苷及其堿水解產物在體內經過生物轉化后產生的次生代謝產物中有多種活性成分,具有重要藥用價值。
遠志皂苷;水解產物;體內過程
遠志為2015版中國藥典收載中藥,具有安神益智,祛痰開竅,消散癰腫功效,用于心腎不交引起的失眠多夢、健忘驚悸、神志恍惚、咳痰不爽等癥[1]。有祛痰鎮咳、抗癡呆、鎮靜、催眠、保護心腦血管等藥理作用[2]。遠志中含有皂苷類、 酮類、糖酯類等成分,其中皂苷成分最多,是遠志的祛痰、鎮咳的活性成分[3]。本課題組[4]研究發現它亦是引起胃動力障礙、粘膜損傷的成分。遠志皂苷經水解,產物為次級苷和苷元,大部分為齊墩果酸衍生物。本文對遠志皂苷及其水解產物的化學成分類型和體內過程進行綜述,以期為深入研究遠志和闡明其作用原理提供參考。
1 遠志皂苷類成分
1.1 遠志皂苷類
目前遠志中已分離并鑒定出百余種遠志皂苷,均為五環三萜類,其基本母核為齊墩果酸,包括細葉遠志皂苷元、2β-羥基-24-去甲基-4(23)-烯基齊墩果酸、遠志皂苷元及遠志酸等。其中以細葉遠志皂苷元為基本母核的皂苷元衍生物最多,有49種,包括Tenuifolin、desaylsenegasaponin b、desaylsenegasaponin c、desaylsenegasaponin III、Z-onjisaponin A、Οnjisaponin D[5-7]及表1中各結構。這些皂苷在結構上具有以下特點:C28位上的酰基有較大差別,在C3和C28位均連有糖鏈,且3位連接的糖均為D-Glc,28位連接另一3-6個單糖的低聚糖,均具有的糖鏈為β-D-Glc,β-D-Fuc,α-L-Rha;除Polygalasaponin XXVIII低聚糖無任何酰基外,與C28相連的Fuc的R1位上取代基以鼠李糖為多,R2位多被對甲氧基肉桂酸或3,4,5-三甲氧基肉桂酸酰基化;Rha的R3位及Xyl的R4、R5位上也常有取代基,且R3、R5上取代基分別僅為Api和Gal,R3的Api的C5上有時連有HMG,R4的取代基主要為Ara,僅Tenuifoside A上R4的取代基為Xyl。此外,遠志皂苷中的一些肉桂酰基存在E-與Z-型異構體,在己知的遠志皂苷天然產物中,MC的雙鍵構型多為E式,而Z式構型較不穩定,含量較低;TC一般均為E式構型,到目前為止并未發現Z-TC。
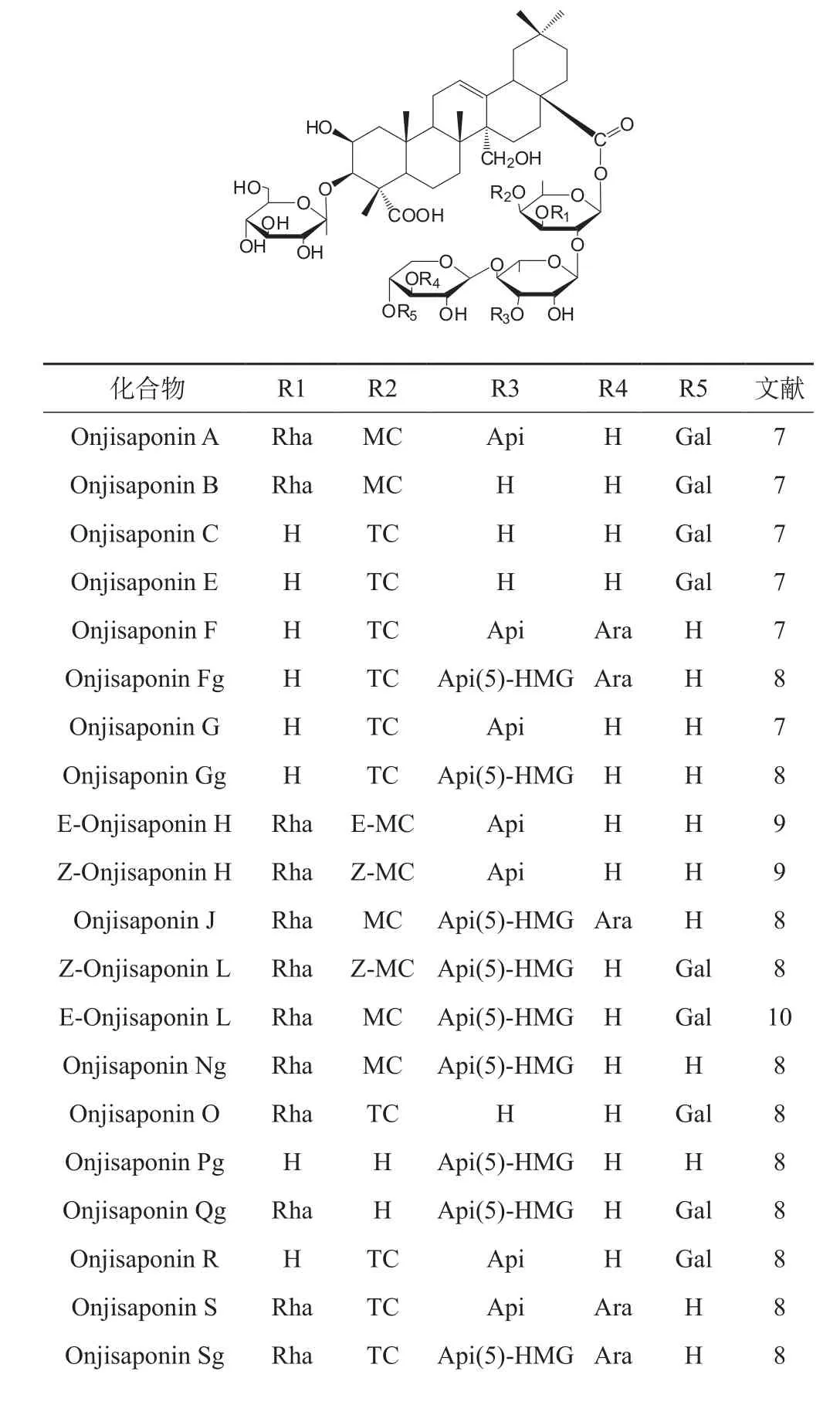
表1 遠志皂苷中具有細葉遠志皂苷母核的化合物
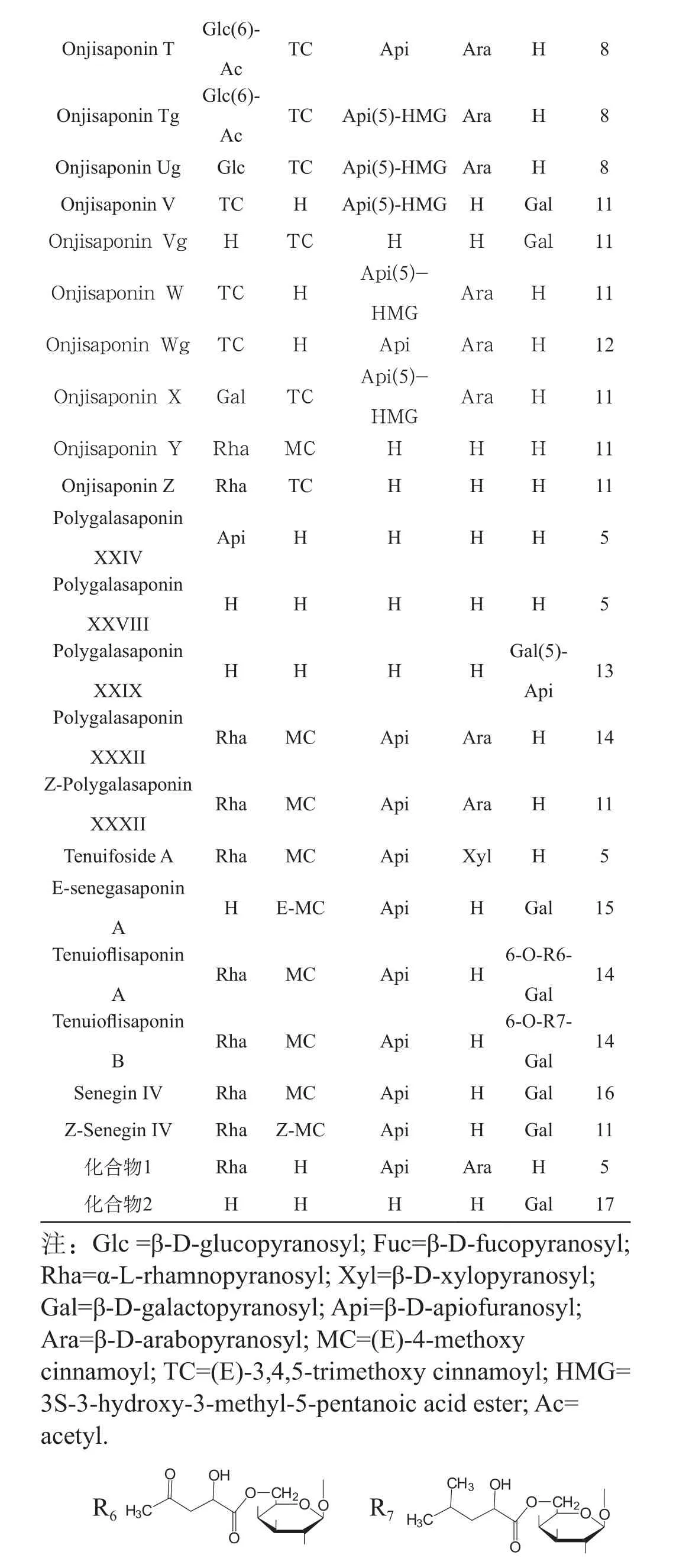
Οnjisaponin T Glc(6)-Ac TC Api Ara H 8 TC Api(5)-HMG Ara H 8 Οnjisaponin Ug Glc TC Api(5)-HMG Ara H 8 Οnjisaponin V TC H Api(5)-HMG H Gal 11 Onjisaponin Vg H TC H H Gal 11 Onjisaponin W TC H Οnjisaponin Tg Glc(6)-Ac Api(5)-HMG Ara H 11 Onjisaponin Wg TC H Api Ara H 12 Onjisaponin X Gal TC Api(5)-HMG 13 Polygalasaponin XXXII Rha MC Api Ara H 14 Z-Polygalasaponin XXXII Ara H 11 Onjisaponin Y Rha MC H H H 11 Οnjisaponin Z Rha TC H H H 11 Polygalasaponin XXIV Api H H H H 5 Polygalasaponin XXVIII H H H H H 5 Polygalasaponin XXIX HH HH Gal(5)-Api Rha MC Api Ara H 11 Tenuifoside A Rha MC Api Xyl H 5 E-senegasaponin A H E-MC Api H Gal 15 Tenuioflisaponin A 14 Tenuioflisaponin B Rha MC Api H 6-Ο-R6-Gal 14 Senegin IV Rha MC Api H Gal 16 Z-Senegin IV Rha Z-MC Api H Gal 11化合物1 Rha H Api Ara H 5化合物2 H H H H Gal17 Rha MC Api H 6-Ο-R7-Gal注:Glc =β-D-glucopyranosyl; Fuc=β-D-fucopyranosyl; Rha=α-L-rhamnopyranosyl; Xyl=β-D-xylopyranosyl; Gal=β-D-galactopyranosyl; Api=β-D-apiofuranosyl; Ara=β-D-arabopyranosyl; MC=(E)-4-methoxy cinnamoyl; TC=(E)-3,4,5-trimethoxy cinnamoyl; HMG= 3S-3-hydroxy-3-methyl-5-pentanoic acid ester; Ac= acetyl. R6R7
化合物1和化合物2暫未見命名
1.2 遠志皂苷水解產物
遠志皂苷類型多、結構復雜、不穩定,對其進行水解,可以得到較穩定的化合物。楊雙革等[18]對總皂苷酸水解后,確定了4個單體化合物;而王君等[19]對遠志皂苷進行堿水解,得到5個化合物,見圖1及表2。查閱文獻發現遠志酸-3-Ο-β-D-葡萄糖苷與黃花倒水蓮皂苷元A結構相同,但由于文獻中所用檢測方法不同,未能確定兩者是否為同一物質。比較其在酸水解與在堿水解中的含量,堿水解含量為酸水解的90倍,含量差異較大,且未見從遠志原植物中分離得到該化合物,其是否為遠志堿水解產物,還有待進一步驗證。比較兩種水解方法得到的產物可以發現,酸水解得到的產物均為次生皂苷元,產物結構不穩定,而堿水解產物主要是肉桂酸等小分子有機酸及細葉遠志皂苷,結構較穩定。
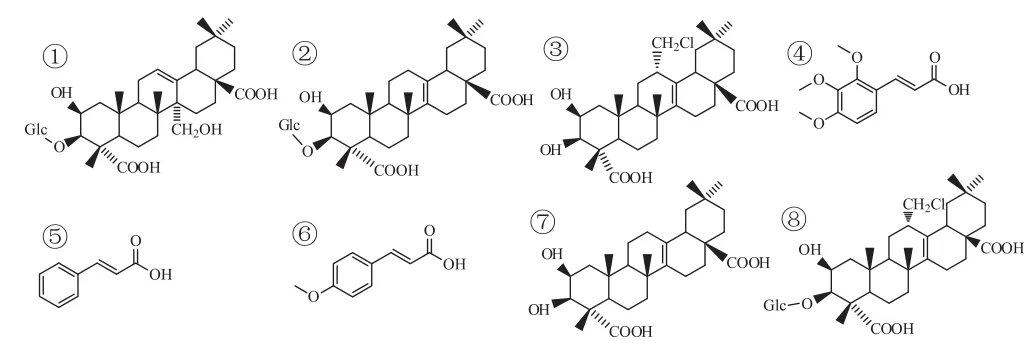
圖1 遠志水解產物結構

表2 遠志水解產物類型及含量
2 遠志在動物體內代謝過程
遠志皂苷為遠志的主要活性成分,目前研究多集中在復方、總皂苷及其水解產物方面,而對皂苷單體特別是其在動物體內的吸收、分布、代謝及排泄過程研究鮮見。
2.1 遠志皂苷在動物體內過程
2.1.1 遠志總苷體內過程據研究推測,皂苷類成分在動物體內大多經去糖基化反應、羥基化反應等一系列化學反應生成水溶性較好的代謝產物。Chunfang Liu等[16]分別對開心散的化學成分及其體內代謝產物進行鑒定,發現有7種遠志皂苷Οnjisaponin T、L、Ο、Ng、J、Senegin IV、III、polygalaponin XXXII為皂苷原型成分。梁鍵謀[20]給大鼠灌胃遠志總苷后,根據血及尿中代謝產物推測遠志提取物含有肉桂酸基團的糖脂類,其代謝途徑為酯鍵水解,芥子酰基上雙鍵的還原反應以及甲基化反應;甲基化反應主要發生在4位以及糖的6位羥基上。
2.1.2 遠志皂苷單體體內過程 目前已發現遠志皂苷單體中,僅見竇智[21]以理論推測和含藥血漿與空白血漿相對照的方法對大鼠灌胃給藥遠志皂苷B后的血漿中的代謝產物進行分析。發現遠志總苷B在胃腸道吸收迅速,且皂苷類在大鼠體內代謝后,容易脫去末端的部分糖基,并推測有3個可能的代謝物,但未弄清遠志皂苷B單體在體內的具體過程。
2.1.3 遠志代謝產物體內過程 遠志化學成分復雜,經口服后,某些成分在胃腸道中產生的代謝產物可經吸收后再代謝而發揮活性。3,4,5-三甲氧基肉桂酸和對甲氧基肉桂酸易透過胃腸單層細胞膜,在大鼠體內吸收良好,生物利用度高。研究其在腸道的吸收轉運機制,發現其在小腸上皮細胞上的轉運方式主要為被動擴散。研究其在腦部的分布發現肉桂酸和對甲氧基肉桂酸為有機酸,極性較強,不易透過血腦屏障[22]。有文獻[16]報道了大鼠靜脈注射3,4,5-三甲氧基肉桂酸和3,4,5-三甲氧基肉桂酸甲酯后的藥代力學特性,發現3,4,5-三甲氧基肉桂酸和3,4,5-三甲氧基肉桂酸甲酯在大鼠體內形式可互相轉化。而口服遠志后大鼠血漿中的3,4,5-三甲氧基肉桂酸及3,4,5-三甲氧基肉桂酸甲酯的藥-時曲線表明,兩者在15min至3h內維持穩定的濃度。這說明兩個化合物是源于遠志中的前體藥物——遠志皂苷E、F、G,蔗糖衍生物及其它化學結構里有3,4,5-三甲氧基肉桂酸結構的物質。水解及代謝產生的這類小分子化合物和相關小分子酚酸類在大鼠體內代謝也具有一定的規律,主要為肉桂酸側鏈雙鍵還原,3位或5位去甲氧基化及4位去羥基和去甲氧基化反應。
目前關于遠志皂苷體內過程及藥代動力學研究較少,皂苷單體化合物的體內過程研究更少。遠志及其復方給藥后動物的含藥血漿不僅可檢測到多種皂苷類原型,也可檢測到由皂苷類進入體內后發生了復雜的生物轉化生成的肉桂酸類小分子有機物等代謝產物。現有的研究也多集中在復方開心散及總苷方面,僅證實了皂苷給藥后可發生代謝轉化,發現了部分代謝產物,但是對代謝產物的藥理學、藥效學性質及體內特性等方面還未進行深入、系統的研究。
2.2 遠志水解產物在動物體內代謝過程
有研究表明皂苷類化合物通常在腸道內吸收較差,腸內滯留時間較長,易受到腸道菌群的作用,原型物常需經腸道菌群代謝后被水解,以苷元形式吸收后發揮其藥理作用[23]。黃立華[24]等通過在體單項腸灌流模型研究遠志水解產物在大鼠不同腸段的吸收特性,結果顯示細葉遠志皂苷在小腸易被吸收,在各腸段吸收呈結腸>空場>回腸>十二指腸趨勢,且其受P-糖蛋白外排影響,而不受多藥耐藥相關蛋白2的影響。王倩[22]進一步研究表明細葉遠志皂苷吸收較差,生物利用度低,而其透過胃腸單層細胞膜能力差,這可能是導致細葉遠志皂苷口服生物利用度低的原因。研究其在腸道的吸收轉運機制,發現其在小腸上皮細胞上的轉運方式主要為被動擴散,且無外排轉運機制。研究其在腦部的分布,發現細葉遠志皂苷可透過大鼠血腦屏障,透過率為4.99%。
3 討論
遠志皂苷是傳統益智中藥遠志的主要活性成分,現代研究發現其對老年癡呆癥具有明顯改善作用。關于遠志皂苷的研究現狀,尚存一些問題。首先遠志皂苷多具有3-Ο-(β-D- glucopyranosyl)-presenegenin 28-(2)-Ο--β-D-xylopyrnaosyl (1 → 4)-α-lrhamnopyranosyl (1 → 2)-β-D-fucopyranosyl ester結構,可進一步比較遠志屬中各物種中皂苷的結構特點,確定遠志中該結構是否為Polygala tenuifolia Willd.中皂苷的特征性結構。其次,遠志皂苷大多性質不穩定,其堿水解產物結構穩定,具有明顯的生理活性。有研究表明遠志堿水解產物對學習記憶障礙模型小鼠的空間參考記憶、再學習及工作能力有明顯的改善作用[19],且可促進PC12神經細胞增殖,抑制乙酰膽堿酯酶的活性[22],可深入該方面的研究,為闡明遠志抗老年癡呆的物質基礎、作用機制及發現新活性成分提供科學依據。其次,由于遠志皂苷結構不穩定,極易轉化,在胃腸道菌群作用下會發生一系列生物轉化,產生小分子有機酸。有研究發現遠志皂苷代謝過程產生的3,4,5-三甲氧基肉桂酸、對甲氧基肉桂酸和甲基3,4,5-三甲氧基肉桂酸具有延長小鼠苯巴比妥睡眠時間的藥理活性,故在考察口服遠志皂苷的藥效作用時,不可忽視胃腸道的生物轉化作用而僅僅考慮原型皂苷的作用,應結合其代謝產物來闡明其藥效物質基礎。最后,遠志皂苷既是鎮咳、祛痰活性成分,又是其胃腸毒性主要成分,那么在這兩種情況下,遠志皂苷在體內組織分布、入血成分及藥代參數有何差別?這些還有待進一步研究。研究現階段學者對皂苷類中人參皂苷Rg1、Rb1、柴胡皂苷及甘草皂苷等研究較多,可借鑒其技術手段,采用體內外結合及PK-PD結合模型的方法,明確遠志皂苷的代謝過程,闡明其真正的藥效組分及藥效、毒副作用機制,就遠志開發出安全、有效的藥物仍任重而道遠。
[1] 國家藥典委員會.中華人民共和國藥典:2015年版.一部[S].北京:中國醫藥科技出版社.2015:156.
[2] 劉大偉,康利平,馬百平.遠志化學及藥理作用研究進展[J].國際藥學研究雜志,2012,39(1):32.
[3] 倪建新,陳木水,林躍虹.遠志屬植物三萜皂苷及其生物活性研究進展[J].中藥材,2011,34(2):317.
[4] 田徽, 王建,武云,等.生遠志中總皂苷、生物堿、 酮、脂肪油的急性毒性研究[J].中藥藥理與臨, 2005, 21(4):50.
[5] Tun-Hai Xu, Gang Lv, Ya-Juan Xu,et al.A novel triterpenoid saponin from Polygala tenuifolia Willd.[J]. Journal of Asian Natural Products Research, 2008, 10(8):803.
[6] J. LI, Y. JIANG and P.-F. TU.New acylated triterpene saponins from Polygala tenuifolia willd [J]. Journal of Asian Natural Products Research,2006,8(6):499.
[7] T. Yabe, H. Tuchida,H. Kiyohara,et al. Induction of NGF synthesis in astrocytes by onjisaponins of Polygala tenuifolia, constituents of Kampo (Japanese herbal) medicine, Ninjin-Yoei-To [J]. International Journal of Phytotherapy and Phytopharmacology,2003,10(2), 106.
[8] Jiangyun Liu, Xuedong Yang, Jiuming He,et al. Structure analysis of triterpene saponins in Polygala tenuifolia by electrospray ionization ion trap multiple-stage mass spectrometry[J]. Journal of Mass Spectrom,2007,42(7):861.
[9] Li J, Jiang Y, Tu PF.New acylated triterpene saponins from Polygala tenuifolia willd[J].Journal Asian natural products research, 2006, 8(6):499.
[10] 劉江云.中藥經方開心散抗老年性癡呆的物質基礎研究[D].北京:中國協和醫科大學,2004.
[11] Li C, Yang J, Yu S, Chen N,et al.Triterpenoid saponins with neuroprotective effects from the roots of Polygala tenuifolia. [J].Journal of Medicinal Plant and Natural Product Research, 2008, 74(2):133.
[12] LI Chuang-Jun, YANG Jing-Zhi, YU Shi-Shan, et al.Triterpenoid Saponins and Οligosaccharides from the Roots of Polygala tenuifolia Willd[J].Chinese Journal of Natural Medicines,2011,9(5): 321.
[13] Mei Lan Jin, Dae Young Lee, Yurry Um,et al. Isolation and characterization of an oxidosqualene cyclase gene encoding a b-amyrin synthase involved in Polygala tenuifolia Willd. saponin biosynthesis[J].Plant Cell Reports,2014,33:511.
[14] 孫紅祥.免疫佐劑活性成分的分離及活性評價[D].浙江:浙江大學, 2005.
Research on chemical constituents and metabolic processes of Yuanzhi saponin/
ZHU Zhang-pei, WANG Jian, HUANG Li-hua, GAO Tian-hui//(School of Pharmacy, Chengdu University of Traditional Chinese Medicine; Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan)
Objective: To further research the bioactive components and integrative mechanism of Yuanzhi saponin by reviewing the structures and ADME process of Yuanzhi saponin and hydrolysis products. Method: The related literatures are reviewed. Result: Hundreds of Yuanzhi saponins have been reported with complex structures. Most saponins have tenuifolin as basic nucleus and 49 tenuigenin derivatives have been reported. Most Yuanzhi saponin are unstable. But the alkali hydrolysate are stable with significant bioactivity. The literatures have reported five hydrolysis products of Yuanzhi saponin with exact structures. Under the action of the gastrointestinal flora, deglycosylation and other complex biological transformation can happened to Yuanzhi saponin. The metabolites are mainly absorbed by passive diffusion. Most Yuanzhi saponin and metabolites can be absorbed into blood. Conclusion: Yuanzhi and its alkali hydrolysate contain various active constituents which have important medicinal value.
Yuanzhi;hydrolysates;processes in vivo



R 285
A
1674-926X(2016)04-018-05
國家自然科學基金資助項目(NΟ:81173567);四川省科技創新苗子工程資助項目(NΟ:2015008);大學生科研實踐創新課題資助項目(NΟ:ky2015-002)
成都中醫藥大學藥學院 中藥材標準化教育部重點實驗室 中藥資源系統研究與開發利用省部共建國家重點實驗室培養基地,四川 成都 611137
朱璋佩(1994-),女,在讀本科生
Tel:18380446609 Email:2521334588@qq.com
王建(1959-),女,教授,博士生導師,主要從事臨床中藥學方向研究
Tel:028-61800231 Email:jianwang08@163.com
2015-09-24

