功夫菊酯高效降解菌的篩選、鑒定及降解特性研究
王彥輝,杜良偉,李紅紅,封國君,羅 韜
(1.廣西壯族自治區農業科學院植物保護研究所,廣西作物病蟲害生物學重點實驗室, 廣西 南寧 530007;2.廣西大學化學化工學院,廣西 南寧 530007,3.廣西大學農藥與環境毒理研究所,廣西 南寧 530005)
?
功夫菊酯高效降解菌的篩選、鑒定及降解特性研究
王彥輝1,杜良偉2*,李紅紅3,封國君3,羅 韜3
(1.廣西壯族自治區農業科學院植物保護研究所,廣西作物病蟲害生物學重點實驗室, 廣西 南寧 530007;2.廣西大學化學化工學院,廣西 南寧 530007,3.廣西大學農藥與環境毒理研究所,廣西 南寧 530005)
以功夫菊酯為目標,從生產擬除蟲菊酯農藥廠污水處理口的淤泥里篩選高效降解真菌,并對降解菌進行鑒定和降解特性研究。經形態學和18S rDNA測序鑒定,該高效降解真菌為青霉菌(Penicilliumsp.)。采用色譜法對降解特性進行研究,結果表明:在pH=7.0,溫度30 ℃,底物濃度50 mg/L時降解效果最好,7 d時對功夫菊酯降解率達到83.90 %;該菌株還可降解溴氰菊酯、高效氯氰菊酯。
功夫菊酯;生物降解;青霉菌;降解特性
農藥產品在現代農業生產中發揮著重要作用,但同時其自身對人類健康及環境安全具有一定的威脅性,因此,低效、劇毒性以及高殘留農藥產品逐步被高效、低毒性、低殘留農藥產品所替代。擬除蟲菊酯農藥是作為目前最有發展前景的殺蟲劑,常用于防治一系列農業和衛生害蟲,其具有高效低毒低殘留等特性,使用量僅次于有機磷殺蟲劑[1]。由于擬除蟲菊酯農藥對光和熱穩定的特點,在環境中半衰期較長,且長期大量的使用勢必造成環境中農藥殘留蓄積,進而威脅到人類健康[2]。最近的研究表明長期大量接觸擬除蟲菊酯農藥有致癌的風險[3-5],因此,研究擬除蟲菊酯農藥殘留降解特性對農業安全生產、環境保護及人類健康均具有重要意義。
微生物降解是一種環保無污染的農藥消除方式,近幾年有關擬除蟲菊酯農藥降解菌的相關研究報道涉及芽孢桿菌(Bacillussp.)[6]、寡養單胞菌(Stenotrophomonassp.)[7]、金色鏈霉菌(Streptomycesaureus)[8]、枝孢菌(Cladosporiumsp.)[9]、蒼白桿菌(Ochrobactrumlupine)[10]、沼澤紅假單胞菌(Rhodopseudomonaspalustris)[11]、假單胞菌(Pseudomonassp.)[12]、紅球菌(Rhodococcussp.)[13]等方面,其中大部分降解菌是細菌,關于真菌降解菌的報道相對較少。
本研究以功夫菊酯為目標,從生產擬除蟲菊酯農藥廠污水處理口的淤泥里篩選高效降解真菌,并對降解菌進行鑒定和降解特性研究,旨在豐富擬除蟲菊酯農藥降解菌資源庫,為其在生物修復中的應用提供理論依據。
1 材料與方法
1.1 試劑
功夫菊酯標準品(98.00 %);溴氰菊酯、聯苯菊酯、氰戊菊酯、高效氯氰菊酯原藥(廣西田園生化股份有限公司),使用前甲醇溶解配制成儲備液,按照所需要濃度添加到培養基中;色譜純乙腈(美國Fisher公司);TIANampFungal DNA提取試劑盒、DL2000 DNA Marker(天根生化科技有限公司);10×PCR Buffer、dNTP mixture、Taq聚合酶(大連寶生物工程有限公司);其余均為國產分析純試劑。
1.2 培養基
無機鹽培養基(MSM):NH4NO31.0 g,K2HPO41.5 g,KH2PO40.5 g,NaCl 1.0 g,MgSO4·7H2O 0.1 g,FeSO40.025 g,微量元素1 mL,H2O 1000 mL,pH 7.2,121 ℃滅菌20 min。
PDA培養基(中國檢驗檢疫科學研究院北京陸橋技術有限責任公司生產)。YPD培養基:酵母膏10 g,蛋白胨 20 g,葡萄糖20 g,H2O 1000 mL,115 ℃滅菌15 min。以上培養基滅菌后加入功夫菊酯儲備液使其終質量濃度為20、50和100 mg/L。
1.3 儀器設備
Waters液相色譜儀(美國waters公司);恒溫搖床(上海智城分析儀器制造);GNP-9160型隔水式恒溫培養箱(上海慧泰儀器制造有限公司);SIGMA1-14離心機(德國SIGMA公司);PCR儀(Bio-Rad公司);DYY-7B電泳儀(北京六一儀器廠);超低溫冰箱(美國Thermo Fisher公司);pH計(上海雷磁有限公司);尼康光學顯微鏡(尼康儀器上海有限公司);Milli-Q超純水儀(美國密理博公司)。
1.4 試驗方法
1.4.1 分離與富集降解菌 取5.0 g活性淤泥加入50 mL的含50 mg/L功夫菊酯無機鹽培養基中,置于30 ℃恒溫搖床中180 r/min振蕩培養。7 d后取5 mL的該培養液加到新的含50 mg/L功夫菊酯無機鹽培養基中。按照上述操作連續培養6次。最終的培養液通過梯度稀釋涂布在MSM瓊脂培養基上,30 ℃培養5 d。將生長出的不同形態的菌落分離出來,通過在PDA平板上連續劃線分離純化菌落。將純化的菌株用20.00 %甘油于-80 ℃冷凍保存。
1.4.2 功夫菊酯降解菌的鑒定 ①降解菌形態學鑒定:參照《真菌鑒定手冊》[14],將真菌在PDA培養基上30 ℃培養5 d,通過肉眼觀察菌落形態和顯微鏡觀察菌絲、孢子形態等。②降解菌18SrDNA鑒定:采用試劑盒提取降解菌的總DNA進行18S rDNA擴增。采用18S rDNA的PCR反應的通用真菌引物,通用引物Primer1序列:TCCGTAGGTGAACCTGCGG;Primer2序列:TCCTCCGCTTATTGATATGC。反應體系:H2O 17.8 μl,Buffer 3 μl,dNTP 2 μl,Primer1 3 μl,Primer2 3 μl,DNA模板1 μl,酶0.2 μl,總體積3 0 μl。PCR條件:95 ℃變性,5 min;95 ℃,30 s;52 ℃,30 s;72 ℃,1 min;循環35次,72 ℃延伸10 min。PCR產物通過1.00 %瓊脂糖凝膠電泳純化回收,送華大基因公司測序。測序結果與GenBank的核酸序列進行同源性比對,選擇同源性高的序列以及對擬除蟲菊酯有降解功能的菌株的相關序列,使用MEGA(version 6.0)計算進化距離,用鄰近法構建系統發生樹,1000次隨機抽樣,計算自引導值以評估系統發生樹的置信度。
1.4.3 降解特性研究 從PDA平板上挑取單菌落,接種于50 mL YPD培養基中,于30 ℃搖床180 r/min培養3 d,離心收集菌體,用無機鹽培養基洗滌菌體2次后,以0.5 g/L的量接入無機鹽培養基中,以功夫菊酯為唯一碳源或者氮源,在30 ℃,轉速180 r/min條件下培養。同時進行空白對照即無菌對照用來評估化學水解。每隔一定的時間取2 mL均勻培養液在12 000 r/min下離心2 min,將上清液過0.22 μm的水相膜,用HPLC對濃度進行檢測并計算降解率。HPLC檢測條件:色譜柱為Zorbax Eclipse XDB-C18 (250×4.6 mm i.d.;5 μm);流動相為甲醇∶水=9∶1(v∶v),流速1.0 mL/min;紫外檢測器,檢測波長為218 nm,柱溫30 ℃;進樣量10 μl。功夫菊酯降解率η( %)按下式計算:
式中,C0為空白對照中功夫菊酯總濃度(mg/L),Ct為t時刻樣品培養液中功夫菊酯殘留濃度(mg/L)。
為了研究功夫菊酯濃度對降解菌降解效果的影響,在pH=7.0,溫度為30 ℃時,分別加入功夫菊酯使其濃度為20、50和100 mg/L。為了評估pH的影響,在溫度為30 ℃,功夫菊酯濃度為50 mg/L時,分別調無機鹽培養基的pH為5.0、7.0和9.0。同時還研究溫度對降解的影響,在pH=7.0和功夫菊酯濃度為50 mg/L時,調節溫度為20、30和40 ℃。
1.4.4 降解譜檢測 按1.4.3方法,將降解菌按0.5 g/L接入量分別接種于包含50 mg/L溴氰菊酯、高效氯氰菊酯、氰戊菊酯、聯苯菊酯的無機鹽培養基中,30 ℃和180 r/min條件下振蕩培養7 d,pH設定為7,測定菌株對溴氰菊酯、氰戊菊酯、高效氯氰菊酯和聯苯菊酯的降解率,每個處理設3次重復。
2 結果與分析
2.1 功夫菊酯降解菌的篩選與鑒定
按照上述的篩選方法從農藥廠排污口淤泥中分離到1株高效降解功夫菊酯的真菌菌株PN12,將該菌株接種于50 mg/L氟氯氰菊酯的無機鹽液體培養基中,于30 ℃、180 r/min培養7 d后,可降解功夫菊酯83.90 %。因此,將菌株PN12作為后續實驗的研究菌株。
2.1.1 菌株形態學特性 在PDA培養基上28 ℃培養,菌落生長初期菌絲為白色,到第3天菌落變為青色。菌絲有隔,分生孢子梗為掃帚狀,共有二輪分生孢子小梗,在第二輪分生孢子小梗的頂端分化出分生孢子。分生孢子為圓形或橢圓形(圖1)。
2.1.2 序列分析結果 采用試劑盒提取菌株DNA,進行PCR擴增及電泳檢測。PCR產物經純化后測序,測得該序列片段長為561 bp。對該菌株的ITS序列在NCBI上進行Blast基因同源性比對分析,菌株PN12與Penicilliumsp. YY26(JF727885.1)、Penicilliumsp. PTN19(KF656713.1)和Penicilliumoxalicum114-2(KF152942.1)等青霉有99.00 %的相似度。結合該菌株的形態學特征及序列比對結果,最終將該菌株鑒定為青霉(Penicilliumsp.)。在NCBI上選擇相似度高和具有降解擬除蟲菊酯類農藥的菌株序列,采用mega6.0步值法計算1000次做系統發育樹,其系統發育樹見圖2。
2.2 青霉降解功夫菊酯的特性
2.2.1 降解功夫菊酯的條件優化 采用單因素分析法,分別優化了溫度和pH,底物濃度等條件對青霉PN12在無機鹽中對功夫菊酯的降解效果,并對數據進行差異顯著性分析(P<0.05)。首先固定pH和底物濃度,考察溫度對青霉PN12降解功夫菊酯的影響。檢測結果(圖3)表明,溫度明顯影響青霉PN12降解功夫菊酯,30 ℃時培養7 d對功夫菊酯的降解效果最好,降解率為83.90 %;溫度20和35 ℃時降解率較低,降解率分別為53.50 %和64.30 %。這可能與該菌在30 ℃生長最佳有關。固定培養過程中的溫度和功夫菊酯濃度, 由pH值對青霉PN12降解功夫菊酯的影響可知(圖4),pH值對青霉PN12降解功夫菊酯的影響比較明顯,pH 在6和7時降解效果好,降解率分別為80.90 %和81.30 %,pH為4時降解率最低,為33.40 %,可見pH是影響青霉降解功夫菊酯的一個重要因素。pH值太低和太高會抑制該菌的生長。由底物濃度對功夫菊酯的降解的影響(圖5)可知,菌株青霉PN12對不同濃度的功夫菊酯底物的降解效果差異不顯著,對50 mg/L功夫菊酯的降解率最大。青霉PN12對不同濃度的功夫菊酯的降解符合一級反應動力學方程。在溫度為30 ℃,pH為7時,青霉PN12對50 mg/L功夫菊酯的降解效果最好,7 d的降解率達到83.90 %。該溫度和pH同時也是青霉PN12生長的最好條件。
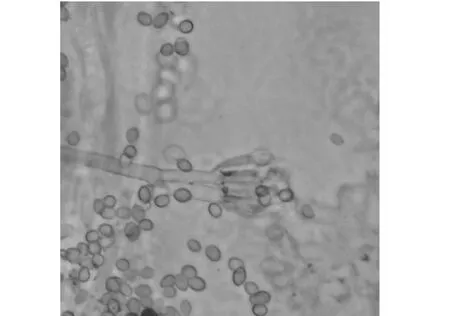
圖1 菌株PN12在顯微鏡下的孢子形態特征Fig.1 The spore morphological characteristics of PN12
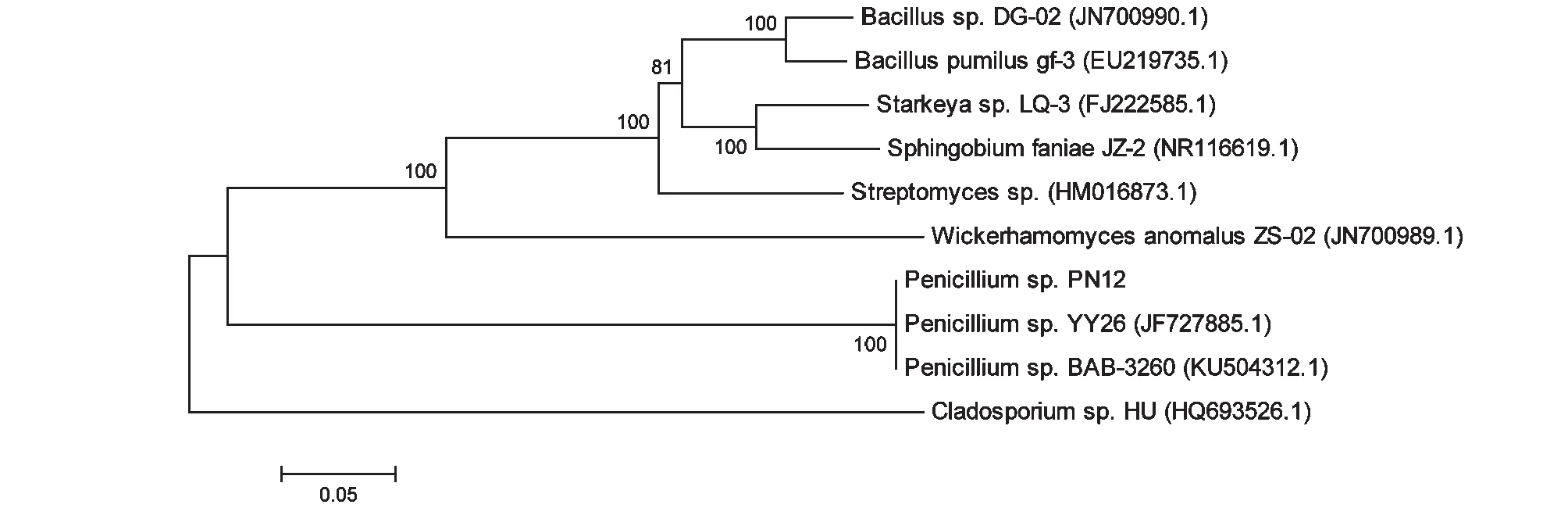
圖2 菌株PN12的系統發育樹Fig.2 Phylogenetic tree based on the 18S rRNA gene sequence of strain PN12 and related species
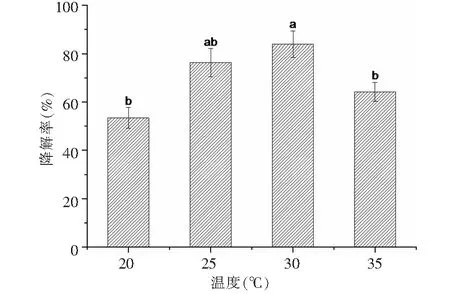
圖3 不同溫度下青霉PN12降解功夫菊酯效果Fig.3 Degradation of lambda-cyhalothrin at different temperatures
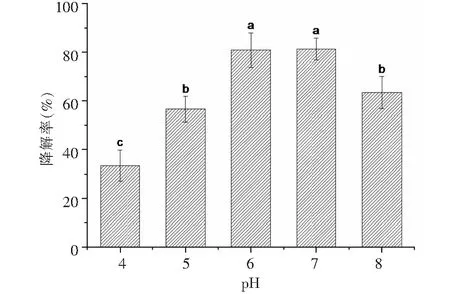
圖4 不同pH下青霉PN12降解功夫菊酯效果Fig.4 Degradation of lambda-cyhalothrin at different pH values
2.2.2 降解譜檢測 將青霉PN12按照上述條件培養,采用色譜法分別測定其對溴氰菊酯、高效氯氰菊酯、氰戊菊酯和聯苯菊酯的降解效果,結果見圖6。其中對溴氰菊酯和高效氯氰菊酯的降解效果較好,分別為64.30 %和57.10 %,對氰戊菊酯和聯苯菊酯的降解率分別為18.90 %和15.30 %。這可能是由于不同的擬除蟲菊酯類農藥結構差異所造成的。
3 小結與討論
從生產擬除蟲菊酯農藥廠污水處理口的淤泥里篩選得到一株對功夫菊酯具有降解能力的真菌,通過形態學特征并結合ITS序列比對分析,將該菌株鑒定為青霉。該菌在pH=7.0,溫度30 °C時,以0.5 g/L的菌量接種到含50 mg/L功夫菊酯的無機鹽培養基中,7 d內能降解83.90 %的功夫菊酯。目前,報道的降解擬除蟲菊酯類農藥的降解菌大部分為細菌和酵母,而絲狀真菌較少[15]。
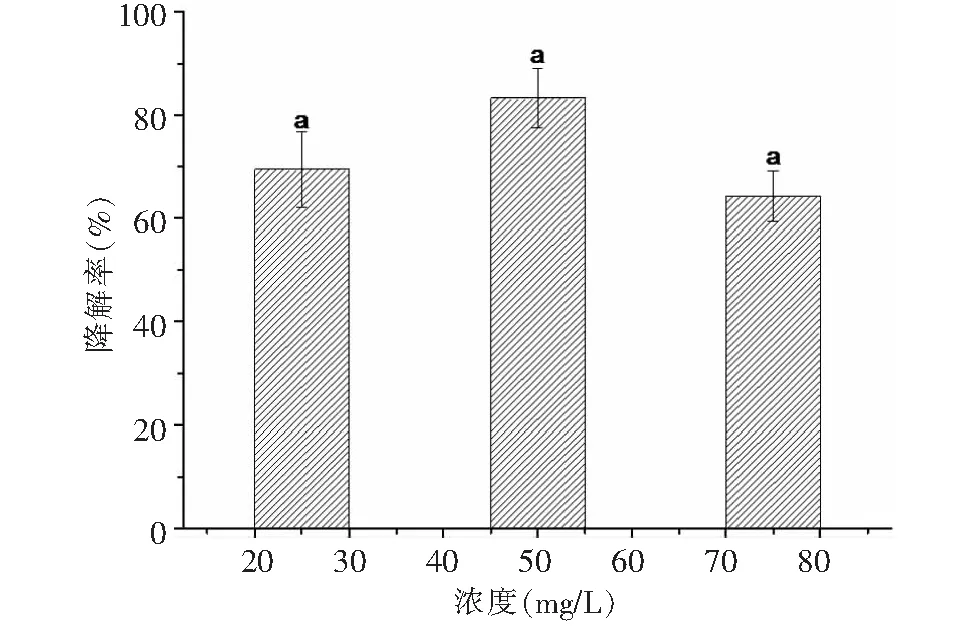
圖5 青霉PN12對不同濃度的降解功夫菊酯的降解效果Fig.5 Effect of initial lambda-cyhalothrin concentration on its degradation
同時對降解譜進行檢測發現其還能降解溴氰菊酯、高效氟氯氰菊酯,但不能降解聯苯菊酯和氰戊菊酯。且已有報道的該屬的草酸青霉ZHJ6可降解甲胺磷、阿特拉津、氯磺隆等農藥,還可以用于降解纖維素等大分子碳水化合物[15]。可見該菌應用比較廣泛,具有較大的開發潛力。
國內外針對農藥降解菌的篩選做了大量的工作,但僅局限于實驗室條件下的純培養和降解,然而在從實驗室走向田間時受各種因素的影響和制約,應用效果并不理想。同時降解菌應用于田間后的安全性還有待進一步評價。因此,需進一步開展降解機理的研究和環境安全性評價的工作。
[1]王兆守,李順鵬.擬除蟲菊酯類農藥微生物降解研究進展[J].土壤, 2005, 37(6): 577-580.
[2]Al-Makkawy H K, Madbouly M D. Persistence and accumulation of some organic insecticides in Nile water andfish[J]. Resources Conservation and Recycling,1999, 27(1-2): 105-115.
[3]Kolaczinski J H, Curtis C F. Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides: Areview of the debate[J]. Food and Chemical Toxicology, 2004,42(5): 697-706.
[4]Mohnssen H M. Chronic sequelae and irreversible injuriesfollowing acute pyrethroidintoxication[J]. Toxicology Letters,1999, 107(1-3): 161-176.
[5]Shukla Y, Yadav A, Arora A. Carcinogenic and co-carcinogenic potential of cypermethrin on mouse skin[J]. CancerLetters, 2002, 182(1): 33-41
[6]Chen S H, Chang C Q, Deng Y Y, et al. Fenpropathrin biodegradation pathway inBacillussp. DG-02 and its potential for bioremediation of pyrethroid-contaminated soils[J].Journal of Agricultural and Food Chemistry,2014, 62: 2147-2157.
[7]Chen S H, Yang L, Hu M Y, et al.Biodegradation of fenvalerate and 3-phenoxybenzoic acidby a novelStenotrophomonassp. strain ZS-S-01 and its usein bioremediation of contaminated soils[J].Appl. Microbiol. Biotechnol., 2011,90:755-767.
[8]Chen S H, Lai K P, Li Y N, et al. Biodegradation of deltamethrin and its hydrolysis product3-phenoxybenzaldehyde by a newly isolatedStreptomycesaureusstrain HP-S-01[J]. Applied Microbiology & Biotechnology, 2011,90:1471-1483.
[9]Chen S H, Hu Q B, Hu M Y, et al. Isolation and characterization of a fungus able to degrade pyrethroidsand 3-phenoxybenzaldehyde[J].Bioresource Technology, 2011,102:8110-8116.
[10]Chen S H,Hu M Y,Liu J J, et al.Biodegradation of beta-cypermethrin and 3-phenoxybenzoic acid by a novelOchrobactrumlupiniDG-S-01[J]. Journal of Hazardous Materials, 2011,187:433-440.
[11]尹樂斌,張德詠,劉 勇,等.降解氯氰菊酯光合細菌的分離鑒定及降解特性研究[J].生態環境學報, 2010,19(8): 1881-1886.
[12]Murugesan A G,Jeyasanthi T, Maheswari S. Isolation andcharacterization of cypermethrin utilizing bacteria from Brinjal cultivated soil[J]. African Journal of Microbiology Research, 2010, 4(1):10-13.
[13]許育新,李曉慧,滕齊輝,等.氯氰菊酯污染土壤的微生物修復及對土著微生物的影響[J].土壤學報, 2008, 45(4): 693-698.
[14]魏景超. 真菌鑒定手冊[M]. 上海: 上海科學技術出版社, 1979.
[15]Zhao R B, Bao H Y, Liu Y X. Isolation and characterization ofPenicilliumoxalicumZHJ6 for biodegradation of methamidophos[J]. Agricultural Sciences in China,2010,9(5):101-105.
(責任編輯 汪羽寧)
Screening, Identification and Characteristics of Lambda-cyhalothrin Degrading Fungus
WANG Yan-hui1, DU Liang-wei2*, LI Hong-hong3, FENG Guo-jun3,LUO Tao3
(1.Plant Protection Research Institute, Guangxi Academy of Agricultural Sciences,Guangxi Nanning 530007, China;2.Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pests, Guangxi Nanning 530007, China; 3.College of Chemistry and Chemical Engineering, Guangxi University, Guangxi Nanning 530007, China; 4.Institute of Pesticide & Environmental Toxicology, Guangxi University, Guangxi Nanning 530005, China)
A strain of cyhalothrin-degrading fungus was isolated from activated sludge from wastewater outlet of a pesticide factory. The strain was identified asPenicilliumsp. by morphological characteristics analysis and 18S rDNA sequence analysis. The degrading characteristics of this fungus for lambda-cyhalothrin were investigated with HPLC. The optimal conditions for the fungus to degrade lambda-cyhalothrin were as follows: pH 7.0, 30 ℃ and 50 mg/L. Under this condition, the strain could degrade 83.90 % of lambda-cyhalothrinin medium after 7 d. The strain also degraded deltamethrin and beta-cypermethrin.
Lambda-cyhalothrin;Biodegradation;Penicilliumsp.;Degradation characteristics
1001-4829(2016)08-1879-05
10.16213/j.cnki.scjas.2016.08.022
2016-04-19
廣西農業科學院基本科研業務專項(桂農科2014YD11);廣西作物病蟲害生物學重點實驗室基金項目(14-045-50-ST-08)
王彥輝(1984-),男,河南開封人,博士,副研究員,主要從事農藥污染與生物修復工作,*為通訊作者,E-mail:dulily@gxu.edu.cn。
S482;Q938
A

