羊肚菌生物轉化玉米醇溶蛋白液體發(fā)酵工藝優(yōu)化
文超婷 鄭明珠 修 琳 盛 悅 劉景圣 蔡 丹
(吉林農業(yè)大學食品科學與工程學院 小麥和玉米深加工國家工程實驗室,長春 130118)
羊肚菌生物轉化玉米醇溶蛋白液體發(fā)酵工藝優(yōu)化
文超婷 鄭明珠 修 琳 盛 悅 劉景圣 蔡 丹
(吉林農業(yè)大學食品科學與工程學院 小麥和玉米深加工國家工程實驗室,長春 130118)
要以玉米蛋白粉為主要原料,采用羊肚菌對其發(fā)酵培養(yǎng),確定羊肚菌生物轉化玉米醇溶蛋白的培養(yǎng)基配方和培養(yǎng)條件。結果表明:羊肚菌生物轉化玉米醇溶蛋白液體發(fā)酵最適培養(yǎng)基配方為:葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%,此條件下,得出菌絲體生物量為1.62 g/100 mL,蛋白轉化率為27.51%。在最適培養(yǎng)基配方的基礎上,液體發(fā)酵培養(yǎng)條件為:接種量10%,培養(yǎng)溫度26 ℃,初始pH 4,裝液量100 mL /500 mL。在此優(yōu)化條件下,試驗驗證得出菌絲體生物量為2.41 g/100 mL、蛋白轉化率為36.69%。
玉米醇溶蛋白 羊肚菌 液體發(fā)酵 菌絲體生物量 蛋白轉化率
玉米蛋白粉中主要的蛋白是玉米醇溶蛋白,占蛋白總量的50%~60%。根據mckinney[1]分類成α型和β型。Tatham[2]研究表明玉米醇溶蛋白分子形狀呈橢圓、長棒球狀,長軸與直徑的比例為7∶1或28∶1。玉米醇溶蛋白的性質由其特殊氨基酸組成決定,特殊的氨基酸組成導致其具有良好的抗氧化性、成膜性、保水性,以及良好的熱可塑性和穩(wěn)定性。玉米醇溶蛋白中含有高比例的疏水性氨基酸,缺少賴氨酸、色氨酸等人體必需的氨基酸,其獨特的氨基酸組成導致玉米蛋白的水溶性差,利用價值低[3-4]。使其不能直接用于人類消費,限制其在人類食品中的使用。國內外學者在尋找玉米醇溶蛋白改性方法方面作了大量工作,這些方法包括化學改性[5-7]、物理改性[8-12]、生物改性等,但是這些改性方法存在生物轉化率低,易造成環(huán)境污染、生產成本高、改性效果不明顯等弊端。
微生物發(fā)酵玉米醇溶蛋白,本質上是利用微生物發(fā)酵過程中分泌的復合酶對蛋白質發(fā)生不同程度的降解,大分子蛋白部分降解為小分子蛋白。真菌類菌種相較于其他菌種具有轉化率高、環(huán)保安全、對原料營養(yǎng)成分破壞小、成本低、原料豐富、產酶活力高等優(yōu)勢,因此本研究選取羊肚菌作為優(yōu)先菌種,羊肚菌在發(fā)酵過程中能夠產生豐富的酶系,如胞外羧甲基纖維素酶、淀粉酶、漆酶、愈創(chuàng)木酚酶、蛋白酶等,能夠更好地作用于玉米蛋白粉,降解玉米蛋白粉中的多糖、蛋白質及細胞壁成分等。我國羊肚菌資源豐富、營養(yǎng)、藥用價值高[13-14],而且羊肚菌具有抗疲勞、免疫調節(jié)等功效使其在醫(yī)藥方面用途廣泛[15-17],目前對于羊肚菌的研究主要以培養(yǎng)基配方、發(fā)酵條件對菌絲體生物量、菌絲體多糖和發(fā)酵液胞外多糖產量影響的研究居多。
本試驗以玉米蛋白粉為主要原料,采用羊肚菌對其進行液體發(fā)酵培養(yǎng),篩選出最適的培養(yǎng)基配方并探索最適培養(yǎng)條件,研究在發(fā)酵過程中,菌絲體生物量、蛋白轉化率及醇溶蛋白一些性質的變化。為改善玉米醇溶蛋白功能特性,提高玉米蛋白粉的應用領域提供參考。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
羊肚菌菌種:吉林農業(yè)大學小麥和玉米深加工國家工程實驗室。
1.1.2 菌種保存斜面培養(yǎng)基
固體麥芽汁培養(yǎng)基:吉林農業(yè)大學小麥和玉米深加工國家工程實驗室提供。
1.1.3 試劑
玉米蛋白粉:吉林中糧生化能源銷售有限公司;玉米粉、馬鈴薯:市售;可溶性淀粉:天津市光復精細化工研究所;麥芽糖、酵母浸粉、蛋白胨:北京奧博星生物技術有限責任公司。
1.2 儀器與設備
HZQ-F160全溫振蕩培養(yǎng)箱:哈爾濱市東聯(lián)電子技術開發(fā)有限公司;LD5-2B 離心機:北京雷勃爾離心機有限公司;K1100全自動凱氏定氮儀:濟南海能儀器股份有限公司。
1.3 方法
1.3.1 羊肚菌的活化:將4 ℃保藏的羊肚菌菌種轉接至新鮮的PDA斜面培養(yǎng)基 ,置培養(yǎng)箱27 ℃培養(yǎng)至第12天時采用。
1.3.2 液體發(fā)酵種子培養(yǎng)基的制備:葡萄糖2%,酵母浸粉1%,KH2PO40.12%,MgSO4·7H2O 0.075%,FeSO4·7H2O 0.001%,pH值自然,121 ℃滅菌20 min,在無菌環(huán)境下,接入到裝有30 mL液體種子培養(yǎng)基的100 mL三角瓶中,置于27 ℃恒溫搖床振蕩培養(yǎng),160 r/min培養(yǎng)6 d得2級種子液備用。
1.3.3 培養(yǎng)基配方單因素篩選試驗
分別以玉米蛋白粉添加量(2%、4%、6%、8%、10%),葡萄糖添加量(1.8%、3%、4.2%、5.4%、6.6%),KH2PO4添加量(0.05%、0.1%、0.2%、0.3%、0.4%),CaSO4添加量(0.05%、0.1%、0.2%、0.3%、0.4%)為單因素,考察各因素對蛋白轉化率、菌絲體生物量的影響。
1.3.4 培養(yǎng)基配方篩選試驗
通過單因素,選定玉米蛋白粉、葡萄糖、KH2PO4、CaSO4進行正交試驗,選用L9(34) 正交表,見表1。500 ml三角瓶中裝入100 ml液體培養(yǎng)基,初始pH為5,滅菌后接入10%二級種子液,置于旋轉式搖床中,轉速160 r/min,24 ℃恒溫振蕩培養(yǎng)6 d,過濾菌絲體離心(4 000 r/min,20min),測量菌絲體生物量,處理離心后的上清液,凱氏定氮測定蛋白質含量。每組 3 個平行,取其平均值。

表1 培養(yǎng)基配方正交試驗因素和水平
1.3.5 液體發(fā)酵培養(yǎng)條件的優(yōu)化試驗
在單因素的基礎上,葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%,對液體發(fā)酵培養(yǎng)條件進行優(yōu)化。因此采用正交表L9(34)對影響的因素:初始pH、培養(yǎng)溫度、裝液量、接種量進行條件優(yōu)化。因素水平表設計分別見表2。

表2 液體發(fā)酵培養(yǎng)條件正交試驗因素和水平
1.4 菌絲體生物量的測定
培養(yǎng)6 d后,培養(yǎng)液經30目尼龍紗布過濾,菌絲體經蒸餾水沖洗數次后,放置在烘箱60 ℃干燥至恒重,稱量菌絲體干重。
1.5 蛋白轉化率的測定
使用凱氏定氮測定方法測定樣品蛋白轉化率。方法參照國標GB 5009.5—2010。蛋白轉化率按照公式進行計算[18]。
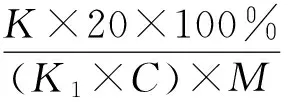
式中:20為酸溶蛋白上清液的總體積/mL;K為酸溶蛋白凱氏定氮數值/mgN/100 mL;K1為樣品的凱氏定氮數值/mgN/100 mL;C為發(fā)酵培養(yǎng)基中樣品的含量/%;M為發(fā)酵培養(yǎng)基的取樣質量/g。
1.6 電泳試驗
采用SDS-聚丙烯酰胺凝膠電泳方法進行電泳試驗。
1.7 乳化性及乳化穩(wěn)定性
樣品經過均質用濃度為0.1%的SDS溶液稀釋成0.1 L,立即用分光光度計在500 nm波長下測定其吸光值E[19]。
E1=t×B0/B0-B10
式中:E1為乳化穩(wěn)定性/min;t為10 min;B0為均質后立刻稀釋測得的吸光度值;B10為均質10 min后稀釋測得的吸光度值。
E2=2×(2.303E)×稀釋倍數/C·D·I
式中:E2為乳化性/m2/g;C為油相所占分數1/3;D為蛋白質濃度0.5%;I為比色皿的光徑/(10 mm)。
1.8 起泡性及泡沫穩(wěn)定性
起泡性及泡沫穩(wěn)定性分別按公式計算。
起泡性(FA%)=VI(mL)×100/100(mL)
泡沫穩(wěn)定性(FS%)=V2(mL)×100/100(mL)
式中:V1為均質后起泡體積;V2為均質后10 min穩(wěn)定起泡體積。
2 結果與分析
2.1 培養(yǎng)基配方的單因素試驗
2.1.1 最適氮源添加量的確定
由圖1可以看出,玉米蛋白粉添加量為6%時,蛋白轉化率、菌絲體生物量最高,蛋白轉化率為22.64%,菌絲體生物量為0.67 g/100 mL,因此本試驗選取玉米蛋白粉添加量4%、6%、8%為變量。

圖1 最適氮源添加量的確定
2.1.2 最適碳源添加量的確定
由圖2可以看出,在葡萄糖添加比例為4.2%時,蛋白轉化率、菌絲體生物量達到最大值,分別為22.64%、0.67g/100 mL,因此本試驗選取葡萄糖添加比例3%、4.2%、5.4%作為變量。
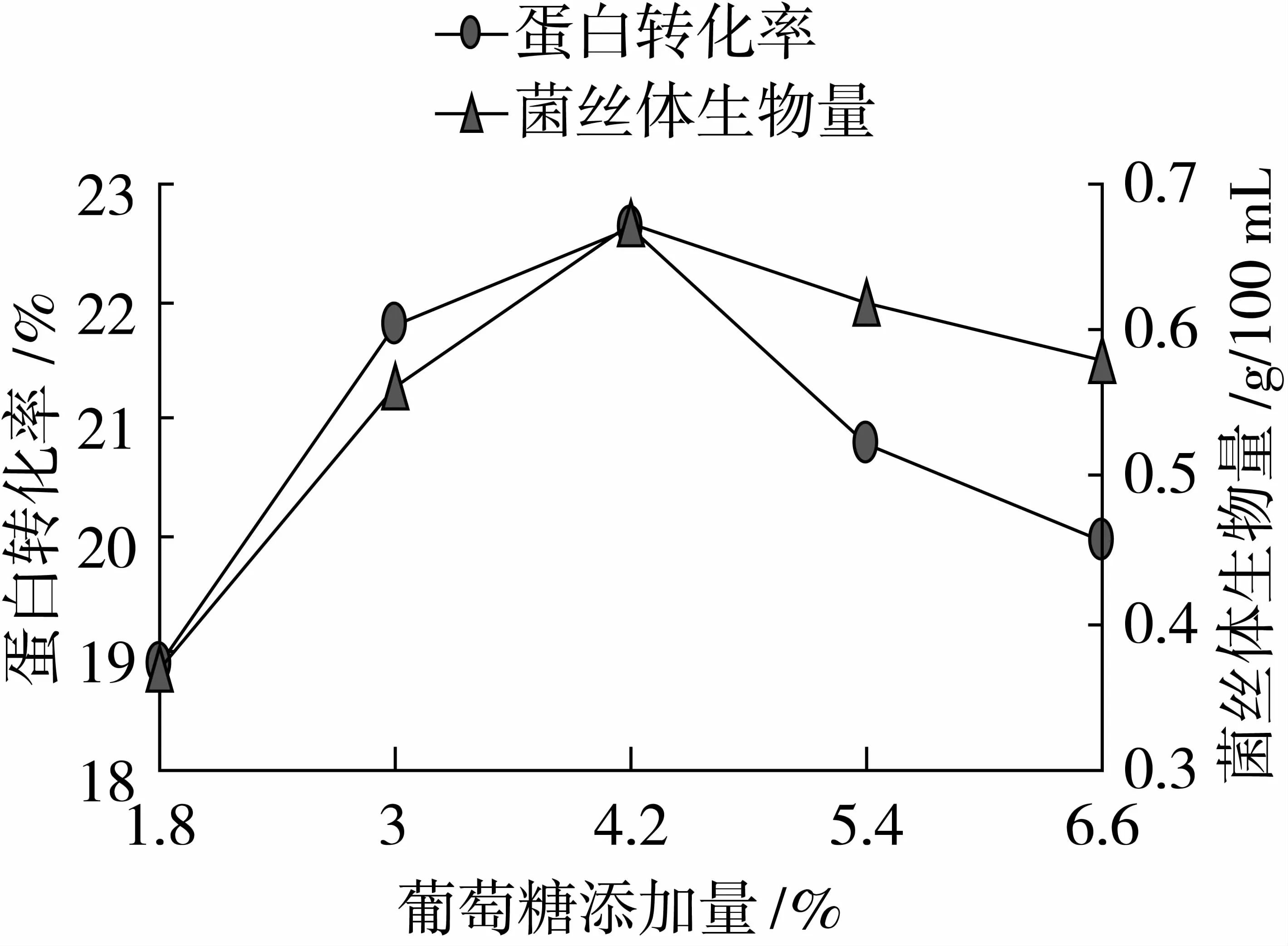
圖2 最適碳源添加量的確定
2.1.3 最適生長因子添加量的確定
由圖3可以看出, KH2PO4添加量為0.2%時,蛋白轉化率、菌絲體生物量最高,蛋白轉化率為23.12%,菌絲體生物量為0.82 g/100 mL,因此本試驗選取KH2PO4添加量0.1%、0.2%、0.3%為變量。
由圖4可以看出, CaSO4添加量為0.2%時,蛋白轉化率、菌絲體生物量最高,蛋白轉化率為22.91%,菌絲體生物量為0.78 g/100 mL,因此本試驗選取CaSO4添加量0.1%、0.2%、0.3%為變量。
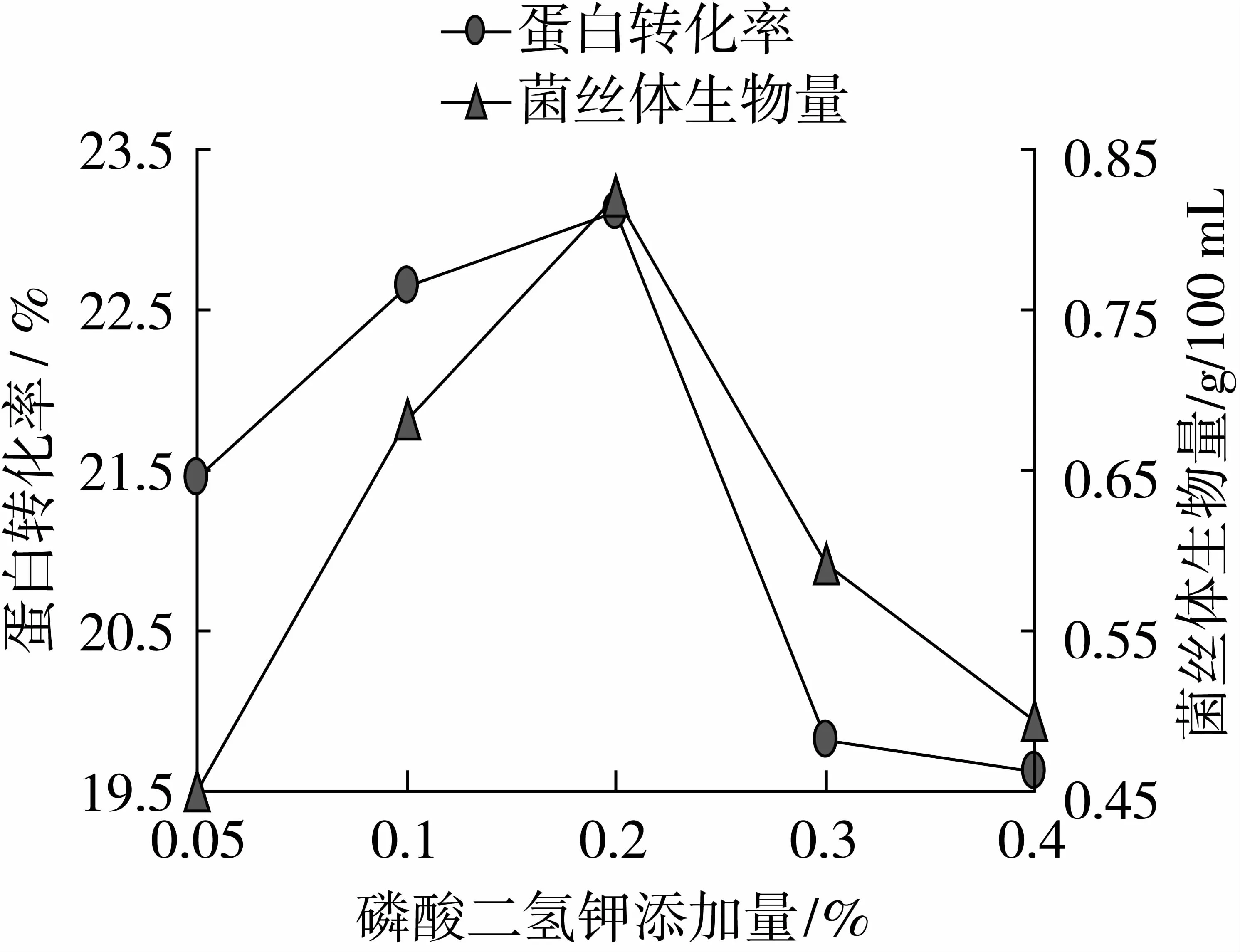
圖3 最適碳酸二氫鉀添加量的確定

圖4 最適碳酸鈣添加量的確定
2.2 培養(yǎng)基配方的正交優(yōu)化試驗
正交試驗設計結果見表3。通過對正交試驗結果進行極差分析,當以菌絲體生物量為指標時,影響菌絲體生物量的主次順序依次為B >A >D >C,并確定了培養(yǎng)基配方為A2B2C3D1,即葡萄糖添加量4.2%,玉米蛋白粉添加量6%,CaSO4添加量0.3%,KH2PO4添加量0.1%。試驗得出菌絲體生物量為1.45 g/100 mL。當以蛋白轉化率為指標時,影響蛋白轉化率的主次順序依次為B>A>D>C,并確定了培養(yǎng)基配方為A3B3C3D2,即葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%。最優(yōu)組合不在這9組試驗中,通過驗證試驗得出蛋白轉化率為27.51%。

表3 培養(yǎng)基配方正交試驗結果
由于以菌絲體生物量為指標得出的極差分析和以蛋白轉化率為指標得出的極差分析不一致,數據分析得知以蛋白轉化率為指標得到的菌絲體生物量、蛋白轉化率比以菌絲體生物量為指標得出的分別高0.17 g/100 mL、2.08%。故選取以蛋白轉化率為指標確定的培養(yǎng)基配方A3B3C3D2,即葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%。
2.3 羊肚菌轉化玉米醇溶蛋白液體發(fā)酵培養(yǎng)條件的單因素試驗
2.3.1 培養(yǎng)基初始pH對蛋白轉化率的影響
由圖5可知,當pH 6時,蛋白轉化率、菌絲體生物量的值達到最高,分別為25.69%、1.29 g/100 mL,因此選取pH為5、6、7。

圖5 最適pH的確定
2.3.2 培養(yǎng)溫度對蛋白轉化率的影響
由圖6可以看出,當培養(yǎng)溫度24 ℃時,達到最高值,分別為26.54%、1.38 g/100 mL,因此選取22、24、26 ℃作為培養(yǎng)溫度的變量。
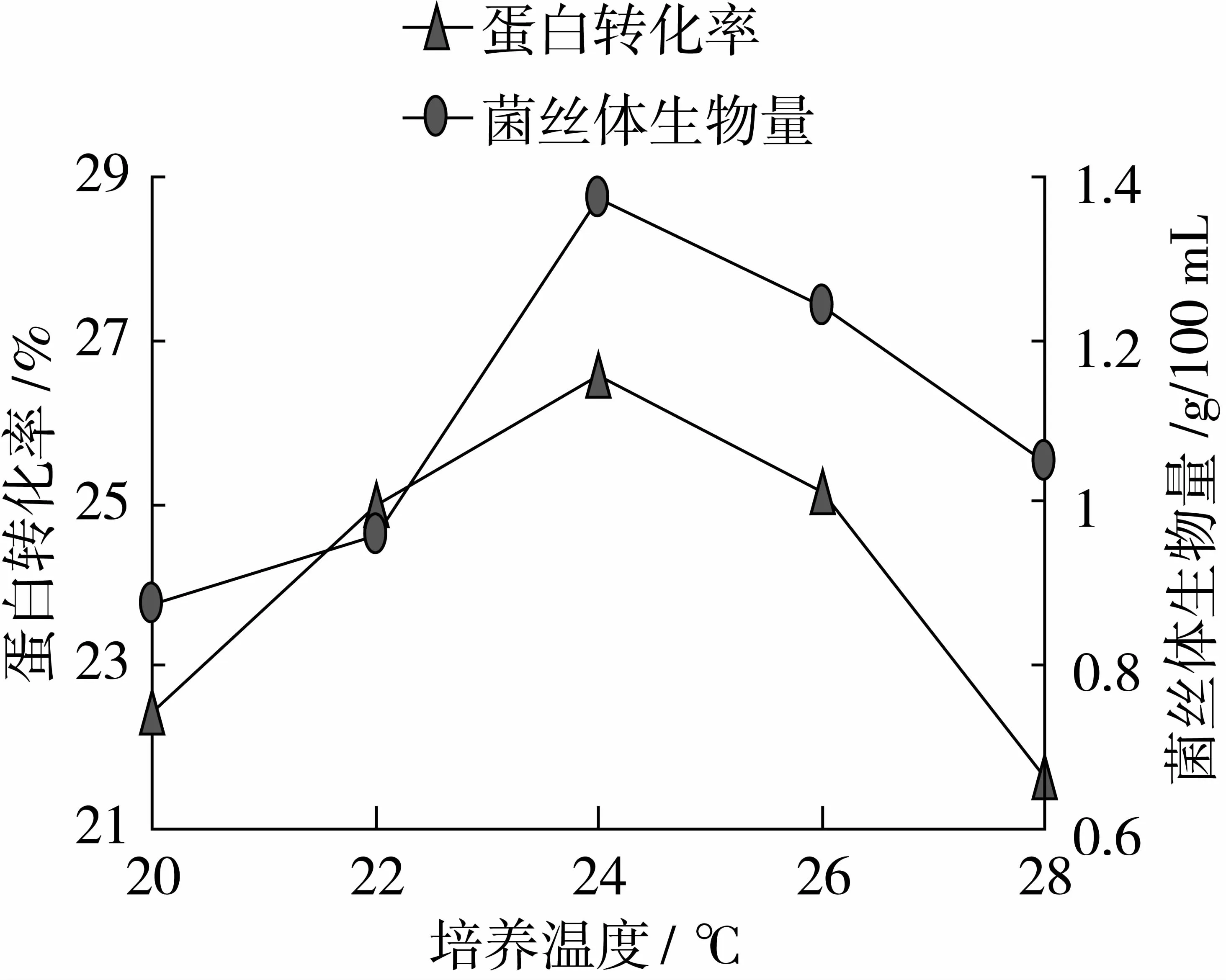
圖6 最適培養(yǎng)溫度的確定
2.3.3 裝液量對蛋白轉化率的影響
由圖7可以看出,當裝液量為100/500 mL時,蛋白轉化率、菌絲體生物量達到最大值,分別為26.19%、1.32 g/100 mL。因此本試驗選取80/500、100/500、120/500 mL作為裝液量的變量。
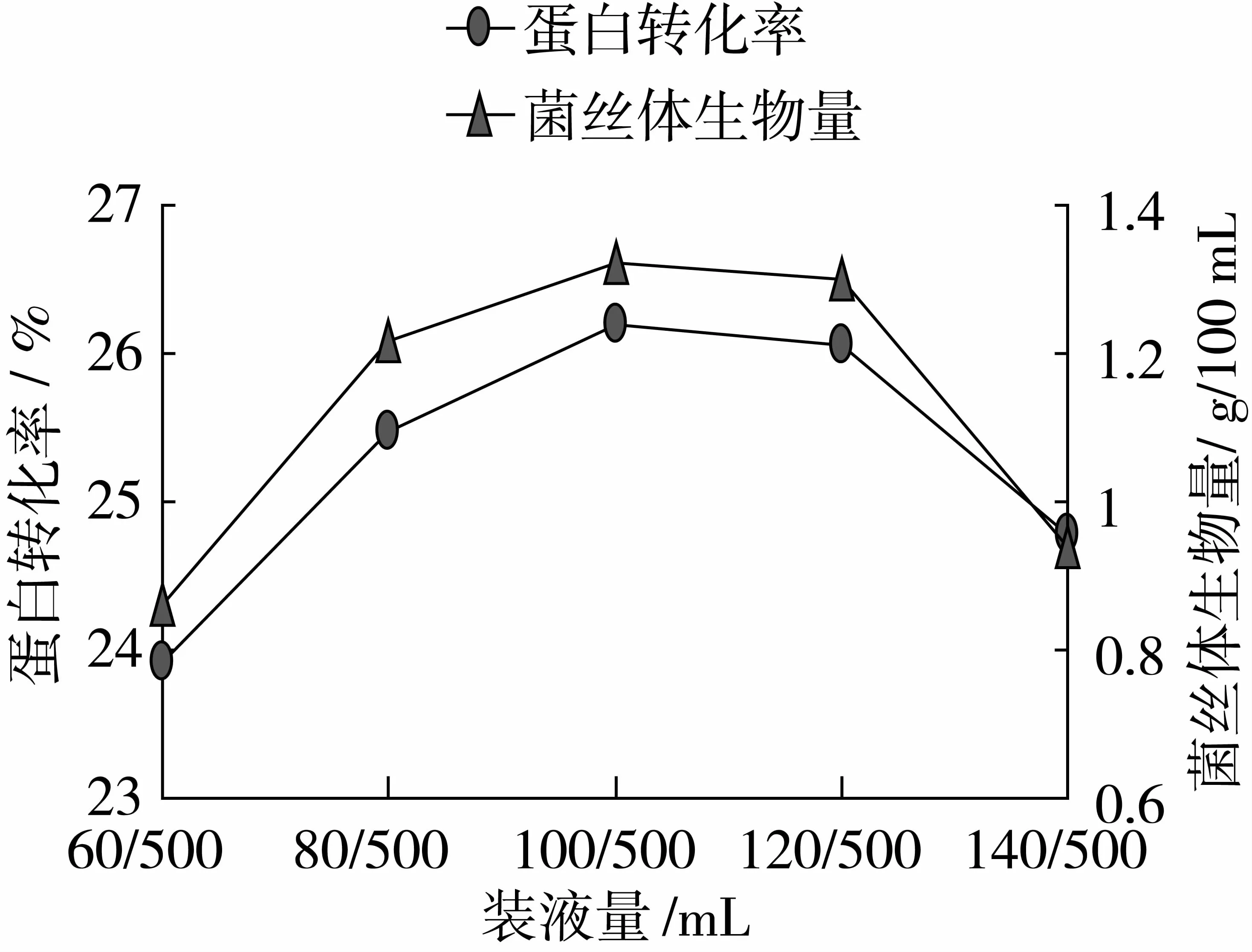
圖7 最適裝液量的確定
2.3.4 接種量對蛋白轉化率的影響
由圖8可以看出,當接種量為10%時,蛋白轉化率、菌絲體生物量達到最大值,分別為26.21%、1.35 g/100 mL。因此本試驗選取8%、10%、12%作為接種量的變量。

圖8 最適接種量的確定
2.4 羊肚菌轉化玉米醇溶蛋白液體發(fā)酵培養(yǎng)條件的正交優(yōu)化試驗
正交試驗設計結果見表4。通過對正交試驗結果表4進行極差分析,以菌絲體生物量、蛋白轉化率為指標,影響菌絲體生物量的主次順序均為B>A>D>C,并確定了培養(yǎng)基配方為A2B3C1D2,即接種量10%,培養(yǎng)溫度26 ℃,初始pH 4,裝液量100/500 mL。得出菌絲體生物量為2.37 g/100 mL、蛋白轉化率為36.73%。在最適培養(yǎng)基配方的基礎上,通過對液體發(fā)酵培養(yǎng)條件進行驗證試驗,做3組平行試驗,在此條件下測得的菌絲體生物量為2.41 g/100 mL。
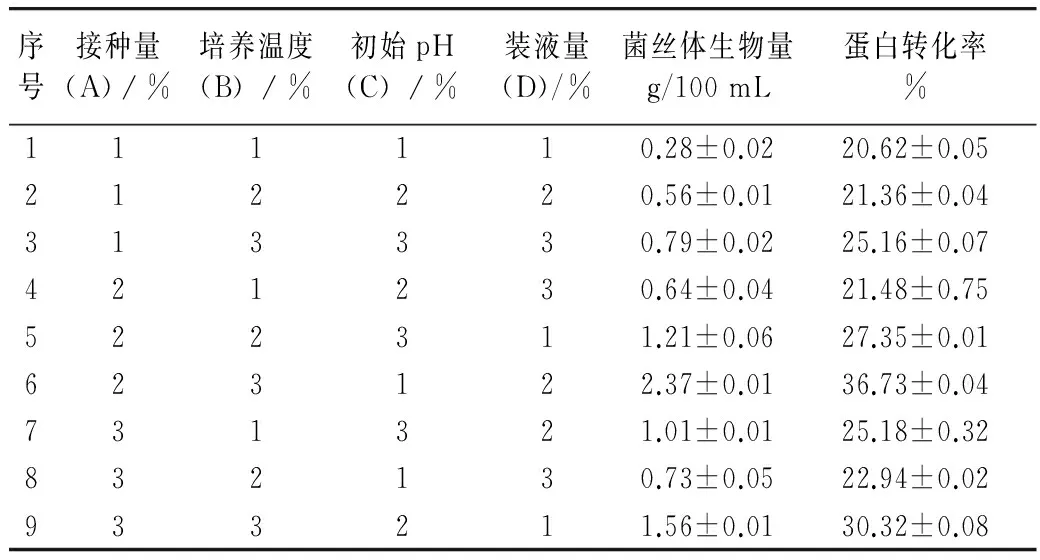
表4 液體發(fā)酵培養(yǎng)條件正交試驗表
由于在發(fā)酵過程中有小部分的氮被羊肚菌利用,故在最適培養(yǎng)基配方、發(fā)酵條件的基礎上,對獲得的蛋白轉化率進行驗證試驗,即:葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%,接種量10%,初始pH 4,每500 mL三角瓶裝液量100 mL,于培養(yǎng)箱中26 ℃條件下恒溫培養(yǎng),發(fā)酵時間6 d,做3組平行試驗,通過凱氏定氮法測得發(fā)酵前培養(yǎng)基中總氮量為9.43%、發(fā)酵液中總氮量為3.48%、發(fā)酵后總氮量為9.48%、羊肚菌代謝產生的含氮量為0.02%,可溶性氮含量為3.46%,得出蛋白轉化率為36.69%。
2.5 電泳
由圖 9 的電泳圖可以看出,隨著發(fā)酵時間的增加,玉米醇溶蛋白逐漸被羊肚菌利用,蛋白質逐漸被分解,深色條帶逐漸變淺。蛋白質分子的表面電荷重新分布,導致維持蛋白質三級、四級結構的結合力變弱,分子間氫鍵、二硫鍵部分斷裂,游離出更多的氨基和羧基,蛋白質分子通過極性基團吸附的水量增加,從而使玉米醇溶蛋白的理化性質得到改善。

注:條帶1:發(fā)酵前;條帶2:發(fā)酵3 d;條帶3:發(fā)酵5 d;條帶4:發(fā)酵7 d。
圖9 不同發(fā)酵時間玉米醇溶蛋白的SDS-PAGE圖譜
2.6 乳化性及乳化穩(wěn)定性
由圖10可以看出,乳化性、乳化穩(wěn)定性隨著發(fā)酵時間的增加,而逐漸增大,發(fā)酵時間在第5天時,乳化性達到最大值:29.13 m2/g,發(fā)酵時間在第6天,乳化穩(wěn)定性達到最大值:41.21 min。隨著發(fā)酵時間的繼續(xù)增加,乳化性、乳化穩(wěn)定性有下降的趨勢。

圖10 發(fā)酵時間對乳化能力的影響
2.7 起泡性及泡沫穩(wěn)定性
由圖11可以看出,起泡性、泡沫穩(wěn)定性隨著發(fā)酵時間的增加,而逐漸增大,發(fā)酵時間在第5天時,起泡性達到最大值212.5%,發(fā)酵時間在第6天時,泡沫穩(wěn)定性達到最大值145.67%,隨著發(fā)酵時間的繼續(xù)增加,起泡性、起泡穩(wěn)定性有下降的趨勢。
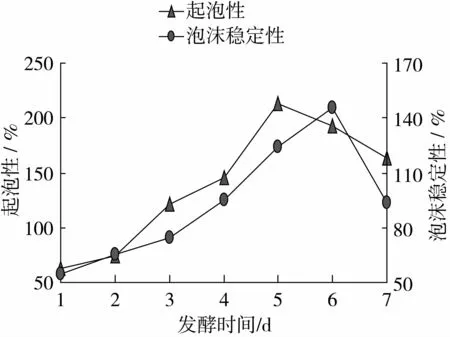
圖11 發(fā)酵時間對起泡性和起泡穩(wěn)定性的影響
3 結論
通過正交試驗,確定了羊肚菌轉化玉米醇溶蛋白液體發(fā)酵的工藝組合。
3.1 羊肚菌轉化玉米醇溶蛋白液體發(fā)酵培養(yǎng)基配方為:葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%。
3.2 羊肚菌轉化玉米醇溶蛋白液體發(fā)酵培養(yǎng)條件工藝是:接種量10%,培養(yǎng)溫度26 ℃,初始pH 4,裝液量100/500 mL。
3.3 在最適培養(yǎng)基配方、培養(yǎng)條件的基礎上,通過驗證試驗得出菌絲體生物量、蛋白轉化率分別為2.41 g/100 mL、36.69%。
[1]Lawliet L M.The encyclopedia of chemistry[M].New York: Reinhold Publishing Company, 1958: 319-320
[2]Shukla A T, Field J M, Morris V J. Solution conformational analysis of the alpha zein proteins of maize[J]. The Journal of Biological Chemistry, 1993, 26(8): 253-259
[3]趙新淮,馮志彪.蛋白質水解物水解度的測定[J].食品科學,1994(11):65-67
[4]劉萍,陳黎斌,楊嚴俊.酶解玉米蛋白制備降血壓肽的研究[J].食品工業(yè)科技,2006,27(5):117-122
[5]Shukla R,Cheryan M.Zein: the industrial protein from corn[J].Industrial Crops and Products,2001,133
[6]袁懷波,劉國慶,陳宗道.磷酸化改性玉米蛋白質的性質[J]. 食品科學, 2007,28(10):50-52
[7]李紅梅,侯立琪,馬興勝.玉米蛋白去酰胺改性的研究[J].糧食與飼料工業(yè),2007(04):19-21
[8]Soliman E A, Furuta M. Influence of irradiation on mechanical and water barrier properties of corn protein based films[J]. Radiation Physics and Chemistry,2009, 78-7(8): 651-654
[9]Lee M, Lee S, Kyung Bin Song. Effect of irradiation on the physicochemical properties of soy protein isolate films[J]. Radiation Physics and Chemistry, 2005, 72 (1) : 35-40
[10]Lee S L,Song K B. Effect of irradiation on the physicochemical properties of gluten films[J]. Food Chemistry,2005, 92: 621-625
[11]Schurer F, Kieffer R, Wieser H, et al. Effect of hydrostatic pressure and temperature on the chemical and functional properties of wheat gluten II. Studies on theinfluence of additives[J]. Journal of Cereal Science, 2007,46(1): 39-48
[12]王標詩,李汴生,尹林清,等.超高靜壓對食品乳化體系的影響[J].食品科學,2008,29(9):74-77
[13]沙業(yè)雄. 羊肚菌研究進展[J]. 食用菌,1990:26-8
[14]章靈華.藥用真菌中生物活性多糖的研究進展[J].中草藥,1992,23(2): 95-99
[15]Duncan C J, Pugh N,Pasco D S,etal. Isolation of a galactomannan that enhances macrophage activation f romthe edible fungus Morchella esculenta [J].Journal of Agricultural and Food Chemistry,2002 ,50(20):5683-5685
[16]孫曉明,張衛(wèi)明,吳素玲,等.羊肚菌抗疲勞作用研究[J].中國野生植物資源,2001,20 (1) :17-18 , 32
[17]孫曉明,張衛(wèi)明,吳素玲,等.羊肚菌免疫調節(jié)作用研究[J].中國野生植物資源,2001,20 (2) :12-13 ,20
[18]NY/T 685-2003,飼料用玉米蛋白粉[S].凱氏定氮國標
[19] Zheng Xi qun,Li Li te,Liu Xiao Lan, et al.Produetion of hydrolysate with antioxid ativeactivity by enzymatic hydrolysis of extruded corn gluten [J]. Applied Microbiology and Biotechnology, 12006,73(4):763-770.
Optimization of Liquid Fermentation Technology for Zein Bioconverted by Morchella Esculenta
Wen Chaoting Zheng Mingzhu Xiu Lin Sheng Yue Liu Jingsheng Cai Dan
(Food Science and Engineering, Jilin Agricultural University National Engineering Laboratory of the Wheat-corn Deep Processing, Changchun 130118)
Taking zein as the main raw material, and making fermentation cultivation in morchella esculenta, to determine the culture medium formula and the optimum conditions of zein bioconverted by morchella esculenta. The results showed that the liquid fermentation culture medium formula was: glucose 5.4%, corn gluten meal 8%, CaSO40.3% and KH2PO40.2%, on this condition, the mycelium biomass was 1.62 g/100 mL, zein conversion rate was 27.51%. On the basis of the optimum medium formula, the conditions of liquid fermentation culture was: inoculum size 10%, culture temperature 26 ℃, the medium initial pH 4, and liquid volume 100 mL/500 mL. On this optimized condition, the experiment educes the mycelium biomass 2.41 g/100 mL and zein conversion rate 36.69%.
zein,morchellaesculenta, liquid fermentation, mycelium biomass,zein conversion rate
TS201.3
A
1003-0174(2016)02-0103-06
吉林省科技發(fā)展計劃(20140204011NY),國家現代農業(yè)產業(yè)技術體系(CARS02-29)
2014-07-11
文超婷,女,1990年出生,碩士,食品生物化學工程與功能性食品
劉景圣,男,1964年出生,教授,博士,糧食深加工與功能性食品
蔡丹,女,1980年出生,副教授,乳品科學與發(fā)酵工程

