醫院可疑醫療設備不良事件的分析與對策
蔣貽芳 高小坤
醫院可疑醫療設備不良事件的分析與對策
蔣貽芳①高小坤②
目的:對醫院可疑醫療設備不良事件(MDR)報告進行數據挖掘,分析不良事件產生的原因,提出相應的解決對策,以確保醫療設備臨床使用安全。方法:從國家藥品不良反應監測中心數據庫中篩選出經過省、市評價的可疑MDR報告300例,利用SPSS統計軟件對不良事件所涉及的醫療設備類別數量、不良事件主要表現、風險類別以及產生的主要原因進行統計分析。結果:MDR產生的原因依次為產品質量相關問題、患者體質與醫療設備之間存在生物不相容性和操作或使用不當。結論:醫療設備生產企業應嚴格按照生產質量管理規范(GMP)生產,確保產品質量。醫療機構應嚴格執行標準操作規程(SOP),主動詢問患者過敏史,完善監測上報工作。
醫療器械;不良事件;過敏;對策;監測上報
[First-author’s address]Department of Pharmacy, Nanjing Gaochun People’s Hospital, Gaochun 211300, China.
醫療設備不良事件(medical device reporting,MDR)是指獲得上市的、合格的醫療器械在正常使用情況下發生的導致或可能導致人體傷害的任何與醫療器械預期使用效果無關的有害事件[1]。MDR與藥品不良反應(adverse drug reactions,ADR)存在許多的共同點:①均指與使用目的無關的使患者產生傷害或不適的反應;②均需及時上報;③上報工作均涉及到生產、經營、使用和監管部門。ADR監測是用來監管藥品安全的一種重要手段,可為臨床合理用藥和維護公眾安全提供有力保障[2]。隨著藥學隊伍的不斷壯大和藥學工作者的不斷努力,ADR上報工作已較為規范,其上報組織健全,網絡架構完善,上報流程合理,報告數量較多、質量較高,對安全用藥起到了很好的警戒作用。然而,MDR監測和上報工作與ADR相比遠遠落后,主要原因是我國醫療器械不良事件監測工作起步晚,并與醫療設備從業人員的多樣性、醫用耗材種類的復雜性和專業性強相關。本研究對醫院可疑MDR進行具體分析,旨在更好地開展MDR監測和上報工作,降低醫療設備的固有風險和潛在風險,提高醫療設備臨床應用的安全性和有效性。
1 資料與方法
1.1 資料來源
從國家藥品不良反應監測中心數據庫中,導出蘇北人民醫院近年來上報的《可疑醫療器械不良事件報告》,篩選出經過省市評價過的可疑MDR報告300例,對其進行階段性的回顧分析。
1.2 分析方法
在導出可疑MDR報告資料后,依據國家食品藥品監督管理局制定的《醫療器械分類目錄》,對所涉及的醫療設備進行系統的分類;采用SPSS 13.0統計軟件對不良事件所涉及的醫療器械類別、數量、主要表現以及產生的主要原因進行分析匯總和評價,并提出對策,其步驟為:①導出數據;②按品種分類;③按名稱匯總MDR報告例數;④從MDR表現和產生原因等方面進行分析。
1.3 MDR分類
我國對醫療設備產品按照風險程序將其分為3類,即Ⅰ類、Ⅱ類和Ⅲ類醫療器械。①Ⅰ類醫療器械:風險程度低,實行常規管理可以保證其安全、有效的醫療器械;②Ⅱ類醫療器械:具有中度風險,需要嚴格控制管理以保證其安全、有效的醫療器械;③Ⅲ類醫療器械:具有較高風險,需要采取特別措施嚴格控制管理以保證其安全、有效的醫療器械[3]。
2 MDR報告結果與分析
2.1 MDR涉及的醫療設備風險類別
在300例可疑MDR報告中,涉及Ⅰ類醫療設備的最少,為34例(占11%);涉及Ⅱ類醫療設備的居中,為96例(占32%);涉及Ⅲ類醫療設備的最多,為170例(占57%),如圖1所示。
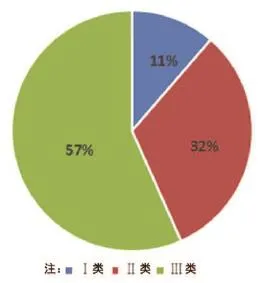
圖1 涉及醫療設備的管理類別示意圖
2.2 MDR涉及的產品分類情況
在300例可疑MDR報告中,涉及的醫療設備類別共有32類76種,報告數量在前5位的醫療設備類別見表1。

表1 可疑醫療設備不良事件涉及的產品分類情況
2.3 MDR涉及的醫療器械名稱和臨床表現
在300例可疑MDR報告中,引起不良事件數量居前6位的醫療器械分別是一次性使用輸液器(帶針)、一次性使用無菌注射器(帶針)、一次性使用靜脈留置針、一次性使用負壓引流器、一次性使用導尿包和一次性使用心電電極,所占比例分別為27.7%、11%、7.3%、3.3%、2.3%和2.3%,其主要臨床表現見表2。
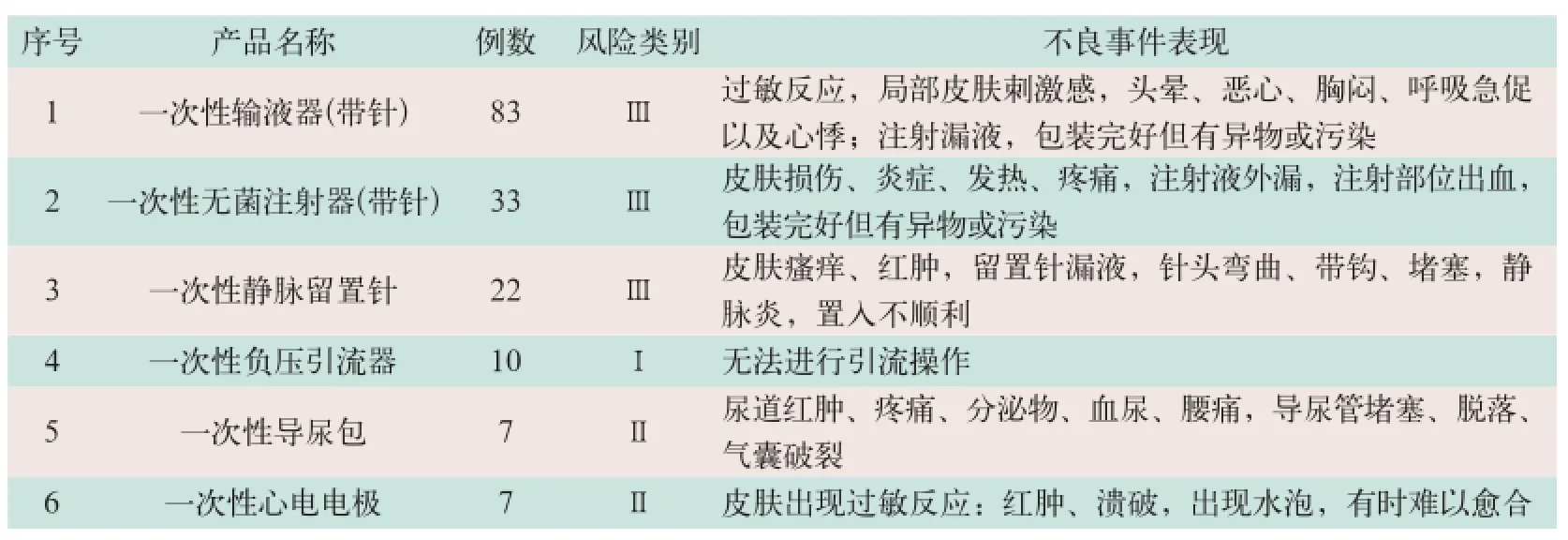
表2 排列前6位MDR的主要臨床表現
2.4 MDR產生的主要原因
(1)對300例MDR報告進行分析,發生MDR的主要因素為:①產品質量相關問題,原包裝產品組件缺失,出廠漏檢,儲運過程中的被損壞等;②患者特殊體質;③未完全按照產品說明書SOP操作,存在使用或操作不當;④其他因素,如儀器老化、心電監護儀自身干擾及管路堵塞等(如圖2所示)。
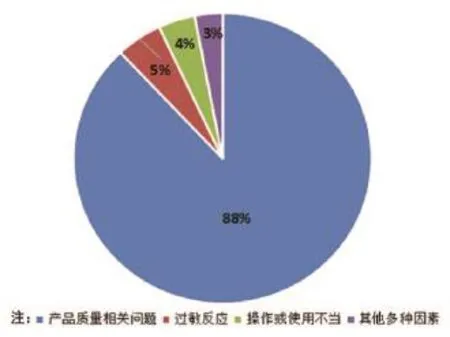
圖2 不良事件產生的主要原因構成示意圖
(2)在MDR報告中產生過敏反應的醫療器械主要是“械”字號的“類藥品”,如一次性使用心電電極、納米銀系列制劑及小兒退熱貼等。不良反應的癥狀主要是皮膚紅腫、潰破等,與藥品產生的過敏反應相似,過敏反應的產生是因為患者的體質與器械制成材料存在較大的生物不相容性[4]。發生過敏反應后應及時處理皮膚損傷癥狀,尋找過敏源,若由電極片引起,則應立即暫停電極片使用或更換其他品牌產品。
(3)在臨床中進行靜脈滴注大量液體時,患者有時會發生寒顫、高熱及嘔吐等癥狀,此現象稱為熱原反應[5]。熱原反應嚴重時可能會導致休克甚至死亡,因此必須了解熱原反應發生的原因,并提前預防。輸液本身含有過量的熱原和過敏物質是引起熱原反應最主要的原因,但輸液器械制造、滅菌不合格或者運輸保存過程中不按規定進行,使輸液器械被熱原污染從而導致熱原反應也是不可忽視的一個重要原因。臨床在處理輸液過程中引起的熱原反應時,要綜合考慮多方面的因素,包括藥液本身和輸液器械。
3 MDR的預防對策
3.1 嚴格按照使用說明書操作
醫療設備使用說明書是反映醫療設備是否安全有效的重要技術性文件,包含了醫療設備的使用方法、注意事項及存儲條件等諸多信息,能夠正確的指導醫療設備的安裝、調試和使用[6]。醫療設備使用說明書對生產企業和使用者(包括醫務人員和患者自身)非常重要,許多MDR的發生可能與未仔細閱讀說明書,錯誤地使用醫療設備而引起。
以角膜塑形(orthokeratology,OK)鏡為例。OK鏡能夠改變角膜形態來矯正屈光不正,但OK鏡的作用是暫時、有限的,療效可逆,患者必須科學佩戴,需要不定期的根據當前矯正效果驗配、更換鏡片,不能夠一副鏡片戴到底。由于產品說明書標注不夠明確,使用者未仔細閱讀說明書的內容,患者長期佩戴后產生視力模糊,角膜發炎等癥狀[7]。因此,醫療機構應充分認識醫療設備使用說明書的重要性,閱讀其注意事項、警示及提示性說明,必要時提醒臨床使用人員或者患者,保證醫療設備使用的安全有效,降低不良事件發生率。
3.2 注意禁忌證及過敏史
針對MDR中過敏反應的產生,完備的預防機制極其重要。臨床使用一次性心電電極、納米銀等“類藥品”的醫療器械前,醫務人員應盡到詢問和告知義務,主動詢問患者過敏史,告知患者有可能會發生過敏反應等不良事件。凡是有過敏史者應盡量避免使用此類醫療設備,必要時可進行相關皮試。有研究表明,使用一次性心電電極前應清潔黏貼部位的皮膚,與常規清潔方法相比,在使用前涂抹一定量的蘆薈膠能夠有效降低心電電極引起過敏等不良事件的發生率[8]。此外,為了更加清楚的分析不良事件發生的原因,應在MDR報告中增加患者使用醫療設備過敏史的內容,這一舉措同時也能夠避免MDR的發生。
3.3 實施嚴格的人員培訓
醫療設備的臨床使用和藥物的臨床使用有所不同,不僅涉及到產品本身,還涉及到設備內部電子元器件運行的穩定度,機械部件的安全性和操作軟件的人性化等工程類技術指標,其指標均需由具備相關知識的專業人員按照標準操作規程(standard operating procedures,SOP)操作[9]。因此,醫務人員的相關培訓必不可少,應該定期對醫療設備的操作人員和維修人員進行職能培訓,組織其參加相關專業的學習研討并制定一定的考核標準,確保在臨床使用中負責操作醫療設備的人員能夠對所使用的設備有足夠的認知和了解,嚴格按照SOP操作,降低MDR發生率,減少對患者的傷害。
3.4 禁止使用召回產品
(1)查詢國家食品藥品監督管理總局網站,關注醫療設備召回信息、醫療設備質量公告、醫療設備不良事件監測信息通報以及醫療設備警戒等相關方面的信息。
(2)專人負責每日瀏覽上述網頁,發現問題及時記錄、調查及匯報。
(3)及時將網站信息轉發內網,告知相關人員[10]。
3.5 生產企業須保證醫療器械生產質量
產生不良事件的原因顯示,醫療設備質量不過關是最主要的因素。我國近半數的醫療設備生產企業規模較小,基礎設施、工作環境、資源配置以及生產能力都較薄弱,醫療設備質量不穩定,企業經營者質量意識淡薄、生產行為不規范、自律性差。
醫療設備生產企業應嚴格執行生產質量管理規范(good manufacturing practice,GMP),各省級食品藥品監督管理部門負責實施GMP的檢查工作,嚴格醫療設備的生產過程控制,從而全面提升我國醫療器械生產企業的整體素質和醫療設備質量監督管理的水平。醫療器械的生產過程需要硬件和軟件的資源。
(1)硬件要求。生產企業應具有與生產產品及生產規模相適應的廠房、生產設備、衛生設施及環境等方面的技術要求。
(2)軟件要求。企業的生產、質量和技術負責人應具有與生產器械相適應的專業能力,并掌握國家有關醫療設備監督管理的法律、法規以及相關產品質量和技術的規定;應當設立質量檢驗機構,具備相適應的質量檢驗能力[11]。
生產企業應高度重視不良事件的發生,提高技術水平、加強安全檢測及嚴格把關質檢環節。同時要做到合理的運輸和儲存,避免野蠻裝卸而造成人為損壞設備,避免高溫和強光,杜絕和減少瑕疵產品到使用一線。對于MDR的處理,必要時可請生產或供應企業的專業人員協助分析和調查,及時解決問題,充分發揮生產企業在MDR發生后的補救作用。
3.6 做好MDR的監測上報工作
建立健全組織領導體系和組織架構,主動報告的制度和流程,不斷修訂、持續改進,通過必要的信息系統支持,方便上報。實行專人負責、多部門配合,共同做好MDR上報工作,并納入年度目標任務,進行不定期監管。
4 完善MDR監報措施
4.1 MDR監測上報現狀
近年來,國際上對醫療設備的監管已經逐漸從上市前審批向上市后監管轉移,而我國MDR的監測上報工作起步比較晚,開展不完善[12]。主要表現在:①報告數量遠遠低于實際發生的數量,報告質量不高;②生產企業參與度不高,大部分的上報工作由醫療機構完成;③公眾和醫務工作者對MDR監測上報工作的認識不足,重視不夠;④醫療設備相關的法規體系不完善,監管力度較薄弱[13]。
4.2 做好培訓指導工作
(1)醫院自身組織MDR知識培訓,普及MDR知識,掌握“可疑即報”原則,全員消除不良事件上報疑慮,使網絡成員人人知曉。
(2)請上級主管部門來院指導,主管部門專家進行專題培訓,形成重視MDR上報氛圍。科主任、護士長、主班以及總責任護士等一線工作人員統一思想、提高認識,并將“三基”考試加入MDR知識相關內容[14]。
(3)采取全方位、多層次及多形式培訓,藥監部門來院專題培訓、專業指導,采用下發宣傳手冊、網絡培訓、醫學工程部與使用部門之間的交流、提醒以及點對點培訓的方式。培訓內容為:①法律法規、相關標準要求以及MDR上報業務知識培訓;②內網系統操作、上報步驟培訓;③可疑不良事件報告表內容解讀培訓;④上報流程、報告填寫專題培訓以及上報實例演示。
4.3 認真組織嚴格獎懲
(1)根據市藥監局MDR上報任務分配表進行院內任務分解,任務下達到科主任、護士長年度目標任務中。
(2)按照獎懲制度、落實獎懲措施。
(3)利用院查房機會,對MDR上報工作點評:報告的數量、質量,上報數量的分布。指導臨床科室規范填寫,現場展示高質量報告范例,旨在不斷提高報告數量和質量,有力促進此項工作的開展。
(4)加強生產企業對MDR上報的積極性,對隱瞞上報的行為要嚴重處罰[15]。
5 結論
對于醫院MDR的預防,可采用戴明循環(plan do check action,PDCA)法進行管理。即Plan(計劃)、Do(執行)、Check(檢查)及Action(行動)。①計劃,擬定整改計劃,對已經發生的不良事件正確規范處理,對潛在的不良事件有一定的預見性;②執行,具體實施,完善機構設置、制定上報制度、制定應急預案、培訓相關人員、收集分析上報的不良事件[16];③檢查,加強監督巡查,檢查機制缺陷和執行情況;④行動,具體處理MDR,相關人員對本部門發生的可疑MDR進行收集分析,通過網絡即時上報當地的食品藥品監督管理局[17]。
醫療設備已廣泛應用到臨床中,但同時各種不良事件也層出不窮,因此完善監測上報工作迫在眉睫。應將監測上報工作落實到醫療器械的生產、經營、使用和監管的各個環節,不斷完善法規體系,突出重點,加強人員素養,強化監管,使MDR監測上報工作穩步推進,從而保證患者用械的安全有效。
[1]丁桂萍,高小坤,于靜.對優化醫用耗材不良事件監測與報告體系的探討[J].檢驗醫學與臨床,2013,10(24):3409-3410.
[2]周勇,田月杰,黃傳海,等.1388例嚴重藥品不良反應報告分析[J].藥物警戒,2008,5(4):225-230.
[3]廖曉曼,李悅菱.從6841-I分類目錄修訂談我國醫療器械分類界定工作[J].首都醫藥,2014(18):12-13.
[4]張景海.廣饒縣256例可疑醫療器械不良事件報告分析[J].齊魯藥事,2011,30(9):553-555.
[5]Lipschultz A.Adverse patient events involving medical devices[J].Biomed Instrum Technol,2013,47(2):154-155.
[6]Lennard N,Coutinho M,Campbell B.The surgeon and medical devices:adverse incident reporting and off-label use[J].Ann R Coll Surg Engl,2013,95(5):309-310.
[7]黃明,劉瑾生,劉婷.醫療設備及醫用耗材不良事件淺析[J].中國醫療設備,2010,25(4):8-9.
[8]陸逸雁,崔文波.一次性心電電極致皮膚過敏的分析與思考[J].中國藥物警戒,2014,11(11):687-692.
[9]張屹俊,施裕新.國內醫療器械臨床試驗現狀分析及對策探討[J].醫療衛生裝備,2013,34(9):93-95.
[10]Alemzadeh H,Raman J,Iyer RK,et al.Analysis of safety-Critical computer failures in medical devices[J].IEEE Security and Privacy,2013,11(4):18-20.
[11]趙穎,顧漢卿.簡述醫療設備生產質量管理規范[J].透析與人工器官,2008,19(4):25-26.
[12]高小燕,李素敏,崔澤實,等.醫學裝備風險管理文獻的計量研究[J].中國醫學裝備,2013,10(4):12-15.
[13]Parvizi N,Woods K.Regulation of medicines and medical devices:Contrasts and similarities[J].Clin Med(Lond),2014,14(1):6-12.
[14]Beydon L,Ledenmat PY,Soltner C,et al.Adverse events with medical devices in anesthesia and intensive care unit patients recorded in the French safety database in 2005-2006[J].Anesthe siology,2012,112(2):367-372.
[15]Ouriel K,Fowl RJ,Davies MG,et al.Reporting standards for adverse events after medical device use in the peripheral vascular system[J].J Vasc Surg,2013,58(3):776-786.
[16]張鵬,陳文霞,荊斌,等.基于醫療設備事件管理的分析系統研究[J].中國醫學裝備,2014,11(5):19-22.
[17]吳君,劉麗萍,胡偉,等.應用PDCA循環提高醫療機構藥品不良反應報告和監測管理質量[J].安徽醫藥,2013,17(10):1808-1809.
Analysis and countermeasures of suspected medical devices adverse events of hospital/
JIANG Yi-fang, GAO Xiao-kun// China Medical Equipment,2016,13(12):20-24.
Objective: To sort out cases of suspected medical device adverse events in Subei hospital, analysis for the reasons of adverse events, and propose measures to ensure the safe clinical use of medical devices. Methods: From the National Adverse Drug Reaction Monitoring Centre database, 300 cases of suspicious medical device adverse events were selected from cities and provinces. The number of categories of adverse events involving medical devices and the main reasons resulting adverse events were analyzed by SPSS. Results: The main reasons resulting the medical device adverse events were quality-related issues of the product, biological incompatibility existing between the patient and the physical device, and improper operation or use. Conclusion: The enterprises of medical devices should product on the basis of GMP strictly to ensure the quality of product. The medical institutions should ask hypersensitivity of patients actively and operate on the basis of SOP strictly to improve the work of monitoring and reporting.
Medical device; Adverse events; Hypersensitivity; Countermeasures; Monitoring and reporting of adverse events
10.3969/J.ISSN.1672-8270.2016.12.007
1672-8270(2016)12-0020-05
R197.39
A
2016-09-27
①南京市高淳人民醫院藥劑科 江蘇 南京 211300
②蘇北人民醫院化學試劑耗材采購中心 江蘇 揚州 225001
蔣貽芳,女,(1993- ),本科學歷,藥師。南京市高淳人民醫院藥劑科,從事臨床藥劑工作。

