Ghrelin在馴鹿器官內(nèi)的表達及定位檢測
張 曼,金 鑫,劉 驕,楊銀鳳
(內(nèi)蒙古農(nóng)業(yè)大學(xué)獸醫(yī)學(xué)院,呼和浩特 010018)
Ghrelin在馴鹿器官內(nèi)的表達及定位檢測
張 曼,金 鑫,劉 驕,楊銀鳳*
(內(nèi)蒙古農(nóng)業(yè)大學(xué)獸醫(yī)學(xué)院,呼和浩特 010018)
為了探索Ghrelin在馴鹿體內(nèi)的表達及定位,采用實時熒光定量PCR(Real-time PCR)和免疫組織化學(xué)技術(shù)對其進行檢測。Real-time PCR結(jié)果顯示Ghrelin在所檢測的17種器官中均有轉(zhuǎn)錄,在皺胃內(nèi)的轉(zhuǎn)錄量最高,其次是胰、十二指腸、睪丸和食管,且轉(zhuǎn)錄量顯著高于其他器官(P<0.05);免疫組化結(jié)果揭示Ghrelin的免疫陽性細胞在食管和皺胃內(nèi)主要分布于黏膜層、黏膜下層和肌層;在瘤胃、網(wǎng)胃、瓣胃的黏膜層、黏膜下層中也可見Ghrelin的免疫陽性細胞,但肌層中未見表達;在腸道主要位于十二指腸、空腸、回腸、結(jié)腸的黏膜層、黏膜下層和肌層,尤其在腸絨毛和黏膜下層分布較多;在肝、胰、甲狀腺、垂體前葉、睪丸、肺、腎、脾器官內(nèi)均有Ghrelin的免疫陽性細胞。Real-time PCR和免疫組化結(jié)果顯示Ghrelin在所檢測的器官內(nèi)均有分布,且在食管和胃腸道內(nèi)表達量及分布范圍最為廣泛,這表明Ghrelin對馴鹿的消化系統(tǒng)可能存在一定的調(diào)節(jié)作用。
Ghrelin;馴鹿;實時熒光定量PCR;免疫組化
Ghrelin(生長素)是一種能夠刺激攝食和促進生長激素釋放的腦腸肽[1],是生長激素促分泌素受體1a(growth hormone secretagogue receptor 1a,GHS-R1a)的一個內(nèi)源性配體。當(dāng)Ghrelin與其特異性受體結(jié)合后不僅能夠促進GH的釋放,還能對心血管、生殖和免疫系統(tǒng)起到調(diào)控作用。研究發(fā)現(xiàn)在人體內(nèi)Ghrelin mRNA和免疫陽性細胞主要分布于消化系統(tǒng)[2-3]。在禽類體內(nèi),李福寶等[4]研究顯示在成年皖西白鵝小腸內(nèi)檢測到Ghrelin免疫陽性細胞的表達。在反芻動物體內(nèi),D. W. Miller等[5]研究顯示在成年綿羊的胃腸道內(nèi)均有分布。Ghrelin廣泛存在于動物體內(nèi),說明該激素可能對動物各器官具有重要的調(diào)節(jié)作用。迄今為止,有關(guān)Ghrelin在人類和嚙齒類動物體內(nèi)的表達及作用機制的研究比較成熟,而關(guān)于Ghrelin在馴鹿體內(nèi)的研究才剛剛起步。目前,本課題組已完成了馴鹿生長素Ghrelin全長cDNA的克隆及序列分析[6],但未見有關(guān)馴鹿器官內(nèi)Ghrelin的表達及定位的報道。因此,本試驗采用Real-time PCR和免疫組織化學(xué)方法,從分子和細胞水平上研究馴鹿體內(nèi)Ghrelin的表達量及免疫陽性細胞分布情況,旨在豐富反芻動物生物學(xué)資料,為探索Ghrelin在馴鹿體內(nèi)的作用及其機制提供依據(jù)。
1 材料與方法
1.1 試劑
RNAiso Plus(Total RNA提取試劑,日本TaKaRa公司),PrimerScriptTMRT reagent Kit with gDNA Eraser(TaKaRa公司),PremixTaqTM(TaKaRa公司),SYBR?Premix ExTaqTMII(Tli RNase Plus,TaKaRa公司),DAB染色液(DAB-0031 福州邁新),Mayor’s蘇木素(AR0005 武漢博士德),即用型SABC-POD(兔IgG)試劑盒(SA1002 武漢博士德),Ghrelin(GHRL)Antibody(BA1619武漢博士德)。
1.2 試驗動物及樣品制備
1頭成年殘疾雄性馴鹿(右后肢缺失)由內(nèi)蒙古大興安嶺北敖魯古雅民族自治鄉(xiāng)提供。馴鹿屠宰后立即將食管、瘤胃、網(wǎng)胃、瓣胃、皺胃、十二指腸、空腸、回腸、結(jié)腸等組織的黏膜進行分離,并切取適量肝、胰、肺、脾、腎、睪丸、垂體前葉、甲狀腺等組織塊,放入液氮中冷凍備用,將以上用于免疫組化的組織塊用生理鹽水清洗后放入4%多聚甲醛固定液中4 ℃固定24 h。
1.3 總RNA的提取和反轉(zhuǎn)錄反應(yīng)
總RNA的提取按照TaKaRa公司(日本)的RNAiso Plus Total RNA提取試劑盒說明書操作。反轉(zhuǎn)錄反應(yīng)使用PrimerScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)試劑盒。去除基因組DNA:6.5 μL的總RNA、RNase Free dH2O 0.5 μL、gDNA Eraser 1.0 μL、5×gDNA Eraser Buffer 2.0 μL,反應(yīng)體系共10 μL,42 ℃水浴2 min。cDNA的合成:10 μL的上述反應(yīng)液、RNase Free dH2O 4.0 μL 、5×PrimeScript Buffer 2(for Real-Time)4.0 μL、RT Primer Mix 1.0 μL、PrimeScriptRT Enzyme Mix I 1.0 μL,反應(yīng)體系共20 μL。于PCR儀進行反轉(zhuǎn)錄,反應(yīng)條件:37 ℃ 15 min ,85 ℃ 5 s,于-20 ℃?zhèn)溆谩?/p>
1.4 Real-time PCR
根據(jù)本課題組呈送到GenBank中的馴鹿Ghrelin部分mRNA序列和跨內(nèi)含子引物設(shè)計原則設(shè)計一對特異性PCR引物。另外根據(jù)馴鹿18S rRNA序列設(shè)計另外一對PCR引物。引物序列見表1,由生工生物工程(上海)股份有限公司合成。
表1 實時定量PCR引物序列
Table 1 The primer sequences for Real-time PCR

基因名稱GenenamesGenBank登錄號GenBankaccession引物序列PrimerpairsequencesGhrelinEU099031.2U?5′?AACGCCCCCTTTGACATTGG?3′D?5′?TGAGGGTGGGGGAACGGACAG?3′18SrRNAAY225108.1U?5′?CCCGGAGAAGGAGCCTGAGAAAC?3′D?5′?TGATGCCCCCGACTGTCCCTATTA?3
采用SYBR Green II熒光染料進行實時定量PCR檢測。反應(yīng)體系:SYBR Premin ExTaq(2×)10 μL,上下游引物各0.8 μL,10倍稀釋的cDNA模板2 μL,dH2O補足20 μL。于實時定量PCR儀(VIIA7,ABI)進行反應(yīng)。反應(yīng)條件:95 ℃ 預(yù)變性30 s;95 ℃ 變性5 s,62 ℃ 退火30 s,45個循環(huán)。每個樣品的18S rRNA基因和Ghrelin基因分別做3個重復(fù)。
1.5 數(shù)據(jù)處理
將RT-PCR得到的Ghrelin基因和18S rRNA基因的Ct值,根據(jù)公式2-ΔCt[7]求出Ghrelin基因的相對轉(zhuǎn)錄量,其中ΔCt=Ct(Ghrelin)-Ct(18S rRNA),并進行統(tǒng)計分析。
1.6 數(shù)據(jù)統(tǒng)計分析
用Graphpad Prism 5軟件進行單因子方差分析,每組重復(fù)3次,檢驗結(jié)果以P<0.05代表差異顯著。
1.7 免疫組織化學(xué)染色
將固定好的組織樣品進行常規(guī)石蠟包埋,切片厚度為4~5 μm,連續(xù)切片。按照免疫組化試劑盒(武漢博士德,SA1002)說明書進行染色。一抗為兔抗人、大鼠、小鼠、兔Ghrelin多克隆抗體(武漢博士德,BA1619)稀釋度為1∶200,對照組用PBS代替一抗。用DAB顯色(福州邁新,DAB-0031),蘇木精復(fù)染,脫水,透明,封片。顯微鏡觀察,陽性產(chǎn)物為棕黃色。
2 結(jié) 果
2.1 Ghrelin在馴鹿器官的轉(zhuǎn)錄
2.1.1Ghrelin基因和18S rRNA基因PCR擴增效率曲線 將Ghrelin和18S rRNA基因cDNA以10倍濃度稀釋后,分別進行實時熒光定量PCR擴增。得到不同濃度下Ghrelin和18S rRNA基因熒光定量PCR的擴增效率曲線(圖1)。兩組標準曲線的回歸系數(shù)分別為R2(Ghrelin)=0.995、R2(18S rRNA)=0.998。Ghrelin和18S rRNA基因轉(zhuǎn)錄量的對數(shù)值(x軸)和Ct值(y軸)存在著反比例的關(guān)系,且擴增效率(E)接近等于1(E=100%),待測基因轉(zhuǎn)錄量的對數(shù)值與Ct值呈明顯的線性關(guān)系,表明可以用熒光定量PCR方法檢測Ghrelin基因的相對轉(zhuǎn)錄情況,并可以通過運用2-ΔCt公式進行目的基因相對轉(zhuǎn)錄量的計算。
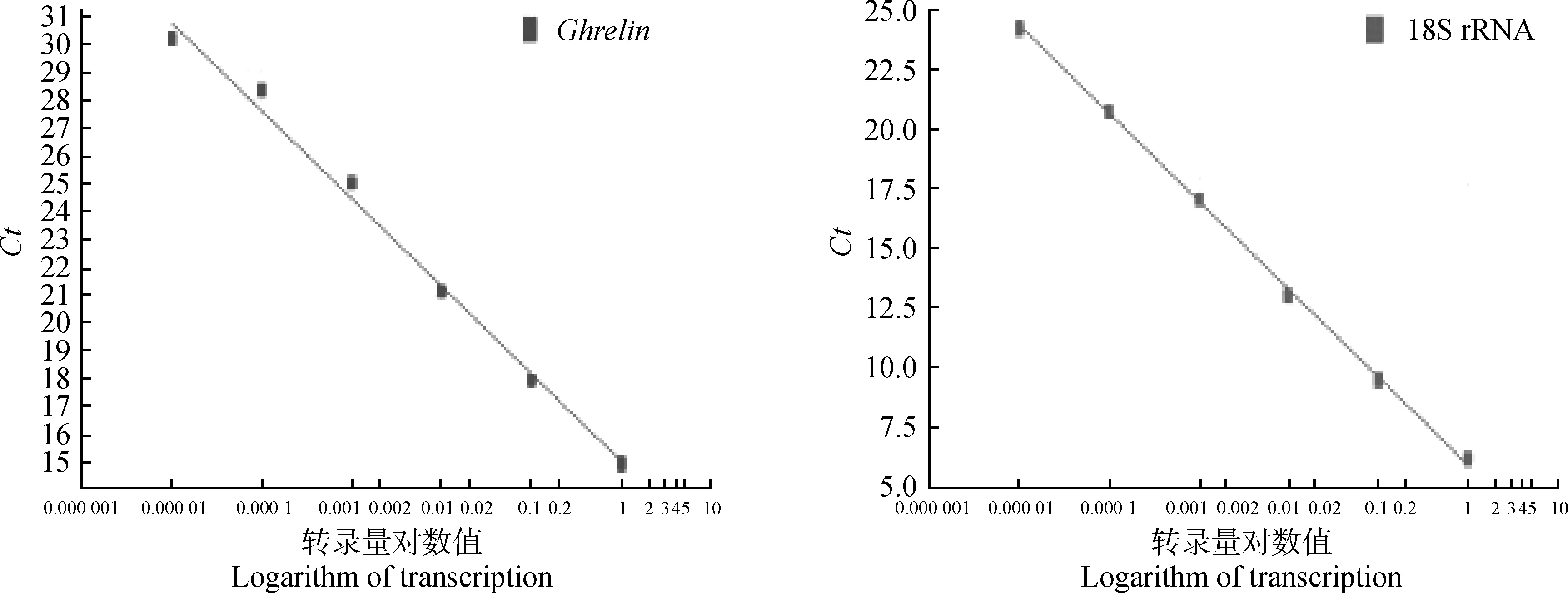
圖1 Ghrelin和18S rRNA基因的擴增效率曲線Fig.1 The Real-time PCR amplification efficiency curve of Ghrelin and 18S rRNA genes
2.1.2Ghrelin相對轉(zhuǎn)錄量 Real-time PCR檢測結(jié)果經(jīng)Graphpad Prism 5軟件分析發(fā)現(xiàn),Ghrelin在馴鹿不同器官內(nèi)均有轉(zhuǎn)錄且相對轉(zhuǎn)錄量差異顯著(圖2),Ghrelin在皺胃內(nèi)的轉(zhuǎn)錄豐度顯著高于其他器官(P<0.05),其次是胰、十二指腸、睪丸和食管,且與瘤胃、網(wǎng)胃、瓣胃、空腸、回腸、結(jié)腸、肝、甲狀腺、垂體前葉、肺、脾、腎等器官內(nèi)的轉(zhuǎn)錄量相比差異顯著(P<0.05)。
2.2 Ghrelin在馴鹿器官的分布
2.2.1 Ghrelin在消化管內(nèi)的分布 免疫組化結(jié)果顯示,Ghrelin免疫陽性細胞在消化管內(nèi)廣泛分布。在食管內(nèi)Ghrelin免疫陽性細胞主要定位于黏膜層、黏膜下層和肌層(圖3A1),黏膜上皮角質(zhì)層內(nèi)分布較少(圖3A2、A2-1);在瘤胃、網(wǎng)胃、瓣胃內(nèi)Ghrelin免疫陽性細胞主要分布于黏膜層和黏膜下層,但著色較淺,肌層未見陽性染色(圖3B1、B2~D1、D2)。在皺胃內(nèi),Ghrelin免疫陽性細胞主要分布于黏膜層、黏膜下層和肌層(圖3E1),且在黏膜上皮和胃底腺區(qū)的腺頸部著色較深、腺體部和腺底部著色較淺(圖3E2)。經(jīng)免疫組化DAB染色發(fā)現(xiàn),在十二指腸、空腸、回腸和結(jié)腸均可見Ghrelin免疫陽性反應(yīng)。在十二指腸內(nèi)Ghrelin的陽性細胞大部分細胞質(zhì)著色,在黏膜層、黏膜下層和肌層均有分布(圖3F1),其中腸絨毛上皮和黏膜下層著色較深,十二指腸腺著色不明顯(圖3F2);空腸內(nèi)的Ghrelin陽性細胞主要集中在腸絨毛上皮和黏膜下層(圖3G1),固有層腸腺和肌層著色不明顯(圖3G2);回腸內(nèi)陽性細胞主要分布于黏膜層和黏膜下層,固有層腸腺著色不明顯,肌層的著色顆粒與十二指腸相比明顯變淡(圖3H1、H2);結(jié)腸著色細胞主要位于黏膜層和黏膜下層,固有層腸腺著色不明顯,肌層未見陽性細胞(圖3I1、I2)。上述各陰性對照組均未發(fā)現(xiàn)陽性信號(圖3A3~I3)。
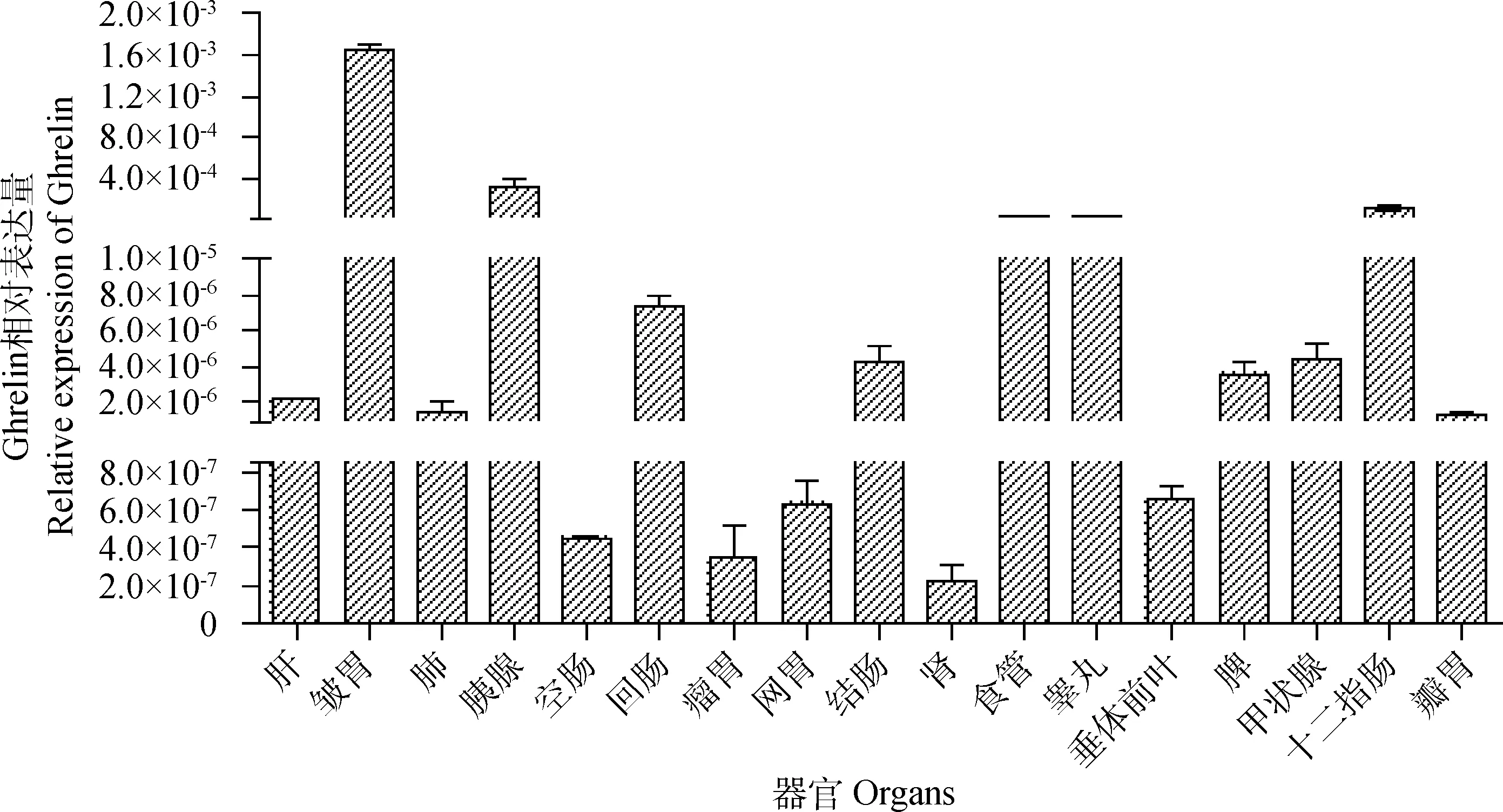
圖2 Ghrelin的相對轉(zhuǎn)錄量Fig.2 Relative expression of Ghrelin
2.2.2 Ghrelin在消化腺內(nèi)的分布 經(jīng)免疫組化DAB法染色后的肝切片,陽性細胞呈棕黃色,細胞質(zhì)內(nèi)顆粒清晰可見,染成一片,說明Ghrelin在馴鹿肝內(nèi)有陽性細胞表達(圖4J1、J2)。陰性對照組未見到陽性染色(圖4J3)。胰腺切片經(jīng)免疫組化DAB法染色后發(fā)現(xiàn),外分泌部和內(nèi)分泌部均有Ghrelin表達(圖4K1)。在外分泌部染色深淺不均一,說明Ghrelin的表達強弱不一致。內(nèi)分泌部中均可見免疫陽性表達,但周邊著色較深,呈深棕色,中間的細胞著色較淡(圖4K2),呈淡棕黃色。陰性對照組未見到陽性反應(yīng)物(圖4K3)。
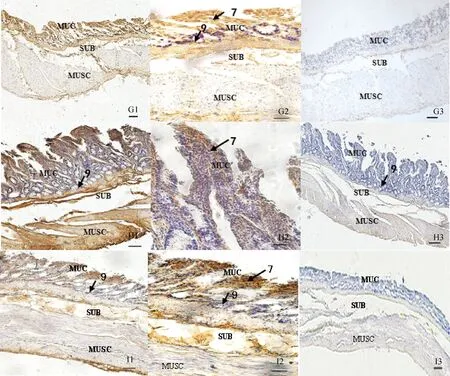
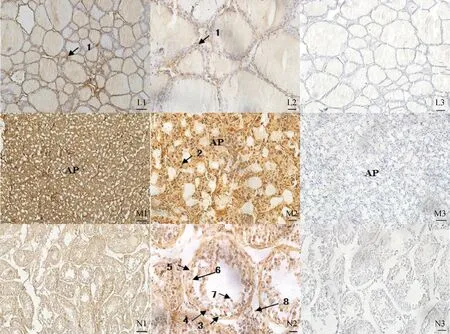
2.2.3 Ghrelin在其他實質(zhì)性器官內(nèi)的分布 Ghrelin在馴鹿的甲狀腺、垂體前葉、睪丸、肺、腎、脾均有免疫陽性反應(yīng)(圖5)。在甲狀腺的濾泡旁細胞和濾泡上皮細胞內(nèi)均可見陽性著色,且染色深淺不一(圖5L1)。在濾泡旁細胞內(nèi)可見細胞質(zhì)著色較深,細胞核為陰性,濾泡上皮細胞內(nèi)胞質(zhì)有少量著色,膠質(zhì)著色不明顯(圖5L2);在垂體前葉的嗜酸性細胞、嗜堿性細胞和嫌色細胞內(nèi)可見Ghrelin免疫反應(yīng),陽性著色較深,大部分為細胞質(zhì)和細胞核周染色,少量細胞核染色(圖5M1、M2);睪丸內(nèi)Ghrelin的免疫陽性細胞在間質(zhì)區(qū)染色明顯,也存在于支持細胞、初級精母細胞、次級精母細胞、精原細胞內(nèi),在精子內(nèi)著色不明顯(圖5N1、N2);Ghrelin在肺內(nèi)可見明顯陽性染色,肺內(nèi)支氣管上皮著色較深(圖5O1),在高倍鏡下可見肺泡細胞的細胞質(zhì)和少量細胞核著色(圖5O2);腎, Ghrelin在腎小囊壁層的扁平上皮細胞和臟層的足細胞以及球旁復(fù)合體內(nèi)著色明顯,近端小管和遠端小管上皮細胞內(nèi)陽性染色相對較淺,且大部分為細胞質(zhì)著色(圖5P2);Ghrelin的免疫陽性細胞在脾的被膜、小梁、白髓和紅髓內(nèi)均有著色(圖5Q1),其中白髓內(nèi)淋巴小結(jié)染色較明顯,紅髓內(nèi)陽性表達主要位于巨噬細胞和網(wǎng)狀細胞內(nèi),細胞質(zhì)著色明顯(圖5Q2)。上述各陰性對照組均無陽性反應(yīng)(圖5L3~Q3)。
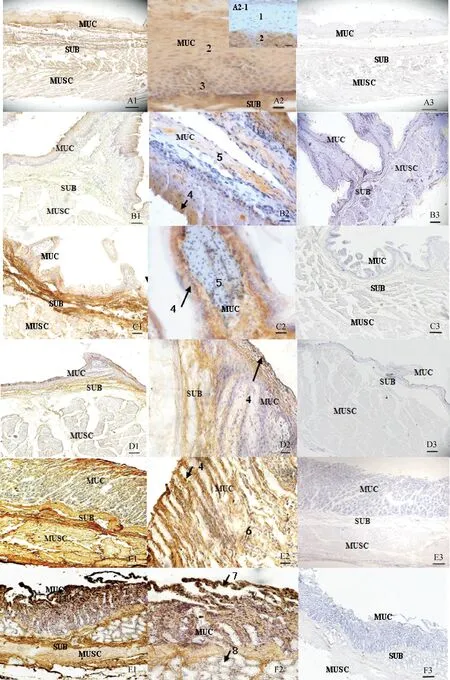
(轉(zhuǎn)下頁 Carried forward)
(續(xù)圖3 Continued)
A.食管;B.瘤胃;C.網(wǎng)胃;D.瓣胃;E.皺胃;F.十二指腸;G.空腸;H.回腸;I. 結(jié)腸;A2-1和1.角質(zhì)層;2.顆粒層和棘層;3.基底層;4.黏膜上皮;5.固有層;6.胃底腺;7.腸絨毛;8.十二指腸腺;9.腸腺;MUC. 黏膜層;SUB.黏膜下層;MUSC.肌層。A1、B1、C1、D1、E1、F1、G1、H1、I1. ×100,標尺=100 μm;A2、A2-1、B2、C2、D2、E2、F2、G2、H2、I2. ×400,標尺=20 μm;A3、B3、C3、D3、E3、F3、G3、H3、I3. 陰性對照×100,標尺=100 μmA. Oesophagus; B. Rumen; C. Reticulum; D. Omasum; E. Abomasum; F. Duodenum; G. Jejumum; H. Ileum; I. Colon; A2-1 and 1. Stratum corneum; 2. Stratum granulosum and stratum spinosum; 3. Stratum basale; 4. Epithelial; 5. Lamina propria; 6. Fundic gland; 7. Intestinal villus; 8. Duodenum glands; 9. Intestinal gland; MUC. Tunica mucosa; SUB. Tunica submucosa; MUSC. Tunica muscularis. A1, B1, C1, D1, E1, F1, G1, H1, I1. ×100, bar=100 μm; A2, A2-1, B2, C2, D2, E2, F2, G2, H2, I2. ×400, bar=20 μm; A3, B3, C3, D3, E3, F3, G3, H3, I3. Negative control, ×100, bar=100 μm.圖3 Ghrelin在馴鹿食管和胃腸道的分布Fig.3 The distribution in the oesophagus, stomach and intestine of Reindeer Ghrelin
3 討 論
3.1 Ghrelin在馴鹿體內(nèi)的表達
Ghrelin是由日本學(xué)者M. Kojima等[1]于1999年發(fā)現(xiàn)的一種含有28個氨基酸殘基的多肽,這28個氨基酸序列在魚、爬行動物、兩棲動物、鳥類和哺乳動物體內(nèi)存在一定的保守性[8],且在人和鼠胃腸道、中樞神經(jīng)系統(tǒng)均有分布[9]。本試驗采用Real-time PCR和免疫組織化學(xué)相結(jié)合的方法檢測了Ghrelin在馴鹿體內(nèi)的表達量及表達部位。
W. Wang等[10]通過檢測0~56日齡羔羊胃腸道內(nèi)Ghrelin的表達,結(jié)果顯示Ghrelin在皺胃內(nèi)的表達量最遠高于其他組織。與本試驗得出的結(jié)果相一致,因此筆者推測Ghrelin在反芻動物皺胃內(nèi)表達量最高,說明反芻動物在表達Ghrelin上可能存在種屬特異性。本研究還發(fā)現(xiàn)Ghrelin在食管、肝、胰、肺、脾、腎、睪丸、垂體前葉、甲狀腺等多種組織中也有廣泛分布,說明Ghrelin可能對動物的內(nèi)分泌系統(tǒng)、呼吸系統(tǒng)、泌尿系統(tǒng)、生殖系統(tǒng)和免疫系統(tǒng)存在重要的調(diào)節(jié)作用。T. Lin等[11]研究發(fā)現(xiàn)Ghrelin
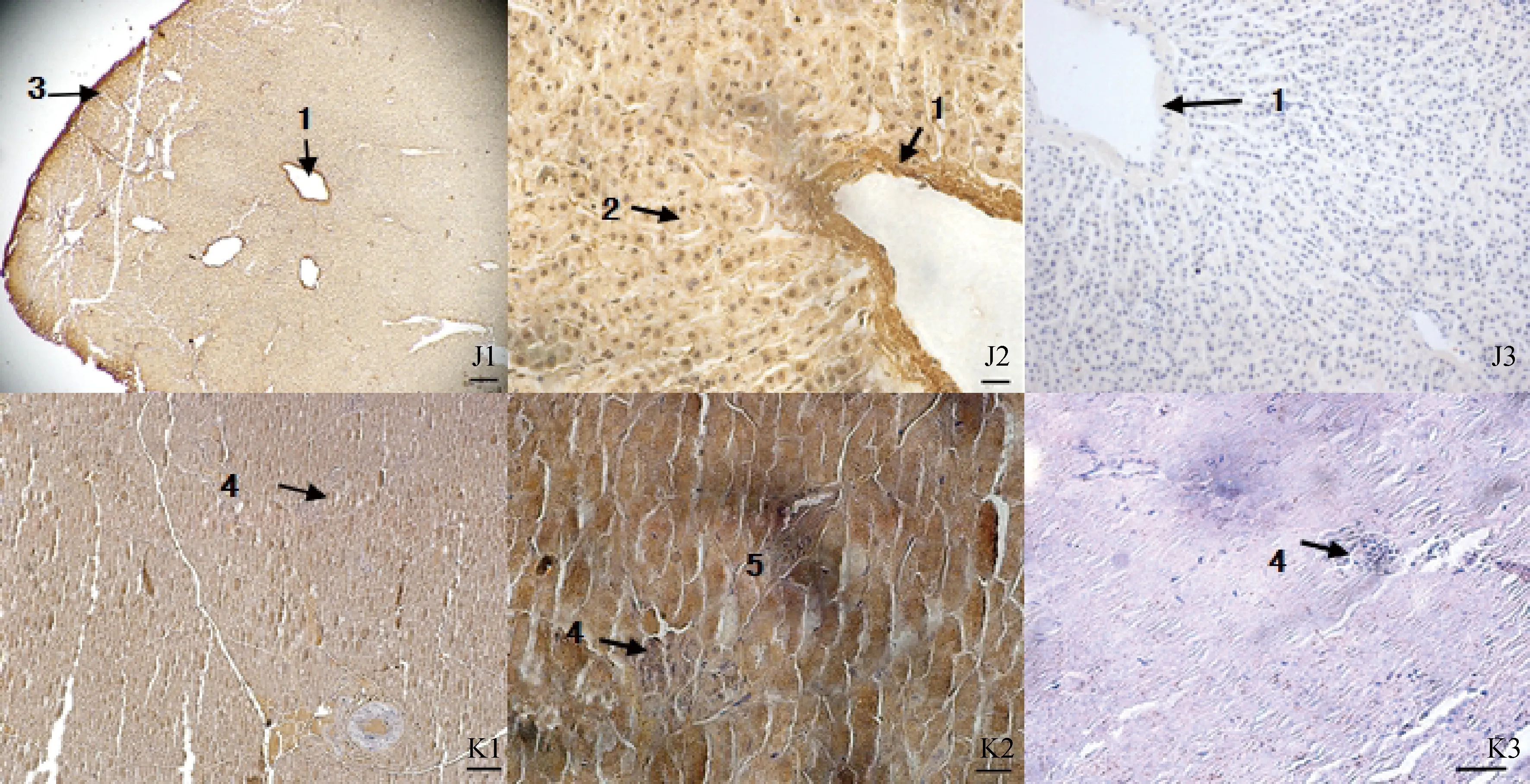
J.肝;K.胰腺;1.中央靜脈;2.肝細胞;3.被膜;4.胰島;5.外分泌部;J1、K1. ×100,標尺=100 μm;J2、K2.×400,標尺=20 μm;J3、K3. 陰性對照, ×100,標尺=100 μmJ. Liver; K. Pancreas; 1. Central vein; 2. Liver cell; 3. Liver capsule;4. Pancreas islet; 5. Exocrine portion; J1, K1. ×100, bar=100 μm; J2, K2. ×400, bar=20 μm; J3, K3. Negative control, ×100, bar=100 μm圖4 Ghrelin在馴鹿肝和胰腺的分布Fig.4 The distribution in the liver and pancreas of Reindeer Ghrelin
(轉(zhuǎn)下頁 Carried forward)
(續(xù)圖5 Continued)

L. 甲狀腺;M. 垂體前葉;N.睪丸;O. 肺;P. 腎;Q. 脾;Q2-1. 白髓;1. 濾泡胖細胞;2. 垂體前葉內(nèi)的免疫陽性細胞;3. 支持細胞;4. 精原細胞;5.初級精母細胞;6.次級精母細胞;7. 精子細胞;8.間質(zhì)細胞;9.支氣管;10.細支氣管;11.肺泡;12.近端小管;13.遠端小管;14.腎小囊;15. 球外系膜細胞;16.被膜;17. 小梁;18.白髓;19.紅髓。L1、M1、N1、O1、P1、Q1. ×100,標尺=100 μm;L2、M2、N2、O2、P2、Q2、Q2-1. ×400,標尺=20 μm;L3、M3、N3、O3、P3、Q3.陰性對照, ×100,標尺=100 μmL. Thyroid gland ; M. Anterior pituitary; N. Testis; O. Lung; P. Kidney; Q. Spleen; Q2-1. White puple;1. Parafolliclar cell; 2. AP section showing positive staining for ghrelin in most cells; 3. Sertoli cells; 4. Spermatogonia; 5. Primary spermatocyte; 6. Secondary spermatocyte; 7. Spermatid; 8. Interstitial cell; 9. Bronchus; 10. Bronchiole; 11. Alveolar; 12. Proximal tubule; 13. Distal tubule; 14. Renal capsule; 15. Extraglomerular mesangial cell ; 16. Splenic capsule; 17. Spleen trabecula; 18. White puple; 19. Red puple; L1, M1, N1, O1, P1, Q1.×100, bar=100 μm; L2, M2, N2, O2, P2, Q2, Q2-1. ×400, bar=20 μm; L3, M3, N3, O3, P3, Q3. Negative control, ×100, bar=100 μm.圖5 Ghrelin在馴鹿甲狀腺、垂體前葉、睪丸、肺、腎、脾的分布Fig.5 The distribution in the thyroid gland, hypophysis, testis, lung, kidney, spleen of Reindeer Ghrelin
在豬的胃和十二指腸內(nèi)表達量最高,其次是胰,與本研究得出的胰內(nèi)Ghrelin表達量高于十二指腸的結(jié)果又存在矛盾,但由于目前關(guān)于鹿屬動物的報道僅有黑麂[12]的肝及胃腸道內(nèi)Ghrelin蛋白定位的研究,而并未發(fā)現(xiàn)其他鹿種Ghrelin的表達及定位,所以現(xiàn)在很難斷言是鹿屬動物Ghrelin共有的特性,還是由于馴鹿Ghrelin發(fā)生了變異,這將有待于進一步研究證實。
3.2 Ghrelin在馴鹿體內(nèi)的分布
迄今為止,Ghrelin免疫陽性細胞已被發(fā)現(xiàn)分布于多種動物的消化管中[12-14]。本試驗發(fā)現(xiàn),Ghrelin陽性細胞分布于馴鹿整個消化管的黏膜層,說明Ghrelin在不同物種間可能存在一定的保守性。本研究還發(fā)現(xiàn),在食管、瘤胃、網(wǎng)胃、瓣胃、十二指腸、空腸、回腸和結(jié)腸的黏膜下層也分布較多,這與Ghrelin陽性細胞在皖西白鵝[4]和大鼠[15]胃腸道內(nèi)的分布結(jié)果不一致,而與陽性細胞在濟寧青山羊[14]和黑麂[12]相一致,進一步說明反芻動物在表達Ghrelin上可能存在種屬特異性。研究發(fā)現(xiàn)Ghrelin免疫陽性細胞在瘤胃、網(wǎng)胃、瓣胃和結(jié)腸的肌層內(nèi)未見免疫陽性表達,而在食管、皺胃和十二指腸可以看見明顯的陽性染色,空腸和回腸內(nèi)染色明顯減少。Ghrelin免疫陽性細胞在消化管肌層內(nèi)的廣泛表達,提示Ghrelin可能對食管和胃腸道的運動具有調(diào)節(jié)作用。
近年來,研究者發(fā)現(xiàn)在淡水鱈[16]和皖西白鵝[4]的肝中均可檢測到Ghrelin陽性表達。本研究同樣發(fā)現(xiàn)Ghrelin免疫陽性細胞在馴鹿肝內(nèi)有棕黃色陽性染色。目前,不同的研究者關(guān)于Ghrelin在不同物種肝中的分布情況及Ghrelin對肝功能的影響結(jié)果還存在差異,因此有必要進一步研究。據(jù)報道,大鼠胰島的A細胞和B細胞存在生長激素促分泌素受體(GHSR),A細胞能合成和分泌Ghrelin,并通過自分泌或旁分泌的方式作用于A細胞本身;此外,Ghrelin可能通過和GHSR的相互作用,調(diào)節(jié)B細胞胰島素的分泌[17]。本試驗結(jié)果顯示,在馴鹿胰腺的外分泌部和內(nèi)分泌部都檢測到Ghrelin陽性表達,且在內(nèi)分泌部外周的染色較中央?yún)^(qū)域強,提示Ghrelin在馴鹿體內(nèi)可能同樣存在調(diào)節(jié)胰島素分泌的作用。
Ghrelin在垂體上的功能主要是促進GH的釋放,本研究發(fā)現(xiàn)Ghrelin在垂體前葉的部分嗜酸性細胞和嗜堿性細胞均有分布,由此推測Ghrelin在垂體可能通過旁分泌/自分泌形式發(fā)揮作用。魏鳳梅等[13]研究顯示,Ghrelin免疫陽性細胞在雞脾的巨噬細胞和網(wǎng)狀細胞、腎小囊壁層的扁平上皮細胞和臟層的足細胞、球內(nèi)系膜細胞、球旁復(fù)合體和肺的巨噬細胞內(nèi)均呈免疫陽性反應(yīng),與本試驗得出的Ghrelin在馴鹿睪丸、肺、腎、甲狀腺和脾的定位結(jié)果基本一致。Ghrelin可劑量依賴性的抑制hCG以及cAMP誘導(dǎo)睪丸分泌睪酮,并調(diào)節(jié)體內(nèi)的睪丸間質(zhì)細胞的增殖和睪丸基因的表達,在hCG誘導(dǎo)的睪酮分泌中,Ghrelin的抑制作用可能與其抑制睪酮合成相關(guān)酶(如StAR蛋白、P450、HSD、17β2HSDIII)的表達有關(guān)[19]。本研究發(fā)現(xiàn)Ghrelin免疫陽性細胞在馴鹿睪丸的間質(zhì)區(qū)、支持細胞和生殖細胞均有分布,提示Ghrelin可能直接調(diào)控睪丸的生物學(xué)功能。
4 結(jié) 論
Real-time PCR和免疫組化結(jié)果顯示,Ghrelin免疫陽性細胞的分布與GhrelinmRNA的表達在馴鹿體內(nèi)是一致的,即Ghrelin在馴鹿的消化系統(tǒng)、內(nèi)分泌系統(tǒng)、呼吸系統(tǒng)、泌尿系統(tǒng)、生殖系統(tǒng)和免疫系統(tǒng)內(nèi)均有表達,且在消化系統(tǒng)內(nèi)的表達最為廣泛。
[1] KOJIMA M, HOSODA H, DATE Y, et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J].Nature, 1999, 402 (6762): 656-660.
[2] ARIYASU H, TAKAYA K, TAGAMI T, et al. Stomach is a major source of ciculating ghrelin, and feeding state determines plasma ghrelin-like immunoreactivity levels in humans[J].JClinEndocrinolMetab, 2001, 86(10): 4753-4758.
[3] GNANAPAVAN S, KOLA B, BUSTIN S A, et al. The tissue distribution of the mRNA of ghrelin and subtypes of its receptor, GHS-R, in humans[J].JClinEndocrinolMetab, 2002, 87(6): 2988.
[4] 李福寶, 方富貴, 李梅清, 等. Ghrelin在成年皖西白鵝小腸內(nèi)的免疫組化定位研究[J]. 畜牧獸醫(yī)學(xué)報, 2007, 38(2): 206-208.
LI F B, FANG F G, LI M Q, et al. Immunohistochemical localization of Ghrelin in the small intestine of adult Wanxi white goose[J].ActaVeterinariaetZootechicaSinica, 2007, 38(2): 206-208. (in Chinese)
[5] MILLER D W, HARRISON J L, BROWN Y A, et al. Immuohistochemical evidence for an endocrine/paracrine role for ghrelin in the reproductive tissues of sheep[J].ReprodBiolEndocrinol, 2005, 3: 60.
[6] 楊銀鳳, 余興邦, 王冠玉, 等. 中國馴鹿生長素(Ghrelin)全長cDNA的克隆及序列分析[J]. 中國獸醫(yī)學(xué)報,2014, 34(10): 1647-1652.
YANG Y F, YU X B, WANG G Y, et al. Cloning and analysis of the full-length cDNA of China reindeer Ghrelin[J].ChineseJournalofVeterinaryScience, 2014, 34(10): 1647-1652. (in Chinese)
[7] SHAO Y J, LIU S Q, TANG X Y, et al. Ontogeny of ghrelin mRNA expression and identification of ghrelin-immunopositive cells in the gastrointestinal tract of the Peking duck, Anas platyrhychos[J].GenCompEndocrinol, 2010, 166(1): 12-18.
[8] KAIYA H, MIYAZATO M, KANGAWA K, et al. Ghrelin: a multifunctional hormone in non-mammalian vertebrates[J].CompBiochemPhysiolAMolIntegrPhysiol, 2008, 149(2): 109-128.
[9] 曹貴方, 呂東媛, 白春玲, 等. 一種新的腦腸肽激素--Ghrelin[J]. 畜牧與飼料科學(xué), 2004(6): 64-66.
CAO G F, LV D Y, BAI C L, et al. A new brain-gut peptide hormone-Ghrelin[J].AnimalHusbandryandFeedScience, 2004(6): 64-66. (in Chinese)
[10] WANG W, CHENG L, GUO J, et al. Expression of Ghrelin in gastrointestinal tract and the effect of early weaning on Ghrelin expression in lambs[J].MolBiolRep, 2014, 41(2): 909-914.
[11] LIN T, MENG Q, SUI D, et al. Molecular cloning and expression analysis of porcine ghrelin O-acyltransferase[J].BiochemGenet, 2011, 49(9-10): 576-586.
[12] 蔣書東, 戴書俊, 方富貴, 等. 黑麂肝、小腸和大腸的組織學(xué)結(jié)構(gòu)及 Ghrelin 的分布[J]. 動物學(xué)雜志, 2012, 47(1): 36-43.
JIANG S D, DAI S J, FANG F G, et al. Histological structure and distribution of Ghrelin in liver,small intestine and large intestine ofMuntiacuscrinifrons[J].ChineseJournalofZoology, 2012, 47(1): 36-43. (in Chinese)
[13] 魏鳳梅, 李玉谷, 葉遠蘭, 等. Ghrelin免疫反應(yīng)陽性細胞在雞外周器官中的定位分布與發(fā)育性變化[J]. 畜牧獸醫(yī)學(xué)報, 2010, 41(3): 341-346.
WEI F M, LI Y G, YE Y L, et al. Localization and development of Ghrelin-immunopositive cells in periphery organs of broiler chickens[J].ActaVeterinariaetZootechicaSinica, 2010, 41(3): 341-346. (in Chinese)
[14] 張德敏. 濟寧青山羊胃腸道Ghrelin免疫陽性細胞與小腸組織結(jié)構(gòu)的發(fā)育性變化[D]. 泰安: 山東農(nóng)業(yè)大學(xué), 2012.
ZHANG D M. Developmental changes of Ghrelin-immunopositive cells in the gastrointestinal tract and morphological structure of small intestine in Jining gray goat[D]. Tai’an: Shandong Agricultural College, 2012. (in Chinese)
[15] SAKATA I, NAKAMURA K, YAMAZAKI M, et al. Ghrelin-producing cells exist as two types of cells, closed- and opened-type cells, in the rat gastrointestinal tract[J].Peptides, 2002, 23(3): 531-536.
[16] NIEMINEN P, MUSTONEN A M, HYVRINEN H. Fasting reduces plasma leptin- and ghrelin-immunoreactive peptide concentrations of the burbot (Lota lota) at 2℃ but not at 10℃ [J].ZoologSci, 2003, 20(9) : 1109-1115.
[17] KAGEYAMA H, FUNAHASHI H, HIRAYAMA M, et al. Morphological analysis of ghrelin and its receptor distribution in the rat pancreas[J].RegulPept, 2005, 126(1-2): 67-71.
[18] TOLLE V, ZIZZARI P, TOMASETTO C, et al.Invivoandinvitroeffects of Ghrelin/motilin-related peptide on growth hormone secretion in the rat [J].Neuroendocrinology, 2001, 73(1): 54-61.
[19] GAYTAN F, BARREIRO M L, CAMINOS J E, et al. Expression of ghrelin and its functional receptor, the type 1a growth hormone secretagogue receptor, in normal human testis and testicular tumors[J].JClinEndocrinolMetab, 2004, 89(1):400-409.
(編輯 白永平)
The Examination of Expression and Localization of Ghrelin in the Reindeer Organs
ZHANG Man, JIN Xin, LIU Jiao, YANG Yin-feng*
(College of Veterinary Medicine,Inner Mongolia Agriculture University, Hohhot 010018,China)
The Real-time PCR and Immunohistochemistry were used to examine the expression and localization of Ghrelin in the reindeer organs. The results of Real-time PCR indicated that Ghrelin was expressed in 17 kinds of organs and the expression in the abomasum was highest, followed by pancreas, duodenal, testis and oesophagus, in which the expression of Ghrelin were remarkably higher than that of the rest organs (P<0.05). Immunohistochemical results showed that Ghrelin-positive cells in the oesophagus and abomasum mainly distributed in the tunica mucosa, tunica submucosa and tunica muscularis and also detected in the tunica mucosa, tunica submucosa of rumen, reticulum, omasum. In the intestine, Ghrelin-positive cells were mainly localized in the tunica mucosa, tunica submucosa and tunica muscularis of duodenum, jejumum, ileum, colon, especially more cells were found in the epithelium of intestinal villi and the tunica submucosa. Ghrelin-positive cells were observed in the liver, pancreas, lung, spleen, kidney, testis, anterior pituitary, thyroid gland. Real-time PCR and immunohistochemistry results showed that Ghrelin was presented in all of the organs that were examined, where the expression and distribution of Ghrelin in the esophagus and gastrointestinal were most widely, suggesting its possible role in regulating the digestive function.
Ghrelin; reindeer; Real-time PCR; immunohistochemistry
10.11843/j.issn.0366-6964.2016.12.022
2016-09-15
內(nèi)蒙古自然科學(xué)基金(2013MS0408)
張 曼(1990-),女,遼寧沈陽人,博士生,主要從事動物解剖及分子生物研究,E-mail:zhangman90514@163.com
*通信作者:楊銀鳳(1963-),女,教授,博士,E-mail:julie1963@163.com
S852.1
A
0366-6964(2016)12-2510-10

