尿毒清顆粒抑制大鼠腎臟間質纖維化作用靶點研究
陳琇萌,俞小敏*,肖潔
(廣州醫科大學附屬第一醫院腎內科,廣東廣州510120)
尿毒清顆粒抑制大鼠腎臟間質纖維化作用靶點研究
陳琇萌,俞小敏*,肖潔
(廣州醫科大學附屬第一醫院腎內科,廣東廣州510120)
目的研究尿毒清抑制大鼠腎臟間質纖維化的作用。方法采用單側輸尿管結扎術制備腎間質纖維化大鼠模型,將10周齡SPF級雄性大鼠60只,隨機分3組:假手術(Sham,n=20)、模型組(UUO,n=20)和尿毒清治療組(UNQ,n=20);UNQ組于于術前1天給予尿毒清2 g/(kg·d)灌胃,假手術組及模型組每天灌胃等量生理鹽水,各組分別于術后第3、7、14天處死5只大鼠,取梗阻側腎臟進行組織學檢查,對腎間質細胞浸潤、腎小管萎縮和腎間質纖維化情況進行半定量評分;采用免疫組化、ELISA和Western Blot分別分析腎組織中轉化生長因子β1(TGF-β1)、纖粘連蛋白(FN)表達。結果與Sham相比,UUO大鼠各時間點的病理損害進行性加重,腎小管間質中TGF-β1、FN表達均增高(P<0.05)。與UUO相比,尿毒清治療后3 d,可觀察到大鼠的腎間質炎性細胞浸潤、腎小管萎縮及腎間質纖維化(P<0.05)明顯減輕,同時腎組織中TGF-β1表達減少(P<0.05);治療后7 d,上述治療作用持續存在,同時進一步使UUO大鼠腎間質的FN表達下降(P<0.05);治療14 d后,腎間質細胞浸潤情況評分(CIS)和慢性病變(包括腎小管萎縮和間質纖維化)評分(AFS)較UUO組分別下降22.2%和19.1%(P<0.05),TGF-β1、FN的表達則較UUO組分別減輕30.8%和30%(P<0.05)。結論尿毒清的保護作用表現在腎損傷的開始就通過減少TGF-β1表達從而使腎間質炎癥細胞浸潤受到抑制,同時還能減少病變腎組織細胞外基質的積聚,從而減輕腎間質纖維化。
尿毒清顆粒;腎臟間質纖維化;TGF-β1;單側輸尿管梗阻模型
本文引用:陳琇萌,俞小敏,肖潔.尿毒清顆粒抑制大鼠腎臟間質纖維化作用靶點研究[J].湖南中醫藥大學學報,2017,37(1):33-37.
腎間質纖維化是各種不同原因的慢性腎臟病進展至終末期腎病的共同病理過程。腎功能的惡化,很大程度上取決于腎小管間質纖維化的程度。單側輸尿管梗阻(unilateral ureteral obstruction,UUO)模型是以進行性小管間質纖維化為特征的實驗性腎病模型,為目前常用的腎間質纖維化模型[1]。目前研究認為,腎小管上皮細胞間充質轉分化(epithelial-mesenchymal transition,EMT)促使腎間質纖維化,而EMT受多種細胞因子、生長因子和激素的調節,其中轉化生長因子-β1(TGF-β1)是最重要的促纖維化因子,主要通過誘導其下游因子表達,啟動并調節EMT的全過程,使細胞外基質顯著增多。纖連蛋白(FN)是構成細胞外基質(ECM)的一種重要成分。ECM合成增多、降解減少,進而過度沉積導致了腎間質的纖維化[2-3]。尿毒清膠囊主要成分是大黃、黃芪、丹參、苦參、白術、茯芩、白芍、制何首烏、丹參、車前草等,是經過多年臨床驗證對慢性腎功能衰竭患者具有良好療效的純中藥制劑。本研究通過建立UUO大鼠腎間質纖維化模型,動態觀察腎臟間質纖維化的病理改變過程及尿毒清對該過程的影響,探討尿毒清抗腎臟間質纖維化的作用機制。
1 材料與方法
1.1 材料
尿毒清顆粒(規格:5g)購自內蒙古康臣藥業(批號20130704);10周齡SPF級雄性大鼠60只,200-250 g,廣東省醫學實驗動物中心提供,許可證:SYXK(粵)2010-0104;兔抗大鼠TGF-β1、FN抗體購自Santa Cruz公司(批號sc-62839),GDPDH抗體購自Biodesign公司,TGF-β1 ELISA試劑盒購自深圳晶美公司。主要儀器有:病理圖像分析系統(Kodak公司)、電泳儀(Amersham公司)、酶標儀(Bio-Rad公司)。
1.2 方法
1.2.1 動物分組與模型建立實驗鼠隨機分為假手術組(Sham,n=20)、模型(UUO,n=20)和模型+治療組(UNQ,n=20)。所有大鼠在SPF級實驗室7 d適應。10%水合氯醛(0.3 mL/100 g)腹腔麻醉,仰臥腹部正中切口2.5~3.5 cm,鈍性分離暴露左側腎盂輸尿管連接部,在其下方1 cm處游離5 mm輸尿管,用4~0線沿上端結扎兩道,在兩結扎點之間剪
斷輸尿管,然后逐層縫合,制備UUO模型。假手術組僅游離左側輸尿管但不結扎。
1.2.2 數據收集尿毒清按55-65 kg成人量15 g/d,折算尿毒清為0.23~0.27 g/(kg·d),大鼠為人體劑量的9~10倍給藥,配成1.0 g/mL藥液,分上午、下午兩次給藥。UNQ組于術前1天予尿毒清2 g/(kg·d)灌胃,Sham組及UUO組每天灌胃等量生理鹽水,各組分別于術后3、7、14 d下午處死5只大鼠。切除左腎,冷鹽水洗凈,留取腎門處橫斷面組織,用于免疫組化染色;剩余腎組織迅速置液氮保存備用。
1.3 檢測方法
1.3.1 腎臟組織病理學檢查及評分腎組織予HE和Masson染色,隨機選取互不重疊10個視野400倍顯微鏡下觀察,按下列標準對腎臟病理改變進行評分:腎間質細胞浸潤評分(cell infiltration score, CIS):無間質細胞浸潤為0分、局灶細胞浸潤1分、多灶細胞浸潤2分、彌漫細胞浸潤3分;包括腎小管萎縮和間質纖維化的慢性病變評分(atrophy and fibrosis score,AFS):按病變面積占該視野的百分比計算,間質纖維化:無計0分、小于25%計1分、25%~50%計2分、大于50%計3分;腎小管萎縮:無計0分、小于25%計1分、25%~50%計2分、大于50%計3分。腎小管間質損傷程度由各評分均值表示。
1.3.2 免疫組織化學染色TGF-β1:石蠟切片大鼠腎組織3 μm厚脫蠟水化后,用0.3%過氧化氫-甲醇滅酶,微波修復,再用2%牛血清蛋白封閉20 min后加抗TGF-β1抗體(1∶200)4℃過夜;再加生物素標記二抗(1∶200)37℃30 min、辣根酶標記鏈酶卵白素(1∶200)37℃30 min,最后DAB顯色。陰性對照用PBS代替一抗。FN應用胃蛋白酶修復后,其染色步驟與TGF-β1相似,使用的抗纖連蛋白抗體濃度為1∶50。
1.3.3 ELISA分析TGF-β1表達取出液氮中的腎組織放入RIPA緩沖液中,再冰上研磨直至組織完全溶解;在4℃中孵育60 min后在同一溫度下14 000×g離心30 min;取出上清液,組織勻漿中的蛋白質濃度和TGF-β1濃度分別用勞馬斯亮藍法和ELISA法測定,校正用樣品中的總蛋白濃度,TGF-β1水平用ng/g蛋白表示。
1.3.4 WesternBlot分析FN表達方法參照參考文獻[4],將上述腎組織勻漿煮沸變性后按200 mg蛋白/孔上樣,使用7.5%SDS-PAGE膠電泳后轉膜,5%脫脂牛奶封閉,加入抗纖連蛋白抗體和抗GAPDH抗體(1∶1 000)過夜,最后用辣根酶標記二抗(1∶5 000)顯影,以GAPDH作為內參照。分析纖連蛋白及GAPDH電泳條帶曝光強度使用圖像分析軟件,用對應相對豐度的比值表示纖連蛋白表達。
1.4 統計學處理
2 結果
2.1 尿毒清對腎臟組織病理變化的影響
光鏡下(圖1-2),Sham組空泡變性在腎小管上皮細胞偶見,腎間質有單核細胞灶狀浸潤。UUO組在造模后第3天出現擴張的腎小管及空泡變性的小管上皮細胞;腎間質可見水腫及多個灶狀的細胞浸潤和增生的梭形核細胞,腎間質有輕微纖維化改變。第7天時擴張的腎小管及空泡變性的小管上皮細胞更明顯,腎間質出現水腫、細胞呈彌漫性增生并有局灶的纖維化。第14天腎小管上皮細胞出現彌漫萎縮,腎間質可見細胞浸潤減輕而成纖維細胞明顯增生,腎間質出現明顯的纖維化生;但腎小球均則未見明顯病變。與UUO組比較,尿毒清治療后腎組織形態學變化均明顯減輕但依然存在;UNQ組第3天CIS和AFS分別減少33.5%和41.9%(P<0.05);第7天時CIS和AFS分別下降26.2%和20.83%(P<0.05);在第14天時CIS和AFS分別下降22.2%和19.1%(P<0.05)(表1-2)。
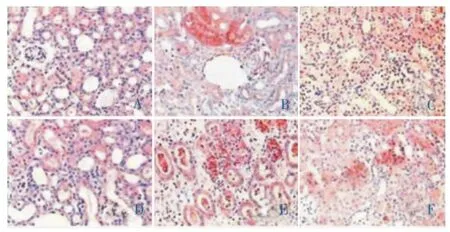
圖1 假手術組、模型組和尿毒清治療組7、14 d腎間質纖維化改變(HE染色,×200)

圖2 假手術組、模型組和尿毒清治療組7、14 d腎間質纖維化改變(Masson染色,×200)
2.2 尿毒清對腎組織TGF-β1表達的影響
如圖3示,Sham組可見TGF-β1偶見在腎小球微弱表達。UUO組在造模后第3天就可見腎小管上皮細胞擴張,腎間質有少量散在的細胞浸潤和TGF-β1高的表達,第7天時腎小管表達TGF-β1的數量明顯增多,TGF-β1表達的強度也明顯增高;到第14天TGF-β1表達仍繼續增高。在UNQ組,第3、7、14天見腎小管上皮細胞擴張,細胞內散在表達TGF-β1且強度較低,腎間質偶見單核細胞浸潤。腎組織勻漿中的TGF-β1蛋白水平用ELISA方法測定,結果發現(表3),Sham組TGF-β1水平在各時間點比較一致。UUO組的TGF-β1在第3天開始就和Sham組有差異,第7、14天表現為逐漸增高(P<0.05),在第3、7、14天分別是同期Sham組的1.81、2.35、2.62倍(P<0.05)。UNQ組TGF-β1水平表現為持續增高趨勢,第14天時是Sham組的1.81倍(P<0.05),但與UUO組比較TGF-β1水平在各時間點都表現為降低,分別降低48.1%、33.6%和30.8% (P<0.05)。
表1 各組大鼠腎間質細胞浸潤評分(±s,n=5)
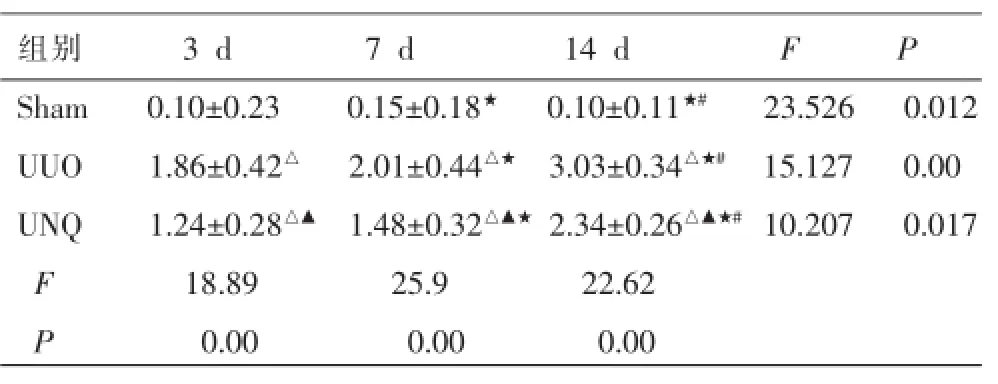
表1 各組大鼠腎間質細胞浸潤評分(±s,n=5)
注:與Sham組比較△P<0.01;與UUO組比較▲P<0.05;與3 d組比較★P<0.05;與7 d組比較#P<0.05。
組別3 d7 d14 dFP Sham0.10±0.230.15±0.18★0.10±0.11★#23.5260.012 UUO1.86±0.42△2.01±0.44△★3.03±0.34△★#15.1270.00 UNQ1.24±0.28△▲1.48±0.32△▲★2.34±0.26△▲★#10.2070.017 F18.8925.922.62 P0.000.000.00
表2 各組大鼠腎間質纖維化評分(±s,n=5)
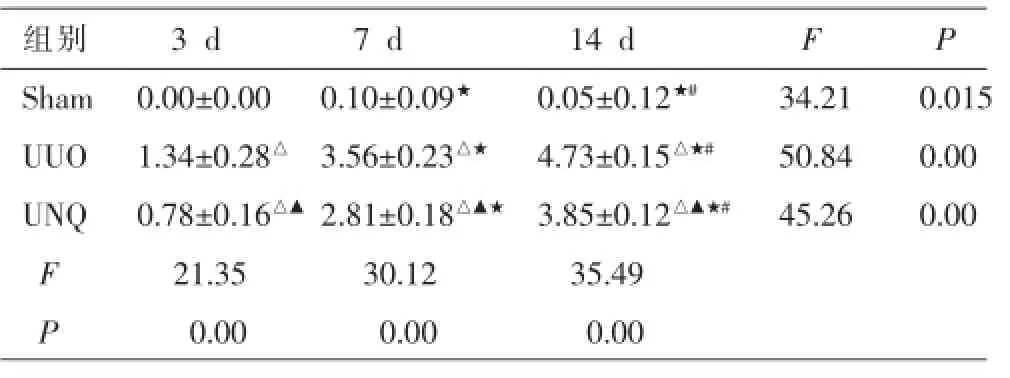
表2 各組大鼠腎間質纖維化評分(±s,n=5)
注:與Sham組比較△P<0.01;與UUO組比較▲P<0.05;與3 d組比較★P<0.05;與7 d組比較#P<0.05。
組別3 d7 d14 dFP Sham0.00±0.000.10±0.09★0.05±0.12★#34.210.015 UUO1.34±0.28△3.56±0.23△★4.73±0.15△★#50.840.00 UNQ0.78±0.16△▲2.81±0.18△▲★3.85±0.12△▲★#45.260.00 F21.3530.1235.49 P0.000.000.00

圖3 假手術組(A)、模型組(B)和尿毒清治療組(C)14 d時TGF-β1表達(免疫組化×200)
表3 尿毒清對腎組織中TGF-β1表達的影響(±s,ng/g)
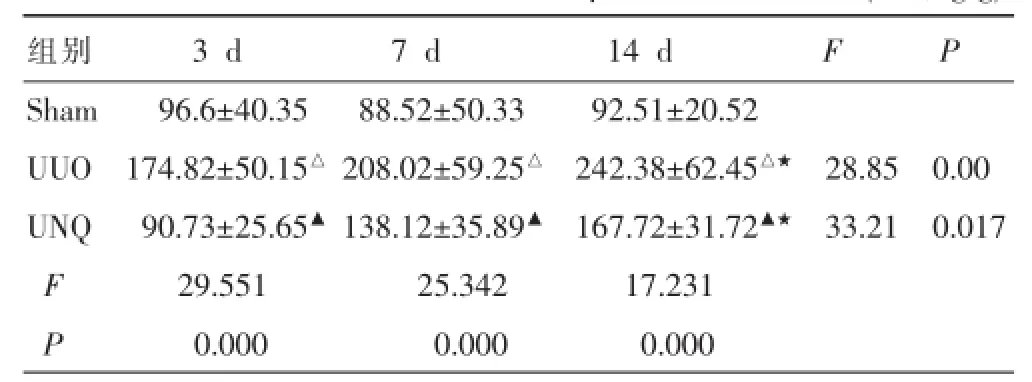
表3 尿毒清對腎組織中TGF-β1表達的影響(±s,ng/g)
注:與Sham組比較△P<0.01;與UUO組比較▲P<0.05;與7 d組比較★P<0.05。
組別3 d7 d14 dFP Sham96.6±40.3588.52±50.3392.51±20.52 UUO174.82±50.15△208.02±59.25△242.38±62.45△★28.850.00 UNQ90.73±25.65▲138.12±35.89▲167.72±31.72▲★33.210.017 F29.55125.34217.231 P0.0000.0000.000
2.3 尿毒清對腎組織FN表達的影響
對FN的觀察發現(圖4):Sham組腎間質FN的表達為偶發、散在,腎小球和腎小管基底膜則表達輕微。UUO組FN主要表達在腎間質發生纖維化病變的區域,表達隨時間延長而逐漸增強;FN在UNQ組與UUO組表達的部位相似,但前者的表達量顯著減少。腎臟組織勻漿用Westernblot檢測FN表達的結果發現(圖5),Sham組未能檢測到FN表達;UUO和UNQ兩組在第3、7、14天檢測到FN的表達均比Sham組的高,其中與UUO組比較,UNQ組在第7、14天FN的表達明顯下降,分別為下降了45%和30%(P<0.05)。
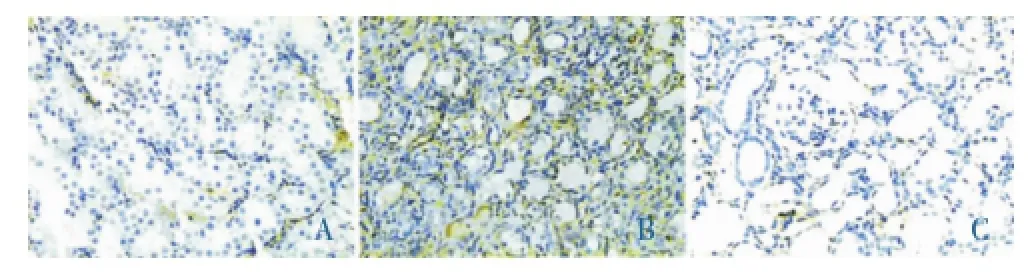
圖4 假手術組(A)、模型組(B)和尿毒清治療組(C)14 d時FN表達(免疫組化×200)

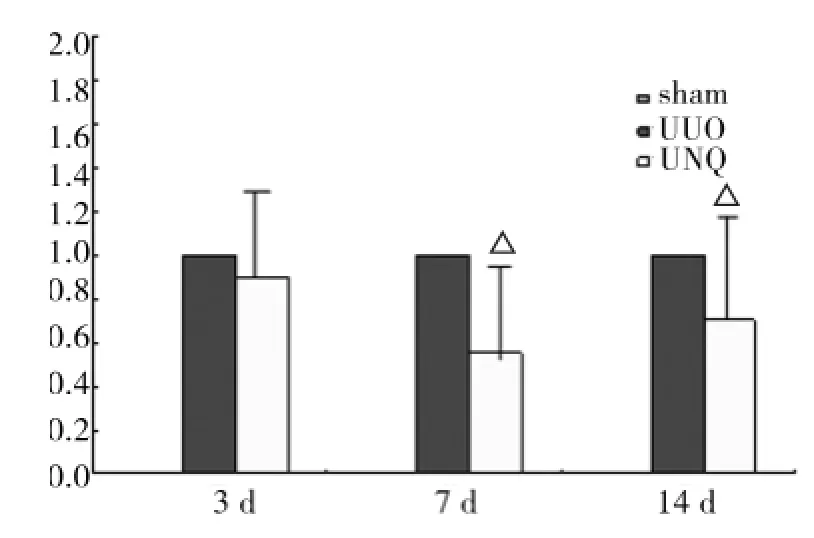
圖5 Westernblot分析FN在各組大鼠的表達電泳圖(上)及柱形圖(下)
3 討論
尿毒清顆粒含大黃、黃芪,研究發現大黃、黃芪有拮抗大鼠腎小管上皮細胞轉分化的作用[5]。臨床觀察表明尿毒清顆粒有保護腎功能的作用。為探討尿毒清在發病時究竟何時發揮保護作用以及其可能的主要作用點,我們在本實驗中選用UUO大鼠模型進行了相關研究。UUO模型被認為是理想的腎間質纖維化模型。尿路梗阻導致輸尿管內壓升高,腎臟有效血流明顯減少,腎素-血管緊張素系統和腎間質內的單核巨噬細胞系統的活化,致使白細胞、單核細胞在腎組織里浸潤,并釋放出能夠破壞腎系膜細胞、小管上皮細胞、間質成纖維細胞及結構的各種酶和因子,從而導致腎臟間質出現纖維化[6-7]。另外,激活的單核巨噬細胞與同樣激活的腎小管上皮細胞相互影響,導致腎組織TGF-β等激活[8],與之相關的多種因子分泌升高,腎臟間質出現大量的炎癥細胞,使得ECM的合成增加,腎臟間質纖維化發生;腎臟病理檢查為小球大致正常而小管細胞表現為萎縮、間質表現為纖維化生[6-7,9]。在本研究中,動態觀察了UUO組造模后第3、7、14天的腎臟病理改變,發現造模后腎小管間質的受損呈進行性加重,到第14天顯著地表現為腎小管細胞萎縮、腎間質纖維化生。上述一系列的改變跟文獻報告的UUO模型病變特點一致。經尿毒清治療后,鏡下檢查可見,腎間質炎癥細胞明顯減少,同時腎小管細胞萎縮和間質纖維化生程度也顯著減輕。本研究提示尿毒清的腎臟保護作用,在腎臟纖維化病變的發生過程中持續存在,且在該變化之前就已開始減輕腎組織的炎癥反應。TGF-β1是由浸潤到腎臟局部的單核巨噬細胞以及腎臟活化的固有細胞分泌,是致使ECM合成的細胞因子,在致病因素作用下會過度表達,從而使腎間質纖維化的發生。研究證實,TGF-β1除了可以激活間質成纖維細胞外,還通過Smad蛋白家族傳遞信號,從而增加ECM如FN的合成[10]。有文獻報道,UUO制模10 h,就可以在梗阻側的腎臟檢測到TGF-β1mRNA開始增加,隨后TGF-β1mRNA仍一直升高[11]。本研究發現,與UUO組比較,UNQ組造模后第3天就可見腎間質炎癥細胞的浸潤減少, TGF-β1表達因受到抑制而減少,在第7天及第14天該作用持續存在;從第7天開始FN表達顯著下降,到第14天該表現仍持續存在,提示在梗阻性腎病的發展過程中尿毒清可能通過抑制EMT合成,或者下調TGF-β1表達從而減輕腎間質纖維化。
綜上所述,在UUO模型中,尿毒清在病變開始就通過減輕炎癥反應和減少TGF-β1分泌而使轉分化的腎臟細胞減少,最后腎間質纖維化減輕,從而發揮其腎臟保護作用,該作用的高峰時間是在造模后7天。這些結果提示,今后研究尿毒清的腎臟保護作用機制可能應把重點放在發病的早期。
[1]Klahr S,Morrissey J.Obstructive nephropathy and renal fibrosis [J].Am J Physiol Renal Physiol,2002,283(5):F861-875.
[2]Yang J,Shultz RW,Mars WM,et al.Disruption of tissue-type plasminogen activator gene in mice reduces renal interstitial fibrosis in obstructive nephropathy[J].J Clin Invest.2002,110 (10):1525-1538.
[3]Stevens VA,Saad S,Chen XM,et al.The interdependence of EGF-R and SGK-L in fibronectin expression in primary kidney cortical fibroblast cells[J].Int J Biochem Cell Biol,2007,39(5): 1047-54.
[4]張瑞芳,萬建新,許艷芳.中藥抗腎小管上皮細胞間充質轉分化的研究進展[J].中國中西醫結合腎病雜志,2011,12(4):368-371.
[5]陳聰,吳勇軍,喻嶸,等.左歸降糖益腎方含藥血漿對高糖培養小鼠足細胞凋亡及Caspase-12表達的影響[J].湖南中醫藥大學學報,2015,35(3):1-4.
[6]Chevalier RL.Molecular and cellular pathophysiology of obstructive nephropathy[J].Pediatr Nephrol,1999,13(7):612-619.
[7]Wen JG,Fr?kiaer J,J?rgenesn TM,et al.Obstructive nephropathy: An update of the experimental research[J].Urol Res,1999,27 (1):29-39.
[8]Zhang XL,Selbi W,de la Motte C,et al.Renal proximal tubularepithelialcelltransforminggrowthfactor-beta1 generation and monocyte binding[J].Am J Pathol,2004,165 (3):763-773.
[9]Massagué J.How cells read TGF-bela signals[J].Nat Rev Mol Cell Boil,2000,1(3):169-178.
[10]Yang J,Liu Y.Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis[J].J Am Soc Nephrol,2002,13(1):96-107.
[11]Walton G,Buttyan R,Garcia-Montes E,et al.Renal growth factorexpressionduringTheearlyphaseofexperimental hydronephrosis[J].J Urol,1992,148(2Pt2):510-514.
(本文編輯 楊瑛)
Study on the Target of Niaoduqing Granule Inhibiting Renal Interstitial Fibrosis in Rats
CHEN Xiumeng,YU Xiaomin*,XIAO Jie
(Division of Nephrology,the First Affiliated Hospital of Guangzhou Medical College,Guangzhou,Guangdong 510120,China)
ObjectiveTo investigate the effect of Niaoduqing granule on renal interstitial fibrosis in rats.MethodsThe renal interstitial fibrosis rat models were built by unilateral ureteral obstruction(UUO).Ten weeks old male rats(n=60)were randomly divided into sham-operated group(Sham,n=20),model group(UUO,n=20)and UUO treated with Niaoduqing group (UNQ,n=20).The rats in UNQ were treated with 2 g/kg·d Niaoduqing by gastric gavage on one day before the operation.The Sham and UUO groups were given a gavage of same volume normal saline every day.Five rats in each group were sacrificed on 3,7 and 14 days after surgery.The renal tubular interstitial fibrosis lesion and the expression of TGF-β1 and FN were detected by pathdogical examine and immunohistochemistry and ELISA and Western Blot.ResultsCompared with the Sham group,the number of infiltrated inflammatory cells in renal interstitial and the score of renal interstitial fibrosis was aggravated,TGF-β1 and FN expression were gradually increased in UUO group(P<0.05).Compared with the UUO group, the number of infiltrated inflammatory cells in renal interstitial and the score of renal interstitial fibrosis was fewer(P<0.05) and the expression of TGF-β1 was dexreased(P<0.05).After 7 days of treatment,the expreesion of FN in renal interstitium of UUO rats was decreased(P<0.05).After 14 days of treatment,the scores of cell infiltration and chronic lesions in renal interstitium had a decline of 22.2%and 19.1%than UUO group(P<0.05),while the expression of TGF-β1 and FN was decreased 30.8%and 30%than UUO group(P<0.05).ConclusionNiaoduqing prevent renal disease progression in early stage by downregulating the expression of TGF-β1 and FN,and inhibit infiltration of inflammatory cell,transdifferentiation of renal tubule cell,extraeellular matrix accumulation and interstitial fibrosis.
Niaoduqing granule;renal interstitial fibrosis;TGF-β1;unilateral ureteral obstruction
R285.5;R692
A
2016-06-09
廣東省中醫藥局資助項目(20131272)。
陳琇萌,女,副主任醫師,研究方向:慢性腎臟病診治。
*俞小敏,女,主任醫師,E-mail:yxm.s@126.com。

