電針對佐劑性關節炎大鼠關節滑膜細胞內TAK1表達的影響
劉梨,祁芳,李艷玲,艾坤*,蔡雄,李鑫,張泓
(1.湖南中醫藥大學第一附屬醫院,湖南長沙410007;2.湖南中醫藥大學,湖南長沙410208)
電針對佐劑性關節炎大鼠關節滑膜細胞內TAK1表達的影響
劉梨1,祁芳2,李艷玲2,艾坤2*,蔡雄2,李鑫2,張泓2
(1.湖南中醫藥大學第一附屬醫院,湖南長沙410007;2.湖南中醫藥大學,湖南長沙410208)
目的觀察電針足三里、關元穴對佐劑性關節炎(AIA)大鼠踝關節滑膜細胞內轉化生長因子β激活激酶1(TAK1)表達的影響,探索電針對類風濕性關節炎(RA)可能的干預機制。方法40只SD大鼠隨機分為空白組、模型組、甲氨蝶呤(MTX)組、電針組,每組10只。采用Fueund氏完全佐劑(FCA)法造模。電針組予以電針大鼠關元穴、雙側足三里穴,MTX組予以0.35 mg/kg劑量的MTX灌胃治療,空白組與模型組每日予以特制大鼠固定器固定后松綁放回籠內飼養。實驗期間每3天1次測量大鼠體質量、足爪容積,并對關節炎指數進行評分;采用放射免疫法檢測TNF-α、用Western Blot檢測TAK1、NF-κB蛋白表達。實驗結束后比較各組大鼠踝關節滑膜滑膜組織中TNF-α,滑膜細胞內TAK1,胞核內NF-κB表達水平。結果與空白組比較,模型組大鼠體質量增長明顯緩慢、足趾腫脹明顯、關節炎指數明顯升高(P<0.01),滑膜組織內TNF-α顯著升高、滑膜細胞內TAK1含量顯著升高、胞核內NF-κB表達顯著升高(P<0.01);與模型組比較,電針組大鼠體質量增長較快、足趾腫脹較輕、關節炎指數較低(P<0.05),滑膜組織中TNF-α低于模型組、滑膜細胞內TAK1、NF-κB表達較低(P<0.05)。結論電針AIA大鼠足三里、關元等穴能夠有效抗炎,其干預機制可能與抑制關節滑膜細胞內TAK1的表達,良性調控NF-κB這一炎癥信號通路有關。
轉化生長因子β激活激酶1;NF-κB;電針;佐劑性關節炎;足三里;關元穴
本文引用:劉梨,祁芳,李艷玲,艾坤,蔡雄,李鑫,張泓.電針對佐劑性關節炎大鼠關節滑膜細胞內TAK1表達的影響[J].湖南中醫藥大學學報,2017,37(1):65-69.
類風濕性關節炎(rheumatoid arthritis,RA)最重要的病理改變是關節滑膜的炎癥與增生,目前的研究表明:RA是人體內多條炎性細胞信號通路被激活的結果,其中NF-κB信號通路在疾病的發生發展中起核心作用[1-3]。研究證實,運用針灸治療RA療效確切且副作用極少[4],然而有關針灸對NF-κB信號通路的干預機制的深入研究卻甚少,因而本實驗通過電針佐劑性關節炎(adjuvant induce arthritis,AIA)大鼠足三里、關元等穴,再現電針的抗炎效應,并基于NF-κB信號通路,通過檢測關鍵性指標,進一步闡釋電針治療可能的抗炎機制。
1 材料與方法
1.1 動物
雄性健康SD大鼠40只,由湖南中醫藥大學動物實驗中心提供,體質量80~100 g,動物許可證號:SYXK(湘)2013-0005,飼養溫度20~25℃,濕度50%~70%,大鼠適應性飼養1周后。實驗過程中對動物的處置均符合《Ethical issues in animal experimentation》[5]中相關動物倫理學標準條例。
1.2 主要試劑與儀器
滅活結核桿菌H37Ra(Detroit,Ml,USA);Sigma礦物油(湖南長沙維爾生物科技有限公司);Mettler Toledo精密電子天平(常州稱重設備系統有限公司),動物紋身儀(深圳市瑞沃德生命科技有限公司);足腫測量儀(意大利UGO Basile);瑞士Hamilton微量注射器(250 μL),Terumo 27 G針頭(北京博朗寧科技有限公司);華佗牌電針治療儀,針灸針:0.18×13 mm(半寸,蘇州醫療用品廠有限司)兔抗TAK1多克隆抗體(Thr184/187)(北京博奧森公司);NF-κB1 p105/p50(5D10D11)Mouse mAb(上海優寧維生物科技股份有限公司);山羊抗兔標記二抗、山羊抗鼠二抗(美國Proteintech公司);ECL顯影液(美國Thermo公司)。
1.3 造模方法
MT懸浮液制備[6]:高溫滅菌后的干燥研缽于精密天平上稱取Mtb 10 mg;移液槍精密吸取礦物油8 mL入研缽中充分研磨,直至礦物油清亮無明顯懸浮雜質;將研磨好的MT懸浮液移入EP管中,經震蕩儀混合均勻后,稀釋、分裝,制成濃度為1.25 mg/mL的懸浮液。
AIA大鼠模型制備[6]:大鼠固定,酒精棉擦拭大鼠尾根部,精密吸取MT懸浮液0.1 mL于大鼠尾根部皮下注射,出針,用棉簽壓進針口片刻,將大鼠放回籠內。
造模后的大鼠第3天皮溫明顯升高,尾根部進針口皮膚開始潰爛;9~12 d大鼠皮毛松散,精神萎靡,體質量下降,耳廓、小趾關節、足趾關節、踝關節不同程度的發紅、腫脹,活動受限,關節炎指數評分>4分,提示造模成功。
1.4 分組與干預方法
SD大鼠按照體質量分層原則隨機分為空白組、模型組、甲氨蝶呤(methotrexate,MTX)組、電針組,每組10只。
1.4.1 電針組取穴定位:參照“十五”國家規劃統編教材《實驗針灸學》[7]大鼠標準穴位圖譜定位及擬人對照法定位。足三里:膝關節后外側,腓骨小頭下約5 mm;關元:從胸劍聯合至恥骨聯合上緣以松緊帶平均分為13等份(每一等分模擬大鼠同身寸一寸),關元為恥骨聯合上緣3寸;阿是穴為關節周圍腫脹嚴重部位。
參照《中國獸醫針灸學》及《實驗針灸學》[8]。自造模后的第1天開始,電針組大鼠固定于特制固定器上,每只大鼠接兩組電針,左、右足三里穴為一組,關元穴與阿是穴為一組,刺激參數:疏密波,頻率為20 Hz,電流1 mA,針身輕顫為宜,治療時間20 min,7 d為1個療程,共3個療程21 d。
1.4.2 MTX組MTX作為陽性藥物,根據人臨床劑量以及大鼠體質量關系換算得出以0.35 mg/kg劑量的MTX灌胃,每周2次,共治療3周。
1.4.3 空白組與模型組每日予以特制大鼠固定器固定20 min后松綁,放回籠內飼養。
1.5 觀察方法與檢測指標
1.5.1 大鼠體質量的測量自造模后的第12天開始(包括第12天)測量每只大鼠體質量,每3天1次,共4次。
1.5.2 足爪容積的測量造模后第9天,用小動物紋身儀在每只大鼠雙側踝關節外上側打點標記,作為足爪容積測量時的標準對線點,然后立即用精確度為0.01 mL的足腫測量儀測量出各組大鼠的基礎足爪容積。隨后于第12天、第15天、第18天、第21天行足爪容積測量。
1.5.3 關節炎評分[9]模型制備完成后每天觀察致炎大鼠的四肢各關節有無紅腫出現,第12天開始(包括第12天)每3天行一次行關節炎的評分,直至第21天實驗結束。具體評分細則為,0分:無關節紅腫;1分:小趾關節的紅腫;2分:足趾關節與小趾關節均有腫脹;3分:踝關節以下的足趾關節及小趾關節腫脹;4分:包括踝關節在內的全部足爪的腫脹。每只大鼠四肢均進行評分,將四肢分數累積,累積分數越高則提示炎癥越嚴重。最高累計為16分。
1.5.4 TNF-α、TAK1轉化生長因子β激活激酶1(transforming growth factor-β activation of protein kinase,TAK1)、NF-κB檢測采用放射免疫法檢測TNF-α、用Western Blot檢測TAK1、NF-κB蛋白表達。第22天處死大鼠取踝關節囊的滑膜組織,用于Western Blot檢測。步驟如下:(1)核蛋白提取:剪取組織,加入CER試劑,勻漿,離心后棄上清,加入NER沉淀,離心后棄上清,加入Suspension Buffer沉淀即得到核蛋白,凍存于-20℃;(2)蛋白濃度檢測:根據樣品數量配制適量BCA工作液,充分混勻,完全溶解蛋白標準品,濃度為2 mg/mL;(3)將標準品按0,1,2,3,4,5,6 μL加到96孔板的標準品孔中,加用于稀釋標準品的溶液補足到20 μL;(4)加適當體積樣品到96孔板的樣品孔中,加用于稀釋標準品的溶液到20 μL;(5)各孔加入200 μL BCA工作液,37℃放置30 min;(6)測定A562。根據標準曲線計算出蛋白濃度。(7)Western-blotting:電泳,轉膜,加免抗TAK1一抗(1∶300),加入NF-KB一抗(1∶200),孵育4℃過夜,加入山羊抗兔標記二抗(1∶40 000)、山羊抗鼠標記二抗(1∶50 000)孵育2 h,清洗后加ECL液顯影,顯色曝光。在每張膜上做一種目的蛋白和相應內參蛋白β,用Image J分析軟件將圖片中每個特定條帶灰度值數字化;目的蛋白的灰度值除以內參β-actin的灰度值作為結果。
1.6 統計學處理
所有數據統計分析均用SPSS 17.0處理。所有數據用“±s”表示,數據資料均行正態性及方差齊性檢驗,符合正態分布且方差齊則用LSD或SNK法,方差不齊用Tamhane`s T2或Dunnett`s T3法;不符合正態分布的資料采用秩和檢驗。
2 結果
2.1 各組大鼠體質量、足趾容積、關節炎指數評分比較
自造模后第3天開始,模型組、MTX組、電針組均出現不同程度精神萎靡、體毛欠規則,大便溏稀,以模型組為甚;各組大鼠體質量、足趾容積、關節炎指數評分比較見圖1。結果顯示:(1)體質量:造模后的第12,15,18,21天測量大鼠體質量,統計分析結果表明:空白組、電針組、MTX組大鼠的體質量顯著高于模型組(P<0.01);電針組體質量則在第21 d顯高于MTX組(P<0.05)(如圖A)。(2)足爪容積:造模后的第9天開始,造模的大鼠先后出現不同程度的足趾關節紅腫、畸形等炎性表現,各組大鼠第12、15、18和21天的足爪容積測量數據顯示:模型組大鼠足趾關節腫脹程度與其余三組比較組大鼠比較有顯著性差異(P<0.01),電針組大鼠腫脹程度相較于空白組與MTX組有統計意義(P<0.05),而電針組與模型組比較,腫脹較輕有統計學意義(P<0.05);說明電針治療能有效減輕關節的水腫,緩解炎癥的發展(如圖B)。(3)關節炎指數評分:模型組、電針組的關節炎評分均與空白組存在顯著性差異(P<0.01),而電針組關節炎指數則明顯低于模型組(P<0.05),進一步表明電針治療減輕了致炎大鼠體內的炎癥反應見圖1。
2.2 各組大鼠踝關節滑膜滑膜組織中TNF-α,滑膜細胞內TAK1,胞核內NF-κB比較
指標檢測數據顯示:(1)模型組大鼠踝關節中滑膜組織內TNF-α顯著高于空白組(P<0.01),而電針組滑膜組織中TNF-α則低于模型組(P<0.05);(2)模型組滑膜細胞內TAK1含量明顯高于空白組(P<0.01),電針組TAK1亦明顯高于空白組(P<0.01),而低于模型組(P<0.05);(3)模型組大鼠滑膜細胞胞核內NF-κB表達顯著高于空白組(P<0.01),而電針組大鼠NF-κB表達亦高于空白組(P<0.05),但低于模型組(P<0.05)。結果見表1。
2.3 TNF-α與TAK1、NF-κB的相關性分析
將每個樣本TAK1、TNF-a、NF-κB值用SPSS軟件進行相關性分析,得出以下結果:(1)TAK1與TNF的相關分析中,P<0.01,R值為0.938;(2)TAK1與NF-κB的相關分析結果為P<0.01,R為0.933;(3)而TNF與NF-κB之間的相關性分析結果P<0.01,R為0.879;以上結果顯示:三者之間有強的正相關性。三者線性關系如圖2所示。
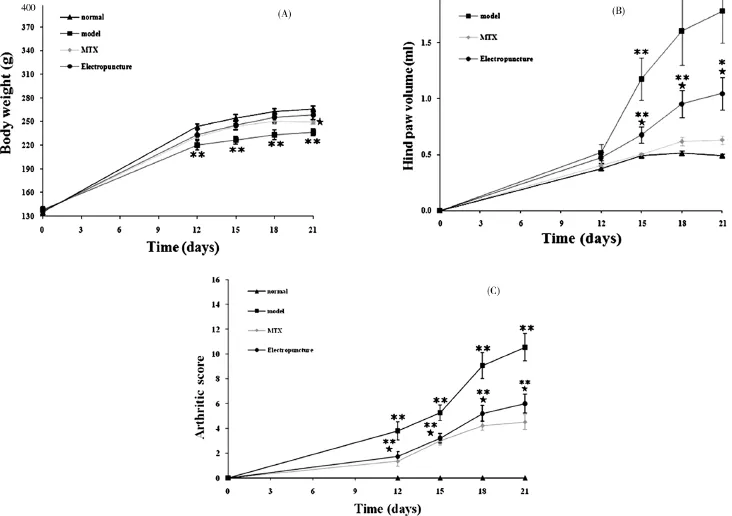
圖1 各組大鼠體質量(A)、足爪容積(B)、關節炎指數評分(C)比較
表1 各組大鼠滑膜組織中TNF-α、關節滑膜細胞內TAK1、胞核內NF-κB比較(±s,n=10,pg/moL)
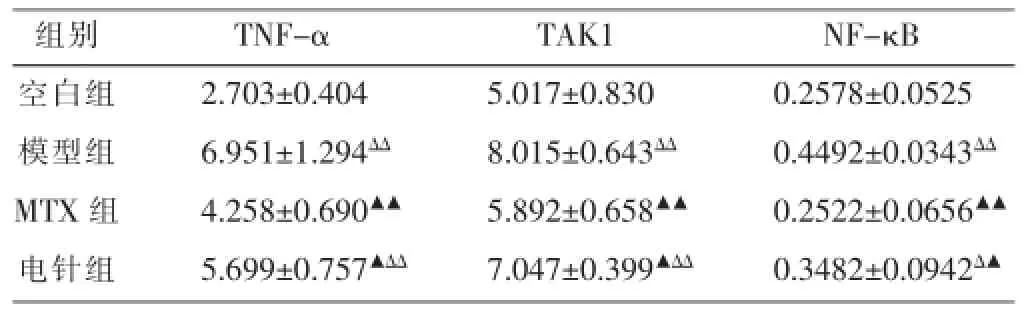
表1 各組大鼠滑膜組織中TNF-α、關節滑膜細胞內TAK1、胞核內NF-κB比較(±s,n=10,pg/moL)
注:與空白組比較ΔP<0.05,ΔΔP<0.01;與模型組比較▲P<0.05,▲▲P<0.01。
組別空白組模型組MTX組電針組TNF-α 2.703±0.404 6.951±1.294ΔΔ4.258±0.690▲▲5.699±0.757▲ΔΔTAK1 5.017±0.830 8.015±0.643ΔΔ5.892±0.658▲▲7.047±0.399▲ΔΔNF-κB 0.2578±0.0525 0.4492±0.0343ΔΔ0.2522±0.0656▲▲0.3482±0.0942Δ▲
3 討論
NF-κB信號通路的激活大體分為標準NF-κB信號通路、旁路NF-κB途徑和非經典型NF-κB信號通路三類[10]。其中標準NF-κB信號通路主要介導與炎癥反應和炎癥細胞增殖與凋亡有關的基因表達,在RA的病情發展中貫穿始終。一方面該信號通路的激活能高效誘導多種細胞因子(如TNF-α、IL-1、IL-6)、黏附分子、趨化因子、免疫受體和急性期反應蛋白等編碼基因的表達,促進炎癥反應,而另一方面它作用于多種凋亡抑制蛋白如c-IAP1、c-IAP2等的表達,保護細胞免受凋亡,打破滑膜細胞增殖與凋亡的平衡最終導致的滑膜細胞類腫瘤樣增殖[11-12]。
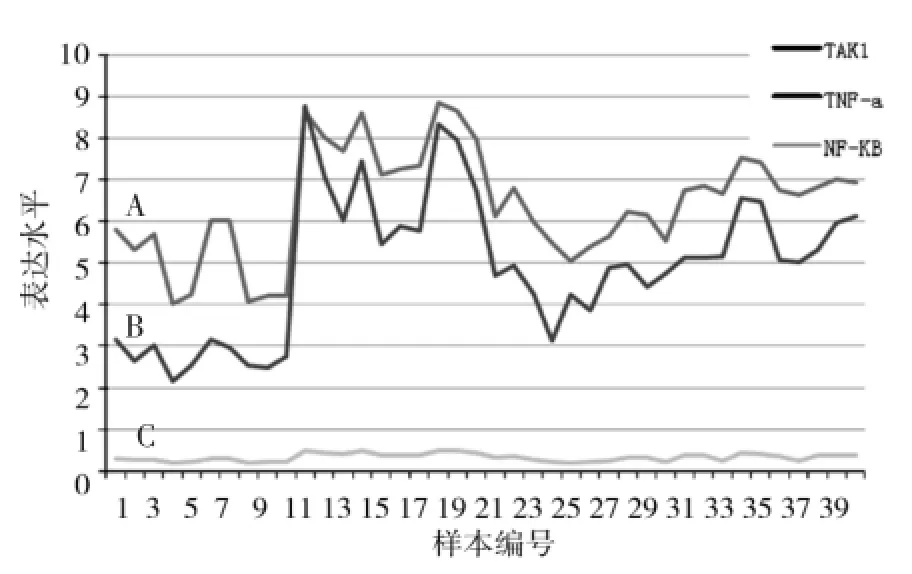
圖2 TAK1、TNF-α、NF-κB三者的線性相關分析
NF-κB的激活主要是TNF-α、IL1β、IL6等多種炎性因子作用的結果,而TNF-α作為一種激活標準NF-κB信號通路的最常見的外部刺激因子,其介導的NF-κB激活機制是[13]:TNF-α與其特異性受體結合后,迅速招募腫瘤壞死因子受體相關因子(TRAF),TRAF通過與TAK1以及TAK1結合蛋白2(TAB2)和TAB3的相互作用,激活TAK1,磷酸化激活IKKβ。活化后的IKK最終使IκB磷酸化降解,激活NF-κB,NF-κB的NLS暴露,進入核內,與靶基因的κB位點結合,發揮轉錄活性,促進炎癥反應的發生。有文獻報道[14]:當TAK1激活環上保守的磷酸化位點Thr/Ser用Ala取代,使得TAK1失活后,IKKβ磷酸化水平顯著下降,抑制NF-κB的表達和NF-κB通路的激活,由此可見,TAK1在TNF-α介導的NF-κB激活機制中起重要的調節作用。本實驗研究中也發現:造模后的大鼠滑膜組織中TNF-α含量顯著增加(P<0.01),滑膜細胞內TAK1含量明顯升高(P<0.01),滑膜細胞內NF-κB在細胞核內高度表達(P<0.01)。
根據臨床特征,RA屬于中醫學“痹證”范疇,其主要治療原則為“扶正祛邪”,選穴配方以局部取穴為主,配合調節免疫功能的特殊治療穴位,本實驗選取了足三里、關元、阿是穴,前期的實驗研究[15-17]顯示:電針足三里、關元等穴能明顯緩解RA動物模型(佐劑性關節炎大鼠)足跖腫脹程度,下調血漿TNF-α、IL-1、IL-2等炎性細胞因子的含量,改善局部炎癥。
本實驗研究結果顯示,造模后的大鼠滑膜細胞內NF-κB在細胞核內高度表達,NF-κB信號通路激活,炎癥反應明顯;而電針佐劑性關節炎大鼠足三里、關元等穴有效下調了炎性細胞因子和NF-κB的表達,減輕大鼠足跖腫脹度,對抗炎癥,且TAK1與NF-κB之間存在很明顯的正性相關關系。結果表明電針佐劑性關節炎大鼠對抗炎癥的作用機制與抑制了NF-κB信號通路上游的TAK1,從而良性調控該信號通路有關。
[1]Li G,Ma Y,Cheng TS,et al.Identical subchondral bone micro architecture pattern with increased bone resorption in rheumatoid arthritis as compared to osteoarthritis[J].Osteoarthritis and Cartilage,2014,22(12):2083.
[2]Bheeshma R,Ruth C,Peter CA,et al.Increased Surgeon Experience With Rheumatoid Arthritis Reduces the Risk of Complications Following Total Joint Arthroplasty[J].Arthritis&Rheumatology,2014,66(3):488-496.
[3]Junpei Teramachi,Akiko Kukita,Yin-Ji Li,et al.Adenosine abolishes mtx-induced suppression of osteoclastogenesis and inflammatory bone destruction in adjuvant-induced arthritis[J].Laboratory Investigation,2011,91(5):719-731.
[4]陸燕,李茹英.王順賢治療寒濕型類風濕性關節炎經驗舉隅[J].南京中醫藥大學學報,2011,27(2):175-177.
[5]Adolphe M,Parodi AL.Ethical issues in animal experimentation [J].Bull Acad Natl Med,2009,193(8):1803-1804.
[6]祁芳,李艷玲,艾坤,等.SD大鼠佐劑性關節炎模型的建立與評估[J].湖南中醫藥大學學報,2016,36(1):23-26.
[7]林文注,王佩.實驗針灸學[M].上海:上海科學技術出版社,1999:288-290.
[8]郭紀光.中國獸醫針灸學[M].北京:農業出版社,1984:60-62.
[9]薛彬.免疫毒理學實驗技術[M].北京:北京醫科大學、中國協和醫科大學聯合出版社,1995:58.
[10]Momoko N.Classical and alternative NF-κB activation pathways and their roles in lymphoid malignancies[J].Clin.Exp. Hematopathol,2005,45(1):15-24.
[11]Gregersen PK.REL,encoding a member of the NF-kappaB family of transcription factors,is a newly defined risk locus for rheumatoid arthritis[J].Nature Genetics,2009,41(7):820–823.
[12]SimmondsRE,FoxwellBM.Signalling,inflammationand arthritis:NF-kappa B and its relevance to arthritis and inflammation.Rheumatology(Oxford),2008,47(5):584-590.
[13]Joanne M.Hildebrand,Zuoan Yi,Claire M.Buchta,et al. Roles of tumor necrosis factor receptor associated factor 3 (TRAF3)and TRAF5 in immune cell functions[J].Immunological Reviews,2011,244(1):55–74.
[14]Chuan OY,Li N,Gu M,et al.Transforming growth factor(TGF)-β-activated kinase 1(TAK1)activation requires phosphorylation of serine 412 by protein kinase A catalytic subunit α(PKACα) and X-linked protein kinase(PRKX)[J].The Journal of Biological Chemistry,2014,289(35):26-37.
[15]艾坤,武丹,常小榮,等.電針對佐劑性關節炎大鼠足跖腫脹度和炎性細胞因子的影響[J].中國康復理論與實踐,2011,17 (7):622-624.
[16]常小榮,艾坤,劉梨,等.電針足三里、關元對佐劑性關節炎大鼠β-內啡肽,ACTH的影響[J].中華中醫藥學刊,2009,27(4): 685-687.
[17]常小榮,劉梨,艾坤,等.電針足三里、關元對佐劑性關節炎大鼠IL-1,IL-2,IL-10,TNF-α的影響[J].中國骨質疏松雜志,2009,15(2):107-110.
(本文編輯 匡靜之)
Effects of Electroacupuncture on TAK1 Expression in Articular Synovial Cell of Rats with Adjuvant-Induced Arthritis
LIU Li1,QI Fang2,LI Yanling2,AI Kun2*,CAI Xiong2,LI Xin2,ZHANG Hong2
(1.The First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;2.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveTo observe the effect of electroacupuncture on Zusanli,Guanyuan acupoints on expression of Transforming growth factor-βactivation of Protein kinase(TAK1)in articular synovial cell of rats with adjuvant-induced arthritis(AIA),and explore the possible intervention mechanisms of electroacupuncture.Methods40 SD rats were randomly divided into blank group,model group,Methotrexate(MTX)group,the electroacupuncture group,10 rats in each group.The AIA model was made according to the Fueund's complete adjuvant(FCA)method.The electroapuncture group rats were given electroacupuncture at Zusanli and Guanyuan point for 20 minutes everyday,3 weeks in all.The MTX group rats were treated with MTX suspension at the dosage of 0.35 mg/kg twice a week since the injection day,3 weeks in total.The weight,paw volume and arthritis scores of rats were measured every 3 days.The TNF-α was detected by using radioimmunoassay.The expressions of TAK1,NF-κB in ankle synovial cell of rats were detected by Western Blot.The TNF-α,TAK1,NF-κB of eachgroupwerecomparedafterintervention.ResultsComparedwiththenormalgroup,thebodyweightgrowth in model group was slow,the feet swelling was significantly severe,arthritis scores increased significantly(P<0.01)and the TNF-α significantly increased,TAK1 in synovial cell significantly increased,NF-κB expression significantly increased faster(P<0.01).Compared with the model group,the body weight in electropuncture group increased faster,the feet swelling was slighter,and arthritis scores got lower(P<0.05),the TNF-α,TAK1 and NF-κB expression in synovial cells were lower(P<0.05).ConclusionElectroacupuncture on Zusanli,Guanyuan of AIA rats is effective,its intervention mechanism may be related to inhibiting the expression of TAK1 in synovial cells,then beneficial regulating on NF-κB the inflammatory signaling pathways.
TAK1;NF-κB;electroacupuncture;adjuvant induce arthritis;Zusanli acupoint;Guanyuan acupoint
R245.97
A
2016-08-23
國家自然科學青年基金(81303048);湖南省科技廳科技計劃一般項目(2014SK3046);湖南省教育廳科學研究優秀青年項目(15B176);湖南省教育廳科學研究項目(14C0854)。
劉梨,女,博士,副教授,研究方向:針灸治病機制研究。
*艾坤,男,醫學碩士,副教授,Email:aikun650@qq.com。

