高效液相色譜-電化學(xué)檢測(cè)指紋圖譜鑒別3 種單花種蜂蜜花源
賀 瓊,何亮亮,康予馨,程 妮,2,呂新剛,2,曹 煒,2,*
高效液相色譜-電化學(xué)檢測(cè)指紋圖譜鑒別3 種單花種蜂蜜花源
賀 瓊1,何亮亮1,康予馨1,程 妮1,2,呂新剛1,2,曹 煒1,2,*
(1.西北大學(xué)化工學(xué)院食品科學(xué)與工程系,蜂產(chǎn)品應(yīng)用技術(shù)研究中心,陜西 西安 710069;2.陜西省蜂產(chǎn)品工程技術(shù)研究中心,陜西 西安 710065)
基于高效液相色譜-電化學(xué)檢測(cè)器(high performance liquid chromatography-electrochemical detection,HPLC-ECD)技術(shù)建立一種新的蜂蜜花源鑒別方法。以采自中國(guó)不同地區(qū)的3 種單花種蜂蜜為研究對(duì)象,構(gòu)建了3 種單花種蜂蜜的HPLC-ECD指紋圖譜,提取HPLC-ECD圖譜共有峰面積信息并應(yīng)用主成分分析和系統(tǒng)聚類(lèi)分析進(jìn)行蜂蜜花源分類(lèi),并對(duì)完全未參與建模的蜂蜜樣品進(jìn)行驗(yàn)證。結(jié)果表明,45 個(gè)蜂蜜樣品(枸杞蜜、荊條蜜、荔枝蜜各15 個(gè)),均可通過(guò)主成分分析和系統(tǒng)聚類(lèi)分析按照其花源正確分類(lèi),正確率達(dá)到100%。該蜂蜜花源鑒別的模型對(duì)完全未參與建模的枸杞蜜、荊條蜜和荔枝蜜樣品的正確預(yù)判率可達(dá)到100%、80%和100%。研究表明,HPLCECD指紋圖譜技術(shù)應(yīng)用主成分分析和系統(tǒng)聚類(lèi)分析可以作為一種快速、準(zhǔn)確、綠色的判別蜂蜜花源的方法。
蜂蜜;高效液相色譜-電化學(xué)檢測(cè)器;指紋圖譜;主成分分析;系統(tǒng)聚類(lèi)分析
蜂蜜是一種由蜜蜂采集植物的花蜜或其分泌物后,在體內(nèi)經(jīng)自身的酶和特殊物質(zhì)的加工釀造而成的天然甜味物質(zhì)[1]。自古以來(lái),蜂蜜就是一種藥食同源的佳品,不僅富含葡萄糖、果糖、氨基酸、有機(jī)酸、維生素、礦物質(zhì)等營(yíng)養(yǎng)成分[2-4]、還具有較高的藥用價(jià)值和保健作用,包括抗氧化、抗衰老、抑菌消炎、保護(hù)心腦血管、增強(qiáng)免疫系統(tǒng)等多種功效[5-7]。
中國(guó)是蜂蜜的生產(chǎn)和消費(fèi)大國(guó),蜂蜜年產(chǎn)量可達(dá)30萬(wàn)~40萬(wàn) t,國(guó)內(nèi)市場(chǎng)需求量達(dá)20萬(wàn) t[8-9],此外,中國(guó)還是一個(gè)蜂蜜出口大國(guó),僅2012年,中國(guó)對(duì)歐盟的蜂蜜出口總量就可達(dá)11萬(wàn) t左右[10]。然而,面對(duì)如此大的市場(chǎng)需求量,我國(guó)的蜂蜜產(chǎn)品卻一直存在質(zhì)量不穩(wěn)定,摻假現(xiàn)象嚴(yán)重等現(xiàn)狀[10],嚴(yán)重影響蜂蜜市場(chǎng)健康有序的發(fā)展。因此,建立可靠、高效的蜂蜜質(zhì)量鑒定方法對(duì)促進(jìn)蜂蜜市場(chǎng)的穩(wěn)定發(fā)展至關(guān)重要。
蜂蜜的質(zhì)量取決于蜂蜜的色澤、成分、口感、風(fēng)味及營(yíng)養(yǎng)價(jià)值,而這些因素均受到蜂蜜地理源和花源的直接影響[11-12]。不同地理源和花源的蜂蜜,不僅口感和營(yíng)養(yǎng)價(jià)值不同,蜂蜜品質(zhì)和價(jià)格也有所差異。因此,尋求高效的蜂蜜花源或地理源鑒定方法一直是國(guó)內(nèi)外學(xué)者研究的熱點(diǎn)。Yücel等[13]曾通過(guò)測(cè)定土耳其蜂蜜中17 種礦物質(zhì)的含量將45 個(gè)樣品正確分為7 類(lèi),Rebane等[14]則根據(jù)不同花源蜂蜜間氨基酸的差異鑒定了7 種蜂蜜的花源,但這些方法步驟繁瑣、耗時(shí)長(zhǎng),且人為帶來(lái)的誤差影響大,結(jié)果可信度較低。于是,為了提高鑒定的可靠性,一些新的技術(shù)手段也應(yīng)用于蜂蜜的花源鑒定研究中。Wei Zhenbo等[15]使用電流計(jì)成功把不同花源和不同地理源的蜂蜜樣品分類(lèi)。Scandurra等[16]利用電化學(xué)阻抗譜建立了一種蜂蜜花源的鑒定方法。Escuredo等[17]和Chen Lanzhen等[18]采用近紅外光譜進(jìn)行蜂蜜花源鑒定的研究。Sergiel等[19]采用3D熒光圖譜鑒定了6 種蜂蜜花源。近些年來(lái),一些建立在紫外光譜檢測(cè)[20]、高效液相色譜(high performance liquid chromatography,HPLC)-二極陣列管檢測(cè)[21]、質(zhì)譜檢測(cè)[22-23]乃至核磁檢測(cè)[24-25]鑒定蜂蜜花源的研究更是層出不窮。然而,隨著鑒定手段可信度的提高,檢測(cè)的成本、時(shí)長(zhǎng)也隨之增加,鑒定結(jié)果的處理也更加復(fù)雜。因此,建立一種低成本、快速、高效的蜂蜜花源鑒別方法是亟待解決的問(wèn)題。
近年來(lái),電化學(xué)檢測(cè)(electrochemical detection,ECD)技術(shù)由于其選擇性好、靈敏度高、響應(yīng)快、造價(jià)低等特點(diǎn),已成為分析低濃度生物樣品的重要手段。HPLC-ECD聯(lián)用技術(shù)結(jié)合了二者的優(yōu)勢(shì),既可通過(guò)HPLC儀將化合物分離,又能通過(guò)電化學(xué)檢測(cè)快速、高效的測(cè)定電化學(xué)活性物質(zhì)。蜂蜜成分復(fù)雜,其中不乏酚酸、黃酮等多種電化學(xué)活性物質(zhì),而不同花源和地理源的蜂蜜,其電化學(xué)活性成分的種類(lèi)與含量亦有所不同。因此,HPLC-ECD有望成為一種鑒定蜂蜜花源的手段。本實(shí)驗(yàn)通過(guò)HPLC-ECD測(cè)定3 種單花種蜂蜜樣品的圖譜,提取樣品共有峰面積信息,應(yīng)用主成分分析(principal component analysis,PCA)和系統(tǒng)聚類(lèi)分析(hierarchical cluster analysis,HCA),探討蜂蜜中電化學(xué)活性物質(zhì)與蜂蜜花源鑒定之間的關(guān)系。
1 材料與方法
1.1 材料與試劑
采集不同產(chǎn)地、不同年份的枸杞蜜、荊條蜜、荔枝蜜樣品共60 份,經(jīng)花粉形態(tài)學(xué)鑒定,其中枸杞蜜樣品18 份,編號(hào)為GQ1~GQ18;荊條蜜樣品20 份,編號(hào)為JT1~JT20;荔枝蜜樣品22 份,編號(hào)為L(zhǎng)Z1~LZ22。具體樣品信息見(jiàn)表1。
Amberlite XAD-2樹(shù)脂 美國(guó)Sigma-Aldrich公司;甲醇(色譜純) 德國(guó)Meker公司;甲酸(色譜純)天津科密歐化學(xué)試劑有限公司;鹽酸、甲醇等其他試劑均為國(guó)產(chǎn)分析純;超純水(18.25 MΩ·cm)。
1.2 儀器與設(shè)備
UltiMate-3000高效液相色譜儀、CoulochemⅢ電化學(xué)檢測(cè)器 美國(guó)Thermo Fisher公司;超純水機(jī) 四川優(yōu)普超純科技有限公司。
1.3 方法
1.3.1 樣品制備
根據(jù)Amberlite XAD-2說(shuō)明書(shū)的方法活化樹(shù)脂,稱(chēng)取活化后的樹(shù)脂50 g裝入層析柱中以供樣品的制備。
分別稱(chēng)取枸杞蜜、荊條蜜、荔枝蜜樣品10 g,溶解于60 mL蒸餾水中,充分溶解,滴加鹽酸調(diào)節(jié)pH值至2。然后注入裝有XAD-2樹(shù)脂的層析柱中,待溶液充分吸附后,分別用100 mL pH 2鹽酸溶液、150 mL蒸餾水充分淋洗以去除其中的糖等極性物質(zhì),最后用100 mL甲醇進(jìn)行洗脫并收集洗脫液。在40 ℃條件下,將洗脫液減壓真空濃縮至干,復(fù)溶于2 mL色譜級(jí)甲醇并用0.45 μm有機(jī)系濾膜過(guò)濾,待HPLC-ECD分析。
1.3.2 HPLC-ECD分析條件
采用Zorbax SB-C18反相色譜柱(250 mm×4.6 mm,5 μm),流動(dòng)相為0.15%甲酸溶液(A)-甲醇(B);流速1.0 mL/min;進(jìn)樣量10 μL;柱溫30 ℃;電化學(xué)檢測(cè)器電壓900 mV;洗脫梯度為0~10 min、5%~15% B;10~20 min、15% B;20~25 min、15%~17% B;2 5~3 0 m i n、1 7%~3 0% B;3 0~5 0 m i n、3 0%~4 0% B;5 0~6 0 m i n、4 0%~5 5% B;60~70 min、55%~80% B;70~75 min、80% B。
2 結(jié)果與分析
2.1 指紋圖譜構(gòu)建及共有峰提取
在60 個(gè)標(biāo)有編號(hào)的樣品中,隨機(jī)選取45 個(gè)樣品(枸杞蜜、荊條蜜、荔枝蜜各15 個(gè)樣品)建立3 種蜂蜜的HPLC-ECD指紋圖譜并提取共有峰信息。記錄下隨機(jī)選取的樣品編號(hào),并按編號(hào)順序分別將3 種蜂蜜的HPLCECD圖譜數(shù)據(jù)導(dǎo)入中藥色譜指紋圖譜相似度評(píng)價(jià)系統(tǒng)A版(2004)軟件,各自自動(dòng)生成的樣品標(biāo)記S1~S15則依次對(duì)應(yīng)特定的編號(hào)。選定枸杞蜜S2樣品、荊條蜜S1樣品、荔枝蜜S1樣品為參照,多點(diǎn)校正以消除各圖譜之間保留時(shí)間的誤差,建立3 種蜂蜜樣品的HPLC-ECD指紋圖譜,如圖1所示。從圖1可以發(fā)現(xiàn),花源相同的蜂蜜樣品,HPLC-ECD指紋圖譜相似度較高,而花源不同的蜂蜜樣品,HPLC-ECD指紋圖譜的差異明顯。
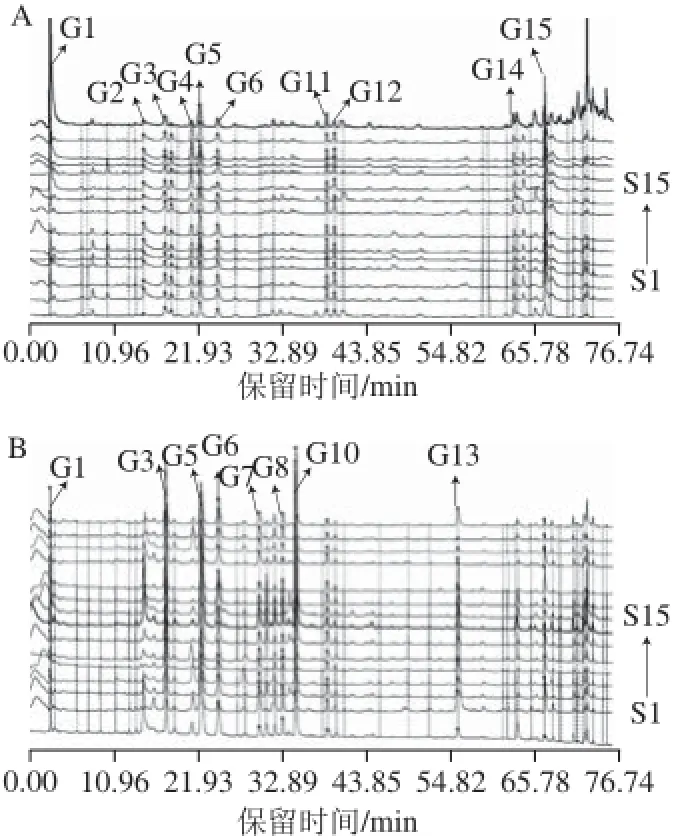
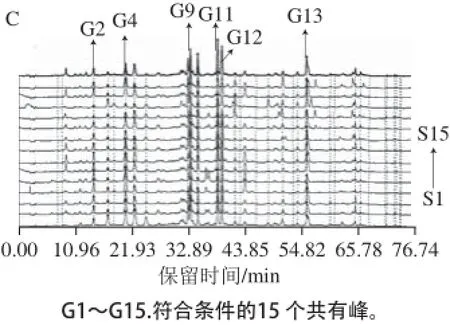
圖1 枸杞蜜(A)、荊條蜜(B)、荔枝蜜(C)HPLC-ECD指紋圖譜Fig. 1 HPLC-ECD fingerprints of medlar honey (A), vitex honey (B) and litchi honey (C)
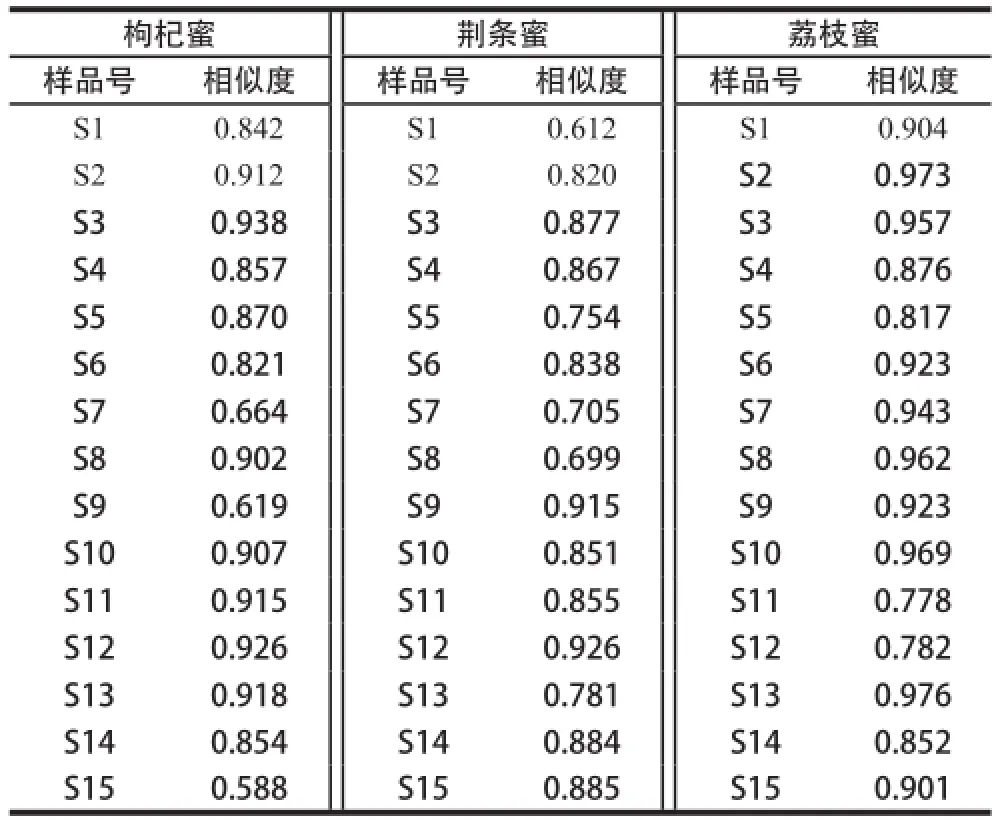
表2 蜂蜜樣品指紋圖譜相似度Table2 Fingerprint similarities among honey samples
由表2可知,除枸杞蜜S15和S9樣品相似度較低以外,其余樣品間的相似度在0.664~0.938之間。荊條蜜樣品的相似度在0.612~0.926之間,除S1的相似度較低,其余樣品相差不大,而荔枝蜜樣品的相似度在0.778~0.976之間。采自不同地區(qū),不同年份的同一種蜂蜜,其相似度差別并不顯著,可見(jiàn),經(jīng)HPLC-ECD分析得出的圖譜結(jié)果并不能從地理源、采集年份上很好地區(qū)分樣品。但是,考慮到本研究中涉及的樣品地理源較少,且樣品的數(shù)量有限等因素,應(yīng)用HPLC-ECD指紋圖譜技術(shù)區(qū)分蜂蜜樣品地理源的研究還有待進(jìn)一步的研究探討。
在中藥色譜指紋圖譜相似度評(píng)價(jià)系統(tǒng)A版軟件中提取3 種蜂蜜樣品色譜峰面積的數(shù)據(jù),篩選色譜峰面積大于700 nA·min的色譜峰作為蜂蜜樣品的共有峰,結(jié)果見(jiàn)圖1。從枸杞蜜樣品中可提取出10 個(gè)共有峰(G1、G2、G3、G4、G5、G6、G11、G12、G14、G15),荊條蜜樣品中可提取出8 個(gè)共有峰(G1、G3、G5、G6、G7、G8、G10、G13),荔枝蜜樣品可提取出6 個(gè)共有峰(G2、G4、G9、G11、G12、G13)。對(duì)比所有共有峰的保留時(shí)間及紫外吸收,合并具有相同保留時(shí)間和紫外吸收的共有峰,最終在45 個(gè)樣品中得到15 個(gè)共有峰(G1~G15)。所有樣品的共有峰保留時(shí)間及峰面積見(jiàn)表3。
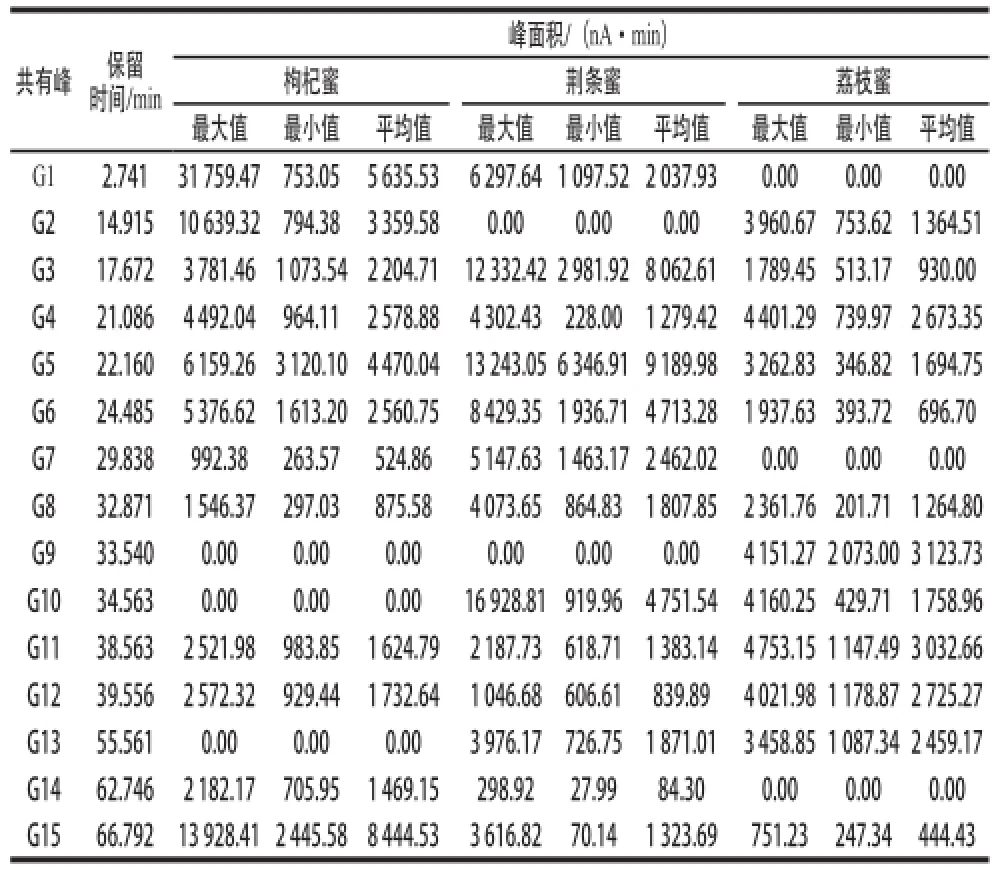
表3 共有峰保留時(shí)間及面積Table3 Retention times and area values of the common peaks
2.2 PCA結(jié)果
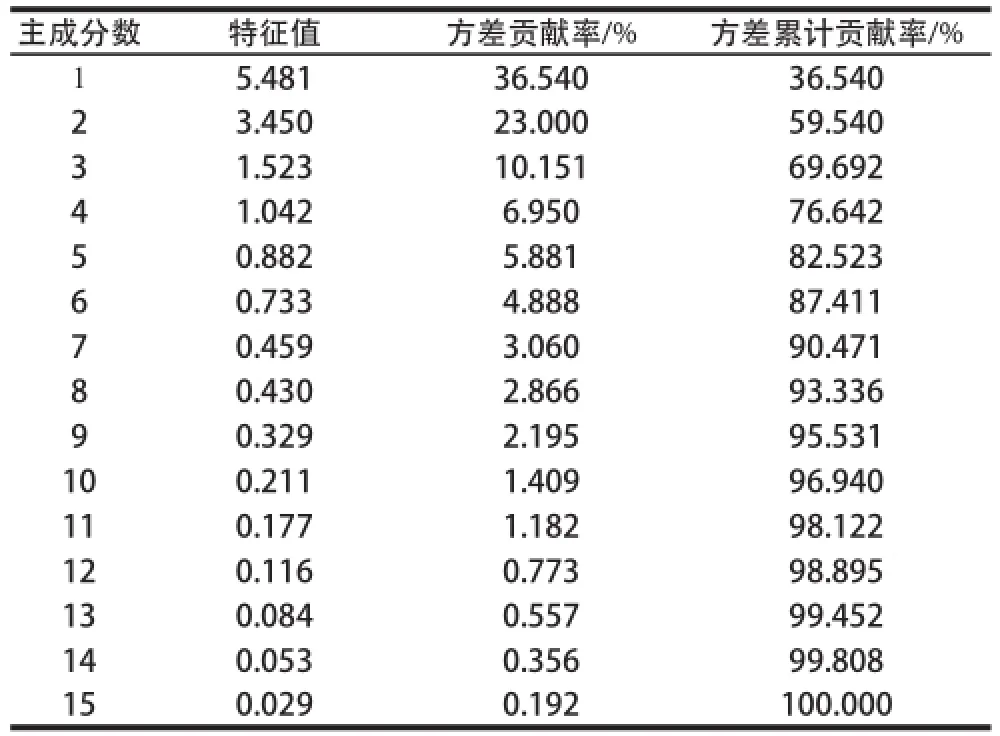
表4 PCA解釋總變量Table4 Total variance explained by principal component analysis
為了從15 個(gè)共有峰中選擇有限的變量指標(biāo)來(lái)代表所有的共有峰信息,對(duì)15 個(gè)共有峰進(jìn)行了PCA。應(yīng)用統(tǒng)計(jì)學(xué)軟件SPSS 19.0對(duì)共有峰面積數(shù)據(jù)進(jìn)行Z-scores標(biāo)準(zhǔn)化后,采用系統(tǒng)默認(rèn)方式進(jìn)行PCA,同時(shí)進(jìn)行KMO(Kaiser-Meyer-Olkin)與Bartlett球形度檢驗(yàn)。分析結(jié)果得到KMO的值為0.719,Bartlett球形度檢驗(yàn)的P值為0.000,表明變量之間適合進(jìn)行PCA。表4給出了PCA解釋總變量。前4 個(gè)主成分(PC1~PC4)的特征值大于1,且其方差累計(jì)貢獻(xiàn)率達(dá)到76.642%。PC1~PC4的方差貢獻(xiàn)率分別為36.540%、23.000%、10.151%和6.950%。其中,PC1的貢獻(xiàn)率主要來(lái)自G5、G12、G7、G3;PC2的貢獻(xiàn)率主要來(lái)自G14和G15;PC3主要綜合了G13和G8的信息;PC4則顯示與G4、G1相關(guān)。
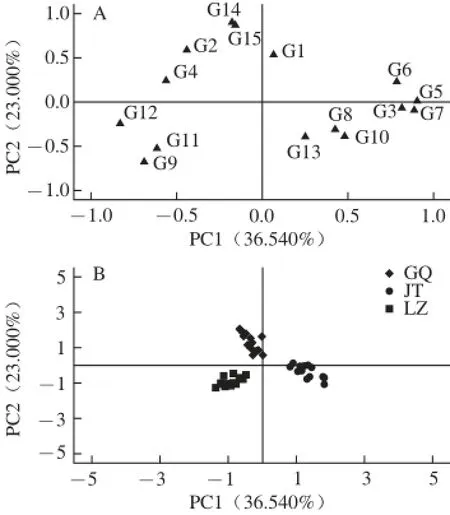
圖2 PC1和PC2的載荷圖(A)和得分圖(B)Fig. 2 Loadings plot (A) and scores plot (B) of PC1 and PC2
圖2 A給出了15 個(gè)共有峰的PC1和PC2載荷圖。基于3 種蜂蜜樣品15 個(gè)共有峰面積信息,分析不同花源蜂蜜樣品間差異的主成分得分如圖2B所示。3 種不同花源的蜂蜜樣品能夠按各自的花源明顯地分為3 類(lèi),其中荔枝蜜樣品和荊條蜜樣品可以在PC1方向上得到很好地區(qū)分,而枸杞蜜樣品可以與荔枝蜜、荊條蜜樣品在PC2方向上得到區(qū)分。無(wú)論是采自同一年份、不同地理源的蜂蜜樣品,還是不同年份、不同地理源的蜂蜜樣品,均可在花源上得到100%正確的分類(lèi)結(jié)果。可見(jiàn),HPLC-ECD共有峰信息充分反映了不同花源蜂蜜的特征信息,應(yīng)用HPLCECD指紋圖譜共有峰技術(shù)可排除地理源的干擾,準(zhǔn)確判別蜂蜜的花源。
2.3 HCA結(jié)果
雖然45 個(gè)蜂蜜樣品只基于PC1和PC2數(shù)據(jù)便可以得到正確的分類(lèi),但在解決實(shí)際問(wèn)題過(guò)程中,僅依靠單因素將多樣本對(duì)象進(jìn)行分類(lèi)是不足以全面、系統(tǒng)地描述其類(lèi)別的,必須更多地考慮多因素分類(lèi)。而HCA則是一種應(yīng)用多因素對(duì)研究對(duì)象進(jìn)行分類(lèi)的方法。HCA可通過(guò)使具有相似特征的樣品聚集在一起,差異性大的樣品分離開(kāi),從而直觀反映樣品之間的性質(zhì)。為評(píng)估不同花源蜂蜜樣品間的關(guān)系,HCA應(yīng)用15 個(gè)共有峰面積信息對(duì)所有45 個(gè)蜂蜜樣品(樣品順序與PCA樣品順序相同)進(jìn)行聚類(lèi)。應(yīng)用統(tǒng)計(jì)學(xué)軟件SPSS 19.0對(duì)共有峰面積數(shù)據(jù)進(jìn)行Z-scores標(biāo)準(zhǔn)化,采用離差平方和法和歐式距離平方的方法聚類(lèi),HCA譜系圖如圖3所示,在樣品編號(hào)前標(biāo)注相應(yīng)的樣品花源。
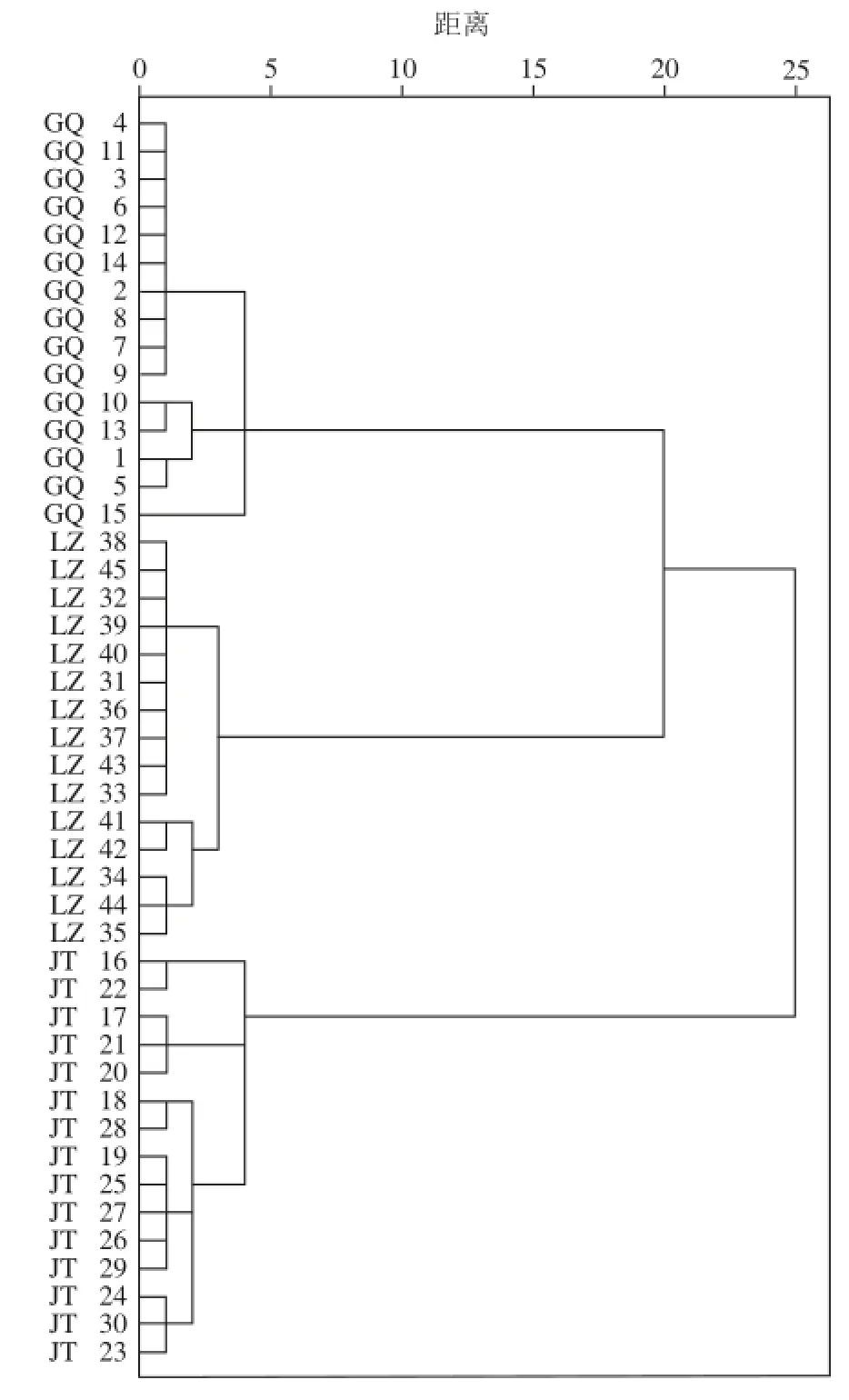
圖3 HCA譜系圖Fig. 3 Dendogram obtained from the hierarchical cluster analysis
從圖3可直觀發(fā)現(xiàn),當(dāng)距離為0時(shí),每個(gè)樣品各自成一類(lèi),隨著距離的增大,具有相似特征的樣品則依次被歸為一類(lèi),直到距離為25時(shí),所有樣品歸為一類(lèi)。當(dāng)距離為5時(shí),45 個(gè)蜂蜜樣品被歸為3 類(lèi),樣品分類(lèi)正確率達(dá)100%。第1類(lèi)為15 個(gè)枸杞蜜樣品,在距離為5時(shí)分為一類(lèi),這一結(jié)果與PC1和PC2的得分圖第2象限的結(jié)果基本一致。第2類(lèi)為15 個(gè)荔枝蜜樣品,在距離為4時(shí)分為一類(lèi),這一結(jié)果與PC1和PC2的得分圖第3象限的結(jié)果相吻合。第3類(lèi)為15 個(gè)荊條蜜樣品,在聚類(lèi)為5時(shí)分為一類(lèi),這一結(jié)果與PC1和PC2的得分圖第4象限的結(jié)果部分一致,雖有一個(gè)樣品歸為第1象限,卻明顯與其余兩種蜂蜜樣品差異較大。由此可見(jiàn),對(duì)多樣本對(duì)象進(jìn)行多因素分類(lèi)得到了與PCA一致的結(jié)果,HCA結(jié)果表明,應(yīng)用HPLC-ECD指紋圖譜共有峰的信息,可對(duì)蜂蜜的花源進(jìn)行鑒定。
2.4 驗(yàn)證實(shí)驗(yàn)結(jié)果
為了進(jìn)一步探究實(shí)驗(yàn)結(jié)果的可靠性,繼續(xù)采用HCA進(jìn)行驗(yàn)證。取隨機(jī)選樣后剩余的15 個(gè)樣品(枸杞蜜樣品3 個(gè),荊條蜜樣品5 個(gè),荔枝蜜樣品7 個(gè)),提取共有峰面積信息進(jìn)行HCA,數(shù)據(jù)Z-scores標(biāo)準(zhǔn)化后采用同樣的離差平方和法和歐式距離平方的方法聚類(lèi),聚類(lèi)譜系圖如圖4所示,在樣品編號(hào)前標(biāo)注相應(yīng)的樣品花源。
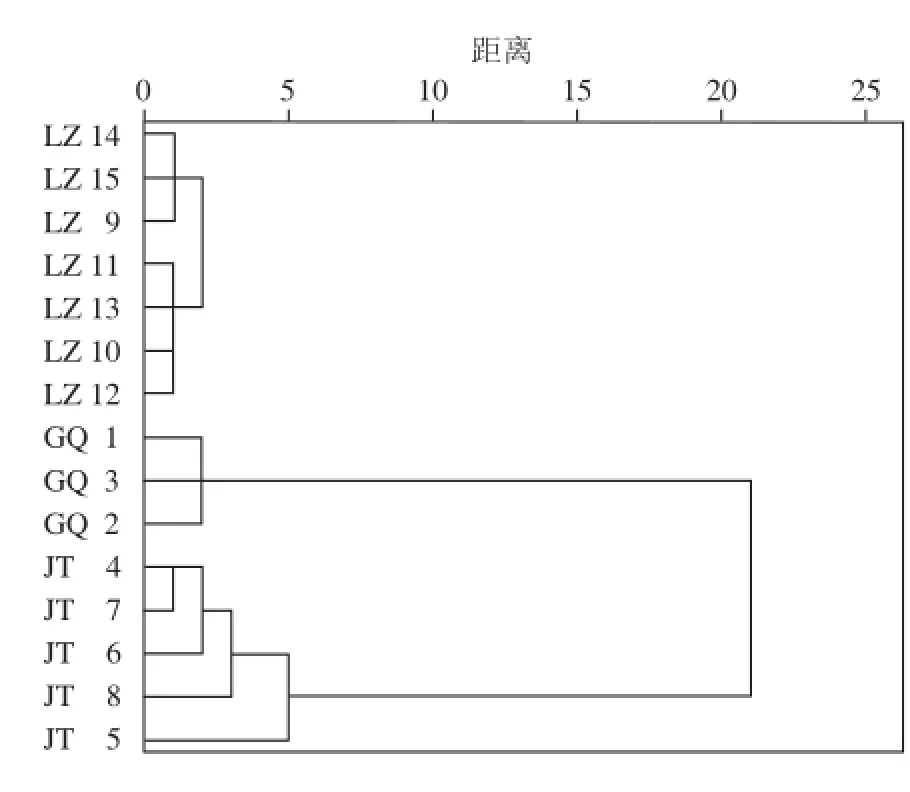
圖4 驗(yàn)證樣品HCA譜系圖Fig. 4 Dendogram obtained from the hierarchical cluster analysis for validation samples
觀察圖4發(fā)現(xiàn),隨著距離的增大,特征相同的樣品依次歸為一類(lèi)。取相同的參數(shù),距離為5時(shí),樣品分為了4 類(lèi),第1類(lèi)為7 個(gè)荔枝蜜樣品,第2類(lèi)為3 個(gè)枸杞蜜樣品,第3類(lèi)為4 個(gè)荊條蜜樣品,其中一個(gè)荊條蜜樣品被分為第4類(lèi)。與實(shí)驗(yàn)?zāi)P徒M相比,除荊條蜜樣品的正確分類(lèi)率較低外(80%),其余樣品均以100%正確率分類(lèi)。分析荊條蜜樣品HCA譜系圖發(fā)現(xiàn),距離為1時(shí),僅有兩個(gè)樣品聚集一類(lèi),距離逐漸增大,樣品逐個(gè)歸為一類(lèi),在距離為5時(shí),一個(gè)荊條蜜樣品未被正確分類(lèi),這可能是因?yàn)榍G條蜜樣品自身的內(nèi)部差異略大造成的。但隨著聚類(lèi)距離的增加,該樣品依然歸于荊條蜜樣品集中,并沒(méi)有誤判。驗(yàn)證實(shí)驗(yàn)表明,提取蜂蜜樣品的共有峰信息并應(yīng)用HCA,是一種鑒別蜂蜜花源的有效手段。
3 結(jié) 論
蜂蜜的花源不同,其電活性物質(zhì)的種類(lèi)和含量亦會(huì)有較大的差異,因此為HPLC-ECD鑒別蜂蜜花源提供了可能。本研究建立了一種利用HPLC-ECD構(gòu)建不同蜂蜜樣品指紋圖譜,提取共有峰面積信息并應(yīng)用PCA和HCA鑒別蜂蜜花源的方法。在60 個(gè)蜂蜜樣品中,隨機(jī)選取3 種蜂蜜45 個(gè)樣品建立模型,提取樣品共有峰面積進(jìn)行PCA和HCA。研究顯示,HCA的分類(lèi)結(jié)果與PC1和PC2得分圖的分類(lèi)結(jié)果一致,3 種蜂蜜均可按照各自的花源正確分類(lèi),且正確率達(dá)到100%。相同參數(shù)條件下,45 個(gè)樣品建立的模型對(duì)15 個(gè)完全未參與建模的枸杞蜜、荊條蜜和荔枝蜜樣品預(yù)測(cè)正確判別率分別為100%、80%和100%。研究表明,通過(guò)構(gòu)建不同蜂蜜樣品的HPLC-ECD指紋圖譜,不僅可以得到單花種蜂蜜樣品較為完整的化合物信息,而且可以對(duì)比不同的蜂蜜樣品,得到單花種蜂蜜的特征化合物信息,為蜂蜜的花源鑒定提供了技術(shù)支持。同時(shí),應(yīng)用HPLC-ECD指紋圖譜共有峰信息并應(yīng)用PCA和HCA,不僅具有檢測(cè)快、準(zhǔn)確度高、成本低等優(yōu)勢(shì),還可以作為一種蜂蜜花源鑒別的新方法,有效地運(yùn)用于實(shí)際鑒定中,為蜂蜜的質(zhì)量控制提供技術(shù)支持。
[1] 曹煒, 陳衛(wèi)軍. 蜂產(chǎn)品深加工技術(shù)[M]. 北京: 中國(guó)輕工業(yè)出版社, 2011: 28-29.
[2] BALL D W. The chemical composition of honey[J]. Journal of Chemical Education, 2007, 84(10): 1643-1646. DOI:10.1021/ ed084p1643.
[3] SILVA L R, VIDEIRA R, MONTEIRO A P, et al. Honey from Luso region (Portugal): Physicochemical characteristics and mineral contents[J]. Microchemical Journal, 2009, 93(1): 73-77. DOI:10.1016/ j.microc.2009.05.005.
[4] 孫政, 程妮, 曹煒. 蜂蜜中氨基酸應(yīng)用研究進(jìn)展[J]. 食品與發(fā)酵工業(yè), 2016, 42(1): 260-263. DOI:10.13995/j.cnki.11-1802/ts.201601046.
[5] GOMES S, DIAS L G, MOREIRA L L, et al. Physicochemical, microbiological and antimicrobial properties of commercial honeys from Portugal[J]. Food and Chemical Toxicology, 2010, 48(2): 544-548. DOI:10.1016/j.fct.2009.11.029.
[6] ALVAREZ-SUAREZ J M, TULIPANI S, DíAZ D, et al. Antioxidant and antimicrobial capacity of several monofloral Cuban honeys and their correlation with color, polyphenol content and other chemical compounds[J]. Food and Chemical Toxicology, 2010, 48(8): 2490-2499. DOI:10.1016/j.fct.2010.06.021.
[7] AHMAD I, JIMENEZ H, YAACOB N S, et al. Tualang honey protects keratinocytes from ultraviolet radiation-induced inflammation and DNA damage[J]. Photochemistry and Photobiology, 2012, 88(5): 1198-1204. DOI:10.1111/j.1751-1097.2012.01100.x.
[8] 裴高璞, 史波林, 趙鐳, 等. 蜂蜜質(zhì)量市場(chǎng)動(dòng)態(tài)及摻假檢測(cè)方法現(xiàn)狀分析[J]. 食品科學(xué), 2013, 34(15): 329-336. DOI:10.7506/spkx1002-6630-201315068.
[9] 袁玉偉, 張志恒, 葉雪珠, 等. 蜂蜜摻假鑒別技術(shù)的研究進(jìn)展與對(duì)策建議[J]. 食品科學(xué), 2010, 31(9): 318-322.
[10] 宋海英. SPS措施對(duì)中國(guó)蜂蜜出口歐盟的影響: 基于面板數(shù)據(jù)的實(shí)證分析[J]. 國(guó)際貿(mào)易問(wèn)題, 2014(1): 83-91.
[11] FERNáNDEZ-TORRES R, PEREZ-BERNAL J L, BELLO-LOPEZ M A, et al. Mineral content and botanical origin of Spanish honeys[J]. Talanta, 2005, 65(3): 686-691. DOI:10.1016/j.talanta.2004.07.030.
[12] MADEJCZYK M, BARALKIEWICZ D. Characterization of Polish rape and honeydew honey according to their mineral contents using ICP-MS and F-AAS/AES[J]. Analytica Chimica Acta, 2008, 617(1): 11-17. DOI:10.1016/j.aca.2008.01.038.
[13] YüCEL Y, SULTANO?LU P. Characterization of Hatay honeys according to their multi-element analysis using ICP-OES combined with chemometrics[J]. Food Chemistry, 2013, 140(1): 231-237. DOI:10.1016/j.foodchem.2013.02.046.
[14] REBANE R, HERODES K. Evaluation of the botanical origin of Estonian uni-and polyf oral honeys by amino acid content[J]. Journal of Agricultural and Food Chemistry, 2008, 56(22): 10716-10720. DOI:10.1021/jf8018968.
[15] WEI Z B, WANG J, WANG Y W. Classification of monofloral honeys from different floral origins and geographical origins based on rheometer[J]. Journal of Food Engineering, 2010, 96(3): 469-479. DOI:10.1016/j.jfoodeng.2009.08.028.
[16] SCANDURRA G, TRIPODI G, VERZERA A. Impedance spectroscopy for rapid determination of honey floral origin[J]. Journal of Food Engineering, 2013, 119(4): 738-743. DOI:10.1016/ j.jfoodeng.2013.06.042.
[17] ESCUREDO O, GONZáLEZ-MARTíN M I, RODRíGUEZ-FLORES M S, et al. Near infrared spectroscopy applied to the rapid prediction of the f oral origin and mineral content of honeys[J]. Food Chemistry, 2015, 170(1): 47-54. DOI:10.1016/j.foodchem.2014.08.061.
[18] CHEN L Z, WANG J H, YE Z H, et al. Classification of Chinese honeys according to their f oral origin by near infrared spectroscopy[J]. Food Chemistry, 2012, 135(2): 338-342. DOI:10.1016/ j.foodchem.2012.02.156.
[19] SERGIEL I, POHL P, BIESAGA M, et al. Suitability of threedimensional synchronous fluorescence spectroscopy for fingerprint analysis of honey samples with reference to their phenolic profiles[J]. Food Chemistry, 2014, 145(15): 319-326. DOI:10.1016/ j.foodchem.2013.08.069.
[20] ROSHAN A R A, GAD H A, EL-AHMADY S H, et al. Authentication of monof oral Yemeni Sidr honey using ultraviolet spectroscopy and chemometric analysis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(32): 7722-7729. DOI:10.1021/jf402280y.
[21] KARABAGIAS I K, BADEKA A, KONTAKOS S, et al. Characterisation and classification of Greek pine honeys according to their geographical origin based on volatiles, physicochemical parameters and chemometrics[J]. Food Chemistry, 2014, 146(1): 548-557. DOI:10.1016/j.foodchem.2013.09.105.
[22] MATTONAI M, PARRI E, QUERCI D, et al. Development and validation of an HPLC-DAD and HPLC/ESI-MS2method for the determination of polyphenols in monofloral honeys from Tuscany (Italy)[J]. Microchemical Journal, 2016, 126: 220-229. DOI:10.1016/ j.microc.2015.12.013.
[23] SCHUHFRIED E, del PULGAR J S, BOBBA M, et al. Classif cation of 7 monofloral honey varieties by PTR-TOF-MS direct headspace analysis and chemometrics[J]. Talanta, 2016, 147(15): 213-219. DOI:10.1016/j.talanta.2015.09.062.
[24] BOFFO E F, TAVARES L A, TOBIAS A C T, et al. Identif cation of components of Brazilian honey by1H NMR and classif cation of its botanical origin by chemometric methods[J]. LWT-Food Science and Technology, 2012, 49(1): 55-63. DOI:10.1016/j.lwt.2012.04.024.
[25] RIBEIRO R O R, MáRSICO E T, da SILVA CARNEIRO C, et al. Classif cation of Brazilian honeys by physical and chemical analytical methods and low f eld nuclear magnetic resonance (LF1H NMR)[J]. LWT-Food Science and Technology, 2014, 55(1): 90-95. DOI:10.1016/ j.lwt.2013.08.004.
Authentication of Three Monofloral Honeys by High Performance Liquid Chromatography with Electrochemical Detection
HE Qiong1, HE Liangliang1, KANG Yuxin1, CHENG Ni1,2, L? Xingang1,2, CAO Wei1,2,*
(1. Department of Food Science and Engineering, School of Chemical Engineering, Applied Technology Research Center of Bee Products, Northwest University, Xi’an 710069, China; 2. Bee Product Research Center of Shaanxi Province, Xi’an 710065, China)
A novel method for the identification of the floral origins of honeys was established by high performance liquid chromatography with electrochemical detection (HPLC-ECD). The HPLC-ECD fingerprints of three monofloral honeys collected from different areas of China were established. From the HPLC-ECD fingerprints, the areas of the common peaks were obtained and principal component analysis (PCA) and hierarchical cluster analysis (HCA) were performed to classify 45 honey samples (15 medlar honey samples, 15 vitex honey samples, and 15 litchi honey samples) according to their floral origins. These samples were successfully classified by PCA and HCA with 100% correct classification rates. To evaluate the reliability of the model based on 45 honey samples, some medlar honey, vitex honey and litchi honey samples which were not included in the modeling sample set were validated with correct prediction rates of 100%, 80% and 100%, respectively. The results indicated that HPLC-ECD combined with PCA and HCA may be used as a fast, accurate and environmentally safe method to differentiate honeys according to their floral origins.
honey; high performance liquid chromatography-electrochemical detection (HPLC-ECD); fingerprint; principal component analysis; hierarchical cluster analysis
10.7506/spkx1002-6630-201702045
TS201
A
1002-6630(2017)02-0290-06
賀瓊, 何亮亮, 康予馨, 等. 高效液相色譜-電化學(xué)檢測(cè)指紋圖譜鑒別3 種單花種蜂蜜花源[J]. 食品科學(xué), 2017, 38(2): 290-295. DOI:10.7506/spkx1002-6630-201702045. http://www.spkx.net.cn
HE Qiong, HE Liangliang, KANG Yuxin, et al. Authentication of three monofloral honeys by high performance liquid chromatography with electrochemical detection[J]. Food Science, 2017, 38(2): 290-295. (in Chinese with English abstract)
10.7506/spkx1002-6630-201702045. http://www.spkx.net.cn
2016-05-16
國(guó)家自然科學(xué)基金面上項(xiàng)目(31272510);陜西省社會(huì)發(fā)展攻關(guān)項(xiàng)目(2016SF-425);西北大學(xué)研究生創(chuàng)新教育項(xiàng)目(YZZ14043);陜西省大學(xué)生創(chuàng)新創(chuàng)業(yè)訓(xùn)練計(jì)劃項(xiàng)目(0687)
賀瓊(1990—),女,碩士研究生,研究方向?yàn)檗r(nóng)產(chǎn)品質(zhì)量控制。E-mail:heqiong732@stumail.nwu.edu.cn
*通信作者:曹煒(1965—),男,教授,博士,研究方向?yàn)榉洚a(chǎn)品深加工及質(zhì)量控制。E-mail:caowei@nwu.edu.cn

