催化過(guò)氧化氫對(duì)石油烴污染土壤的氧化能力
張秋子,韋云霄*,姜永海,魏曉飛,汪福旺
1.北京建工環(huán)境修復(fù)股份有限公司,北京 100015 2.中國(guó)環(huán)境科學(xué)研究院,北京 100012
?
催化過(guò)氧化氫對(duì)石油烴污染土壤的氧化能力
張秋子1,韋云霄1*,姜永海2,魏曉飛1,汪福旺1
1.北京建工環(huán)境修復(fù)股份有限公司,北京 100015 2.中國(guó)環(huán)境科學(xué)研究院,北京 100012
針對(duì)催化過(guò)氧化氫對(duì)石油烴污染場(chǎng)地土壤進(jìn)行異位氧化修復(fù),通過(guò)使用不同濃度過(guò)氧化氫及不同摩爾比的過(guò)氧化氫和催化穩(wěn)定劑與污染土壤進(jìn)行反應(yīng),比較過(guò)氧化氫在不同條件下對(duì)石油烴的氧化降解性能。結(jié)果表明:催化過(guò)氧化氫反應(yīng)過(guò)程中產(chǎn)生的中間產(chǎn)物羥基自由基和超氧陰離子為最主要的氧化基團(tuán);當(dāng)過(guò)氧化氫濃度為0.50%~1.00%,氧化劑與催化穩(wěn)定劑摩爾比為75∶1~100∶1時(shí),總石油烴的降解率較高;過(guò)高的過(guò)氧化氫濃度或過(guò)低的氧化劑與催化穩(wěn)定劑摩爾比會(huì)導(dǎo)致過(guò)氧化氫分解過(guò)快,氧化劑與污染物的接觸時(shí)間降低,從而達(dá)不到理想的污染物去除率;過(guò)氧化氫在快速分解時(shí),優(yōu)先氧化碳數(shù)較低的石油烴。
過(guò)氧化氫;石油烴;催化氧化;降解率;土壤修復(fù)
法國(guó)工程師Fenton于1894年發(fā)現(xiàn),溶解的二價(jià)鐵鹽可以在弱酸性條件下使其催化稀釋的過(guò)氧化氫分解,并引發(fā)強(qiáng)烈的氧化反應(yīng),二價(jià)鐵離子使過(guò)氧化氫分解生成羥基自由基,該反應(yīng)被稱為芬頓反應(yīng),反應(yīng)式如下[1]:
Fe2++H2O2→Fe3++OH-+OH·
(1)
由于芬頓反應(yīng)的氧化性極強(qiáng),且反應(yīng)速率非常快,在發(fā)現(xiàn)之初并未在工業(yè)中得到廣泛使用。直到1955年,芬頓試劑在廢水處理中表現(xiàn)出了良好的處理效果,強(qiáng)氧化性的羥基自由基可將水溶液中難降解有機(jī)物的結(jié)構(gòu)破壞并將其氧化分解。隨著環(huán)境工程行業(yè)的發(fā)展,過(guò)氧化氫逐漸被應(yīng)用于污水處理和土壤地下水的場(chǎng)地修復(fù)[2]。
芬頓反應(yīng)這一概念仍應(yīng)用于早期的基于過(guò)氧化氫的原位化學(xué)氧化場(chǎng)地修復(fù)中。然而,在亞鐵離子對(duì)過(guò)氧化氫實(shí)際的催化氧化中,其發(fā)生的化學(xué)過(guò)程遠(yuǎn)不限于式(1)的反應(yīng)。因此,Watts等[3]在2005年將基于過(guò)氧化氫和亞鐵離子等金屬催化劑的化學(xué)氧化過(guò)程統(tǒng)稱為催化過(guò)氧化氫反應(yīng)(catalyzed hydrogen peroxide, CHP)。
面對(duì)日益嚴(yán)重的石油烴對(duì)土壤的污染,使用催化過(guò)氧化氫來(lái)氧化降解污染土壤中的總石油烴(total petroleum hydrocarbon,TPH)、苯系石油烴(benzene, toluene, ethylbenzene, xylene,BTEX)和多環(huán)芳烴(polycyclic aromatic hydrocarbon,PAH)已成為較常用的場(chǎng)地修復(fù)技術(shù)。Kang等[4]用催化過(guò)氧化氫去除中性條件下土壤中的BTEX,污染物降解率在3 h內(nèi)達(dá)97%以上。孫燕英等[5]用催化過(guò)氧化氫處理重度柴油污染土壤,在不同的pH條件下,降解率均在96%以上。Krembs[6]總結(jié)了9個(gè)使用催化過(guò)氧化氫處理土漿中TPH的工程案例,結(jié)果表明,在所有案例中過(guò)氧化氫的氧化效果均良好。上述研究驗(yàn)證了催化過(guò)氧化氫在小試、中試及工程實(shí)施中能有效地去除土壤中的石油烴。而對(duì)于氧化實(shí)施過(guò)程中氧化劑濃度以及使用的催化劑與螯合穩(wěn)定劑的配比對(duì)反應(yīng)過(guò)程和氧化效率的影響鮮有報(bào)道。筆者通過(guò)催化過(guò)氧化氫與受石油烴污染的土樣進(jìn)行反應(yīng),研究TPH降解效果與過(guò)氧化氫濃度以及氧化劑與催化穩(wěn)定劑配比的關(guān)系,確定參與氧化反應(yīng)的主要中間產(chǎn)物,并探究過(guò)氧化氫對(duì)不同碳鏈長(zhǎng)度的TPH的氧化機(jī)理。
1 材料與方法
1.1 場(chǎng)地概述
污染土壤樣品采自北京市郊區(qū)某汽油柴油泄露污染場(chǎng)地。通過(guò)場(chǎng)地勘測(cè),測(cè)定污染場(chǎng)地地層及油污情況大致為:地下0~2 m為人工堆積層,含油量約為7%;地下2~5 m為卵石層,含油量約為7%;地下5~16 m為粉質(zhì)黏土層,含油量約為18%,為污染最嚴(yán)重的土層;地下16 m以下為卵石層,含油量約為2%。污染場(chǎng)地土壤擬采用異位化學(xué)氧化進(jìn)行修復(fù)處理。
1.2 試驗(yàn)方法
在上述污染場(chǎng)地含油量高的區(qū)域,隨機(jī)采集10 kg有代表性的污染土樣,裝入自封袋中密封運(yùn)回實(shí)驗(yàn)室,保持密封狀態(tài)并儲(chǔ)存于4 ℃冷藏冰柜中。
試驗(yàn)開(kāi)始前,把污染土樣迅速均勻混合并篩除其中摻雜的石塊。在室溫下于電子秤上稱取9份均質(zhì)后的土樣,每份200 g,各土樣分別放于1 L燒杯中。其中,1份為空白對(duì)照樣,其余8份土樣分為2組,每組4個(gè)樣品。分別測(cè)試在不同過(guò)氧化氫濃度(第1組)及不同過(guò)氧化氫與催化穩(wěn)定劑摩爾比(第2組)的條件下,土壤中TPH的殘留濃度受藥劑投加情況的影響。試驗(yàn)中使用的氧化劑為質(zhì)量濃度10%的過(guò)氧化氫;催化劑為0.15 molL的FeSO4·7H2O,分子量為278;穩(wěn)定劑為0.15 molL的Na3[C3H5O(COO)3]·2H2O,分子量為294。
第1組包括4個(gè)樣,分別向各樣品中加入濃度為0.50%、0.75%、1.00%及1.50%的過(guò)氧化氫,編號(hào)為S1、S2、S3和S4,過(guò)氧化氫與催化劑和催化穩(wěn)定劑的摩爾比均控制為100∶1。第2組包括4個(gè)樣,向各處理樣中投加的過(guò)氧化氫與催化穩(wěn)定劑的摩爾比分別為100∶1、75∶1、50∶1和25∶1,編號(hào)為S5、S6、S7和S8,過(guò)氧化氫的濃度控制為1.00%。
教師展示蝗蟲(chóng)、壁虎、蜘蛛、蜥蜴、蝸牛、蚯蚓、鳥(niǎo)、魚(yú)、渦蟲(chóng)、海葵、青蛙、蟾蜍、貓和虎的圖片,以此為基礎(chǔ)創(chuàng)設(shè)問(wèn)題情境,提出問(wèn)題:①將這12種動(dòng)物分為兩組,應(yīng)如何劃分?每組有哪些動(dòng)物?②將每組動(dòng)物再分類,又可分為哪幾類?每類有哪些動(dòng)物?③請(qǐng)把不同的動(dòng)物類群按照從簡(jiǎn)單到復(fù)雜的順序進(jìn)行排列。④仿照植物分類的圖解,小組合作完成上述動(dòng)物的分類圖解(圖2)。
向樣品中投加試劑的順序:1)添加去離子水調(diào)節(jié)土壤含水量;2)加入硫酸亞鐵與檸檬酸鈉的螯合混合液;3)投加過(guò)氧化氫溶液。向各試樣中投加溶液的總體積均為60 mL,具體投加量見(jiàn)表1。試劑投加后保持每0.5 h攪拌1次的頻率,試驗(yàn)總反應(yīng)時(shí)間為6 h。
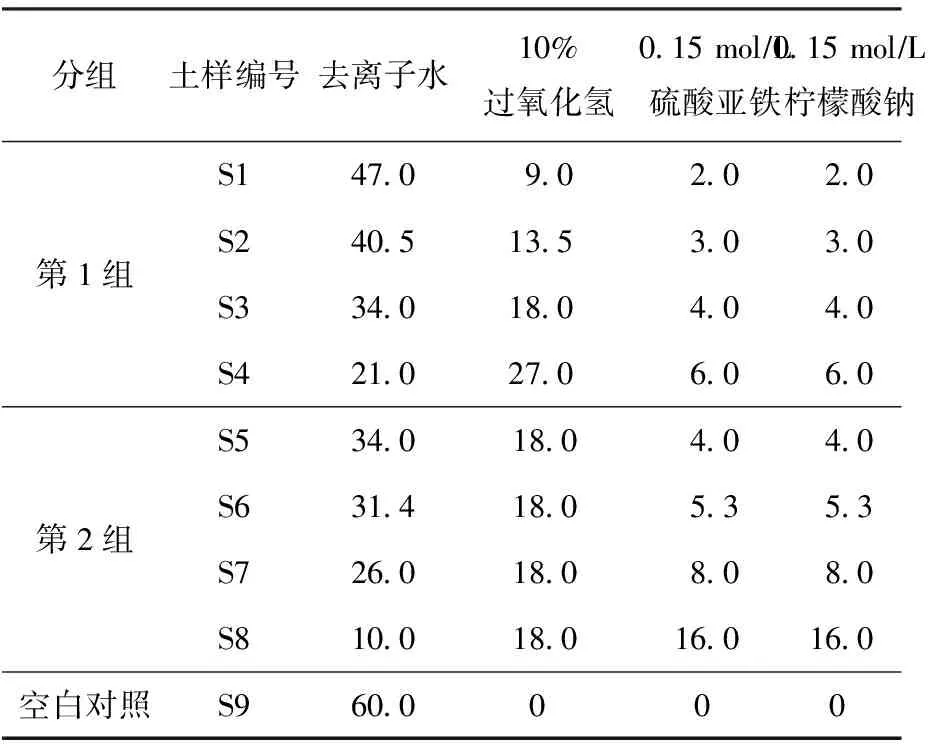
表1 試驗(yàn)中向各試樣投加試劑的量Table 1 The summary of reagent dosage in the bench-scale test mL
注:土樣量均為200 g;S1~S4為分別加入0.50%、0.75%、1.00%和1.50%的過(guò)氧化氫;S5~S8分別為投加過(guò)氧化氫與催化穩(wěn)定劑的摩爾比為100∶1、75∶1、50∶1和25∶1。
1.3 分析方法
試驗(yàn)中的樣品均送至第三方商業(yè)實(shí)驗(yàn)室進(jìn)行分析檢測(cè)。各樣品在反應(yīng)完全后的TPH殘留濃度根據(jù)石油烴中碳原子數(shù)分為4段進(jìn)行分析:碳原子數(shù)為C6~C9部分使用氣相色譜-質(zhì)譜法分析揮發(fā)性有機(jī)物;碳原子數(shù)為C10~C14,C15~C28及C29~C36部分使用非鹵代有機(jī)物氣相色譜法進(jìn)行分析[7-8]。氦氣被用于吹掃并作為氣相色譜中的載氣,注射溫度為240 ℃,載氣流量為1 mLmin,初始溫度為35 ℃,以9 ℃min升溫至250 ℃,保持最終溫度為250 ℃,直至所有預(yù)期的化合物完全洗脫。
鐵與錳的土壤濃度測(cè)定方法參照文獻(xiàn)[9]。
2 結(jié)果與討論
2.1 TPH降解率
由于C6~C9的石油烴在常溫下極易揮發(fā),在反應(yīng)前濃度低于100 mgkg,反應(yīng)后濃度為15~80 mgkg,相較于其他區(qū)間的石油烴濃度較低,不適合單獨(dú)比較,因此將C6~C9與C10~C14合并進(jìn)行比較。C29~C39為重質(zhì)石油烴,未出現(xiàn)在該污染土壤中,反應(yīng)前后濃度均低于100 mgkg,因此將C15~C28與C29~C36合并進(jìn)行比較。過(guò)氧化氫與各土樣進(jìn)行充分氧化反應(yīng)后,C6~C14,C15~C36和TPH的殘留濃度及降解率見(jiàn)表2。
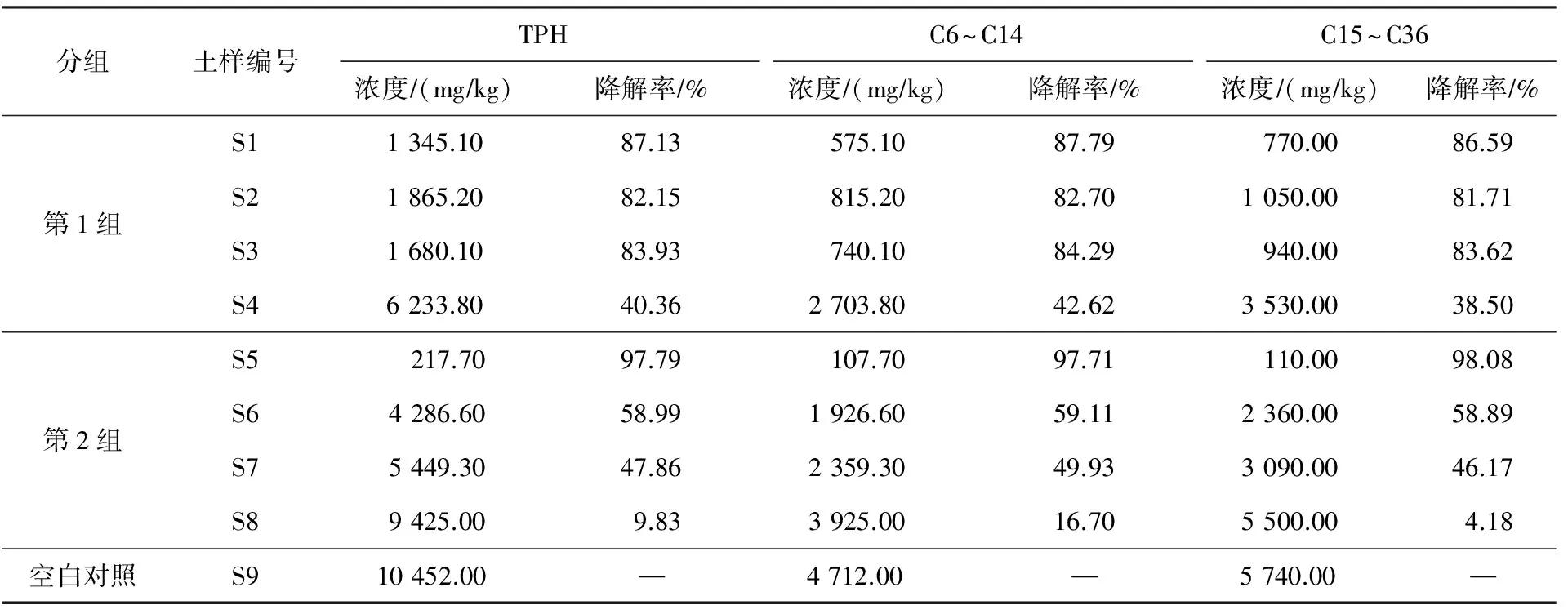
表2 反應(yīng)后TPH、C6~C14和C15~C36在各試樣中的殘留濃度和降解率Table 2 Residual TPH, C6~C14 and C15~C36 concentration and degradation rate of each sample after reaction
注:同表1。
根據(jù)TPH的殘留濃度數(shù)據(jù),第1組的試驗(yàn)結(jié)果如圖1(a)所示。從圖1(a)可以看出,0.50%、0.75%及1.00%的H2O2相較于1.50%的H2O2對(duì)TPH的處理效果較好,且這3組的TPH殘留濃度沒(méi)有明顯差異,為1 345.10~1 680.20 mgkg,降解率為82.15%~87.13%。而1.50%的H2O2處理后TPH的殘留濃度仍高達(dá)6 233.80 mgkg,降解率為40.36%。
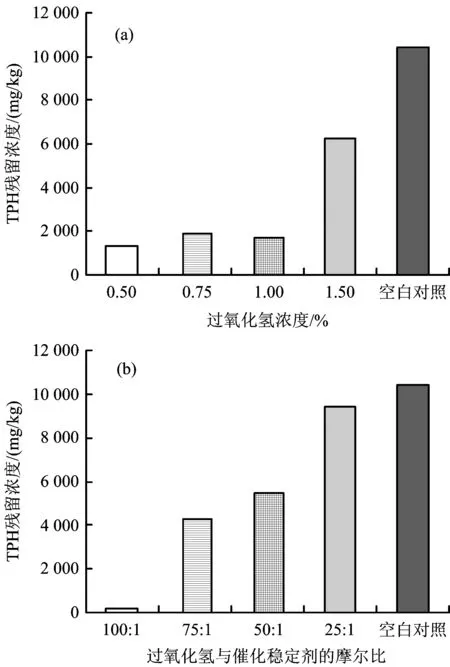
圖1 TPH殘留濃度與試劑投加量的關(guān)系Fig. 1 The relationship between the TPH residual concentration of each sample and dosage
2.2 氧化反應(yīng)基團(tuán)
過(guò)氧化氫受亞鐵離子催化的反應(yīng)過(guò)程已得到較詳細(xì)的報(bào)道,主要涉及以下反應(yīng)[10]:
Fe2++H2O2→Fe3++OH-k=63 L(mol·s)
(2)
OH·+H2O2→H2O+HO2·
k=3.3×107L(mol·s)
(3)
HO2·+H2O2→H2O+O2+OH·
(4)
Fe2++OH·→Fe3++OH
k=3.2×108L(mol·s)
(5)
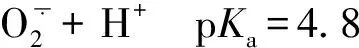
(6)
Fe3++HO2·→Fe2++O2+H+
k=2×103L(mol·s)
(7)

(8)
Fe3++H2O2?Fe(HO2)2++H+ke=3.1×10-3
(9)
Fe(HO2)2+→Fe2++HO2· k=2.7×10-3s-1
(10)
在過(guò)氧化氫參與的氧化過(guò)程中,式(2)產(chǎn)生的中間產(chǎn)物羥基自由基被認(rèn)為是最主要的氧化基團(tuán)。其強(qiáng)氧化性(Eo為2.59 V)無(wú)差別地與土壤顆粒表面吸附物及土壤溶液中的各有機(jī)物和無(wú)機(jī)物發(fā)生氧化還原反應(yīng),包括污染物、自然有機(jī)質(zhì)、無(wú)機(jī)礦物質(zhì)以及溶解質(zhì)等。由于以上物質(zhì)與羥基自由基反應(yīng)的競(jìng)爭(zhēng)性,過(guò)氧化氫對(duì)目標(biāo)污染物的降解率由各參與反應(yīng)物質(zhì)的反應(yīng)速率和其與過(guò)氧化基團(tuán)間的親和度決定。只有當(dāng)關(guān)注污染物與氧化物的反應(yīng)速率高于溶液中的其他物質(zhì),并且有足夠的親和度時(shí),關(guān)注污染物才能得到有效降解。從表2可以看出,2組試驗(yàn)中較高的TPH降解率分別可達(dá)87.79%和98.08%,證明在恰當(dāng)?shù)乃巹┡浔鹊臈l件下,催化過(guò)氧化氫足以有效降解土壤中的總石油烴。
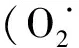
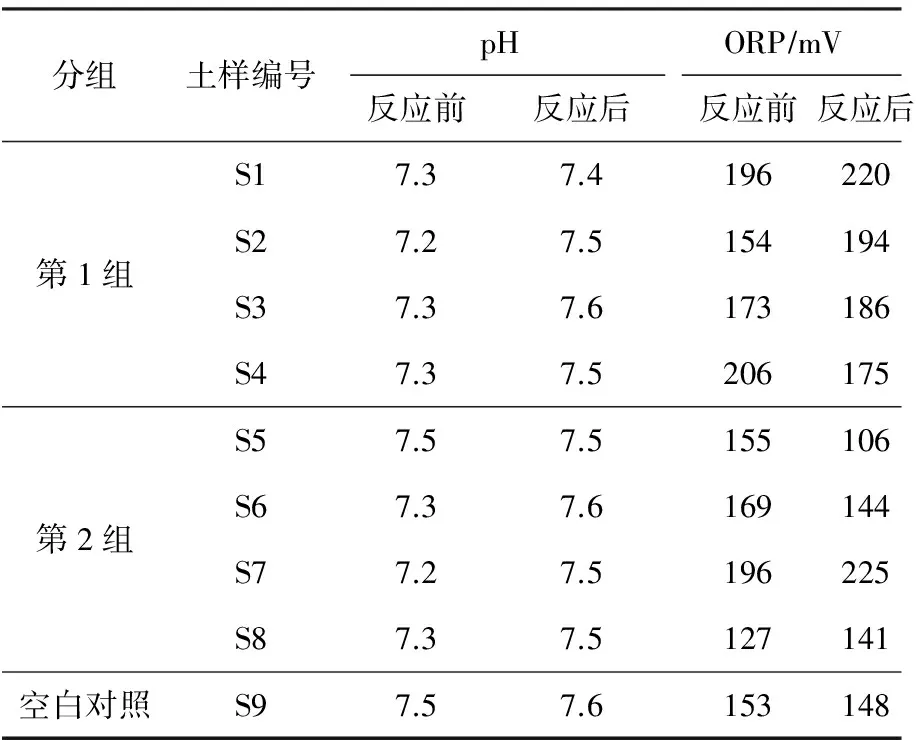
表3 反應(yīng)前后各試樣中的pH和ORPTable 3 pH and ORP in each sample before and after reaction
注:同表1。
根據(jù)式(2)~式(10)的反應(yīng)速率常數(shù)〔k,L(mol·s)〕可以判斷,反應(yīng)多屬于二級(jí)反應(yīng),反應(yīng)中各反應(yīng)物濃度對(duì)反應(yīng)速率均有影響。因此在過(guò)氧化氫濃度較高的情況下,其分解速率也將會(huì)大大提高〔如式(2)~式(4)〕,在幾十s甚至幾s內(nèi)完成反應(yīng)[13]。觀察發(fā)現(xiàn),各土漿溶液中明顯生成氣泡的時(shí)間為0.5~2.0 h,表明當(dāng)螯合劑檸檬酸鈉存在時(shí),通過(guò)螯合劑分子與亞鐵離子的強(qiáng)結(jié)合作用形成大分子螯合物,降低Fe2+的催化活性并保證其在溶液中的穩(wěn)定存在,從而能夠維持反應(yīng)較為緩慢地進(jìn)行[14]。通過(guò)上述分析以及第1組的測(cè)試結(jié)果表明,高濃度的過(guò)氧化氫會(huì)導(dǎo)致反應(yīng)速率上升而使其消耗過(guò)快,其對(duì)TPH的降解效果反而弱于低濃度的過(guò)氧化氫,而檸檬酸鈉的存在則起到了螯合穩(wěn)定亞鐵離子,延緩過(guò)氧化氫分解的作用。
2.3 優(yōu)先反應(yīng)物
催化過(guò)氧化氫對(duì)C6~C14與C15~C36的降解率見(jiàn)圖2。從圖2(a)可以看出,H2O2濃度為0.50%、0.75%和1.00%時(shí),C6~C14與C15~C36石油烴的降解率差別在1.50個(gè)百分點(diǎn)以內(nèi);而在H2O2濃度為1.50%時(shí),C6~C14的降解率比C15~C36高4.12個(gè)百分點(diǎn)。從圖2(b)可以看出,C6~C14與C15~C36的降解率在氧化劑與催化穩(wěn)定劑摩爾比為100∶1和75∶1時(shí)差別小于1.00個(gè)百分點(diǎn),而50∶1和25∶1時(shí),C6~C14的降解率比C15~C36分別高出3.76和12.52個(gè)百分點(diǎn)。
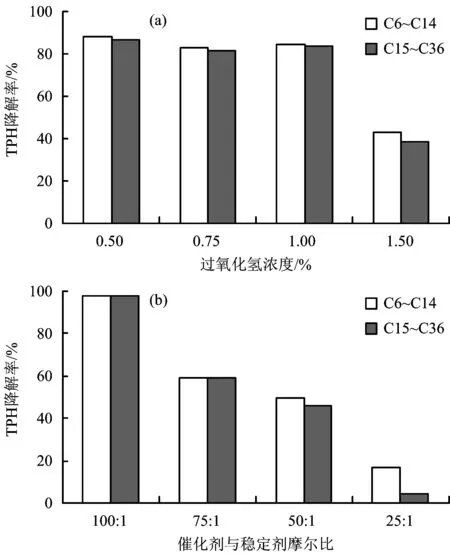
圖2 C6~C14和C15~C36的石油烴在各試樣中的降解率Fig.2 The degradation rate of C6-C14 and C15-C36 TPH in each sample
圖1(b)結(jié)果顯示,當(dāng)過(guò)氧化氫與催化穩(wěn)定劑的摩爾比為100∶1時(shí),該組的氧化效果遠(yuǎn)優(yōu)于其他組。在式(2)、式(5)和式(7)的3個(gè)二級(jí)反應(yīng)中,當(dāng)亞鐵離子的摩爾百分?jǐn)?shù)上升時(shí),將加快過(guò)氧化氫的分解,其提高過(guò)氧化氫分解速率對(duì)TPH降解帶來(lái)的減益效果大于其促進(jìn)生成氧化基團(tuán)的增益效果。Ferrarese等[15]在對(duì)PAH的化學(xué)氧化研究中也得到相似結(jié)果:當(dāng)使用50 mmolL的高錳酸鉀氧化PAH時(shí),PAH的降解率為91%;而使用50 mmolL高錳酸鉀加上50 mmolL過(guò)氧化氫時(shí),PAH的降解率降低至74%。過(guò)氧化氫的加入使氧化劑濃度增加,導(dǎo)致高錳酸鉀的分解速率加快,從而降低了氧化劑與PAH的接觸時(shí)間,使PAH的降解率降低。
綜上,當(dāng)過(guò)氧化氫對(duì)TPH的處理效果越差,即降解率越低時(shí),不同碳數(shù)的石油烴分子間的降解率的差別也越大。造成TPH降解率降低主要是由于過(guò)氧化氫的分解過(guò)快,原因包括過(guò)氧化氫的濃度過(guò)高以及氧化劑與催化穩(wěn)定劑摩爾比過(guò)低。可以推斷,在過(guò)氧化氫分解過(guò)快而與TPH接觸時(shí)間不足的情況下(如S4、S7和S8組),低碳數(shù)石油烴分子將優(yōu)先參與氧化反應(yīng)。過(guò)氧化氫分解越快,氧化劑與有機(jī)物接觸時(shí)間越短,則該效應(yīng)越明顯。
2.4 土壤自然理化條件對(duì)氧化反應(yīng)的影響
土壤中自然存在的鐵錳氧化礦物〔如水鐵礦(Fe2O3·0.5H2O)、針鐵礦(FeOOH)、赤鐵礦(Fe2O3)、磁鐵礦(Fe3O4)、菱鐵礦(FeCO3)、軟錳礦(β-MnO2)、水錳礦(MnOOH)等〕也可以對(duì)過(guò)氧化氫的分解起催化作用。這些金屬氧化物作為催化劑,在其顆粒表面對(duì)過(guò)氧化氫進(jìn)行催化分解,因此比表面積越大的礦物質(zhì)的催化效果越強(qiáng),如水鐵礦與軟錳礦,在不同的pH環(huán)境下其催化效率和產(chǎn)物也有差異[16]。此類通過(guò)土壤中自然存在的鐵錳氧化物對(duì)過(guò)氧化氫催化反應(yīng)的過(guò)程和機(jī)理已在之前的研究中得到了充分的論證[17]。試驗(yàn)土壤中鐵和錳的濃度分別為256及89 mgkg,向各樣品中加入的亞鐵離子濃度為168~872 mgkg,因此自然存在的鐵、錳濃度對(duì)反應(yīng)中催化金屬總量產(chǎn)生了重要的影響。可以合理推測(cè)本試驗(yàn)中,土壤中本身存在的鐵錳氧化物和試驗(yàn)中加入的亞鐵離子共同參與過(guò)氧化氫的催化反應(yīng)。本試驗(yàn)的目的是為了檢驗(yàn)不同藥量配比對(duì)過(guò)氧化氫氧化效果的影響,并未對(duì)土壤中的鐵錳氧化物的催化效果展開(kāi)定量調(diào)查,在此暫不討論土壤中存在的鐵錳氧化物對(duì)反應(yīng)的影響。
pH對(duì)過(guò)氧化氫在土壤中的催化反應(yīng)效率及過(guò)程有很大的影響。Huling等[18]發(fā)現(xiàn),降低反應(yīng)環(huán)境的pH可增加金屬離子的溶解度,從而促進(jìn)其在地下的遷移率和催化效率。Villa等[19]指出,在低pH的多孔介質(zhì)環(huán)境下,氧化劑和金屬氫氧化物的溶解度也同時(shí)得到提高。根據(jù)Beltran等[20]的總結(jié),在pH為3時(shí)羥基自由基能保持最大活性,同時(shí)可以讓鐵離子保持在溶液狀態(tài)中,因此大部分催化過(guò)氧化氫的小試和中試將反應(yīng)pH維持在2~4。然而由于地下土壤系統(tǒng)通常有良好的緩沖能力,pH一般維持在6~8而難以調(diào)節(jié)至酸性,因此也有部分研究關(guān)注pH在中性情況下氧化劑的性能[21-22]。
為測(cè)試調(diào)節(jié)污染土壤pH的工程可行性,試驗(yàn)測(cè)試了檸檬酸與土壤混合后pH的降低效果。當(dāng)向200 g土壤中加入80 mL 0.4 molL的檸檬酸,靜置12 h后,土壤pH由7.22降至5.72,達(dá)不到pH為2~4的目標(biāo)。說(shuō)明該場(chǎng)地土壤的緩沖能力強(qiáng),從工程經(jīng)濟(jì)的角度來(lái)考慮,實(shí)際工程中不使用檸檬酸來(lái)調(diào)節(jié)土壤pH,如有必要可使用鹽酸替代。
在催化過(guò)氧化氫反應(yīng)過(guò)程中生成的氧化基團(tuán),除了與土壤中的目標(biāo)污染物反應(yīng)外,還會(huì)與其他物質(zhì)發(fā)生反應(yīng),其中自然有機(jī)質(zhì)(NOM)為最主要的非目標(biāo)反應(yīng)物。土壤中的NOM會(huì)通過(guò)吸附污染物和催化劑,以及作為電子供體消耗氧化基團(tuán)等作用,降低過(guò)氧化氫的反應(yīng)活性和效率。本試驗(yàn)未對(duì)土壤中自然有機(jī)質(zhì)對(duì)過(guò)氧化氫的影響做進(jìn)一步的研究。在未來(lái)的研究中可通過(guò)比較氧化反應(yīng)前后土壤中總有機(jī)碳的含量差異,同時(shí)分析目標(biāo)污染物的去除率,來(lái)解釋氧化劑對(duì)目標(biāo)污染物的降解效率以及土壤中自然有機(jī)質(zhì)對(duì)氧化劑消耗的影響。
3 結(jié)論
(1)在催化過(guò)氧化氫與中性的石油烴污染土壤的反應(yīng)中,羥基自由基和超氧陰離子共同參與石油烴的氧化降解反應(yīng)。
(2)在工程中使用過(guò)氧化氫異位氧化石油烴污染物時(shí),應(yīng)當(dāng)將H2O2的濃度控制在0.50%~1.00%,以避免濃度過(guò)高導(dǎo)致氧化劑的快速降解。同時(shí),氧化劑與催化穩(wěn)定劑的比例不應(yīng)過(guò)低,其最佳摩爾比為75∶1~100∶1。
(3)當(dāng)過(guò)氧化氫消耗過(guò)快而使其與石油烴接觸時(shí)間降低時(shí),低碳數(shù)的石油烴分子將優(yōu)先于高碳數(shù)分子參與氧化反應(yīng)。在實(shí)際工程中可以根據(jù)總石油烴濃度及施工情況,來(lái)調(diào)節(jié)過(guò)氧化氫的用量和催化穩(wěn)定劑比例以優(yōu)化氧化處理效果。
[1] SIEGRIST R L,CRIMI M,SIMPKIN T J.In situ chemical oxidation for groundwater remediation[M].New York:Springer,2011:34.
[2] YANG X,XU X,XU J,et al.Iron oxychloride (FeOCl):an efficient Fenton-like catalyst for producing hydroxyl radicals in degradation of organic contaminants[J].Journal of the American Chemical Society,2013,135(43):16058-16061.
[3] WATTS R J,TEEL A L.Chemistry of modified Fenton’s reagent (catalyzed H2O2propagations-CHP) for in situ soil and groundwater remediation[J].Journal of Environmental Engineering,2005,131:612-622.
[4] KANG N,HUA I.Enhanced chemical oxidation of aromatic hydrocarbons in soil systems[J].Chemosphere,2005,61(7):909-922.
[5] 孫燕英,劉菲,陳鴻漢,等.H2O2氧化法修復(fù)柴油污染土壤[J].應(yīng)用化學(xué),2007,24(6):680-683. SUN Y Y,LIU F,CHEN H H,et al.Remediation of diesel-contaminated soil by hydrogen peroxide oxidation technology[J].Chinese Journal of Applied Chemistry, 2007,24(6):680-683.
[6] KREMBS F J.Critical analysis of the field-scale application of in situ chemical oxidation for the remediation of contaminated groundwater[D].Golden:Colorado School of Mines,2008.
[7] US EPA.Volatile organic compounds by gas chromatographymass spectrometry (GCMS):method 8260C[R].Washington DC:US EPA,2006.
[8] US EPA.Nonhalogenated organics by gas chromatograph:method 8015C[R].Washington DC:US EPA,2007.
[9] 魯如坤.土壤農(nóng)業(yè)化學(xué)分析方法[M].北京:農(nóng)業(yè)科技出版社,2000:50-54.
[10] de LAAT J,LE G T,LEGUBE B.A comparative study of the effects of chloride,sulfate,and nitrate ions on the rates of decomposition of H2O2and organic compounds by Fe(Ⅱ)H2O2and Fe(Ⅲ)H2O2[J].Chemosphere,2004,55:715-723.
[11] FURMAN O,LAINE D F,BLUMENFELD A,et al.Enhanced reactivity of superoxide in water-solid matrices[J].Environmental Science & Technology,2009,43:1528-1533.
[12] SMITH B A,TEEL A L,WATTS R J.Identification of the reactive oxygen species responsible for carbon tetrachloride degradation in modified Fenton’s systems[J].Environmental Science & Technology,2004,38:5465-5469.
[13] JUNG Y,PARK J,KO S,et al.Stabilization of hydrogen peroxide using phthalic acids in the Fenton and Fenton-like oxidation[J].Chemosphere,2013,90(2):812-819.
[14] USMAN M,HANNA K,HADERLAIN S.Fenton oxidation to remediate PAH in contaminated soils:a critical review of major limitations and counter-strategies[J].Science of the Total Environment,2016,569570:179-190.
[15] FERRARESE E,ANDREOTTOLA G,OPREA I A.Remediation of PAH-contaminated sediments by chemical oxidation[J].Journal of Hazardous Materials,2008,152:128-139.
[16] TEEL A L,FINN D D,SCHMIDT J T,et al.Rates of trace mineral-catalyzed decomposition of hydrogen peroxide[J].Journal of Environmental Engineering,2007,133:853-858.
[17] CAO M,WANG L,WANG L,et al.Remediation of DDTs contaminated soil in a novel Fenton-like system with zero-valent iron[J].Chemosphere,2012,90(8):2303-2308.
[18] HULING S G,PIVETZ B E.Engineering issue:in-situ chemical oxidation[R].Washington DC:US EPA Agency Office of Research and Development,2006:58.
[19] VILLA R D,TROVO A G,NOGUEIRA R F P.Environmental implication of soil remediation using the Fenton process[J].Chemosphere,2008,71:43-50.
[20] BELTRAN F J,GOZALEZ M,RIVAS F J,et al.Fenton reagent advanced oxidation of polynuclear aromatic hydrocarbon in water[J].Water,Air & Soil Pollution,1998,105:685-700.
[21] BURBANO A A,DIONYSIOU D D,SUIDAN M T,et al.Oxidation kinetics and effect of pH on the degradation of MTBE with Fenton reagent[J].Water Research,2005,39:107-118.
[22] KAN E,HULING S G.Effects of temperature and acidic pre-treatment on Fenton-driven oxidation of MTBE-spent granular activated carbon[J].Environmental Science & Technology,2009,43:1493-1499.□
Oxidizing capacity of catalyzed hydrogen peroxide to petroleum hydrocarbon contaminated soil
ZHANG Qiuzi1, WEI Yunxiao1, JIANG Yonghai2, WEI Xiaofei1, WANG Fuwang1
1.Beijing Construction Engineering Group Environmental Remediation Co., Ltd., Beijing 100015, China 2.Chinese Research Academy of Environmental Sciences, Beijing 100012, China
Regarding to the petroleum hydrocarbon polluted sites that are remediated with H2O2based ex-situ chemical oxidation, the oxidizing capacity and reactive process of catalyzed H2O2were studied with different H2O2mass fractions and oxidant to catalyststabilizer ratios. It is found that hydroxyl radical and superoxide anion are the major oxidation groups. The H2O2mass fraction of 0.50%-1.00% and the oxidant to catalyststabilizer ratio of 75∶1-100∶1 provide higher total petroleum hydrocarbon (TPH) degradation rate. The results demonstrated that high H2O2concentration and low oxidant to catalyststabilizer ratio may lead to rapid H2O2decomposition that reduce the contact time between oxidant and contaminant and decrease the oxidizing efficiency. In addition, it is also found when H2O2is under rapid decomposition, it tends to oxidize hydrocarbon molecules with less carbon number.
hydrogen peroxide; petroleum hydrocarbon; catalytic oxidation; degradation rate; soil remediation
2016-06-03
張秋子(1984—),女,碩士,主要從事污染場(chǎng)地修復(fù)技術(shù)研究,zhangqiuzi@bceer.com
*通信作者:韋云霄(1988—),男,博士,主要從事污染場(chǎng)地修復(fù)技術(shù)研究,weiyunxiao@bceer.com
X53
1674-991X(2017)01-0065-06
10.3969j.issn.1674-991X.2017.01.010
張秋子,韋云霄,姜永海,等.催化過(guò)氧化氫對(duì)石油烴污染土壤的氧化能力[J].環(huán)境工程技術(shù)學(xué)報(bào),2017,7(1):65-70.
ZHANG Q Z, WEI Y X, JIANG Y H, et al.Oxidizing capacity of catalyzed hydrogen peroxide to petroleum hydrocarbon contaminated soil[J].Journal of Environmental Engineering Technology,2017,7(1):65-70.

