苜蓿莖點霉對紫花苜蓿光合生理的影響
樊秦,李彥忠
(1.草地農(nóng)業(yè)生態(tài)系統(tǒng)國家重點實驗室,蘭州大學草地農(nóng)業(yè)科技學院,甘肅 蘭州 730020;2.甘肅中醫(yī)藥大學,甘肅 蘭州 730000;3.中國農(nóng)業(yè)科學院草原研究所,內(nèi)蒙古 呼和浩特 010010)
苜蓿莖點霉對紫花苜蓿光合生理的影響
樊秦1,2,李彥忠1,3*
(1.草地農(nóng)業(yè)生態(tài)系統(tǒng)國家重點實驗室,蘭州大學草地農(nóng)業(yè)科技學院,甘肅 蘭州 730020;2.甘肅中醫(yī)藥大學,甘肅 蘭州 730000;3.中國農(nóng)業(yè)科學院草原研究所,內(nèi)蒙古 呼和浩特 010010)
苜蓿莖點霉侵染紫花苜蓿后嚴重影響其產(chǎn)量和質(zhì)量。本研究采用植物生長室盆栽法,利用光合作用測量系統(tǒng)研究苜蓿莖點霉對紫花苜蓿葉片光合生理的影響。結果表明, 除侵染第27天外,苜蓿莖點霉使紫花苜蓿葉片凈光合速率(Pn)、氣孔導度(Gs)和蒸騰速率(Tr)降低,對胞間二氧化碳濃度(Ci)在侵染前期影響不大。在侵染至23 d,紫花苜蓿葉片光化學量子效率(Fv/Fm)、PSⅡ反應中心激發(fā)能捕獲效率(Fv′/Fm′)、PSⅡ反應中心電荷分離實際量子效率(ΦPSⅡ)、電子傳遞速率(ETR)、光化學猝滅系數(shù)(qP)和非光化學淬滅系數(shù)(qN)顯著降低。光補償點 (LCP)、CO2補償點(CCP)和羧化效率(CE)降低。表明苜蓿莖點霉通過降低紫花苜蓿葉片中光合電子傳遞率捕獲效率、非光化學猝滅系數(shù)(qN)和羧化效率(CE),而產(chǎn)生光抑制,使CO2的同化作用降低,影響紫花苜蓿的生長發(fā)育。
紫花苜蓿;苜蓿莖點霉;葉綠素熒光;光合響應曲線;CO2響應曲線
紫花苜蓿(Medicagosativa),豆科苜蓿屬植物,是世界種植面積最大的牧草,也是我國分布最廣的牧草。隨著苜蓿種植面積的擴大, 其病害也日益趨于嚴重。在紫花苜蓿葉部及莖部病害中,春季黑莖病是紫花苜蓿產(chǎn)量、種子產(chǎn)量和品質(zhì)變劣下降的主要因素。紫花苜蓿春季黑莖病, 又稱葉斑病或輪紋病,其病原菌為Phomamedicaginis(苜蓿莖點霉), 在美國溫帶地區(qū)、加拿大、澳大利亞、歐洲一些國家和南美洲都有報道,在我國吉林、甘肅、內(nèi)蒙古、河北、陜西和黑龍江也有報道[1-3]。這種病原最嚴重危害是對植株地上部分的危害,使葉變黃,脫落,病枝條上部常枯萎死亡,莖基腐,花序枯死,使苜蓿產(chǎn)量減少50%,同時也會影響種子產(chǎn)量,使種子不飽滿,皺縮。此外由于苜蓿莖點霉可造成根冠和根腐,它可減少牧草密度和可持續(xù)使用[4-6]。植物—病原菌互作是植物病理生理學研究的熱點問題之一,光合性能的強弱直接關系到植物抗病性[7],有些植物感病后會導致光合作用下降[8-14],但小麥(Triticumaestivum)葉銹病會使小麥光合速率提高并誘導蔗糖在病葉中積累[15]。因此,病原菌對光合作用的影響與其寄主有關。有研究表明苜蓿莖點霉可損害紫花苜蓿葉片光合系統(tǒng)Ⅱ[16],但對其光合生理指標的變化未進行系統(tǒng)研究。然而植物光合生理的變化是其生長發(fā)育抵抗生物脅迫的基礎。因此研究苜蓿莖點霉如何影響紫花苜蓿光合生理反應具有重要意義。本試驗以苜蓿莖點霉在不同時間侵染紫花苜蓿與對照相比,觀察苜蓿莖點霉對紫花苜蓿葉片光合特性的影響,以期為紫花苜蓿的選育、栽培、推廣和管理提供光合生理生態(tài)方面的科學依據(jù)。
1 材料與方法
1.1 試驗材料
1.1.1 供試品種 供試紫花苜蓿品種德寶由北京正道生態(tài)科技有限公司提供。
1.1.2 供試菌株 苜蓿莖點霉經(jīng)分離純化,并由蘭州大學草地農(nóng)業(yè)科技學院李彥忠教授鑒定所得(KP207577)。將莖點霉菌株在 PDA 平板上 25 ℃培養(yǎng) 30 d,待充分產(chǎn)孢后,加無菌水,經(jīng) 4 層無菌紗布過濾,除去菌絲體,配成孢子懸浮液(濃度為1.0×106個/mL) 備用。
1.2 試驗設計及取樣
以德寶紫花苜蓿為材料在甘肅中醫(yī)藥大學植物生長室進行盆栽。2015年3月6日播種于直徑為9 cm的花盆中,按照完全隨機區(qū)組設計將處理組和對照組各5盆,每盆播種6粒(苗),擺放在植物培養(yǎng)箱室中種植(15~25 ℃,14 h自然光照)。2015年6月25日試驗組用噴霧器進行病原菌噴霧接種,每盆植株以葉片正反面充分濕潤為宜,并避光保濕,對照組噴滅菌水同樣處理。第4天恢復光照,每2 d澆水一次,接種至第6天,葉片出現(xiàn)暗褐色至黑色近圓形或不規(guī)則形的小點,其發(fā)病癥狀與田間癥狀相同,對照植株未出現(xiàn)上述癥狀。病葉經(jīng)鏡檢及分離培養(yǎng)后,其病原菌鑒定為苜蓿莖點霉。7月1日進行光合相關參數(shù)測定,測定時選擇上部長勢一致,光照相似的相同葉位處測量3片葉片,測量3株,每個葉片均測定5次。病葉侵染嚴重度分級,見表1。苜蓿莖點霉對紫花苜蓿葉片在不同侵染時間的侵染嚴重程度,見圖1。
1.3 試驗測定指標及方法
1.3.1 光合參數(shù)的測定 光合測定時間2015年7月1日至7月23日開始于每日上午9:00-12:00時測定。測定系統(tǒng)為LI-6400XT便攜式光合作用測量系統(tǒng)和6400-02B紅藍光源葉室測定,測定光強為1000 μmol/(m2·s)。測定Pn(光合速率)、Gs(氣孔導度)、Ci(胞間二氧化碳濃度)和Tr(蒸騰速率)。測定時選擇上部長勢一致,光照相似的相同葉位處測量3片葉片,測量3株,每個葉片均測定5次,讀取數(shù)據(jù)。
1.3.2 葉綠素熒光參數(shù)測定 采用LI-6400XT便攜式光合作用測量系統(tǒng)和6400-40熒光葉室進行測定,于2015年7月13日至7月23日開始于每日7:00前對葉片進行標記,采用錫紙包裹,避光處理30 min,進行暗反應, 測定其F0(the fluorescence parameters of the minimum initial fluorescence, 最小初始熒光)和Fv/Fm(photochemical quantum efficiency, 光化學量子效率),當日上午10:00打開活化光源,進行光反應,將葉片加入葉室,測定光適應狀態(tài)下葉片的Fv′/Fm′ (PSⅡ reaction center of excitation energy capture efficiency, 光下開放的PSⅡ反應中心的激發(fā)能捕獲效率)、ΦPSⅡ(the relative quantum efficiency of PSⅡ photochemistry, PSⅡ反應中心電荷分離實際量子效率)、ETR (electron transport rate, 電子傳遞速率)、qP(photochemical quenching, 光化學猝滅系數(shù))和qN(nonphotochemical quenching, 非光化學猝滅系數(shù))。測定時選擇上部長勢一致,光照相似的相同葉位處測量3片葉片,測量3株,每個葉片均測定5次,讀取數(shù)據(jù)。

表1 病葉侵染嚴重度分級Table 1 The disease severity level of M. sativa infected by P. medicaginis
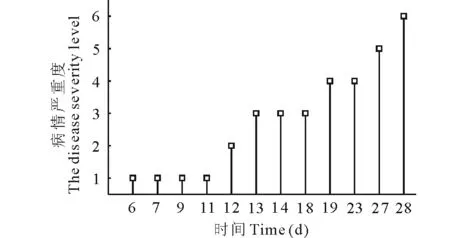
圖1 在不同侵染時間苜蓿莖點霉對紫花苜蓿侵染的嚴重度Fig.1 The disease severity level of M. sativa infected by P. medicaginis at different infection time
1.3.3 光響應曲線測定 于2015 年7月21 日9:00-12:00, 采用LI-6400XT便攜式光合作用測量系統(tǒng)和6400-02B紅藍光源葉室測定。對紫花苜蓿對照組和試驗組葉片(嚴重度5級)進行光響應曲線的測定。測定時將CO2濃度控制在(500±1) μmol CO2/mol。在光合有效輻射分別為2000, 1800, 1800, 1600, 1400, 1200, 1000, 800, 600, 400, 300, 200, 150, 120, 100, 80, 60, 40, 20, 10, 0 μmol/(m2·s) 下進行測定,凈光合速率(Pn)為0時的光強為光補償點(light compensation point,LCP),凈光合速率最大時的光強為光飽和點(light saturation point,LSP)。采用光合計算軟件計算光補償點、光飽和點、最大凈光合速率(maximum net photosynthetic rate,Pnmax)以及表觀量子效率(apparent quantum yield,AQY)。
1.3.4 CO2響應曲線的測定 于2015年7月22日采用LI-6400XT便攜式光合作用測量系統(tǒng)和6400-02B紅藍光源葉室測定CO2響應曲線。測定時設定光強為1000 μmol/(m2·s),采用Li-6400液化CO2鋼瓶提供不同的CO2濃度,對紫花苜蓿對照組和試驗組葉片(嚴重度5級)進行CO2響應曲線的測定。分別在CO2濃度為0, 60, 80, 100, 120, 150, 200, 400, 600, 800, 1000, 1200, 1400, 1600, 1800, 2000 μmol CO2/mol的條件下測定葉片Pn,然后采用光合計算軟件計算參數(shù):最大凈光合速率(Pnmax)、核酮糖-1,5-二磷酸(Rubp)羧化效率(CE)、CO2飽和點(CSP)、CO2補償點(CCP)和光呼吸速率(Rp)。
1.4 統(tǒng)計與分析
用SPSS 21.0 for windows統(tǒng)計軟件對數(shù)據(jù)進行統(tǒng)計分析,進行t檢驗分析 (*P<0.05,**P<0.01),數(shù)據(jù)均為平均值±標準誤(means±SE)。用Origin 8.5作圖。
2 結果與分析
2.1 苜蓿莖點霉對紫花苜蓿氣體交換參數(shù)的影響
2.1.1 苜蓿莖點霉對紫花苜蓿凈光合速率(Pn)的影響 由圖2A可見,試驗組病葉隨著病情嚴重度加重,Pn值并沒呈下降趨勢,而是呈波浪形浮動。在不同侵染時間與對照組比均降低并具顯著性差異,Pn在葉片接菌后不同侵染時間較對照組降低幅度大多在20%~45%之間,接菌第11和27天降低幅度最小,為6.0%左右,接菌第13和23天降低幅度大,分別為55.08%和63.21%。 說明苜蓿莖點霉能夠影響紫花苜蓿的凈光合速率。
2.1.2 苜蓿莖點霉對紫花苜蓿胞間二氧化碳濃度(Ci)的影響 由圖2B可見,除侵染第27天外,試驗組Ci在不同侵染時間變化幅度較小。與對照組相比,Ci值在感染后第9、14、19天比對照組高3.07%~7.38%,但沒有顯著性差異。感染至第27天降低幅度最大,為53.31%。說明苜蓿莖點霉會影響紫花苜蓿對二氧化碳的吸收利用。
2.1.3 苜蓿莖點霉對紫花苜蓿氣孔導度(Gs)的影響 由圖2C可見,試驗組Gs最大值在侵染第18和19天,侵染至第28天時Gs降至最低。與對照組相比,在不同侵染時間Gs均降低并呈顯著性差異,侵染第19天Gs較對照組降低幅度最小,為11.60%,降低幅度為70%以上的為侵染至第13、27和28天。表明苜蓿莖點霉可使紫花苜蓿葉片氣孔導度降低。
2.1.4 苜蓿莖點霉對紫花苜蓿蒸騰速率(Tr)的影響 由圖2D可見,試驗組在侵染第19天Tr值最大,在第28天Tr值最小。與對照組相比, 在不同侵染時間Tr值均降低,并呈顯著性差異。病葉較對照組在不同侵染時間降低多在20%~50%,降低幅度在55%以上的為侵染第13天降低59.16%,侵染第27天降低70.50%,第28天降低69.00%。說明苜蓿莖點霉可通過降低氣孔導度降低紫花苜蓿蒸騰速率。
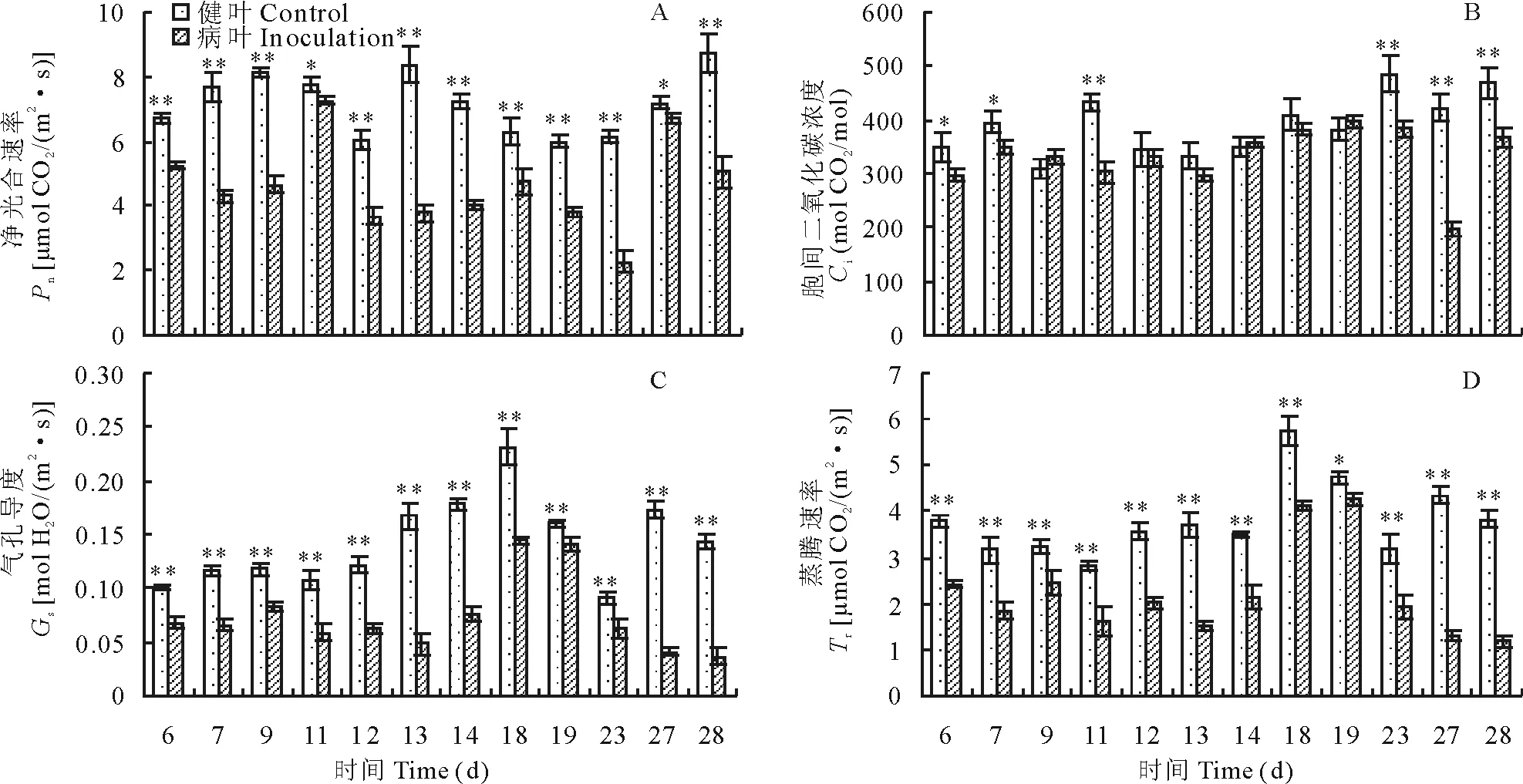
圖2 苜蓿莖點霉對紫花苜蓿葉片光合速率、胞間CO2濃度、氣孔導度和蒸騰速率的影響Fig.2 Effect of P. medicaginis on the photosynthetic rate (Pn), CO2 concentration (Ci), stomatal conductance (Gs) and transpiration rate (Tr) of M. sativa leaves*P<0.05,**P<0.01.下同。The same below.
2.2 苜蓿莖點霉脅迫對紫花苜蓿葉綠素熒光動力學參數(shù)的影響
葉綠素熒光參數(shù)與光合作用的各種反應密切相關,任何逆境脅迫對光合作用的影響都可以通過葉綠素熒光動力學反映出來。葉綠素熒光是光合作用變化的探針,通過對各種熒光動力學參數(shù)的分析可以獲知有關光能利用途徑的信息[17]。
2.2.1 苜蓿莖點霉對紫花苜蓿初始熒光(F0)的影響F0是光照下最小初始熒光,又稱基底熒光或暗熒光。指植物經(jīng)過充分暗適應的光合機構光系統(tǒng)Ⅱ(PSⅡ)反應中心全部開放時的葉綠素熒光發(fā)射強度,主要與PSⅡ天線色素內(nèi)的最初激子密度及葉綠素含量有關,而與光合作用的光化學無關[18]。由圖3A可見,試驗組F0值均低于對照組,與對照組比F0值降低最小幅度為侵染第27天,降低5.92%,最大降低幅度為感染第18天,降低46.75%。
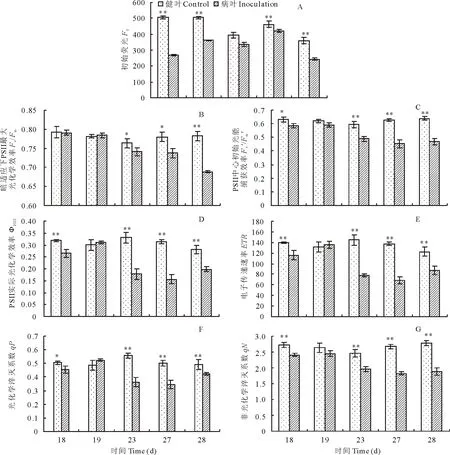
圖3 苜蓿莖點酶對紫花苜蓿葉片葉綠素熒光動力學參數(shù)的影響Fig.3 Effect of P. medicaginis on chlorophyll fluorescence kinetics parameters of M. sativa leaves
2.2.2 苜蓿莖點霉對紫花苜蓿光化學量子效率(Fv/Fm)的影響Fv/Fm表示葉片沒有遭受任何脅迫并經(jīng)過充分暗適應,其PSⅡ最大光能轉(zhuǎn)化效率,也被稱為開放的PSⅡ反應中心能量捕獲效率,反映了PSⅡ反應中心原初光能轉(zhuǎn)化效率。持續(xù)穩(wěn)定的Fv/Fm值表明PSⅡ未受到損害[18]。由圖3B可見,對照組在不同測定時間保持持續(xù)穩(wěn)定(P<0.05),試驗組Fv/Fm隨著侵染程度的加重逐漸降低,侵染至第23天時Fv/Fm值呈顯著性降低,侵染至第28天時降為最低,較對照組降低11.93%。表明隨著苜蓿莖點霉對紫花苜蓿葉片損害程度的加重,紫花苜蓿葉片PSⅡ受損加重。
2.2.3 苜蓿莖點霉對紫花苜蓿PSⅡ反應中心激發(fā)能捕獲效率(Fv′/Fm′)的影響Fv′/Fm′表示光存在時PSⅡ反應中心初始光能捕獲效率。由圖3C可見,各對照組間Fv′/Fm′值無顯著性差異(P>0.05)。試驗組隨著侵染程度的加深Fv′/Fm′值逐漸降低,在侵染第23天時Fv′/Fm′值呈顯著性降低。除侵染第19天外,試驗組較對照組Fv′/Fm′均呈顯著性降低,最小降低為侵染至第19天,為4.64%,最大降低為侵染至第27天,為27.70%。
2.2.4 苜蓿莖點霉對紫花苜蓿PSⅡ反應中心電荷分離實際量子效率(ΦPSⅡ)和電子傳遞速率(ETR)的影響ΦPSⅡ是指當光存在時PSⅡ反應中心電荷分離實際量子效率,反映被用于光化學途徑激發(fā)能占進入PSⅡ總激發(fā)能的比例,是植物光合能力的一個重要指標。ETR反映實際光強條件下的表觀電子傳遞效率[19]。由圖3D和圖3E可見,試驗組ΦPSⅡ和ETR在感染第19天分別較對照組高2.97%和3.04%,但無顯著性差異,侵染至第23天后ΦPSⅡ和ETR顯著下降,接種第27天降低幅度較對照組最大,分別為50.18%和50.24%。表明植物光化學激發(fā)能和光合電子傳遞速率由于苜蓿莖點霉的影響而降低和變慢。
2.2.5 熒光猝滅動力學 光化學淬滅系數(shù)qP表示PSⅡ反應中心開放程度,反映PSⅡ天線色素吸收的光能用于光化學電子傳遞的份額,qP愈大,PSⅡ的電子傳遞活性愈大,反映光合活性的高低[20]。非光化學淬滅系數(shù)qN代表PSⅡ天線色素吸收的光能不能用于光化學電子傳遞而被用于非光化學反應的程度。由圖3F可見,對照組qP相差不大,試驗組各值相差較大。在苜蓿莖點霉侵染至第19天時qP值高于對照組,但沒有顯著性差異,在侵染至第23天時qP值呈顯著性下降,在侵染第27天達到最小值,較對照組降低最大幅度為第23天,為34.85%。qP下降說明 PSⅡ中的質(zhì)體醌(QA)氧化態(tài)數(shù)量減少,導致 PSⅡ反應中心開放部分比例降低,使QA向泛醌(QB)光合電子傳遞受到抑制。表明苜蓿莖點霉使紫花苜蓿葉片PSⅡ反應開放比例降低。
由圖3G可見,對照組qN值相差較小,試驗組葉片在侵染第23天開始qN值顯著降低,除侵染第19天,qN值均顯著低于對照組,與對照組比降低最小幅度在侵染第19天,為7.06%,侵染第28天最大降低幅度為32.34%。表明隨著苜蓿莖點霉侵染程度的加重,紫花苜蓿葉片電子傳遞和熱耗散能力最終均降低,病葉熱耗散降低。
2.3 苜蓿莖點霉脅迫對光響應曲線和CO2響應曲線的影響
2.3.1 對光響應參數(shù)的影響 苜蓿莖點霉侵染紫花苜蓿葉片后,在不同光照強度下病葉和健葉光響應曲線變化有差異。從圖4A可以看出,在0~120 μmol CO2/(m2·s)的光強范圍內(nèi),病葉中凈光合速率幾乎呈線性增長,在120~1400 μmol CO2/(m2·s)光強范圍內(nèi)凈光合速率的增長處于極緩慢狀態(tài),在光強為1600~2000 μmol CO2/(m2·s)時凈光合速率開始下降,說明病葉在一定的光照強度下,葉片光合作用處于抑制狀態(tài)。健葉在0~800 μmol CO2/(m2·s)的光強范圍內(nèi),葉片中凈光合速率幾乎呈線性增長,800~2000 μmol CO2/(m2·s)光強范圍內(nèi)凈光合速率的增長處于極緩慢狀態(tài)。用雙曲線修正模型擬合并計算參數(shù):光補償點、光飽和點、最大凈光合速率以及表觀量子效率。由表2可見,苜蓿莖點霉侵染紫花苜蓿葉片后,使葉片光飽和點、光補償點、最大凈光合速率和暗呼吸速率均顯著性低于健葉(P<0.05),表觀量子效率大于健葉,但無顯著性差異。說明苜蓿莖點霉的侵染使紫花苜蓿葉片適于在弱光下生長,對強光產(chǎn)生抑制[21]。
2.3.2 對CO2響應參數(shù)的影響 CO2濃度對健葉和病葉光合作用有顯著影響,CO2響應曲線變化有差異。從圖4B可以看出,在0~600 μmol CO2/mol的濃度范圍內(nèi),病葉凈光合速率幾乎呈線性增長,在800~1800 μmol CO2/mol濃度范圍內(nèi)凈光合速率基本維持穩(wěn)定,在光強為1800~2000 μmol CO2/mol時凈光合速率逐漸下降,健葉在0~1000 μmol CO2/mol的濃度范圍內(nèi),凈光合速率幾乎呈線性增長,1000~2000 μmol CO2/mol濃度范圍內(nèi)凈光合速率處于緩慢增長狀態(tài)。用雙曲線修正模型擬合并計算參數(shù):最大凈光合速率、核酮糖-1,5-二磷酸(Rubp)羧化效率、CO2飽和點、CO2補償點和光呼吸速率。由表2可見,苜蓿莖點霉侵染紫花苜蓿葉片后,試驗組葉片Pnmax、CE和CSP都顯著低于對照組,CCP和Rp顯著高于對照組。紫花苜蓿侵染后適于病葉在一定的CO2濃度下,葉片的凈光合速率被抑制。苜蓿莖點霉侵染紫花苜蓿葉片后使其Rubp羧化效率減低,在一定高CO2濃度下,產(chǎn)生光合抑制。

圖4 苜蓿莖點霉對紫花苜蓿葉片光合響應曲線和CO2響應曲線的影響Fig.4 Effect of P. medicaginis on photosynthetic response curves and the CO2 response curve of M. sativa leaves

參數(shù)Parameters樣品Samples健葉Control病葉Inoculation光飽和最大凈光合速率Thelightsaturationmaxnetphotosyntheticrate[Pnmax,μmolCO2/(m2·s)]8.4654±0.1391a3.5123±0.1008b表觀量子效率Apparentquantumyield[AQY,μmolCO2/(m2·s)]0.0324±0.0035a0.0447±0.0039a光飽和點Thelightsaturationpoint[LSP,μmol/(m2·s)]2066.2562±38.6887a1278.4824±271.1648b光補償點Thelightcompensationpoint[LCP,μmol/(m2·s)]19.5365±0.3059a12.6252±0.2342b暗呼吸速率Darkrespirationrate[Rd,μmolCO2/(m2·s)]0.6007±0.0560a0.5042±0.0427aCO2飽和最大凈光合速率CO2saturationmaxnetphotosyntheticrate[Pnmax,μmolCO2/(m2·s)]18.2413±0.3161a10.7427±0.2741bRubp羧化效率Rubpcarboxylationefficiency[CE,μmolCO2/(m2·s)]0.0643±0.0034a0.0361±0.0034bCO2飽和點CO2saturationpoint(CSP,μmolCO2/mol)2041.9194±60.2874a1441.5865±13.0886bCO2補償點CO2compensationpoint(CCP,μmolCO2/mol)4.9983±0.2863b32.6146±0.2548a光呼吸速率Photorespirationrate[Rp,μmolCO2/(m2·s)]0.3154±0.0093b1.1097±0.1044a
注:同行數(shù)據(jù)后不同小寫字母表示在P=0.05水平差異顯著(Studentt檢驗)。
Note: The different lowercase letters in the same line stand for significant differences atP=0.05 level (Studentttest).
3 討論
3.1 對光合和葉綠素熒光的作用
植物受到脅迫導致光合作用下降,分為氣孔因素和非氣孔因素。氣孔限制是由于氣孔關閉,阻斷植物CO2的供應,造成植物光合作用下降[22]。非氣孔限制包括光合器官的破壞和抑制,光合磷酸化解偶聯(lián),暗反應酶系失活和細胞質(zhì)膜的破壞等,即使提供足夠的CO2,光合作用仍然不能正常運行[23]。本研究發(fā)現(xiàn),苜蓿莖點霉侵染造成紫花苜蓿葉片凈光合速率(Pn)降低,氣孔導度(Gs)下降,但胞間CO2濃度(Ci)除侵染第27天急劇下降外基本變化不大。當參數(shù)Gs與Ci以同樣趨勢下降時,才能確定Pn的降低是由氣孔因素造成的[24]。由此可見,本研究中Pn降低是由非氣孔因素造成。
在苜蓿莖點霉侵染初期,紫花苜蓿葉片ΦPSⅡ、qP和ETR會有不同程度升高,說明苜蓿莖點霉侵染后使PSⅡ反應中心開放部分比例加大, 增加葉片PSⅡ光合電子傳遞能力。光合作用的電子傳遞與形成ATP的光合磷酸化相偶聯(lián),這將有助于為光合碳同化提供更充足的ATP和NADPH。但隨著病情逐漸嚴重,在侵染至23 d,ΦPSⅡ、qP、ETR和Fv′/Fm′顯著降低,導致NADPH降低,使光合電子傳遞率降低,光學活性降低,使光合作用受到抑制[25-27],qN在苜蓿莖點霉侵染后降低,使反應葉片吸收的光能散熱減少,最終加重對光合系統(tǒng)Ⅱ的損傷。苜蓿莖點霉侵染紫花苜蓿后其葉片PSⅡ的光化學效率Fv/Fm降低,說明侵染使PSⅡ的結構和功能都受到損傷,葉綠體把所捕獲的光能轉(zhuǎn)化為化學能的效率降低,使光合碳同化所需ATP合成減少。F0初始熒光降低是由非光化學能量耗散而引起的,具保護作用。
3.2 對光響應曲線的作用
光照強度對植物的光合特性有顯著影響[28],植物葉片光飽和點與光補償點反映了植物對光照條件的要求,病葉光補償點LCP和光飽和點LPS低于健葉,AQY高于健葉但無顯著性差異,說明苜蓿莖點霉侵染葉片后,使紫花苜蓿葉片結構和生理功能發(fā)生變化,使葉片中防御強光破壞的保護機制減弱,如葉黃素循環(huán)的熱耗散和活性氧清除能力降低,使其適用于弱光。病葉光合作用的飽和光強大大低于健康葉片,因此當暴露在強光下時,出現(xiàn)光合作用的光抑制作用甚至可能有光氧化和光破壞。病葉暗呼吸速率(Rd)低于健葉,說明其對CO2在光下被重新回收利用率降低[29-31]。
3.3 對CO2響應曲線的影響
植物的光合速率受植物體內(nèi)葉綠體的光合速率和CO2供應控制,苜蓿莖點霉侵染紫花苜蓿后,紫花苜蓿葉片CCP升高,CSP降低使葉片CO2利用幅度變窄,凈光合速率降低,影響植物生長。葉片最大羧化速率是表征植物光合能力的重要參數(shù),是光合作用過程中羧化反應這一重要限速反應的速率,對光合速率起著決定作用,提高葉片最大羧化速率是提高光能利用率的關鍵[32]。植物葉片羧化效率是光合速率與CO2濃度的比值,反映核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco) 的活性大小及含量多少,Rubisco 活性越大,含量越高,羧化效率就越高,它決定植物的最大凈光合速率(Pnmax)、暗呼吸速率(Rd)和光呼吸速率(Rp)等過程[33-34]。苜蓿莖點霉侵染紫花苜蓿葉片后, Rubp羧化效率(CE)較對照組降低,其可能原因是紫花苜蓿葉片被苜蓿莖點霉侵染后,其葉片內(nèi)部構造發(fā)生重排,葉片葉綠素含量、Rubisco 含量開始減少,葉片最大羧化速率隨之下降[35-36]。
4 結論
苜蓿莖點霉侵染紫花苜蓿后,使其光合作用降低,為非氣孔因素。苜蓿莖點霉可降低紫花苜蓿葉片中光合電子傳遞捕獲速率、非光化學猝滅系數(shù)(qN)和羧化效率(CE),產(chǎn)生光抑制,并使CO2的同化作用降低,加重對PSⅡ的損害進而影響植物生長。但隨著葉片病情的加重,光合作用并未迅速降低,而是呈波浪形浮動,說明在苜蓿莖點霉侵染紫花苜蓿后,寄主也產(chǎn)生一些防御機制,同時病原菌為其生存也會改變植物的生理生化過程,因此還需從植物與光合作用有關的碳代謝、氮代謝、次生代謝產(chǎn)物及抗病蛋白基因表達等方面進行更深入研究。
References:
[1] Liu R. Alfalfa spring black stem. Grassland and Turf, 1986, (4): 1-6. 劉若. 苜蓿春季黑莖病(輪紋病). 草原與草坪, 1986, (4): 1-6.
[2] Nan Z B. New record of forage fungus disease in China. Pratacultural Science, 1986, 3(2): 61-63. 南志標. 國內(nèi)牧草真菌病害新記錄. 草業(yè)科學, 1986, 3(2): 61-63.
[3] Xue F X. Grass Pathology[M]. Third edition. Beijing: China Agricultural Press, 2008: 110-111. 薛福祥. 牧草病理學[M]. 第3版. 北京: 中國農(nóng)業(yè)出版社, 2008: 110-111.
[4] Barbetti M J, Nichols P G H. Effect ofPhomamedicaginisandLeptosphaerulinatrifoliion herbage and seed yield and coumestrol content of annualMedicagospecies. Phytophylactica, 1991, 23: 223-227.
[5] Rodriguez R, Leath K T, Hill R R. Pathogenicity ofPhomamedicaginisvar.medicaginisto roots of alfalfa. Plant Disease, 1990, 7(9): 680-683.
[6] Rodriguez R, Leath K T. Pathogenicity ofPhomamedicaginisvar.medicaginisto crowns of alfalfa. Plant Disease, 1992, 7(6): 1237-1240.
[7] Yang Z X, Ding Y F, Zhang X Q,etal. Impacts ofAlternariaalternatastress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances. Acta Ecologica Sinica, 2015, 35(12): 4146-4154. 楊志曉, 丁燕芳, 張小全, 等. 赤星病脅迫對不同抗性煙草品種光合作用和葉綠素熒光特性的影響. 生態(tài)學報, 2015, 35(12): 4146-4154.
[8] Sasaki Y, Asamizu E, Shibata D,etal. Monitoring of methyl jasmonate-responsive genes inArabidopsisby cDNA macroarray: self-activation of jasmonic acid biosynthesis and crosstalk with other phytohormone signaling pathways. DNA Research, 2001, 8: 153-161.
[9] Macedo T B, Bastos C S, Higley L G,etal. Photosynthetic responses of soybean to soybean aphid (Homoptera: Aphididae) injury. Journal of Economic Entomology, 2003, 96(1): 188-193.
[10] Scharte J, Sch?n H, Weis E. Photosynthesis and carbohydrate metabolism in tobacco leaves during an incompatible interaction withPhytophthoranicotianae. Plant Cell and Environment, 2005, 28(11): 1421-1435.
[11] Aldea M, Hamilton J G, Resti J P,etal. Comparison of photosynthetic damage from arthropod herbivory and pathogen infection in understory hardwood samplings. Oecologia, 2006, 149: 221-232.
[12] Swarbrick P J, Schulze-Lefert P, Scholes J D. Metabolic consequences of susceptibility and resistance in barley leaves challenged with powdery mildew. Plant Cell and Environment, 2006, 299(6): 1061-1076.
[13] Shimizu T, Satoh K, Kikuchi S,etal. The repression of cell wall- and plastid-related genes and the induction of defense-related genes in rice plants infected with rice dwarf virus. Molecular Plant-Microbe Interactions, 2007, 20(3): 247-254.
[14] Nabity P D, Zavala J A, DeLucia E H. Indirect suppression of photosynthesis on individual leaves by arthropod herbivory. Annals of Botany, 2009, 103: 655-663.
[15] Chang Q, Liu J, Wang Q L,etal. The effect ofPucciniastriiformisf. sp.triticion the levels of water-soluble carbohydrates and the photosynthetic rate in wheat leaves. Physiological and Molecular Plant Pathology, 2013, 84(1): 131-137.
[16] Hwang S F, Wang H, Gossen B D,etal. Impact of foliar diseases on photosynthesis, protein content and seed yield of alfalfa and efficacy of fungicide application. European Journal of Plant Pathology, 2006, 115: 389-399.
[17] Zhao H J, Zou Q, Yu Z W. Chlorophyll fluorescence analysis technique and its application to photosynthesis of plant. Journal of Henan Agricaltural University, 2000, 34(3): 248-251. 趙會杰, 鄒琦, 于振文. 葉綠素熒光分析技術及其在植物光合機理研究中的應用. 河南農(nóng)業(yè)大學學報, 2000, 34(3): 248-251.
[18] Bai J J, Wu J W, Li J Y,etal. Effects of drought stress on chlorophyll fluorescence parameters of two fast-growing tree species. Journal of South China Agricultural University, 2015, 36(1): 85-90. 白晶晶, 吳俊文, 李吉躍, 等. 干旱脅迫對2種速生樹種葉綠素熒光特性的影響. 華南農(nóng)業(yè)大學學報, 2015, 36(1): 85-90.
[19] Xu W H, Wu F Z, Wang Z G,etal. Response of photosynthetic characteristics and disease resistance of watermelon to companion with wheat. Chinese Journal of Eco-Agriculture, 2014, 22(6): 655-660. 徐偉慧, 吳鳳芝, 王志剛, 等. 連作西瓜光合特性及抗病性對小麥伴生的響應. 中國生態(tài)農(nóng)業(yè)學報, 2014, 22(6): 655-660.
[20] Huang W, Zhang X G. Effect of potassium nutrition on photosynthesis and yield of pellicle melon. Chinese Journal of Soil and Fertilizer, 2009, (2): 23-26. 黃偉, 張曉光. 鉀素對薄皮甜瓜光合作用和產(chǎn)量的影響. 中國土壤與肥料, 2009, (2): 23-26.
[21] Zhu J J, Liu Z G, Wang H X. Obstacles for natural regeneration ofLarixolgensisplantations on montane regions of eastern Liaoning Province, China. Chinese Journal of Applied Ecology, 2008, 19(4): 695-703. 朱教君, 劉足根, 王賀新. 遼東山區(qū)長白山落葉松人工林天然更新障礙分析. 應用生態(tài)學報, 2008, 19(4): 695-703.
[22] Helena S, Sarka S, Renata S. Effects of biotic stress caused by potato virus Y on photosynthesis inipttransgenic and controlNicotianatabacumL. Plant Science, 2006, 171(5): 607-616.
[23] Weng X Y, Jiang D A. Influence of enzymes and relative factors on diurnal variation of photosynthetic rate in rice. Journal of Biomathematics, 1999, 14(4): 495-500. 翁曉燕, 蔣德安. 影響水稻光合日變化的酶和相關因素的分析. 生物數(shù)學學報, 1999, 14(4): 495-500.
[24] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiolog, 1982, 33: 317-345.
[25] Chou H M, Bundock N, Rolfe S A,etal. Infection ofArabidopsisthalianaleaves withAlbugocandida(white blister rust) causes a reprogramming of host metabolism. Molecular Plant Pathology, 2000, 1(2): 99-113.
[26] Tang X, Rolfe S A, Scholes J D. The effect ofAlbugocandida(white blister rust) on the photosynthetic and carbohydrate metabolism of leaves ofArabidopsisthaliana. Plant Cell and Environment, 1996, 19(8): 967-975.
[27] Walters D R, McRoberts N. Plants and biotrophs: a pivotal role for cytokinins. Trends in Plant Science, 2006, 11(12): 581-586.
[28] Bj?rkman O, Holmgren P. Photosynthetic adaptation to light intensity in plants native to shaded and exposed habitats. Physiologia Plantarum, 1996, 19(3): 854-859.
[29] Kang H J, Li H, Quan W,etal. Causes of decreasing mitochondrial respiration under light in four crops. Chinese Journal of Plant Ecology, 2014, 38(10): 1110-1116. 康華靖, 李紅, 權偉, 等. 四種作物光下暗呼吸速率降低的原因. 植物生態(tài)學報, 2014, 38(10): 1110-1116.
[30] Xu D Q, Zhang Y Z. Photo-inhibition of photosynthesis in plants. Plant Physiology Communications, 1992, 28(4): 237-243. 許大全, 張玉忠. 植物光合作用的光抑制. 植物生理學通訊, 1992, 28(4): 237-243.
[31] Demmig-Adams B, Adams III W W. Photo-protection and other responses of plants to high light stress. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43: 599-626.
[32] Gao Z, Zhang R X, Fang M. Advances on mechanisms of senescence of ribulose-1,5-bisphosphate carboxylase/oxygenase and photosynthetic electron transport chain in plant. Journal of Nanjing Agricultural University, 1995, 18(2): 26-33. 高忠, 張榮銑, 方敏. 植物葉片中RuBP羧化酶/加氧酶及光反應機構衰老機理的研究進展. 南京農(nóng)業(yè)大學學報, 1995, 18(2): 26-33.
[33] Farquhar G D, Von Caemmerer S, Berry J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3 species. Planta, 1980, 149(1): 78-90.
[34] Wullschleger S D. Biochemical limitations to carbon assimilation in C3 plants-A retrospective analysis of the A/Cicurves from 109 species. Journal of Experimental Botany, 1993, 44(5): 907-920.
[35] Teng W L, Han Y P, Li W B. Marginal effect index on the yield characters of soybean cultivars with different leaf shape. Soybean Science, 2008, 27(3): 420-422. 滕衛(wèi)麗, 韓英鵬, 李文濱. 不同葉形大豆品種產(chǎn)量性狀邊際效應指數(shù)分析. 大豆科學, 2008, 27(3): 420-422.
[36] Gao Z Q, Feng S Z, Li T H,etal. Comparisons of anatomical structure, component and photosynthetic capacity of leaves at different apple canopy positions. Chinese Journal of Eco-Agriculture, 2010, 18(6): 1245-1250. 高照全, 馮社章, 李天紅, 等. 蘋果樹冠不同部位葉片結構、內(nèi)含物和模擬光合能力的比較. 中國生態(tài)農(nóng)業(yè)學報, 2010, 18(6): 1245-1250.
The effect of Phoma medicaginis on the photosynthetic physiology of Medicago sativa
FAN Qin1,2, LI Yan-Zhong1,3*
1.StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China; 2.GansuUniversityofChineseMedicine,Lanzhou730000,China; 3.InstituteofGrasslandResearch,ChineseAcademyofAgriculturalSciences,Hohhot010010,China
The yield and quality ofMedicagosativaare seriously affected by the fungal pathogenPhomamedicaginis. A study has been undertaken using growth chamber pot experiments and the LI-6400/XT photosynthesis measurement system to investigate the effects of this pathogen on the photosynthetic physiology ofM.sativa. The results showed that until 27 days post-inoculation (dpi) the net photosynthetic rate (Pn), stomatal conductance (Gs) and transpiration rate (Tr) ofM.sativawere reduced byP.medicaginisinfection. In the early stages of infection there were little changes in intercellular CO2concentration (Ci) in the leaves. By 23 dpi, infected leaves showed significant reductions in photochemical quantum efficiency (Fv/Fm), PSⅡ reaction center of excitation energy capture efficiency (Fv′/Fm′), the relative quantum efficiency of PSⅡ photochemistry (ΦPSⅡ), electron transfer rate (ETR), photochemical quenching (qP) and non-photochemical quenching (qN). Light compensation point, CO2compensation point and carboxylation efficiency (CE) also decreased. The results indicate that the photosynthetic electron transfer rate and capture efficiency, non-photochemical quenching (qN), and carboxylation efficiency (CE) decreased in leaves infected byP.medicaginis, leading to light suppression and a decrease in the assimilation of CO2that affect the growth and development ofM.sativa.
Medicagosativa;Phomamedicaginis; chlorophyll fluorescence; photosynthesis response curve; CO2response curve
10.11686/cyxb2016275
http://cyxb.lzu.edu.cn
2016-07-14;改回日期:2016-09-20
公益性行業(yè)(農(nóng)業(yè))科研專項(201303057),國家牧草產(chǎn)業(yè)技術體系(CARS-35)和國家自然科學基金(31272496)資助。
樊秦(1976-), 女, 重慶酉陽人,副教授,在讀博士。E-mail:fanqin408@126.com*通信作者Corresponding author. E-mail:liyzh@lzu.edu.cn
樊秦, 李彥忠. 苜蓿莖點霉對紫花苜蓿光合生理的影響. 草業(yè)學報, 2017, 26(1): 112-121.
FAN Qin, LI Yan-Zhong. The effect ofPhomamedicaginison the photosynthetic physiology ofMedicagosativa. Acta Prataculturae Sinica, 2017, 26(1): 112-121.

