碳包覆改性制備高倍率性能的鋰離子電池正極材料LiNi1/3Co1/3Mn1/3O2
鄭卓郭孝東吳振國向偉滑緯博鐘本和楊秀山*,
(1四川大學高分子研究所,成都610065)
(2四川大學化學工程學院,成都610065)
(3成都理工大學材料與化學化工學院,成都610059)
碳包覆改性制備高倍率性能的鋰離子電池正極材料LiNi1/3Co1/3Mn1/3O2
鄭卓1郭孝東2吳振國2向偉3滑緯博2鐘本和2楊秀山*,2
(1四川大學高分子研究所,成都610065)
(2四川大學化學工程學院,成都610065)
(3成都理工大學材料與化學化工學院,成都610059)
采用碳酸鹽共沉淀-高溫固相法制備了一系列表面碳包覆改性(w=1.0%,2.0%,3.0%)的LiNi1/3Co1/3Mn1/3O2正極材料,借助X射線衍射(XRD)分析、掃描電鏡(SEM)、透射電鏡(TEM)、電化學阻抗譜(EIS)和恒電流充放電測試等表征手段對材料的晶體結構、微觀形貌和電化學性能進行了較系統的研究。結果表明,碳成功地包覆在了材料顆粒的表面,碳包覆改性后的材料具有良好的α-NaFeO2結構(空間群:R3m),且隨著包碳量的增加,一次顆粒平均尺寸逐漸增大(從177nm增至209nm)。表面的無定形碳層可以提高材料的電子導電率,減少電極材料與電解液的副反應,故而碳包覆材料的電化學性能都有了一定程度提升。包覆碳量為2.0%的樣品高倍率和長循環性能最好,在2.7~4.3V,1C下循環100次后,容量保持率為93%;在0.1C、0.2C、0.5C、1C、3C、5C、10C和20C時的放電比容量分別為:155、148、145、138、127、116、104和96mAh·g-1。在超高倍率50C(9A·g-1)時,其放電比容量還能達到62mAh·g-1(原始LiNi1/3Co1/3Mn1/3O2材料僅為30mAh·g-1),倍率性能十分優異。
碳酸鹽共沉淀法;碳包覆;高倍率性能;LiNi1/3Co1/3Mn1/3O2;鋰離子電池
0 引言
自1990年LiCoO2正極材料出現以來,鋰離子電池已被廣泛應用于便攜式電子設備、大型儲能設備、電動汽車(EVs)和混合動力汽車(HEVs)等各類動力電源領域[1-3]。傳統的LiCoO2鋰離子電池面臨著高成本、高毒性以及安全性問題,因此限制了其進一步的發展。目前,具有層狀結構的LiNixCoyMn1-x-yO2系列三元氧化物因其較高的放電比容量和較高的電壓平臺,且擁有較高的能量密度而被認為是一種極具潛力的正極材料[4-5]。其中三元材料LiNi1/3Co1/3Mn1/3O2的3種過渡金屬離子價態固定[6-7],Ni為+2價,Co為+3價,Mn為+4價,它作為等同于LiNiO2、LiCoO2和LiMnO2三者的固溶體,同時兼具了LiNiO2的低毒性、高容量,LiCoO2的高導電性和LiMnO2的穩定性等優點,被認為是最有可能替代LiCoO2的正極材料。
盡管LiNi1/3Co1/3Mn1/3O2材料用于鋰離子電池的優勢明顯,但其也存在不足,如在高倍率電流密度下,電池容量衰減較快,倍率性能較差[8]。Aurbach等[9]的研究表明,正極活性物質的容量衰減與材料顆粒表面的物理化學性質密切相關,因為Li+的擴散遷移以及界面電荷轉移都需要穿過材料表面來進行。許多研究報道[10-13]也證實了表面包覆改性的方法可以減少電解液與電極材料之間的副反應,保證Li+在長循環嵌/脫過程中的主體結構穩定,從而電化學性能優異。碳因為其優異的電子導電率,可以提供快速的電子傳輸而被廣泛用于層狀氧化物材料的表面包覆改性[14-21],以期獲得優異的倍率性能。Cao等[21]以蔗糖為碳源,制備得到了碳包覆的LiCoO2,包碳處理后的材料在1C的放電比容量能達到123mAh·g-1,而原始材料的放電比容量只有31.4mAh·g-1;Mei等[15]以PEG-600為碳源,制備得到了LiNi1/3Co1/3Mn1/3O2/C的核-殼結構材料,在2.8~4.6V,5C時的放電比容量還能保持在130mAh· g-1左右。雖然碳包覆在三元材料中的應用較廣泛,但目前文獻對碳包覆改性后的三元材料高倍率性能(10C及以上)的報道較少,而這方面電性能在鋰離子電池的實際應用中十分重要。
本研究采用蔗糖作為碳源,通過碳酸鹽共沉淀法在LiNi1/3Co1/3Mn1/3O2正極材料的表面進行碳包覆改性。通過碳包覆,在LiNi1/3Co1/3Mn1/3O2表面包覆上一層無定型碳,可以提高材料的導電性能,保證材料的主體結構穩定。本文一共設計了3組不同的包碳量(w= 1.0%,2.0%,3.0%),系統地研究了LiNi1/3Co1/3Mn1/3O2材料隨包碳量不同其形貌、結構和電化學性能的變化,并從中優選出了一組最佳的包碳量,此時制得的LiNi1/3Co1/3Mn1/3O2材料具有最優的循環穩定性和高倍率性能,具有應用于高功率型鋰離子電池的前景。
1 實驗部分
1.1 材料合成
將一定量的Ni(NO3)2·4H2O、Mn(CH3COO)2·4H2O、Co(NO3)2·6H2O和LiNO3溶解在去離子水中,配成濃度為1.5mol·L-1的溶液,以碳酸氫銨(NH4HCO3)和氨水(NH3·H2O)分別作為沉淀劑和配位劑,溶解在去離子水中配成2mol·L-1的溶液。在高速攪拌下(1000r· min-1)分別滴加到反應釜中,反應溫度控制在50℃,反應溶液的pH值約為8.0。待反應完全之后,將溫度升高至60℃陳化10h,再將粉體在100℃下真空干燥12h得到前驅體。最后將前驅體粉體與鋰鹽均勻混合在550℃下預燒6h,再在850℃下煅燒12h,制得LiNi1/3Co1/3Mn1/3O2三元材料。
為了確保碳成功包覆在材料顆粒表面,本實驗首先將制得的LiNi1/3Co1/3Mn1/3O2材料分散于無水乙醇中,并提前超聲分散1h,然后在超聲條件下加入碳源(蔗糖)反應2h,以期達到均勻包覆的目的。之后將溶液在100℃下干燥一晚,再研磨得到混合粉體,最后此粉體在Ar氣氛下500℃煅燒5h制得表面包覆碳層的LiNi1/3Co1/3Mn1/3O2材料。本實驗一共考察了3組不同質量分數的碳包覆量,分別為w=1.0%、2.0%、3.0%,制得的樣品分別編號為P1、P2、P3。對未進行包碳處理的原始LiNi1/3Co1/3Mn1/3O2材料也進行了相同的超聲分散處理以及重新燒結過程,制得的材料命名為P0。圖1為碳包覆LiNi1/3Co1/3Mn1/3O2材料合成路線示意圖。
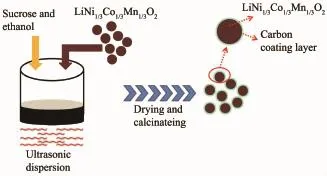
圖1 碳包覆LiNi1/3Co1/3Mn1/3O2材料合成路線示意圖Fig.1Synthetic route of the carbon-coated LiNi1/3Co1/3Mn1/3O2materials
1.2 材料表征
X射線衍射(XRD)用于分析材料的晶體結構,采用飛利浦公司的PW1730多晶轉靶X射線儀(工作條件:管壓40kV,管流30mA,Cu Kα靶,λ=0.154056nm),掃描角度范圍為10°~70°,掃描速度為2°·min-1,并用TOPAS精修軟件對晶胞參數進行精修處理。采用日本日立(Hitachi)S-4800型電場發射式掃描電子顯微鏡(SEM)對顆粒的形貌和尺寸進行表征和分析(工作電壓30kV)。采用日本電子JEM-2100高分辨透射電鏡(TEM)對碳包覆層的情況進行表征和分析(工作電壓200kV)。采用ST-2258A型數字式多功能四探針測試儀測試材料的電子電導率。將材料粉末用模具壓制成圓片,測試圓片的厚度l和面積s,將正極材料圓片放到四探針測試儀上,調節電流(I)大小,讀出對應的電壓值(U),電阻值電子電導率κ計算公式如下:
1.3 材料的電化學性能測試
正極材料(LiNi1/3Co1/3Mn1/3O2)、乙炔黑、粘結劑(PVDF)按照質量比為80∶13∶7混合,并加入適量的N-甲基吡咯烷酮調均成漿。首先將漿料均勻涂覆在鋁箔上,并在真空100℃下干燥10h,再將這些涂有漿料的鋁箔切成直徑為14mm的圓片,并在20MPa下壓實得到電池的正極片,每個片上的正極材料活性物質質量為3~4mg·cm-2。金屬鋰片作為負極,采用Celgard 2400型隔膜,電解液為LiPF6(1mol·L-1)/ECDMC(體積比為1∶1),再與正極片一起在充滿Ar氣的手套箱中組裝成CR2032扣式電池。本文是在室溫下進行恒電流充放電性能測試,充放電電壓為2.7~4.3V,1C=180mA·g-1。0.1C~1C的充放電機制:在相應的倍率下恒流充放電。1C~50C的充放電機制:以1C恒流充電,再在相應的倍率下恒流放電。采用德國Zennium IM6電化學工作站對電池的電化學阻抗譜(EIS)進行測試,測試頻率范圍在100kHz~10mHz,擾動電壓為5mV,得到的數據用Zview 2軟件進行電化學元件模型數值擬合分析。
2 結果與討論
為了更加準確的研究碳包覆對材料晶體結構的影響,圖2(a~d)分別對未包覆碳和包覆碳后的LiNi1/3Co1/3Mn1/3O2材料進行XRD精修分析。由圖可以發現這4個材料均具有典型的六方α-NaFeO2結構,空間群為R3m,沒有雜質峰的存在。特征峰(006)/(102)和(108)/ (110)分裂明顯,說明4種材料均具有較高的結晶度層狀結構[22]。精修后的XRD數據列于表1。由相關文獻報道可知[23],c/a值代表面心立方結構的三角扭曲程度,如果該立方結構不發生扭曲,則象征著三角扭曲程度的c/a值就為其值越大,說明層狀結構越完整。P2樣品具有最大的c/a值(4.9790),即具有更完整的層狀結構,有序性更好。對于層狀結構材料的XRD衍射圖,(003)峰代表R3m層狀結構,(104)峰代表R3m層狀結構和Fm3m立方結構混合反射的總和,故I(003)/I(104)值是衡量Li+/Ni2+陽離子混排程度的重要指標[24],其值越大,陽離子混排程度越小。通常認為,I(003)/ I(104)的比值大于1.2,則說明陽離子混排程度較小。由精修的晶胞參數數據可發現,4個樣品的I(003)/I(104)比值均大于1.2,且P2樣品的值最大(1.4584),陽離子混排最小。另外,采用四探針法對P0、P1、P2和P3材料的電子電導率進行了測試,其值分別為:4.8×10-8、5.5×10-7、3.4×10-6和6.2×10-6S·cm-1,可發現包碳后材料的電子導電率相對于原始未包碳材料都得到了提高,且隨著包碳量的增加,材料的電子導電率逐漸增大。
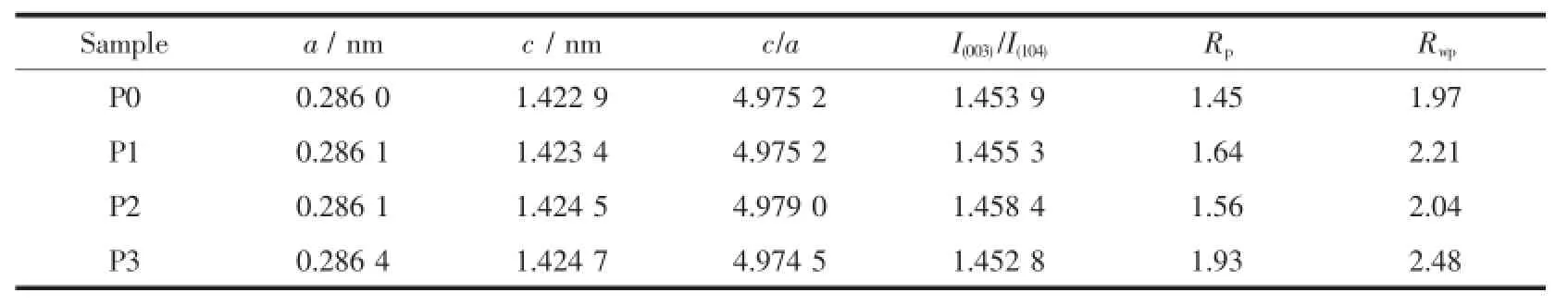
表1 樣品的XRD精修結果Table 1Refined lattice parameters of the samples
圖2 樣品的XRD精修圖Fig.2XRD patterns of the samples
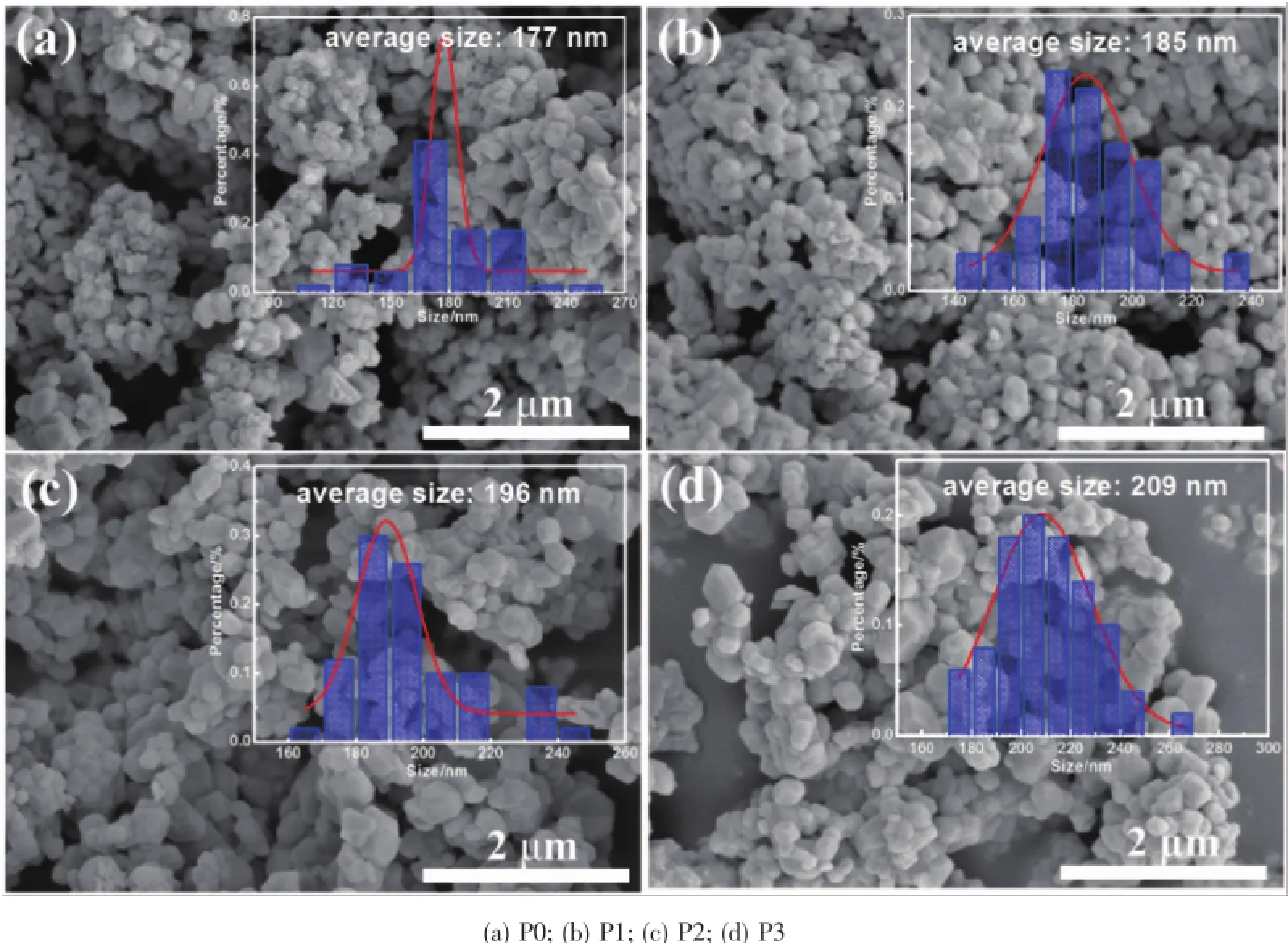
圖3 樣品的SEM圖Fig.3SEM images of the samples

圖4 P2樣品的TEM圖像(a)和SAED圖像(b)Fig.4TEM image(a)and SAED image(b)of P2sample
圖3為這4種材料的SEM圖。由圖可以發現,隨著包覆碳量的增加,顆粒的形貌并未發生顯著變化,顆粒形貌始終為球形或類球形結構,但顆粒平均尺寸呈現出逐漸增大的趨勢,圖3中的內嵌圖是用Smile View軟件對材料SEM圖中晶粒進行測量分析統計得到的一次粒徑分布圖[25],由圖可發現P0、P1、P2、P3樣品的平均一次顆粒徑分別為177、185、196、209nm。一次顆粒徑增大的原因主要是因為顆粒表面包覆的碳層量逐漸增加。為了確定碳是否成功地包覆在顆粒表面,圖4給出了P2樣品的TEM和SAED分析。由圖4(a)明顯可以觀察到顆粒表面均勻包覆了一層無定型的碳層,其厚度大約為5nm。從TEM圖像觀察到2個相鄰晶格條紋之間的間距為0.47nm,對應層狀結構(003)峰的晶面間距。從圖4(b)的SAED圖譜可以發現,制得的P2材料呈現出典型的單晶六方晶型結構[26],此選區電子衍射的晶帶軸為[001]方向。
圖5(a)給出了4種材料在2.7~4.3V的倍率循環性能圖。每個材料在0.1C下循環6次,再在0.2C~20C下分別循環11次。由圖我們可以發現,隨著倍率的增加,材料放電比容量逐漸減少,P0樣品呈現出最小的放電比容量,P2樣品具有最高的放電比容量,其在0.1C、0.2C、0.5C、1C、3C、5C、10C和20C下的放電比容量分別為:155、148、145、138、127、116、104和96mAh ·g-1。此樣品的倍率性能優于文獻中所報道的性能[25,27-29]。這4種材料在不同倍率下的容量保持率如圖5(a)中的內嵌圖所示。由圖可以發現,包碳之后的材料倍率性能相比于未包碳處理的原始LiNi1/3Co1/3Mn1/3O2材料都有一定程度的提升,其中P2樣品具有最高的容量保持率。P2樣品在0.2C、0.5C、1C、3C、5C、10C和20C相對于0.1C的容量保持率分別為:95.4%、93.1%、88.9%、81.7%、74.3%、67.0%和61.6%,相比于P0樣品在不同倍率下的容量保持率92.1%、87.7%、83.2%、73.6%、62.5%、55.2%和47.9%有較大的提高。表面包碳材料倍率性能的提升可歸因于碳層使得材料表面的電子導電率變大,從而使得電子傳輸能力增強,對整個電池體系的電化學反應起到了一定促進作用。圖5(b~e)為這4種材料在不同倍率下的充/放電曲線圖。由圖可以觀察到,隨著電流密度的增加,各個材料的平均放電平臺都有一定程度的下降,一般這種現象與電極極化密不可分,而導致電極極化現象是因為在電池不斷循環過程中,電池的內阻增大(包括SEI膜的阻力以及界面轉移阻抗Rct的阻力)[30],從而使得電池的不可逆程度變大。由圖可發現P2樣品的放電平臺衰減最小(圖5(d)),說明材料的可逆性最好,電池在循環過程中的極化現象有一定程度的緩解。圖5(f)為P0和P2樣品在超高倍率下的放電曲線圖,P2樣品的倍率性能十分優異,在50C(9A·g-1)時,其放電比容量仍能達到62mAh·g-1,而P0樣品僅為30mAh·g-1。
圖6為樣品在2.7~4.3V,1C下循環100次的循環性能圖(內嵌圖),以及經容量歸一化處理之后樣品在第1次和100次的放電曲線圖。P0、P1、P2和P3樣品在循環100次后的容量保持率分別為:83%、90%、93%和88%。實驗結果表明包碳改性之后的材料循環穩定性得到了改善,相比于未包碳處理的原始P0材料都有一定程度的提高,其中P2樣品的循環穩定性能最佳,其原因可歸結于包覆在材料表面的碳層可以減緩在長時間循環過程中電解液與材料主體相的副反應,從而維持電極材料的晶體結構完整性。此外,為了更加準確地探究這4種樣品循環穩定性能差距的原因,我們對放電比容量進行了歸一化處理[31],排除了容量衰減的影響,研究了放電曲線的可逆性,以及放電電壓平臺隨著循環次數增加而衰減的情況。由圖可發現,P0樣品的第1次和100次放電曲線差別最大,電壓平臺下降最明顯,在循環過程中的極化現象最嚴重,可逆性差,故而循環穩定性最差;而P1、P2、P3樣品的放電曲線可逆性都較好,電壓平臺衰減相對較小,材料極化程度低,所以循環穩定性較好,在長循環后還能有較大的容量保持率。
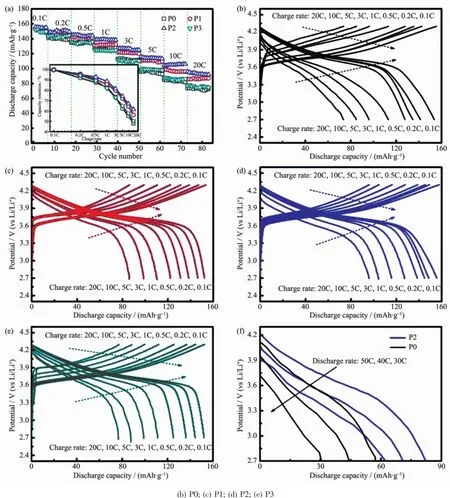
圖5 (a)樣品在2.7~4.3V下的倍率性能和在不同倍率下的容量保持率(內嵌圖);(b~e)樣品在不同倍率的充放電曲線; (f)P0和P2樣品在超高倍率下的放電曲線Fig.5(a)Rate capability and corresponding capacity retentions(inset)of the samples between 2.7and 4.3V; (b~e)Charge/discharge curves of the samples at different rates;(f)Ultra-high rate performance of the P0and P2samples
圖7為P0和P2電極材料在2.7~4.3V,1C下循環100次后的XRD圖。由圖可發現P0樣品的(006)/ (102)和(108)/(110)峰完全消失了,說明該材料的層狀主體結構在循環中受到了嚴重的破壞。相反,P2樣品的(006)/(102)和(108)/(110)峰依然較為清晰,分裂較明顯,說明該材料的層狀結構保持較好。同時,P0和P2電極材料的I(003)/I(104)值分別為0.93和1.14,也進一步證實了P2樣品的晶體層狀結構穩定。
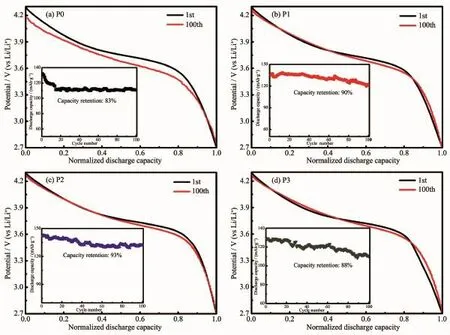
圖6 樣品在2.7~4.3V,1C下的循環穩定性(內嵌圖),以及經容量歸一化處理之后樣品在第1次和100次的放電曲線圖Fig.6Cycling stability of the samples at 1C between 2.7and 4.3V(inset)and the discharge profiles of the 1st and 100th cycles of the samples after normalization of capacity
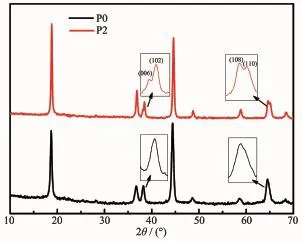
圖7 P0和P2電極材料在2.7~4.3V,1C下循環100次后的XRD圖Fig.7XRD patterns of the P0and P2electrodes after 100cycles at 1C between 2.7and 4.3V
對這4個材料進行了電化學阻抗圖譜(EIS)測試,所有測試的電池都經過了圖5(a)的倍率性能測試。Nyquist曲線和經Zview軟件擬合的等效電路圖如圖8(a)和8(b)所示。由圖可發現,樣品的阻抗譜都由高頻區的一個半圓和低頻區的一條斜線組成。在高頻區阻抗譜與Z′軸的截距表示電池固有阻抗(Rs),主要來源于電解液阻抗、隔膜阻抗等。半圓代表了電極材料和電解液之間的界面阻抗(Rct),反映了Li+界面反應的難易程度,越小表示反應越易進行。斜線表示Warburg阻抗(W1),表明Li+在固相正極材料中的擴散阻力[32-33]。圖8(c)為擬合得到的阻抗值柱狀圖。由圖可發現,4個樣品的Rs值相近(因為是同一批電池,裝電池的條件都一樣,所以Rs的值類似),而Rct呈現出較大差異,擬合的數值變化趨勢和前面所述的樣品電化學性能變化情況相同。P2樣品的Rct值最小,其次是P1樣品,說明一定量的碳包覆改性可以提高材料的電化學性能,其原因可歸結于碳具有優異的電子導電率,當它包覆在材料表面時,可以減少Li+的界面電荷轉移阻抗,使得Li+能夠快速的嵌入和脫出材料表面,從而提高材料的倍率循環性能。但當包覆的碳量進一步增大時(P3樣品),會導致包覆層太厚,進而增大Li+擴散到材料主體相的路徑,反而使得其Rct值變大。但總體來說,進行表面包碳改性后的材料Rct值都有所減少,電化學性能也有一定程度的提升,所以表面包碳改性不失為一種改善材料電化學性能簡單可行的方法。
為了更加深入研究樣品的Li+傳輸能力,本文還對4種原始電極材料進行了電化學阻抗圖譜(EIS)測試(如圖9(a)所示),內嵌圖為經Zview軟件擬合的等效電路圖。并采用如下公式對樣品的鋰離子擴散系數(DLi+)進行了擬合計算[34-35]:

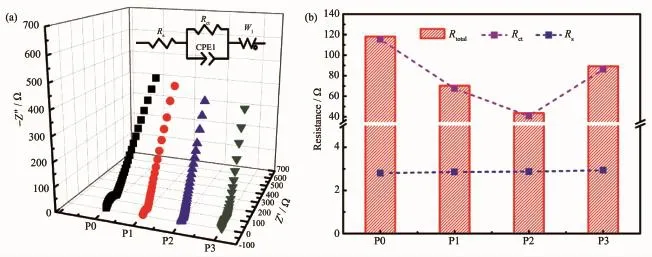
圖8 (a)樣品的EIS圖譜和等效電路圖(內嵌圖);(b)擬合的阻抗柱狀圖Fig.8(a)Nyquist plots and corresponding equivalent circuit(inset)of the samples; (b)Histogram of the corresponding fitted parameters of the samples
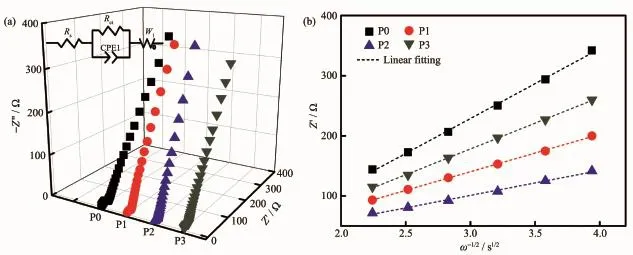
圖9 (a)原始樣品的EIS圖譜;(b)實軸阻值(Z′)與角頻率平方根倒數(ω-1/2)的關系圖Fig.9(a)EIS plots of the pristine samples;(b)Relationship between real parts of the complex impedance(Z′)and ω-1/2in the low frequency region

式中R為氣體常數,T為絕對溫度;Rct為界面轉移阻抗;A為電極面積,n為每摩爾的電子轉移量(對于Li+為1),F為法拉第常數,C為Li+在電極中的物質的量濃度,σ為Warburg系數。樣品的Warburg系數(σ)通過公式(2)以及圖9(b)的Z′~ω-1/2關系圖的擬合直線斜率計算得到,再經公式(1)計算得到4個樣品(P0、P1、P2和P3)的DLi+分別為2.6×10-12、1.9×10-11、3.5×10-11和6.8×10-12cm2·s-1,其結果與圖5(a)的倍率性能測試結果相一致。P2樣品具有最大的鋰離子擴散系數,可在離子傳輸過程中提供更多的Li+參與到電極反應中,所以其倍率性能最優異。
3 結論
采用碳酸鹽共沉淀法合成了一系列表面碳包覆改性的LiNi1/3Co1/3Mn1/3O2正極材料(w=1.0%、2.0%、3.0%)。研究結果表明,碳成功地包覆在了材料顆粒的表面(TEM分析),包碳后的材料電化學性能都得到了一定程度的提升。其中包碳量為2.0%的材料高倍率和長循環性能最好,在20C時的放電比容量為96mAh· g-1,在超高倍率50C(9A·g-1)時,其放電比容量還能達到62mAh·g-1(原始LiNi1/3Co1/3Mn1/3O2材料僅為30mAh·g-1),在1C下循環100次后,容量保持率為93%。與此同時,EIS測試結果也證明了表面包碳改性后的材料Rct值都有所減少,說明表面包碳的方式起到了降低Li+界面電荷轉移阻抗的作用,使得Li+能夠容易地嵌入和脫出材料的表面。表面包碳改性這種方法工藝簡單,制得材料的倍率性能優異,有用于高功率型鋰離子電池的前景,同時該改性手段對于制備其他高倍率、高容量的材料也具有一定的工藝參考價值。
參考文獻:
[1]Dunn B,Kamath H,Tarascon J M.Science,2011,334(6058): 928-935
[2]Tarascon J M,Armand M.Nature,2001,414(6861):359-367
[3]Manthiram A,Murugan A V,Sarkar A,et al.Energy Environ. Sci.,2008,1:621-638
[4]Hua W B,Guo X D,Zheng Z,et al.J.Power Sources,2015, 275:200-206
[5]Ahn W,Lim S N,Jung K N,et al.J.Alloys Compd.,2014, 609(9):143-149
[6]Cho T H,Park S M,Yoshio M,et al.J.Power Sources,2005, 142(1/2):306-312
[7]Lee M H,Kang Y J,Myung S T,et al.Electrochim.Acta, 2004,50(4):939-948
[8]WANG Hai-Yan(王海燕),TANG Ai-Dong(唐愛東),HUANG Ke-Long(黃可龍),et al.Chinese.J.Inorg.Chem.(無機化學學報),2008,24(4):593-599
[9]Aurbach D,Gamolsky K,Markovsky B,et al.J.Electrochem. Soc.,2000,147(4):1322-1331
[10]Huang Y,Chen J,Cheng F,et al.J.Power Sources,2010, 195(24):8267-8274
[11]Hashem A M A,Abdel-Ghany A E,Eid A E,et al.J.Power Sources,2011,196(20):8632-8637
[12]Riley L A,Atta S V,Cavanagh A S,et al.J.Power Sources, 2011,196(6):3317-3324
[13]Lu J,Peng Q,Wang W,et al.J.Am.Chem.Soc.,2013,135(5):1649-1652
[14]Wu Z Z,Han X G,Zheng J X,et al.Nano Lett.,2014,14(8): 4700-4706
[15]Mei T,Zhu Y C,Tang K B,et al.RSC Adv.,2012,2(33): 12886-12891
[16]Hsieh C T,Mo C Y,Chen Y F,et al.Electrochim.Acta, 2013,106(9):525-533
[17]Hu Y Y,Zhou Y K,Wang J,et al.Mater.Chem.Phys.,2011, 129(1/2):296-300
[18]Kim H S,Kong M Z,Kim K,et al.J.Power Sources,2007, 171(2):917-921
[19]Guo R,Shi P F,Cheng X Q,et al.J.Alloys Compd.,2009, 473(1/2):53-59
[20]Han Y M,Zhang Z F,Zhang L B,et al.Trans.Nonferrous Met.Soc.China,2013,23(10):2971-2976
[21]Cao Q,Zhang H P,Wang G J,et al.Electrochem.Commun., 2007,9(5):1228-1232
[22]Li J F,Xiong S L,Liu Y R,et al.Nano Energy,2013,2(6): 1249-1260
[23]Zhang X Y,Jiang W J,Mauger A,et al.J.Power Sources, 2010,195(5):1292-1301
[24]ZHANG Ji-Bin(張繼斌),HUA Wei-Bo(滑緯博),ZHENG Zhuo(鄭卓),et al.Acta Phys.-Chim.Sin.(物理化學學報), 2015,31(5):905-912
[25]Zheng Z,Hua W B,Liao S X,et al.RSC Adv.,2015,5(72): 58528-58535
[26]Gabrisch H,Yi T,Yazami R.Electrochem.Solid-State Lett., 2008,11(7):A119-A124
[27]HUA Wei-Bo(滑緯博),GUO Xiao-dong(郭孝東),ZHENG Zhuo(鄭卓),et al.Chem.Res.Appl.(化學研究與應用), 2014,26(3):441-444
[28]Huang Z D,Liu X M,Zhang B,et al.Scripta Mater.,2011, 64(2):122-125
[29]Sa Q,Gratz E,He M,et al.J.Power Sources,2015,282:140-145
[30]Wu F,Li N,Su Y F,et al.Adv.Mater.,2013,25(27):3722-3726
[31]Zheng Z,Guo X D,Zhong Y J,et al.Electrochim.Acta, 2016,188:336-343
[32]Aurbach D,Levi M D,Gamulski K,et al.J.Power Sources, 1999,81-82(9):472-479
[33]Striebel K A,Sakai E,Cairns E J.J.Electrochem.Soc., 2002,149(1):A61-A68
[34]Mai L,Li S,Dong Y,et al.Nanoscale,2013,5(11):4864-4869
[35]Li B,Han C,He Y B,et al.Energy Environ.Sci.,2012,5(11):9595-9602
Preparation of Carbon-Coated LiNi1/3Co1/3Mn1/3O2Cathode for High-Rate Lithium Ion Batteries
ZHENG Zhuo1GUO Xiao-Dong2WU Zhen-Guo2XIANG Wei3HUA Wei-Bo2ZHONG Ben-He2YANG Xiu-Shan*,2
(1Polymer Research Institute,Sichuan University,Chengdu 610065,China)
(2School of Chemical Engineering,Sichuan University,Chengdu 610065,China)
(3College of Materials and Chemistry&Chemical Engineering,Chengdu University of Technology,Chengdu 610059,China)
A series of carbon-coated LiNi1/3Co1/3Mn1/3O2cathodes(w=1.0%,2.0%,3.0%)have been prepared by the carbonate co-precipitation,high temperature solid state method.Powder X-ray diffraction(XRD),scanning electron microscopy(SEM),transmission electron microscopy(TEM),electrochemical impedance spectroscopy (EIS)and galvanostatic charge-discharge tests were employed to analyze the crystal structure,micromorphology and electrochemical properties of the as-prepared materials.The results indicate that carbon was successfully coated on the particle surface,and the carbon-coated LiNi1/3Co1/3Mn1/3O2cathodes have well-ordered α-NaFeO2structure(Space group:R3m).The average primary particle sizes were gradually increased(from 177to 209nm) with the increased carbon coating.The amorphous carbon layer on the surface could enhance the electronic conductivity and decrease the side reactions between electrolyte and electrodes,thus improving the electrochemicalperformance.The 2.0%carbon-coated sample has the best high rate and long-term cycling stability.After 100cycles at 1C between 2.7and 4.3V,the material retained 93%of its initial capacity.At 0.1C,0.2C,0.5C,1C, 3C,5C,10C and 20C,the specific capacities of the material were 155,148,145,138,127,116,104and 96mAh·g-1,respectively.This sample exhibits an excellent ultra-high rate performance with a high discharge capacity of 62mAh·g-1(the pristine LiNi1/3Co1/3Mn1/3O2barely delivers 30mAh·g-1)even at the ultra-high rate 50C(9A·g-1).
carbonate co-precipitation;carbon-coated;high rate performance;LiNi1/3Co1/3Mn1/3O2;lithium-ion battery
O646
A
1001-4861(2017)01-0106-09
10.11862/CJIC.2017.020
2016-08-23。收修改稿日期:2016-11-18。
國家自然科學基金(No.21506133)和四川省科技支撐計劃(No.2014GZ0077)資助項目。*
。E-mail:yangxs@scu.edu.cn

