他克莫司對大鼠肝臟蛋白磷酸酶2A表達的影響
王得恩,陳充抒2,王宏宇,馬永華,徐 春
他克莫司對大鼠肝臟蛋白磷酸酶2A表達的影響
王得恩1,陳充抒2,王宏宇1,馬永華1,徐 春1
目的 通過建立他克莫司(FK-506)誘導的糖尿病大鼠模型,探討FK-506對大鼠肝臟蛋白磷酸酶2A(protein phosphatase 2A, PP2A)表達的影響。方法 將40只雄性SD大鼠(體重80~100 g/只)隨機分成FK-506組和對照組,每組20只。FK-506組給予FK-506灌胃,劑量為4 mg/(kg·d);對照組給予等量飲用水。每月測量大鼠的空腹血糖及FK-506血藥濃度,連續測量5個月。5個月后空腹狀態下乙醚麻醉處死大鼠,心尖穿刺取血測量大鼠空腹血清胰島素水平,并計算穩態模式評估胰島素抵抗指數(homeostasis model assessment-insulin resistance index,HOMA-IR)和胰島素敏感指數(insulin secretion index,ISI),用免疫組化方法檢測大鼠肝臟組織中PP2A的表達。使用SPSS 17.0軟件對數據進行統計分析。結果 給藥3個月后FK-506組血糖平均濃度為(8.07±0.84) mmol/L,有80%(16/20)的大鼠血糖濃度大于7 mmol/L,高于對照組的(5.27±0.38)mmol/L;5個月后 FK-506組所有大鼠血糖濃度大于7 mmol/L。FK-506組大鼠的HOMA-IR高于對照組(t=47.80, P<0.05),ISI低于對照組(t=37.70, P<0.05)。FK-506組的PP2A在肝組織細胞漿內的表達水平高于對照組(χ2=19.80, P<0.05)。結論 FK-506可成功誘導大鼠糖尿病模型。在FK-506誘導的糖尿病大鼠肝臟中,PP2A 表達明顯增高,這可能是FK-506升糖的作用機制之一。
他克莫司;器官移植后糖尿病;蛋白磷酸酶2A;大鼠;胰島素抵抗
器官移植術是終末期疾病比較有效的治療方法,隨著外科學、異體配型技術、免疫抑制藥的發展,器官移植受者長期存活得以實現,移植后糖尿病(post transplantation diabetes mellitus,PTDM)是器官移植后的并發癥之一,其發病率逐年增加。移植后免疫抑制藥為PTDM的危險因素之一,臨床研究發現,糖皮質激素和鈣調磷酸酶抑制藥可以引起血糖的升高[1,2],他克莫司(FK-506)是一種鈣調磷酸酶抑制藥,其升血糖作用機制尚不清楚。
蛋白磷酸酶2A(protein phosphatase 2A, PP2A)是一類Ser/Thr蛋白磷酸酶抑制藥,通過去磷酸化作用使已經磷酸化的激酶脫磷酸化,影響多種信號通路的傳導。本研究模擬移植術后患者正常用藥途徑及用藥量,使用移植術后患者最常用的免疫抑制藥物FK-506作為誘導劑,建立大鼠的糖尿病模型,用免疫組化方法觀察FK-506組與對照組大鼠肝臟PP2A的表達水平,探討PP2A在FK-506誘導型糖尿病中的作用。
1 材料與方法
1.1 動物材料 無特定病原體(specific pathogen free,SPF)級的雄性SD大鼠40只,個體健康、鼠齡相仿,體重為80~100 g/只,出生后未做特殊處置,自然實驗室環境生長,購自中國軍事科學院醫學中心實驗室[實驗動物許可證號:SCXK(京) 2005-0006]。
1.2 試劑材料 FK-506膠囊:規格為1 mg/粒,安斯泰來制藥有限公司;放免胰島素檢測試劑盒:上海生物制品研究所;二步法EnVisionTM試劑盒:Dako生物公司(批號:K400511);PP2A 試劑:CST公司(批號:2038)。
1.3 分組及給藥 將40只大鼠隨機分為兩組:FK-506組和對照組,每組20只,兩組的平均體重依次為(89.65±4.91)g、(89.60±4.50)g,體重組間差異無統計學意義(t=0.34, P=0.97),有可比性。
FK-506組給藥劑量為4 mg/(kg·d),對照組給予等量日常飲用水,兩組大鼠均在禁食禁水8 h后,經胃管灌胃給藥,1 h后喂食。每月測空腹血糖和FK-506濃度,5個月后乙醚麻醉處死大鼠,心尖取血分離出血漿于-70℃冰箱(Thermo公司)中保存,大鼠肝臟和胰腺組織放于4%多聚甲醛中保存。
1.4 放免法測定大鼠血清胰島素水平 穩態模式評估(homeostasis model assessment,HOMA)指數計算方法:計算胰島素敏感指數(insulin secretion index, ISI)和HOMA胰島素抵抗指數( HOMA insulin resistance index, HOMA-IR)。計算公式:ISI=1/空腹血糖(fasting blood glucose,FBG)×空 腹 胰 島 素(fasting serum lisulin,FINS);HOMA-IR=FBG×FINS/22.5。
1.5 化學發光法測定血漿中FK-506的濃度 FK-506組大鼠尾靜脈取血,以3000 r/min離心15 min得到血清標本,與特異抗體混合,加入標記的FK-506作為酶競爭物,并與微珠上的FK-506藥物抗體進行結合,接種采用磁場促使微珠分離,清洗后再將預激法和激發劑產生化學發光反應,最后根據標準曲線得出FK-506的濃度。
1.6 免疫組化方法分析肝臟組織中PP2A蛋白的表達
免疫組化結果分析:(1)將每一視野下陽性細胞按照百分比(%)分為5級。0分為無陽性細胞;1分為陽性±s描述,計數資料采用頻數與率描述。(1)兩組大鼠的體重、血糖水平、ISI和HOMA-IR的比較采用兩組獨立樣本t檢驗,6個時間點兩組血糖比較的檢驗水準調整為0.05/6,以P<0.008為差異有統計學意義;(2)兩組大鼠PP2A表達強度比較采用χ2檢驗;以P<0.05為差異有統計學意義。
2 結 果
2.1 FK-506血藥濃度的測定 每月末對FK-506組大鼠尾靜脈取血,監測每個月血藥濃度:第1個月(7.71±0.30) ng/ml,第2個月(8.40±0.48)ng/ml,第3個月(8.87±0.26)ng/ml,第4個月(8.91±0.18)ng/ml,第5個月(9.07±0.24)ng/ml。FK-506組大鼠平均5個月FK-506血藥濃度維持在(8.59±0.59)ng/mL,與人體抗排異治療所要求的血藥濃度一致。
2.2 血糖水平的測定 空腹(禁食禁水8 h以上)大鼠尾靜脈取血,測定大鼠的血糖水平。實驗前兩組平均血糖水平無差異(t=0.56, P=0.58)。第3個月,FK-506組大鼠血糖平均濃度為(8.07±0.84)mmol/L ,且有80%(16/20)大鼠血糖濃度>7.0 mmol/L;第5個月,FK-506組所有大鼠血糖濃度>7.0 mmol/L,糖尿病模型誘導成功。同期,對照組所有大鼠的血糖濃度<7.0 mmol/L。用藥前及用藥后兩組血糖情況見表1。
2.3 HOMA-IR及ISI 用藥5個月后,FK-506組大鼠的HOMA-IR高于對照組[(4.82±0.10) vs (3.24±0.11),t=47.80,P<0.05],ISI低于對照組[(0.092±0.002) vs(0.137±0.005),t=37.70,P<0.05]。
2.4 大鼠肝臟PP2A 表達水平 用藥5個月后,對大鼠肝臟標本行免疫組化染色。顯微鏡下與對照組大鼠比較,FK506組大鼠肝臟細胞被著為棕褐色(圖1、圖2)。測定PP2A的表達水平,FK-506組大鼠肝臟標本中PP2A陽性率為80%(16/20),對照組PP2A陽性率為10%(2/20),組間差異有統計學意義(χ2=19.80,P<0.05)。細胞≤10%; 2分為陽性細胞11%~50%; 3分為陽性細胞51%~75%;4分為陽性細胞>75%。(2)將每個細胞的著色強度分為4級:0分為無色,1分為淡黃色,2分為棕黃色,3分為棕褐色。(3)標本的陽性細胞百分比積分×顏色的強度積分>3分可確定為陽性。
1.7 大鼠糖尿病模型建立標準 大鼠尾部靜脈取血,監測尾靜脈平均血糖水平>7.0 mmol/L。
1.8 統計學處理 使用SPSS 17.0軟件對數據進行統計分析。計量資料采用x
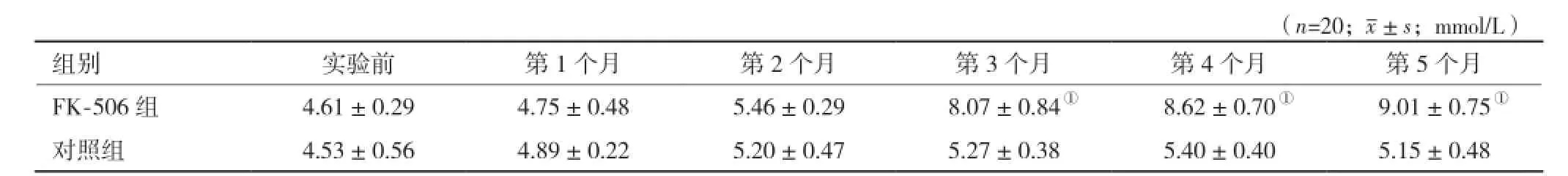
表1 兩組大鼠用藥期間每個月末血糖水平的比較
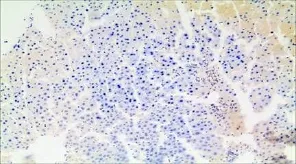
圖1 對照組肝臟組織PP2A的表達(免疫組化染色×100)
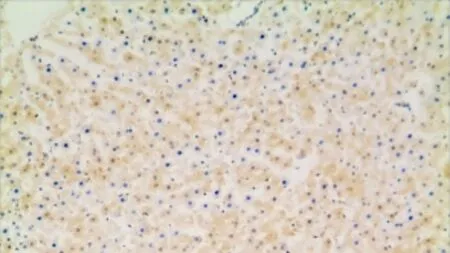
圖2 FK-506組肝臟組織PP2A的表達(免疫組化染色×100)
3 討 論
FK-506作為第二代神經鈣蛋白抑制藥(calcineurin inhibitor, CNI)的代表性藥物,屬于大環內酯類抗生素,通過作用于T細胞而發揮免疫抑制作用。由于FK-506比其他CNI類藥物免疫抑制效用更強且更安全,被廣泛應用于器官移植領域及非移植領域,逐漸成為最常用的免疫抑制藥物。長期使用FK-506可引起糖代謝紊亂,甚至引起PTDM。實驗證實FK-506可以對胰島β細胞產生直接損害作用[3]。FK-506處理過的胰島β細胞及動物模型胰島β細胞的細胞核、細胞漿等都發生改變,甚至出現胰島β細胞凋亡。本研究將FK-506組的大鼠血液藥物濃度控制在6~10 μg/L之間,這是目前臨床維持免疫抑制作用最有效藥物濃度,同時研究者觀察到FK-506大鼠空腹血糖水平上升,HOMA-IR上升,而ISI下降,最終完成了FK-506誘導的糖尿病模型的建立。動物實驗證實,FK-506誘導的糖尿病模型中:空腹血糖升高,空腹胰島素水平升高,C-肽濃度上升,ISI下降、HOMA-IR上升,確定PTDM患者存在IR[3-5]。導致機體發生IR的原因主要有肥胖、炎性反應、氧化應激、線粒體功能障礙、微量元素缺乏、丙型肝炎等。有研究認為,在上述各種原因導致的IR中均存在PP2A的作用,在高脂飲食喂養的大鼠IR模型中,內臟脂肪細胞內PP2A的表達明顯增加,該研究認為PP2A表達增加,導致信號通路磷脂酰肌醇3激酶-蛋白激酶(phosphatidylinositol 3 kinase-serine/threonine kinase,PI3K-Akt)途徑被抑制,其中具體表現為Akt蛋白激酶磷酸化水平下降使大鼠磷酸化-絲氨酸蘇氨酸蛋白激酶(phospho-protein serine threonine kinase,P-Akt)減少,引起IR[6-9]。PP2A家族的主要成員參與了炎性因子對胰島素受體底物-1(insulin receptor substrate-1,IRS-1)的Ser307磷酸化位點的影響,降低了Akt的磷酸化水平,抑制了胰島素信號通路[7]。Yan等[8]證明了轉錄因子FOXO1(forkhead box protein O1)活化核內轉運的關鍵調節因子是PP2A,氧化應激時胰島β細胞中的PP2A與FOXO1的核內趨向激活相關,在2型糖尿病小鼠模型中也發現,血糖增高的同時,胰島β細胞中的PP2A和細胞核的FOXO1水平都有所升高。而FOXO1活化和核內聚集是氧化應激發生IR的關鍵。Galbo等[9]認為,游離脂肪酸可增加PP2A的活性,而選擇性改變胰島素在肝臟葡萄糖代謝中的活性,線粒體功能障礙引起內臟組織中游離脂肪酸增多。因此,可推測線粒體功能異常引起PP2A活性增加使P-Akt下降,葡萄糖合成激酶(glycogen synthase kinase-3 α,Gsk-3α)激活抑制糖原合成酶并促使糖的異生。研究人員發現,丙型肝炎病毒(hepatitis C virus,HCV)促進PP2A表達,抑制胰島素信號的傳導,作為HCV誘發糖尿病的機制之一[10-12]。綜上所述,PP2A活性增加是導致IR的重要環節。本研究由FK-506誘導糖尿病模型,并選取糖代謝的主要器官肝臟作為研究對象,分析了PP2A在肝臟組織中的表達,結果顯示,糖尿病大鼠的肝臟中PP2A的表達明顯高于對照組,提示PP2A在FK-506引起胰島素抵抗中發揮一定的作用。
IR發生在胰島素與胰島素受體結合以后的信號傳導過程,胰島素信號傳導途徑主要有兩條:一條是通過PI3K-Akt途徑,另一條是通過蛋白活化絲裂原激活蛋白酶(mitogen-activated protein kinase,MAPK)途徑。PI3K-/Akt途徑在IR中占據重要的位置,而MAPK信號傳導途徑在IR發生中并非主要作用,實驗證實,抑制MAPK通路后,葡萄糖的利用和糖原合成均未受到明顯影響,而PP2A參與胰島素信號通路中多個信號分子的去磷酸化[13-15]。本研究發現FK-506導致大鼠肝臟組織PP2A的表達增加,這可能是FK-506升糖機制之一。
FK-506可誘導大鼠發生糖尿病,在FK-506誘導的糖尿病大鼠的肝臟中,PP2A 表達明顯增高。FK-506通過增加PP2A的表達水平,干擾胰島素信號傳導通路,可能是FK-506引起胰島素抵抗的機制之一。
[1]Sulanc E, Lane J T, Puumala S E, et al. New-onset diabetes mellitus after kidney transplantation: an application of 2003 international guidelines [J]. Transplantation, 2005, 80(7): 945-952. DOI: 10.1097/01. TP.0000176482.63122.03.
[2]Kurzawski M, Dziewanowski K, Kêdzierska K, et al. Association of transcription factor 7-like 2(TCF7L2)gene polymorphism with posttransplant diabetes mellitus in kidney transplant patients medicated with tacrolimus [J]. Pharmacological Reports, 2011, 63(3): 826-833. DOI: 10.1016/S1734-1140(11)70595-3.
[3]滕雅芹, 牛玉堅, 徐 春, 等. 他克莫司對大鼠血糖的影響及其機制的探討[J]. 中國實驗動物學報, 2012, 20(2): 74-77. DOI: 10.3969/j.issn.1005-4847.2012.02.015.
[4]Zelle D M, Corpeleijn E, Deinum J, et al. Pancreatic betacell dysfunction and risk of new-onset diabetes after kidney transplantation [J]. Diabetes Care, 2013, 36(7): 1011-1021. DOI: 10.2337/dc12-1894.
[5]Goodyer W R, Gu X, Liu Y, et al. Neonatal betacell development in mince and human is regulated by calcaineurin/NFAT [J]. Dev Cell, 2012, 23(1): 21-34. DOI: 10.1016/j.devcel.2012.05.014.
[6]Jun H S, Hwang K, Kim Y, et al. High-fat diet alters PP2A, TC10, and CIP4 expression in visceral adipose tissue of rats [J]. Obesity, 2008, 16(6): 1226-1231. DOI: 10.1038/ oby.2008.220.
[7]Cohen P T, Philp A, Vázquez-Martin C. Protein phosphatase 4-from obscurity to vital functions [J]. FEBS Lett, 2005, 579(15): 3278-3286. DOI: 10.1016/ j.febslet.2005.04.070.
[8]Yan L, Guo S, Brault M, et al. The B55α-containing PP2A holoenzyme dephosphor- ylates FOXO1 in islet β-cells under oxidative stress [J]. J Biochem, 2012, 444(2): 239-247. DOI: 10.1042/BJ20111606.
[9]Galbo T, Olsen G S, Quistorff B, et al. Free fatty acidinduced PP2A hyperactivity selectively impairs hepatic insulin action on glucose metabolism [J]. PLoS One, 2011, 6(11): e27424. DOI: 10.1371/journal.pone.0027424.
[10]Negro F. Mechanisms of hepatitis C virus-related insulin resistance [J]. Clin Res Hepatol Gastroenterol, 2011, 35(5): 358-363. DOI: 10.1016/j.clinre.2011.01.011.
[11]Bernsmeier C, Duong F H, Christen V, et al. Virus-induced overexpression of protein phosphatase 2A inhibits insulin signaling in chronic hepatitis C [J]. J Hepatol, 2008, 49(3): 429-440. DOI: 10.1016/j.jhep.2008.04.007.
[12]Bose S K, Shrivastava S, Meyer K, et al. Hepatitis C virus activates the mTOR/S6K1 signaling pathway in inhibiting IRS-1 function for insulin resistance [J]. J Virol, 2012, 86(11): 6315-6322. DOI: 10.1128/JVI.00050-12.
[13]Kinney B P, Qiao L, Levaugh J M, et al. B56 alpha/protein phosphatase 2A inhibits adipose lipolysis in high-fat dietinduced obese mice [J]. Endocrinology, 2010, 151(8): 3624-3632. DOI: 10.1210/en.2010-0245.
[14]O'Neill H M, Holloway G P, Steinberg G R. AMPK regulation of fatty acid metabolism and mitochondrial biogenesis: Implications for obesity [J]. Mol Cell Endocrinol, 2013, 366(2):135-151. DOI: 10.1016/ j.mce.2012.06.019.
[15]Mistafa O, Aram G, Sandeep K, et al. Purinergic receptormediated rapid depletion of nuclear phosphorylated Akt depends on pleckstrin homology domain leucine-rich repeat phosphatase, calcineurin, protein phosphatase 2A, and PTEN phosphatases [J]. J Biol Chem,2010, 285(36): 27900-27910. DOI: 10.1074/jbc.M110.117093.
(2016-09-14收稿 2016-12-14修回)
(本文編輯 羅發菊)
Effect of tacrolimus in the expression of protein p-hosphatase 2A in liver tissue
WANG De'en1, CHEN Chongshu2, WANG Hongyu1, MA Yonghua1, and XU Chun1. 1. Department of Endocrinology, 2. Department of Pharmacology, General Hospital of Chinese People's Armed Police Force, Beijing 100039, China
XU Chun, E-mail: wjxuchun@soho.com
Objective This study aimed to establish whether tacrolimus (FK-506) induced diabetes in rats, and analyze the effect of FK-506 on the expression of protein phosphatase 2A (PP2A) in liver tissue of the rats. Methods 40 male SD rats (80-100 g) were randomly divided into FK-506 group and control group. The rats in FK-506 group were administrated with tacrolimus 4 mg/kg daily. The rats in control group were given the same amount of normal drinking water daily. Rat body weights, fasting blood glucose concentration and blood concentration of tacrolimus were measured monthly. After 5 months all rats were euthanized by ether anesthesia. Fasting serum insulin levels of the rats were determined by puncture of cardiac apex, and then homeostasis model assessment-insulin resistance index (HOMA-IR) and insulin secretion index (ISI) were calculated. The expressions of PP2A in liver tissue of the rats were determined by immunohistochemical method. Software of SPSS 17.0 was used for statistical analysis. Results Three months after feeding of FK-506, the average concentration of blood glucose in FK-506 group was (8.07±0.84) mmol/L, in which blood glucose concentrations of 80% of the rats was greater than 7 mmol/L, and were higher as compared with control group (5.27±0.38) mmol/L; blood glucose concentration of all the rats in group FK-506 were greater than 7 mmol/L five months after feeding of FK-506. The HOMA-IR in FK-506 group was significantly higher than in control group (t=47.80, P<0.05) and ISI was significantly lower than the control group (t=37.70, P<0.05). The expression of PP2A in liver tissue in FK-506 group was higher than in control group (χ2=19.80, P<0.05). Conclusions FK-506 can induce diabetes in rats. The expressions of PP2A in liver tissues of diabetic rats induced by FK-506 were increased, which may be due to the hyperglycemic effects of tacrolimus.
tacrolimus; post-transplantation diabetes mellitus; protein phosphatase2A; rat; insulin resistance
R587.1
10.13919/j.issn.2095-6274.2017.02.006
武警總醫院科研項目(WZ20130303)
100039 北京,武警總醫院:1.內分泌科, 2. 藥劑科
徐 春,E-mail:wjxuchun@soho.com

