分光光度法測定全釩液流電池釩電解液中磷含量的不確定度評定
劉月菊 張鵬 姜雪蓮(大連博融新材料有限公司,遼寧 大連 116450)
分光光度法測定全釩液流電池釩電解液中磷含量的不確定度評定
劉月菊 張鵬 姜雪蓮(大連博融新材料有限公司,遼寧 大連 116450)
本文敘述了鉍磷鉬藍(lán)分光光度法測定全釩液流電池釩電解液中磷含量測定的不確定度評定方法。通過對溶液配制過程和儀器測定過程的各種不確定度影響因素的評估,建立了全釩液流電池釩電解液中磷含量測定的不確定度評定數(shù)學(xué)模型,從而為測定的準(zhǔn)確性提供了理論基礎(chǔ)。
不確定度;分光光度法;全釩液流電池,釩電解液;磷
全釩液流電池(Vanadium Redox Battery,縮寫為VRB)[1],是一種液態(tài)氧化還原電池,也是一種新型清潔能源存儲裝置[2]。與其他類型電池相比,具有功率大、壽命長、可靠性高、操作和維修費用少等明顯的技術(shù)優(yōu)勢[3],因此在儲能行業(yè)具備無可估量的發(fā)展?jié)摿Γ踔劣锌赡軐⒏淖兾磥淼哪茉锤窬帧?/p>
而釩電解液組成成份含量的高低、雜質(zhì)的含量,以及添加劑的用量會嚴(yán)重影響電池中膜及電極的壽命。因此其成分檢測方法,備受重視。
全釩液流電池電解液是硫酸、硫酸釩(V2(SO4)3)和硫酸氧釩(VOSO4)的混合溶液,在其中添加磷酸可以提高電池電解液的性能。因此準(zhǔn)確測定釩電解液中的磷含量,對全釩液流電池的性能提高和商業(yè)推廣十分重要。
使用鉍磷鉬藍(lán)分光光度法測定電解液中的磷含量,快速、準(zhǔn)確、高效的滿足了電解液大規(guī)模生產(chǎn)的要求。而測量不確定度是與測量結(jié)果相關(guān)聯(lián)的參數(shù),它表征了可以合理的賦予被測對象的數(shù)值的分散程度。由于其具有廣泛的應(yīng)用性與實用性,因此對測量不確定度的評定非常重要。
本文主要針對鉍磷鉬藍(lán)分光光度法測定釩電解液中磷含量的測量結(jié)果不確定度進(jìn)行了分析和評估。
1 實驗部分
1.1 原理
在硝酸介質(zhì)中,磷酸中的磷與鉍及鉬酸銨生成絡(luò)合物,以抗壞血酸還原成磷鉬藍(lán),于分光光度計700nm處,測量其吸光度。
測量方法依據(jù)標(biāo)準(zhǔn):GB∕T 24583.5-2009。
1.2 主要儀器設(shè)備
T6紫外-可見分光光度計和30mm比色皿;2mL移液管;50mL、500mL、1000mL容量瓶。
1.3 測定過程
磷標(biāo)準(zhǔn)使用溶液的配制:用2mL無分度移液管移取濃度為1000mg∕L的磷標(biāo)準(zhǔn)溶液至500mL容量瓶中,用純水稀釋定容,配成濃度為4.00mg∕L的磷標(biāo)準(zhǔn)使用液。
工作曲線的繪制:取7個50mL容量瓶,分別加入磷標(biāo)準(zhǔn)使用液0.00、1.00、2.00、4.00、6.00、8.00、10.00mL,加入5mL硝酸鉍溶液,混勻,加入5mL磷顯色溶液,混勻,加入5mL抗壞血酸溶液,加水定容至刻度,搖勻,室溫放置10min,用30mm比色皿于分光光度計波長700nm處,測定其吸光度。
樣品的測定:準(zhǔn)確移取2.00mL釩電解液樣品于1000mL容量瓶中,加入2mL硝酸,搖勻至溶液呈純藍(lán)色,加水定容至刻度;再分取2.00mL稀釋后的溶液于50mL容量瓶中,加入1.5mL硝酸,搖勻,加入5mL硝酸鉍溶液,混勻。后續(xù)步驟與工作曲線的繪制步驟一致。
1.4 計算公式
通過測定工作曲線可以得到一元線性回歸方程:

其中y:樣品的校正吸光度A;
x:樣品的含磷量(ug);
b:回歸方程的斜率;
a:回歸方程的截距。
計算釩電解液中磷濃度(mol∕L):

其中m:樣品的含磷量(ug);
M:磷的相對分子質(zhì)量(g∕mol);
V:取樣體積(mL)。
2 建立數(shù)學(xué)模型,提出評估方法及程序
根據(jù)檢測方法和數(shù)學(xué)模型分析,各輸入量估計值彼此不相關(guān),按不確定度傳播規(guī)律,合成不確定表示為
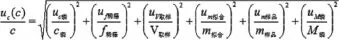
式中:uc(c)—測定釩電解液中磷的合成標(biāo)準(zhǔn)不確定度;
uc磷—標(biāo)準(zhǔn)貯備液配制引入的不確定度;
uf稀釋—標(biāo)準(zhǔn)溶液稀釋過程引入的不確定度;
uV取樣—樣品測量取樣引入的不確定度;
um擬合—校準(zhǔn)曲線擬合引入的不確定度;
um樣品—樣品重復(fù)性引入的不確定度;
由于在與愛迪生競爭市政照明投標(biāo)中失敗,馬克沁不得不在42歲那年遠(yuǎn)赴英倫重新創(chuàng)業(yè)。他無意中發(fā)現(xiàn)一種名叫“加特林排槍”的多管武器,有十來根槍管,需要四名射手搖動發(fā)射,威力不小,但極其笨重、射速也慢,作戰(zhàn)性能不高。不久,馬克沁在一次步槍體驗中,右肩被射擊時的后坐力震得輕一塊、紫一塊。有了這些經(jīng)歷后,馬克沁決心把后坐力與“加特林排槍”的原理結(jié)合起來,發(fā)明一種新型快速發(fā)射的自動武器。
uM磷—磷的相對分子質(zhì)量引入的不確定度。
根據(jù)鉍磷鉬藍(lán)分光光度法測定釩電解液中磷含量的方法測定程序的操作順序來逐一進(jìn)行分析,計算每步驟的不確定度,最后將各不確定度分類進(jìn)行合成。
3 實例分析給出釩電解液樣品中磷含量測定結(jié)果
3.1 標(biāo)準(zhǔn)物質(zhì)引入的不確定度
磷標(biāo)準(zhǔn)貯備液(GSB 04-1741-2004(a))的相對不確定度可由標(biāo)準(zhǔn)物質(zhì)證書上得到:磷標(biāo)準(zhǔn)貯備液濃度為1000mg∕L,相對不確定度為0.7%,屬正態(tài)分布,按k=2,置信概率p近似95%,推算出標(biāo)準(zhǔn)物質(zhì)相對標(biāo)準(zhǔn)不確定度:
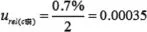
3.2 標(biāo)準(zhǔn)使用溶液的稀釋配制過程的不確定度
稀釋總磷標(biāo)準(zhǔn)貯備液時,用了2mLA級無分度移液管、500mLA級容量瓶,相對不確定度如表1。
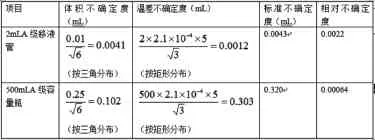
表1 標(biāo)準(zhǔn)使用溶液的稀釋配制過程的不確定度
由上述兩次稀釋造成的標(biāo)準(zhǔn)使用溶液的稀釋配制過程的相對不確定度為:

樣品取樣過程中,分別用了兩次2mLA級無分度移液管、50mLA級容量瓶和1000mLA級容量瓶。其相對不確定度如表2。

表2 樣品取樣過程產(chǎn)生的不確定度
由上述各步驟造成的樣品取樣過程產(chǎn)生的相對不確定度為:

3.4 曲線擬合產(chǎn)生的不確定度
4.00 mg∕L的磷標(biāo)準(zhǔn)使用溶液通過稀釋配制出濃度分別為0、2.0、4.0、8.0、12.0、16.0、20.0ug的7個標(biāo)準(zhǔn)溶液,由于校準(zhǔn)標(biāo)準(zhǔn)溶液的不確定度與吸光度測量的不確定度比,小到可以忽略,因此,在采用最小二乘法擬合校正曲線時,計算得到磷的濃度的不確定度僅與吸光度的測量不確定度有關(guān),同時也不考慮七個校準(zhǔn)標(biāo)準(zhǔn)溶液之間的相關(guān)性。
對七個校準(zhǔn)標(biāo)準(zhǔn)溶液各測量三次,共計21次,測量到的吸光度A數(shù)據(jù)如表3。

表3 磷工作曲線
擬合校準(zhǔn)曲線方程為(A取三次平均值)
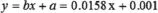
其中:y:樣品的校正吸光度A;
x:樣品的含磷量(ug);
b:回歸方程的斜率;
a:回歸方程的截距。
則吸光度測量的實驗標(biāo)準(zhǔn)差為:

對被測樣品測量三次,p=3,測得試液磷的濃度:m=29.02ug
其標(biāo)準(zhǔn)不確定度為:

其中:根據(jù)最小二乘法擬合公式
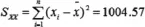
以上式中:i—下標(biāo),指第幾個工作曲線溶液;
j—下標(biāo),指獲得工作曲線的測量次數(shù);
n—工作曲線的校準(zhǔn)點測量次數(shù),如工作曲線上有7個校準(zhǔn)點,每點測量3次,則n=21;
x-——不同工作曲線溶液濃度的平均值。
此時,由曲線擬合帶來的標(biāo)準(zhǔn)不確定度為

3.5 磷的相對分子質(zhì)量引入的不確定度
因分子量引入的不確定度較小,可以忽略不計。
3.6 樣品重復(fù)測量產(chǎn)生的不確定度
實驗中對待測樣品進(jìn)行10次獨立測量(n=10)得到測定結(jié)果如下表4所示,試樣磷含量,單位mol∕L。

