采用EF-1α序列分析法對苜蓿根腐病病原菌
——銳頂鐮刀菌的鑒定
易銘,梁嘉俊,史建,李洪建,程積民,焦鋒*
(1.西北農林科技大學動物科技學院,陜西 楊凌 712100;2.彬縣西坡鄉動物衛生監督所,陜西 彬縣 713500)
采用EF-1α序列分析法對苜蓿根腐病病原菌
——銳頂鐮刀菌的鑒定
易銘1,梁嘉俊1,史建2,李洪建1,程積民1,焦鋒1*
(1.西北農林科技大學動物科技學院,陜西 楊凌 712100;2.彬縣西坡鄉動物衛生監督所,陜西 彬縣 713500)
苜蓿根腐病對苜蓿生長和產量造成嚴重影響,為了解引起根腐病病原真菌的種類,本文對從陜西省定邊縣牧草草場紫花苜蓿根部分離得到的根腐病病原菌進行形態學觀察、EF-1α序列分析鑒定及接種試驗。結果表明:通過對病原菌在PDA培養基中的分離、純化得到的單菌落形態學觀察及顯微鏡下菌絲、孢子的觀察,該病原菌屬于引起苜蓿根腐病的鐮刀菌屬(Fusarium);用CTAB法提取病原菌基因組DNA,并對EF-1α序列進行PCR擴增、回收純化、克隆測序,將測序結果進行Blast比對,構建系統發育樹,分析與Genbank已知近緣種屬親緣關系,結果顯示與銳頂鐮刀菌(F.acuminatum)親緣關系最近,可信度達99%;最后通過根部接種試驗,接種苜蓿根部發病癥狀與田間根腐病發病癥狀一致,鑒定結果顯示本試驗研究的引起紫花苜蓿根腐病的病原菌為鐮刀菌屬銳頂鐮刀菌(F.acuminatum)。
紫花苜蓿;根腐病;EF-1α;銳頂鐮刀菌
紫花苜蓿(Medicagosativa)屬薔薇目,豆科,苜蓿屬草本植物,是世界上栽培最早、種植面積最廣的豆科牧草。紫花苜蓿不僅能夠改良土壤結構,且蛋白含量高、氨基酸組成比例合理、維生素含量豐富,有"牧草之王"的美稱[1]。紫花苜蓿種植面積大,產量高,經濟效益顯著,是我國重要的牧草資源,而苜蓿病害是制約苜蓿生產和影響苜蓿產品質量的最主要因素。導致病害的病原微生物包括真菌、細菌、病毒、線蟲等,據統計全球每年由牧草病蟲害造成的牧草生產損失達35%以上[2]。苜蓿病害使苜蓿營養成分下降,進而降低了飼用價值和經濟價值。隨著我國苜蓿生產的快速發展,種植面積的擴大和集約化程度的不斷提高,苜蓿病害所造成的損失也愈發嚴重。一些原來不重要的病害、危害不大的病害,可能會成為爆發性的、廣泛流行的病害。因此,苜蓿病害研究工作對提高苜蓿產量及產品質量有著重要的作用。
苜蓿根腐病是世界性病害,普遍發生在各苜蓿種植地區。因苜蓿利用年限較長,苜蓿根腐病已成為苜蓿產量下降和植株衰敗的一個極其重要的原因[3]。苜蓿根腐病多由鐮刀菌侵染導致,該病對苜蓿生長的各個時期均可造成嚴重危害,導致根中柱腐爛,根莖和根中部變空,分支減少,側根大量腐爛死亡,固氮能力降低,苜蓿壽命和利用年限縮短[4],王雪薇等[5]的研究表明根腐病是限制新疆苜蓿生產的主要因素,死亡率可達60.08%~70.45%;孟嫣等[6]報道甘肅定西地區苜蓿發病植株比健康植株發芽延遲20 d左右,且分蘗數明顯減少,植株稀疏,生長緩慢;陳雅君等[7]對黑龍江各地區紫花苜蓿根腐病的調查發現,根腐病在各地區均有發生,嚴重地區發病率高達92%。苜蓿鐮刀菌根腐病主要病原菌為尖孢鐮刀菌(Fusariumoxysporium)、腐皮鐮刀菌(F.solani)、燕麥鐮刀菌(F.avenaceum)等。
真菌的分類與鑒定在過去一般采用形態學的方法,即根據真菌的形態、生長特點、孢子結構等特征來加以區分。但是真菌種類眾多,往往不同種屬的真菌表現出相似的特征,僅依靠形態學進行鑒定準確性比較低,同時也難以在種的層次上判斷真菌的分類。而準確的診斷是制定經濟有效的防治病害的基礎,因此能夠準確鑒定真菌病原菌的種類是十分必要的。隨著分子生物學技術的發展,越來越多的植物病理學研究者用分子標記技術應用于苜蓿病害的分子鑒定中。相比傳統的形態學方法,分子技術手段更能夠反映出不同種病原真菌的本質區別,能夠客觀、準確而又快速地鑒定植物病原菌。通過將得到的病原菌信息在生物信息學數據庫中比對,研究人員能夠更好地研究真菌的表型、遺傳、地域分布之間的關系。目前常用于真菌分類鑒定的DNA片段主要有5.8S rDNA基因,18S rDNA基因,28S rDNA基因,ITS(intra transcription spacer)序列,IGS(intragenic spacer)序列,線粒體細胞色素b(mitochondrial cytochrome b)基因,翻譯延伸因子(translationelongation factor,TEF)基因等[8]。其中EF-1α序列常用來鑒定鐮刀菌屬真菌[9],且EF-1α在物種鑒定方面有高分辨能力,較以往的ITS序列有較多的種間變異,適于作為系統進化研究的遺傳標記[10]。
本試驗將田間發病苜蓿根部病原菌分離純化培養,結合形態學和序列分析法對其進行鑒定。由于利用ITS序列分析法未能對此病原菌進行種級分類,采用EF-1α序列分析法進行鑒定,并將測序結果進行Blast比對,構建系統發育樹,同時對比其與ITS序列進化樹的不同,進而鑒定病原菌的種屬關系。本試驗是國內首次利用EF-1α序列分析法對苜蓿根腐病病原菌進行鑒定的報道,以期為苜蓿根腐病的診斷和防治提供理論依據。
1 材料與方法
1.1 試驗材料
本試驗所用的紫花苜蓿植株及病根于2015年8月采自陜西省榆林市定邊縣牧草種植基地(N 37°42′6.45″;E 107°37′28.75″)。選取病害癥狀典型的發病植株根部進行拍照,并用木質標本夾制作標本。
1.2 病原真菌分離
根據《植病研究方法》[11]真菌的分離培養步驟,在無菌操作環境下,從病斑邊緣處切取3 mm×3 mm小塊病組織,先用1%次氯酸鈉溶液消毒5~7 min,再置于75%乙醇3~5 s,之后以無菌水沖洗3次,接種在PDA培養基上,置于25 ℃培養箱活化培養。采用劃線培養法對菌落進行純化,共培養10個培養皿的單菌落作為重復對照,并用斜面PDA培養基保種。
1.3 病原菌形態學特征和病原物的鑒定
依據真菌學分類的常規方法,在PDA平板培養基上觀察并記錄菌落形狀、色澤與生長速度等特征;顯微鏡下觀測分生孢子的形態、大小、隔膜數,頂端細胞喙的有無、形態、大小。
1.4 CTAB法提取苜蓿真菌病原菌基因組DNA
參照Guo等[12]的方法,部分操作稍有改進:在培養基表面刮取菌絲,取250 mg左右液氮研磨、粉碎,加入600 μL的CTAB提取液、10 μL β-巰基乙醇,65 ℃水浴30 min;4 ℃ 12000 r/min離心10 min;取上清,加入1 μL的RNA 酶,37 ℃水浴1 h;加入24 μL無水乙醇及24 μL乙酸鉀KAC(5 mol/L),冰上放置1 h;加等體積600 μL氯仿-異戊醇(24∶1),充分混勻,4 ℃ 12000 r/min離心10 min;取上清,加入等體積酚/氯仿/異戊醇(25∶24∶1),4 ℃ 12000 r/min離心10 min;取上清,加等體積的氯仿/異戊醇(24∶1)再次抽提;取上清,加600 μL異丙醇,混勻后-20 ℃靜置沉淀30~60 min;4 ℃ 12000 r/min離心10 min,棄上清,沉淀加入75%乙醇300 μL洗滌,7000 r/min離心5 min,重復2次;沉淀在超凈臺吹風干燥;100 μL ddH2O溶解DNA,-20 ℃保存備用。
1.5 病原菌EF-1α序列的PCR擴增和檢測
PCR擴增引物為:EF-1H(5′-ATGGGTAAGGAAGACAAGAC-3′)和EF-2T(5′-GGAAGTACCAGTGATCATGTT-3′)[13]。擴增體系為20 μL,其中模板DNA 1 μL,上下引物各1 μL,ddH2O 7 μL,Taq Mix 10 μL。擴增程序為94 ℃預變性3 min;94 ℃變性30 s,55 ℃退火30 s ,72 ℃延伸1 min,34個循環;72 ℃延伸5 min。擴增產物進行瓊脂糖凝膠電泳,90 V下電泳30 min,經 EB染色后在紫外凝膠成像系統下觀測照相。
1.6 PCR產物的克隆、測序
PCR產物使用TianGen試劑盒純化回收后,連接入PMD-19T載體,16 ℃水浴1 h;將10 μL連接產物加入到融化的感受態中,冰浴30 min,再42 ℃熱激45~90 s,立即冰浴2 min;將連接產物與感受態加入到500 μL預熱37 ℃的LB液體培養基中,搖床震蕩培養60 min;取70~100 μL涂布在含有Amp(50 mg/mL)、IPTG(200 mg/mL)、X-gal(200 mg/mL)的LB固體培養基平板上,37 ℃倒置過夜培養;藍白斑篩選后放入含Amp(50 mg/mL)的LB液體培養基中,37 ℃震蕩過夜培養;經菌液PCR鑒定和Tiangen kit質粒小提試劑盒提取質粒DNA后送測序,測序結果在NCBI上進行核酸BLAST比對分析,并利用Mega軟件的UPGMA法和NJ法構建系統發育樹,分析其與GenBank公布的近緣種的親緣關系,確定病原菌種類。
1.7 病原菌根部接種試驗
采用根部接種法。用無菌的鐵匙刮取PDA平板上的菌落到10 mL離心管中,加入5 mL無菌水,用漩渦振蕩器使懸浮液混合均勻,7000 r/min離心5 min,離心后取上清液即為孢子懸浮液,用血球計數板觀察計數孢子懸液濃度,并稀釋使濃度約為5×105個/mL。試驗組接種對象選用在溫室內培養一月后的無病紫花苜蓿,3組重復,每組3株;接種前先用清水洗凈根部,用滅菌過的刀片對根部造成輕微割傷;采用浸根接種法,將根部浸入孢子懸浮液數分鐘,接菌后的苜蓿置于溫室內正常管理。對照組苜蓿根部同樣造成割傷,并用清水做同樣處理。定期記錄發病情況并選取病癥典型植株拍照。
2 結果與分析
2.1 苜蓿根腐病癥狀及病原真菌形態特征
植株感病后枝條萎蔫下垂,生長緩慢,葉片變黃枯萎。根部出現黃褐色病斑,病斑逐漸擴大呈黃褐色水漬狀。主根或側根表皮呈黃褐色,病部表皮腐爛,有根毛脫落。根中部變空,分枝減少,側根大量腐爛死亡。病原菌在PDA培養基上,25 ℃條件下,生長2 d后菌落平均直徑為1.3 cm,4 d后為3.13 cm,7 d后生長速度較快,近鋪滿全皿,并出現3層顏色,最外層為淺黃色,中間層為色素棗紅色,最內層為黃色孢子團堆,菌落平均直徑8.5 cm(圖1)。氣生菌絲繁茂,呈白色絨狀,色素棗紅色;無小型分生孢子,大型分生孢子形態較為一致,鐮刀型,彎曲,中部細胞膨大,頂孢呈長錐形,多為2~5橫隔膜。根據植株發病癥狀,病原菌形態特征等,依據植物病原真菌學[14],初步認定病原菌屬于半知菌亞門絲孢綱瘤座孢目鐮刀菌屬(Fusarium)。
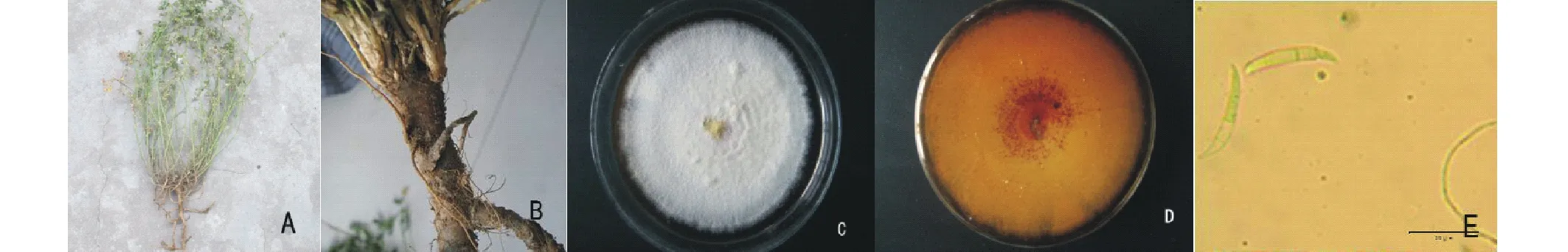
圖1 苜蓿根腐病發病癥狀及病原形態特征Fig.1 The symptoms of alfalfa Fusarium root rot and morphology of isolated pathogen A、B:發病植株癥狀;C、D:PDA培養基上菌落正面與背面;E:光學顯微鏡下大型分生孢子。A,B:Symptoms of Fusarium root rot;C,D:Front and back surface of the colony on PDA;E:Macroconidium under light microscopy.
2.2 PCR擴增及測序
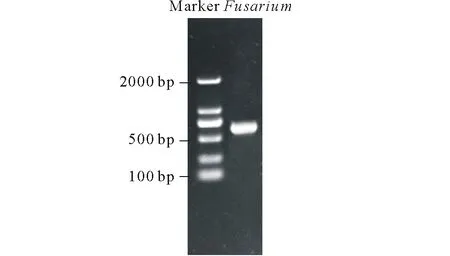
圖2 PCR擴增產物電泳圖Fig.2 The agarose gel electrophoresis of DNA products amplified by PCR
以CTAB法提取出的病原菌DNA為模板,用EF-1H/EF-2T作為引物做PCR擴增,5 μL點樣電泳,在紫外凝膠成像系統下拍照如圖2,條帶單一較亮,且無非特異性擴增條帶,分子量在500~750 bp之間。
藍白斑篩選后,通過菌液PCR檢測,挑選陽性克隆的菌樣,送測序,測序結果如圖3。用Bioxm軟件對測序結果堿基成分及GC含量進行分析,得到根腐病病原菌EF-1α序列總長度為674 bp,其中G+C含量為51.19%。

圖3 苜蓿鐮刀菌根腐病病原菌EF-1α序列Fig.3 The EF-1α sequence of alfalfa Fusarium root rot pathogen
2.3 EF-1α序列系統發育樹的構建
在本試驗的前期研究中,使用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)對此病原菌的rDNA-ITS序列進行擴增和測序,得到長度為524 bp的核苷酸序列,用NJ法構建ITS序列的系統發育樹(圖4)。可以看到病原菌ITS序列seq2與銳頂鐮刀菌(Fusariumacuminatum)、 燕麥鐮刀菌(Fusariumavenaceum)、三線鐮刀菌(Fusariumtricinctum)在一個分支,且可信度(bootstrap)

圖4 病原菌rDNA-ITS序列的NJ樹Fig.4 The NJ tree of rDNA-ITS sequence
為68%,說明此病原菌和鐮刀菌屬銳頂鐮刀菌、燕麥鐮刀菌、三線鐮刀菌的真菌親緣關系比較近,但由于病原菌與鐮刀菌屬的這幾個近緣種在系統進化樹上同在一個分支且無法再分,單獨根據ITS序列系統發育樹尚無法準確判斷病原菌的種級分類水平。
因此采用EF-1α序列分析法繼續進行鑒定,將EF-1α序列測序得到的序列與GenBank中已有序列進行核酸BLAST比對分析,得到與GenBank中已有序列同源性較高的菌種信息(表1),參比菌種均來自于被鐮刀菌侵染的不同植株[15-18],本試驗病原菌序列與Fusariumacuminatum序列同源性最高,Ident值為99%。
用Mega 6.0軟件將相似序列進行比對,采用K2模型,分別用NJ法(圖5)和UPGMA(圖6)法構建EF-1α序列的系統進化樹。
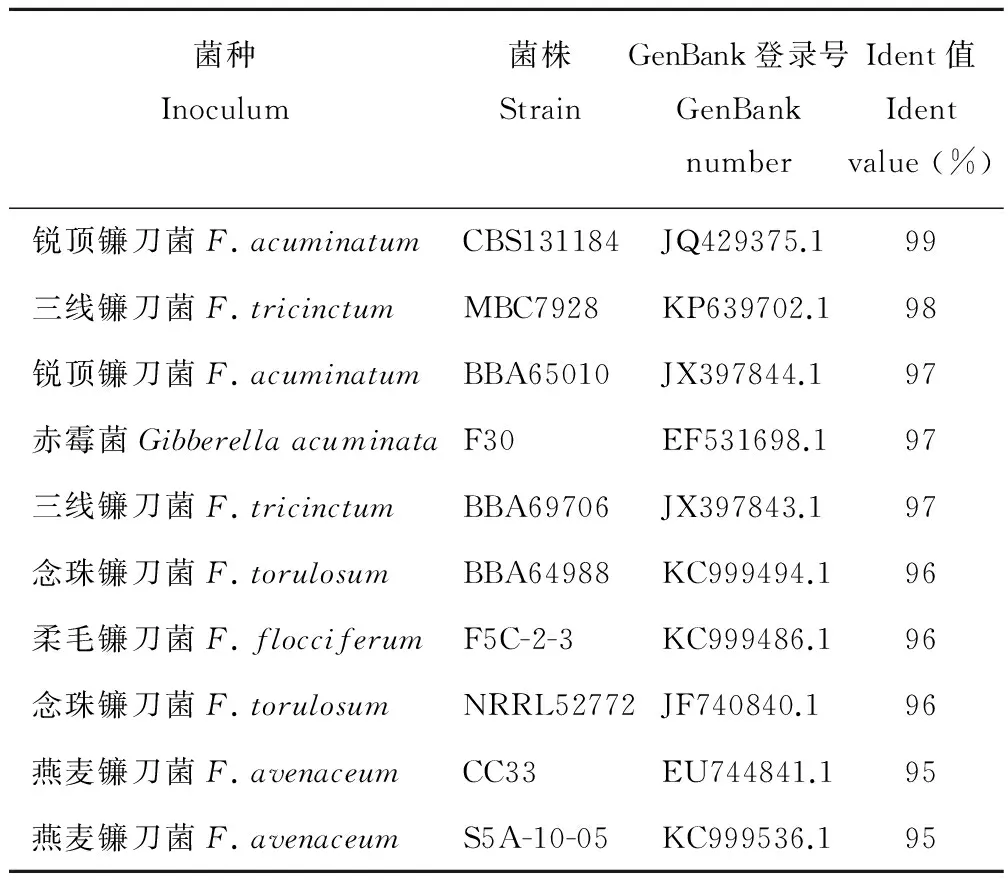
表1 Blast比對得到相似序列的菌種信息Table 1 Strains of similar sequence
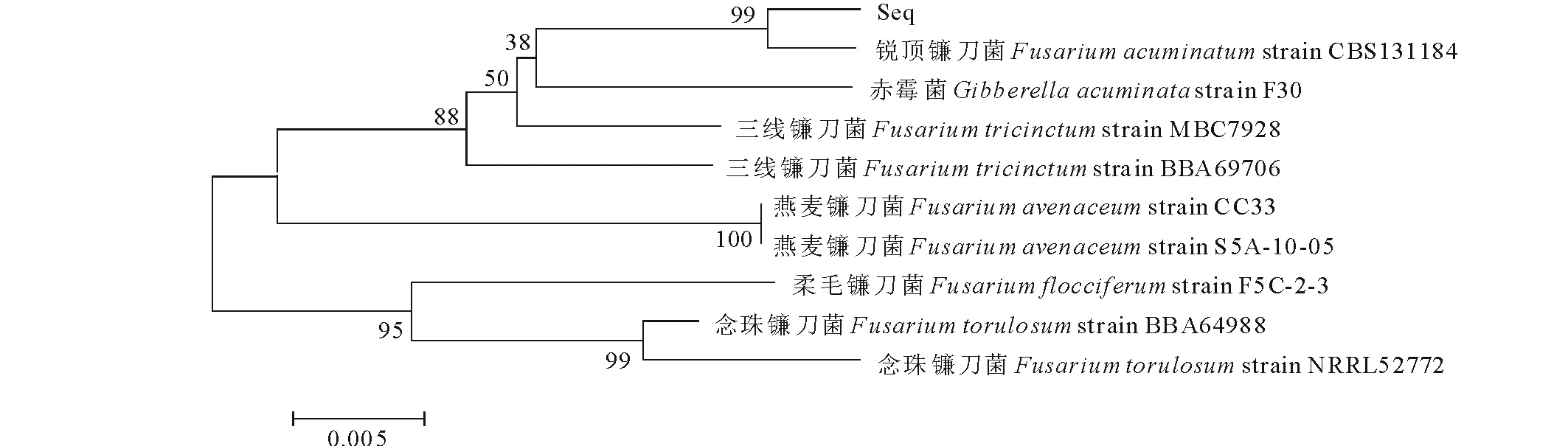
圖5 病原菌EF-1α序列的NJ樹Fig.5 The NJ tree of EF-1α sequence
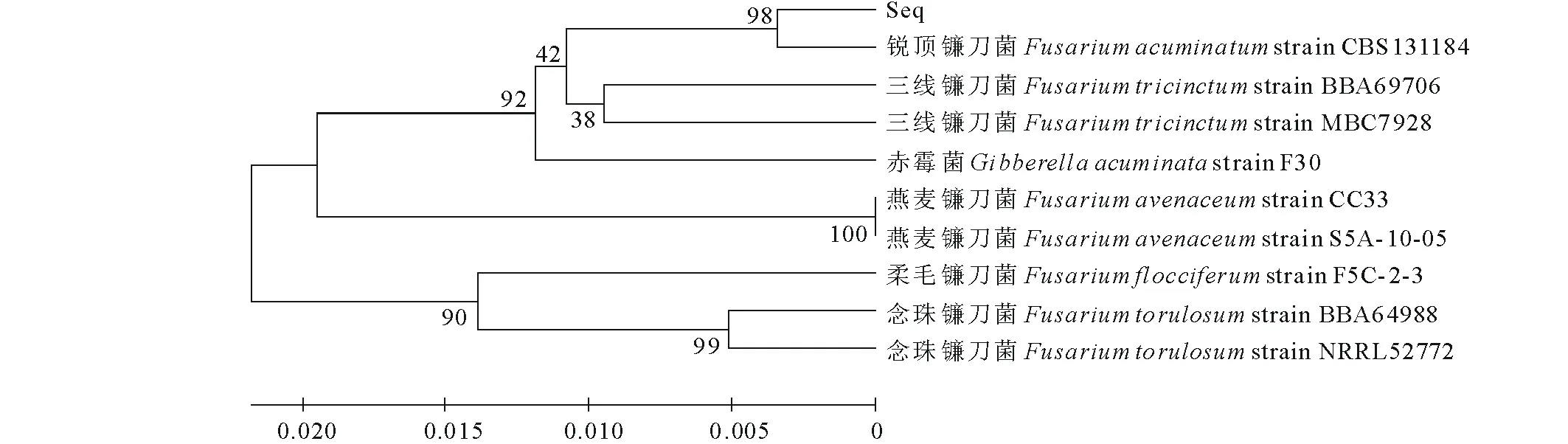
圖6 病原菌EF-1α序列的UPGMA樹Fig.6 The UPGMA tree of EF-1α sequence
分支上側數字為大于50%的Bootstrap檢驗值(1000次重復),通過對NJ樹的分析結果表明:在遺傳距離為0.005,bootstrap為1000次檢驗時,病原菌EF-1α序列與Fusariumacuminatum在同一分支,且可信度達99%,可以初步認定本試驗研究的苜蓿根腐病病原菌屬于Fusariumacuminatum(銳頂鐮刀菌)種;UPGMA樹的結果與NJ樹結果一致。結合兩種建樹結果可以說明,引起本試驗中苜蓿根腐病的病原菌為銳頂鐮刀菌。
2.4 病原菌根部接種驗證
接種的9株健康苜蓿有5株接種一周后出現明顯發病癥狀,接種兩周后可觀察到:試驗組苜蓿根部出現明顯腐爛癥狀,主根呈黃褐色,表皮腐爛,根毛脫落,發病癥狀與田間癥狀相似,而對照組則沒有發病現象(圖7)。將試驗組發病苜蓿根部病原菌再分離,純化培養,得到與原接種所用相同病原菌,根據科赫法則,可說明本試驗研究的病原菌是引起紫花苜蓿根腐病的病原菌,即銳頂鐮刀菌(Fusariumacuminatum)。
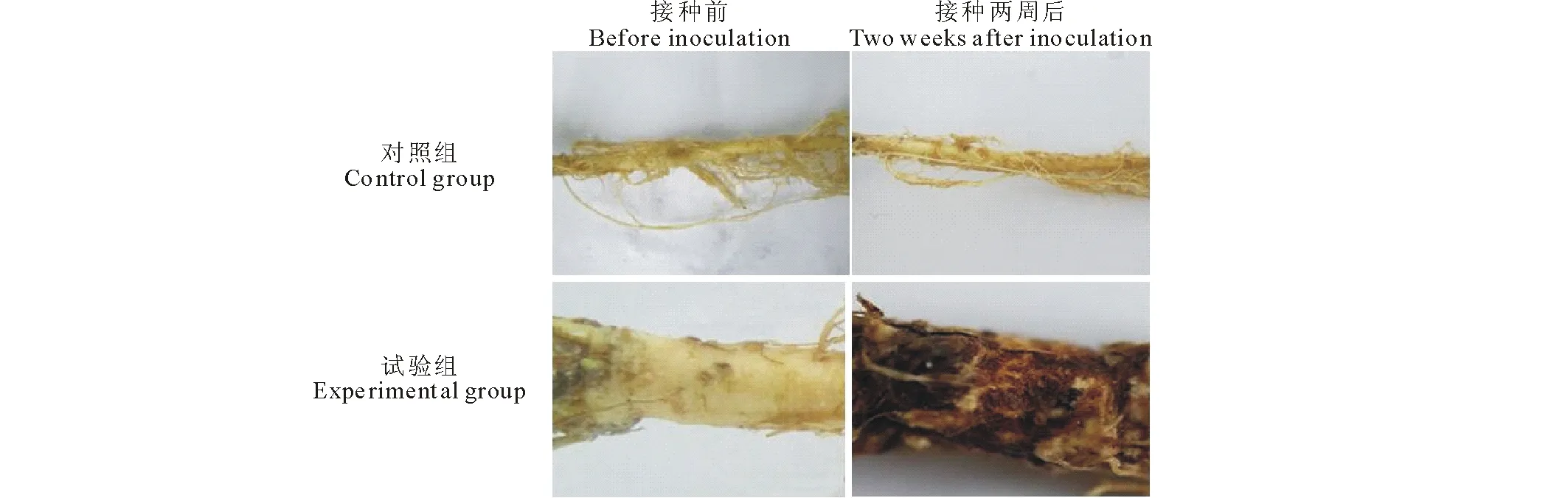
圖7 孢子懸浮液浸根法接種結果Fig.7 The results of inoculated with conidial suspension by root dipping
3 結論與討論
苜蓿根部病害是由土傳真菌所致,是影響苜蓿產量和產品質量的重要因素。據統計,在已研究證實的侵入苜蓿根部的真菌中,鐮刀菌屬(Fusarium)占比重最大,是引起苜蓿根部病害的主要致病菌[19]。苜蓿根腐病是苜蓿主要的根部病害,先后報道的病原菌種類達28種,其中鐮刀菌13種[20]。在本研究中,從陜西省定邊縣牧草種植基地采集發病苜蓿,病株生長緩慢,葉片枯萎變黃,病部表皮腐爛,根毛脫落,符合苜蓿根腐病發病癥狀;將病部病原菌分離、純化培養,得到病原菌單菌落,菌落氣生菌絲繁茂,色素棗紅色;在光學顯微鏡下觀察,大型分生孢子形態較為一致,鐮刀型,頂孢延長成錐形,2~5橫隔,大小在3.5~5.9 μm×27.4~69.8 μm之間,符合鐮刀菌的形態特征,可初步判定分離得到的病原菌屬鐮刀菌屬。
由于同屬真菌形態差異不明顯,通過形態特征觀察難以進行種級分類鑒定,使用分子鑒定可以快速準確地鑒定植物病原菌。在目前的植物病原菌鑒定報道中,使用rDNA-ITS序列進行分子鑒定是最為普遍的,但rDNA的ITS序列進化快速,被認為缺乏保守性,在真菌分類鑒定方面使用單一基因作為分子標記具有一定的不可靠性。在本試驗中,使用rDNA-ITS序列分析法構建鐮刀菌系統進化樹,苜蓿根腐病ITS序列與銳頂鐮刀菌(Fusariumacuminatum)、 燕麥鐮刀菌(Fusariumavenaceum)、三線鐮刀菌(Fusariumtricinctum)在一個分支,且可信度(bootstrap)為68%,試驗病原菌與鐮刀菌屬的這幾個近緣種在系統進化樹上同在一個分支且無法再分,因此認為單獨的根據ITS序列尚無法準確判斷本研究中病原菌的種級分類水平,需要用其他序列再次進行分析。
翻譯延伸因子(translationelongation factor,TEF)基因常作為分子標記對真菌進行鑒定分類和系統進化分析。其中EF-1α序列常用來鑒定鐮刀菌屬真菌,如Zhao等[21]采用EF-1α序列進行進化分析對九州鐮刀菌、擬枝孢鐮刀菌、厚垣鐮刀菌等進行鑒定。且EF-1α在物種鑒定方面有高分辨能力,較以往的ITS序列有較多的種間變異,適于作為系統進化研究的遺傳標記。因此本試驗采用EF-1α序列分析法對苜蓿根腐病病原菌進行鑒定,并構建系統進化樹。結果表明病原菌EF-1α序列與Fusariumacuminatum在同一分支,且可信度達99%,可認定本試驗研究的苜蓿根腐病病原菌屬于Fusariumacuminatum(銳頂鐮刀菌)種。同時接種試驗表明分離得到的病原菌是本研究中苜蓿根腐病致病病原菌,且與已報道的關于銳頂鐮刀菌致病性試驗結果相符[22]。
綜上,通過對紫花苜蓿根腐病病原菌的形態特征觀察、EF-1α序列分子鑒定、致病性試驗,可以表明本試驗所研究苜蓿根腐病病原菌為銳頂鐮刀菌(Fusariumacuminatum)。對比rDNA-ITS與EF-1α序列鑒定結果的不同,可以認為不同的序列分析法對不同菌種有著不同的適用性,這可能與不同菌種序列進化速度不同有關。因此在對某種病原菌進行鑒定時,有必要用不同種序列構建發育樹,才能得到相對可靠的結論。本文是首次關于陜西省苜蓿根部病害的報道,并且通過分子序列鑒定確定了病原真菌種類,以期為生產中苜蓿根腐病的診斷及進一步的防治提供理論依據。
References:
[1] Geng H Z, Wu Y F, Cao Z Z. Chinese Alfalfa[M]. Beijing: Chinese Agriculture Press, 1995: 114-130. 耿華珠, 吳永敷, 曹致中. 中國苜蓿[M]. 北京: 中國農業出版社, 1995: 114-130.
[2] Nan Z B. Establishing sustainable management system for disease of pasture crops in China. Acta Prataculturae Sinica, 2000, 9(2): 1-9. 南志標. 建立中國的牧草病害可持續管理體系. 草業學報, 2000, 9(2): 1-9.
[3] Cao L X, Zhao C H, Kong Q Q,etal. Advances in Alfalfa root rot pathogen and control research. Inner Mongolia Agriculture Science and Technology, 2006, (3): 36-37. 曹麗霞, 趙存虎, 孔慶全, 等. 紫花苜蓿根腐病病原及防治研究進展. 內蒙古農業科技, 2006, 3: 36-37.
[4] Xue F X. Grassland Protection[M]. Beijing: Chinese Agriculture Press, 2009. 薛福祥. 草地保護學——牧草病理學分冊[M]. 北京: 中國農業出版社, 2009.
[5] Wang X W, Wang C L, Zhou G,etal. Investigation and analysis on Lucerne diseases from Altay newly-established areas in northern Xinjiang. Journal of Xinjiang Agriculture University, 1996, 19(3): 40-44. 王雪薇, 王純利, 周剛, 等. 新疆阿勒泰新墾區苜蓿病害調查與分析. 新疆農業大學學報, 1996, 19(3): 40-44.
[6] Meng Y, Li M Q. Research progress on alfalfa crown and root rot pathogen and their control. Pratacultural Science, 2005, 22(5): 89-92. 孟嫣, 李敏權. 苜蓿根和根莖腐爛病病原及防治研究進展. 草業科學, 2005, 22(5): 89-92.
[7] Chen Y J, Cui G W. Survey and separation of alfalfa root rot pathogen in Heilongjiang Province. Grassland of China, 2001, 23(3): 78-79. 陳雅君, 崔國文. 黑龍江省紫花苜蓿根腐病調查及病原分離. 中國草地, 2001, 23(3): 78-79.
[8] Zhang B. Identification, Classification, and Phylogenetic Relationships of Pathogenic Fungi Based on Mitochondrial Cytochrome b Gene and Translation Elongation Factor Gene Analysis[D]. Jilin: Basic Medical College of Jilin University, 2007. 張波. 線粒體細胞色素b和翻譯延伸因子基因分析用于病原真菌的分離、鑒定和系統發生[D]. 吉林: 吉林大學基礎醫學院, 2007.
[9] Kristensen R, Gauthier G, Berdal K G. DNA microarray to detect and identify trichothecene and moniliformin-producingFusariumspecies. Journal of Applied Microbiology, 2007, 102(4): 1060-1070.
[10] Yergeau E, Filion M, Vujanovic V. A PCR-denaturing gradient gel electrophoresis approach to assessFusariumdiversity in asparagus. Journal of Microbiological Methods, 2005, 60(12): 143-154.
[11] Fang Z D. The Method on Studies of Plant Pathology[M]. Beijing: Chinese Agriculture Press, 1998: 122-125. 方中達. 植病研究方法[M]. 北京: 中國農業出版社, 1998: 122-125.
[12] Guo L D, Hyde K D, Liew E C Y. Identification of endophytic fungi fromLivistonachinensisbased on morphology and rDNA sequences. New Phytologist, 2000, 147: 617-630.
[13] O’Donnell K, Kistler H C, Cigelnik E,etal. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(5): 2044-2049.
[14] Zhang Z Y, Leng H Q, Zhang Z M,etal. Plant Pathogenic Mycology[M]. Chengdu: Sichuan Science and Technology Press, 1988: 384-386. 張中義, 冷懷瓊, 張志銘, 等. 植物病原真菌學[M]. 成都: 四川科學技術出版社, 1988: 384-386
[15] Mahdi Dacari, Anne Dvan Diepeningen, Assadollah Babai-Ahari,etal. Rapid identification ofFusariumgramminespecies complex using Rolling Circle Amplification(RCA). Journal of Microbiological Methods, 2012, 89(1): 63-70.
[16] O’Donnell K, Humber R A, Geiser D M,etal. Phylogenetic diversity of insecticolous fusaria inferred from multilocus DNA sequence data and their molecular identification via FUSARIUM-ID andFusariumMLST. Mylologia, 2012, 104(2): 427-445.
[17] Stenglein S A, Rodriguero M S, Chandler E,etal. Phylogenetic relationships ofFusariumpoae based on EF-1 alpha and mtSSU sequences. Fungal Biology, 2010, 114(1):96-106.
[18] Grafenhan T, Patrick S K, Roscoe M,etal. Fusarium damage in cereal grains from Western Canada. Journal of Agricultural and Food Chemistry, 2013, 61(23):5425-5437.
[19] Guo Y X, Nan Z B, Wang C Z,etal. Progress in research on root invading fungi ofMedicagosativa. Acta Prataculturae Sinica, 2009, 18(5): 243-249. 郭玉霞, 南志標, 王成章, 等. 苜蓿根部入侵真菌研究進展. 草業學報, 2009, 18(5): 243-249.
[20] Chen Y J, Liu X M, Cui G W,etal. Research progress in root rot of alfalfa. Grassland of China, 2000, (1): 51-56. 陳雅君, 劉學敏, 崔國文, 等. 紫花苜蓿根腐病的研究進展. 中國草地, 2000, (1): 51-56.
[21] Zhao Z H, Lu G Z, Jiang Z D,etal. Identification ofFusariumkyushuense,F.sporotrichioidesandF.chlamydosporumusing EF-1α sequence data and morphological characteristics of conidia in aerial mycelium. Mycosystema, 2011, 30(5): 713-720.
[22] Li M Q. Comparative pathogenicity of isolates ofFusariumspp and cultivars resistance in alfalfa. Grassland of China, 2003, 25(1): 39-43. 李敏權. 苜蓿根和根頸腐爛病病原致病性及品種抗病性研究. 中國草地, 2003, 25(1): 39-43.
Identification ofFusaruimacuminatumisolated fromMedicagosativaroot using the EF-1α sequence analysis method
YI Ming1, LIANG Jia-Jun1, SHI Jian2, LI Hong-Jian2, CHENG Ji-Min1, JIAO Feng1*
1.CollegeofAnimalScienceandTechnology,NorthWestAgricultureandForestryUniversity,Yangling712100,China; 2.AnimalHealthInspectionofXipoCountry,Binxian713500,China
Alfalfa root rot causes serious reductions in alfalfa growth and yield. To identify the species of pathogenic fungus causing root rot disease, the root rot pathogen ofMedicagosativa(alfalfa) collected from pasture in Dingbian County, Shaanxi Province, was analyzed by morphological observations, EF-1α sequence analysis, and inoculation tests. The mycelium and spores of a single colony of the pathogen growing on culture medium were observed under a microscope. Based on its morphology, the pathogen was identified as aFusariumfungus. The genomic DNA was extracted from the pathogen using the cetyl-trimethylammonium bromide method, and the translation elongation factor gene was selected for PCR amplification, gel recycling, purification, cloning, sequencing, and phylogenetic analyses. A phylogenetic tree constructed using MEGA and sequences available in Genbank showed that the pathogen had the closest relationship withFusariumacuminatum(99%). In the root inoculation test, the disease symptoms of roots inoculated with the isolated pathogen were the same as those characteristic of root rot disease ofM.sativain the field. Together, these results verified that the pathogen causing root rot disease ofM.sativain Shaanxi Province isF.acuminatum.
Medicagosativa; root rot; EF-1α;Fusariumacuminatum
10.11686/cyxb2016100
http://cyxb.lzu.edu.cn
2016-03-09;改回日期:2016-05-11
國家公益性行業(農業)科研專項經費項目(201303157)和國家現代農業牧草產業技術體系(CRAS-35)資助。
易銘(1990-),男,黑龍江牡丹江人,在讀碩士。E-mail: yiminggodlike@163.com
*通信作者Corresponding author. E-mail: fjiao@nwsuaf.edu.cn
易銘, 梁嘉俊, 史建, 李洪建, 程積民, 焦鋒. 采用EF-1α序列分析法對苜蓿根腐病病原菌——銳頂鐮刀菌的鑒定. 草業學報, 2017, 26(2): 61-68.
YI Ming, LIANG Jia-Jun, SHI Jian, LI Hong-Jian, CHENG Ji-Min, JIAO Feng. Identification ofFusaruimacuminatumisolated fromMedicagosativaroot using the EF-1α sequence analysis method. Acta Prataculturae Sinica, 2017, 26(2): 61-68.

